多穗柯三叶苷的抑制糖尿病关键酶活性和抗氧化性
2011-10-18宁正祥董华强
张 毅,宁正祥,*,董华强
(1. 华南理工大学轻工与食品学院,广东 广州 510641;2. 佛山科学技术学院食品科学系,广东 佛山 528231)
多穗柯三叶苷的抑制糖尿病关键酶活性和抗氧化性
张 毅1,宁正祥1,*,董华强2
(1. 华南理工大学轻工与食品学院,广东 广州 510641;2. 佛山科学技术学院食品科学系,广东 佛山 528231)
从多穗柯中提取分离得到三叶苷,以抗糖尿病药物阿卡波糖为阳性对照,检测多穗柯三叶苷对小肠α-葡萄糖苷酶和胰脏α-淀粉酶活性的抑制作用和对α-葡萄糖苷酶活性抑制类型,并以芦丁为阳性对照检测其清除DPPH自由基能力。结果显示:多穗柯三叶苷对α-葡萄糖苷酶有明显抑制作用,为非竞争性抑制,抑制效果与阿卡波糖无明显差别,对α-淀粉酶活性的抑制率低于阿卡波糖;清除DPPH自由基能力强于芦丁。表明多穗柯三叶苷是一种有应用潜力的抗糖尿病活性物质。
三叶苷;多穗柯;α-葡萄糖苷酶;α-淀粉酶;糖尿病
Ⅱ型糖尿病又称非胰岛素依赖型糖尿病(NIDDM),表现为患者血糖水平升高[1]。近年来的流行病学研究表明,餐后血糖水平是糖耐量受损(impaired glucose tolerance,IGT)患者发展为Ⅱ型糖尿病的重要因素,严格控制餐后血糖可减少大血管及微血管并发症的发生[2-5]。餐后血糖水平的上升与胰脏α-淀粉酶促进淀粉水解和小肠黏膜上的α-葡萄糖苷酶水解葡萄糖苷键生成葡萄糖分子密切相关[6]。因此对α-葡萄糖苷酶和α-淀粉酶的抑制是防治Ⅱ型糖尿病的一个有效途径。
阿卡波糖(acarbose)是临床常用的α-葡萄糖苷酶抑制剂,它也是α-淀粉酶的强抑制剂[7]。阿卡波糖虽然有效,但却存在引起肠道不适等明显的副作用[8]。研究指出这是由于对胰脏α-淀粉酶的过度抑制引起的[7]。因此,有必要寻找有效而副作用小的α-葡萄糖苷酶抑制剂[9-10]。
多穗柯(Lithocarpus polystachyus Rehd) 主要分布于我国长江以南各省区[11-12],是我国传统民间草药和保健饮料植物[13]。Dong等[14]用多穗柯黄酮粗提物灌胃处理四氧嘧啶糖尿病模型小鼠,证明有明显的抗糖尿病活性。本实验将对多穗柯三叶苷抑制α-葡萄糖苷酶、α-淀粉酶活性及抗氧化活性进行研究和评价。
1 材料与方法
1.1 材料、试剂与仪器
多穗柯(Lithocarpus polystachyus Rehd)嫩叶采自贵州东部山区。
根皮苷(99.7%)、DPPH(分析纯)、α-葡萄糖苷酶(EC 3.2.1.20)、对硝基苯-β-D-半乳糖吡喃糖苷(PNPG)、猪胰腺α-淀粉酶(EC 3.2.1.1,VI型) 美国Sigma公司;抗坏血酸、芦丁(99.6%)、3,5-二硝基水杨酸、酒石酸钠钾(四水) 上海晶纯试剂有限公司;阿卡波糖 德国拜耳公司。
UV-260紫外-可见分光光度仪 日本岛津公司;2690高效液相色谱仪 美国Waters公司;M2emicroplate reader仪 美国Molecular device公司;ZQ2000质谱仪 美国 Waters公司;DRX400核磁共振波谱仪 德国Bruker公司。
1.2 多穗柯三叶苷分离纯化
提取分离步骤见参考文献[15-16]。取多穗柯嫩叶,采用微波辅助法提取得粗提物,经大孔树脂和中性氧化铝柱层析后获得结晶。
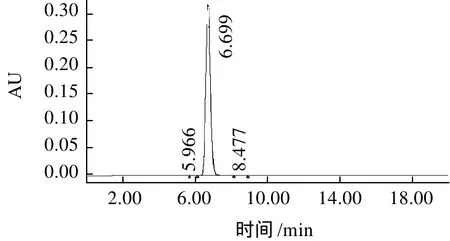
图1 多穗柯三叶苷提取物高效液相色谱图Fig.1 HPLC chromatogram of trilobatin separated from Lithocarpus polystachyus Rehd
1.3 分析检测方法
1.3.1 色谱条件
色谱柱:Diamonsil C18(150mm×4.6mm,5μm);流动相:甲醇、水体积比6:4;流速:1.0mL/min;进样量:10μL;检测波长:283nm。
1.3.2 电喷雾-质谱(ESI-MS )检测
喷雾毛细管电压2.89kV,离子源温度100℃,脱溶剂气温度250℃,负离子扫描,扫描范围50~800m/z。
1.3.3 核磁共振(NMR)波谱分析
待测样品用DMSO-d6溶解后,在室温,400MHz条件下进行1H和13C核磁共振波谱分析。
1.3.4 抑制α-葡萄糖苷酶活性测定
参照参考文献[17]的测定方法,略作修改。取60μL待测液(0.8mg/mL样品液、0.8mg/mL 阿卡波糖溶液,同量的缓冲液作为空白对照)于96孔酶标板中,加入50μL α-葡萄糖苷酶溶液 (0.2U/mL),振匀后于37℃水浴保温10min,加入50μL 5.0mmol/L PNPG溶液振匀,在37℃水浴中反应20min,加入160μL Na2CO3溶液 (0.2mol/L)终止酶促反应,置于405nm波长处测吸光度(A)。由于多穗柯三叶苷本身有颜色,因此每个样品需要测定背景吸收,并最终测定结果进行校正。每个样品重复3次取平均值。抑制率按式(1)计算。
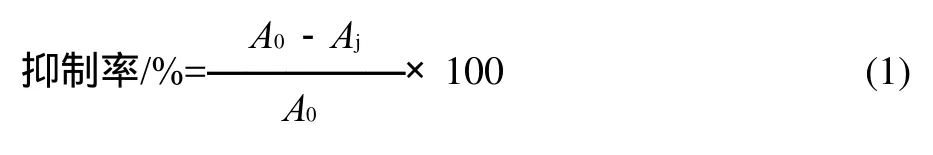
式中:Aj为样品组吸光度;A0为空白对照组吸光度。
将最大抑制率一半所需样品的浓度定义为IC50,以评价对α-葡萄糖苷酶的抑制水平。采用Lineweaver-Burk作图法,对多穗柯三叶苷抑制α-葡萄糖苷酶的机理进行分析。
1.3.5 抑制α-淀粉酶活性测定
参照参考文献[17]的测定方法,略作修改。取40μL待测液(0.8mg/mL样品溶液或0.8mg/mL阿卡波糖溶液,以同量缓冲液作为空白对照)于25mL比色管中,加入200μL胰α-淀粉酶溶液 (1.0U/mL),在37℃水浴中使酶活化10min,添加400μL底物可溶性淀粉(1.0g/100mL)在25℃反应10min,加入1.0μL DNS(A液(12.0g四水合酒石酸钾钠溶于 8.0mL 2mol/L NaOH)与B液(0.88g的3,5-二硝基水杨酸溶于46mL去离子水)体积比为1: 1)终止反应,进行沸水浴5min,冷却至室温后加入10mL蒸馏水以稀释,在540nm波长处测定吸光度。抑制率按式(2)计算。
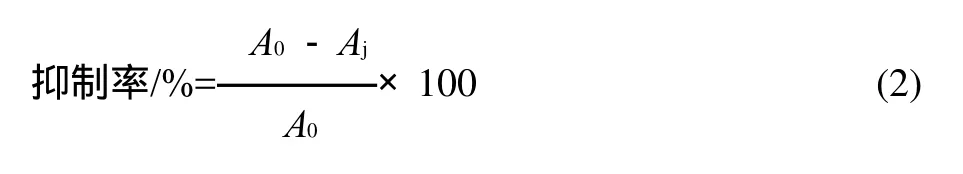
式中:Aj为样品组吸光度;A0为空白对照组吸光度。
将最大抑制率一半所需样品的浓度定义为IC50以评价对胰α-淀粉酶的抑制水平。
1.3.6 清除DPPH自由基能力测定
参照参考文献[17]的方法,略作修改。以甲醇为溶剂,配制不同质量浓度的样品溶液,吸取50μL待测液于96孔酶标板中,加入150μL DPPH溶液 (0.2mmol/L),摇匀,25℃避光静置30min,置于517nm波长处测定吸光度。按式(3)计算对DPPH自由基的清除能力。

式中:Q为DPPH自由基清除率;A0为不加试样DPPH溶液的吸光度;At为加试样反应后 DPPH溶液吸光度。
以清除DPPH自由基达到稳定态50%清除率所需加入抗氧化样品的质量浓度为IC50,用以表示其抗氧化能力。
2 结果与分析
2.1 多穗柯黄酮结晶的结构鉴定与表征
2.1.1 HPLC检测结果
分离得到的多穗柯黄酮结晶的HPLC检测结果(图1)表明,保留时间与标准品根皮苷(phloridzin)一致,纯度达到99.87%,推断其与根皮苷分子有非常相似的化学结构。
2.1.2 ESI-MS检测结果
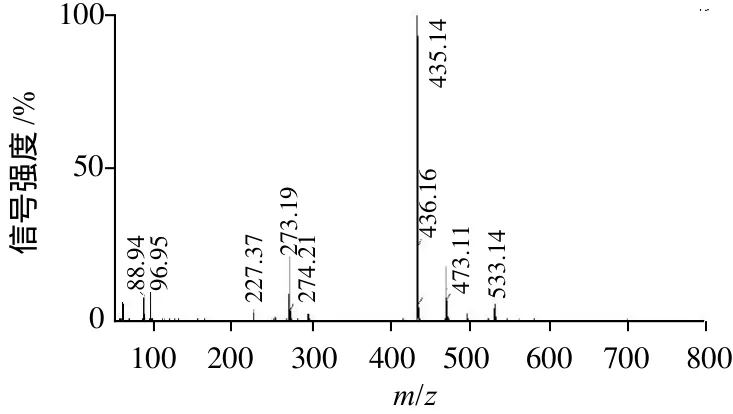
图2 多穗柯三叶苷ESI-MS图-Fig.2 ESI-MS spectrum of ion [M-H]-of trilobatin separated from Lithocarpus polystachyus Rehd
如图2所示,峰435m/z是根皮苷的负离子准分子峰[Ph-H]-(Ph=Phlridzin,根皮苷);峰273m/z是根皮苷分子失去一个葡萄糖残基的负离子峰[Ph-glucoside]-;峰471m/z 是含2个结合水的根皮苷准分子峰[Ph·2H2O-H]-。这个三叶苷的ESI-MS结果与标准品根皮苷结果完全一致(图3A)。
2.1.3 NMR检测结果
1.1H-NMR:
δ(H-2, H-6)=7.01, δ(H-3, H-5)=6.65;δ(H-3', H-5')=6.05;δ(H-β) = 2.77。
2.13C-NMR:
δ(C-1) = 131.4, δ(C-2, C-6) = 129.1, δ(C-3, C-5) = 115.0,δ(C-4) = 155.4;
δ(C-1') = 105.3, δ(C-2', C-6') = 163.9, δ(C-3', C-5') = 94.9,δ(C-4') = 163.3;
δ(C = O) = 205.0, δ(C-α) = 45.6, δ(C-β) = 29.3;
δ(G-1) = 99.5, δ(G-2) = 73.0, δ(G-3) = 77.1, δ(G-4) =69.2, δ(G-5) = 76.4, δ(G-6) = 60.4。
上述测定结果与文献报道根皮素- 4′-β- D -葡萄苷测定结果一致,因此确定该化合物为根皮素- 4′-β- D -葡萄糖苷(trilobatin,trb)即三叶苷,结构式见图3(B)。
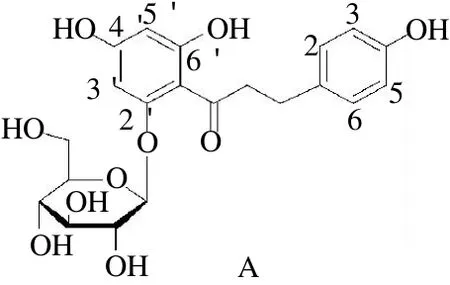
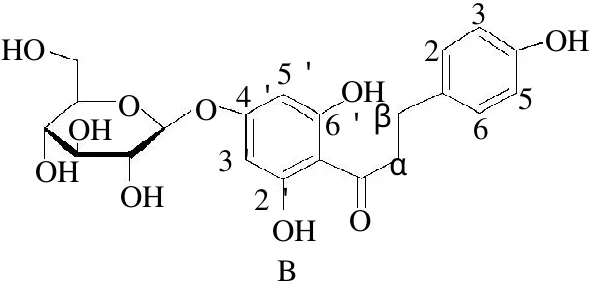
图3 根皮苷(A)和三叶苷(B)的化学结构式Fig.3 Chemical structures of phloridzin (A) and trilobatin (phloretin-4-β-D-glucoside) from Lithocarpus polystachyus Rehd (B)
2.2 三叶苷对α-葡萄糖苷酶和α-淀粉酶活性的抑制
2.2.1 与阿卡波糖和芦丁的比较

图4 阿卡波糖、三叶苷、芦丁对α-葡萄糖苷酶和α-淀粉酶活性抑制作用对比Fig.4 Inhibitory effects of trilobatin, acarbose, and rutin at a concentration level of 0.8 mg/mL onα-glucosidase (A) andα-amylase(B)
从图4A可看出,多穗柯三叶苷对α-葡萄糖苷酶活性有较强的抑制作用,抑制率明显高于芦丁,与阿卡波糖没有明显区别;对α-淀粉酶活性虽也有抑制作用,但抑制率却明显低于阿卡波糖(图4B)。这说明多穗柯三叶苷是一种较强的α-葡萄糖苷酶抑制剂和较弱的α-淀粉酶抑制剂。
2.2.2 不同质量浓度三叶苷、阿卡波糖和芦丁对α-葡萄糖苷酶抑制活性的影响
由图5可见,随着三叶苷质量浓度的增加,对α-葡萄糖苷酶的抑制活性也随之上升,至0.8mg/mL时达到最高,说明三叶苷对α-葡萄糖苷酶的抑制活性是剂量依赖型的。比较不同质量浓度三叶苷、阿卡波糖和芦丁对α-葡萄糖苷酶抑制活性可看出,随质量浓度增加,三叶苷对α-葡萄糖苷酶抑制活性的上升速度快于芦丁,但稍慢于阿卡波糖。三叶苷抑制α-葡萄糖苷酶活性的IC50值为0.37mg/mL,也是介于阿卡波糖(0.28mg/mL)和芦丁(0.45mg/mL)之间。

图5 不同质量浓度三叶苷、阿卡波糖和芦丁对α-葡萄糖苷酶的抑制作用Fig.5 Concentration dependent inhibitory effects of trilobatin,acarbose, and rutin on α-glucosidase
2.2.3 三叶苷对α-葡萄糖苷酶活性抑制机理
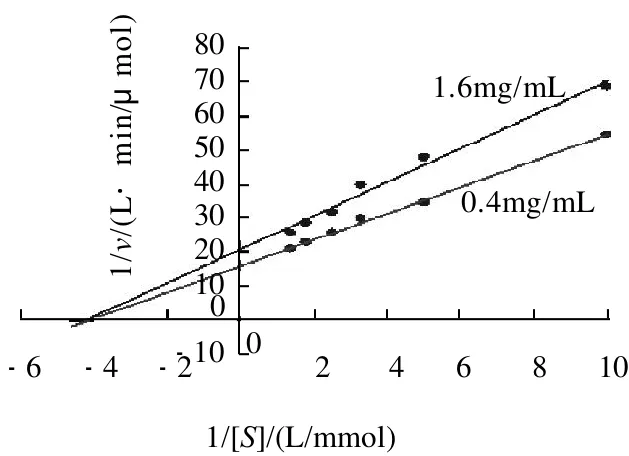
图6 三叶苷抑制α-葡萄糖苷酶Lineweaver-Burk双倒数曲线图Fig.6 Lineweaver-Burk plot analysis of the inhibition kinetics of trilobatin on α-glucosidase
由图6可见,不同质量浓度的两条三叶苷抑制曲线倒推相交于X轴负值区域,与典型的非竞争性抑制图形完全一致,说明三叶苷对α-葡萄糖苷酶的抑制机理属于非竞争性抑制。
2.3 三叶苷对DPPH自由基清除能力
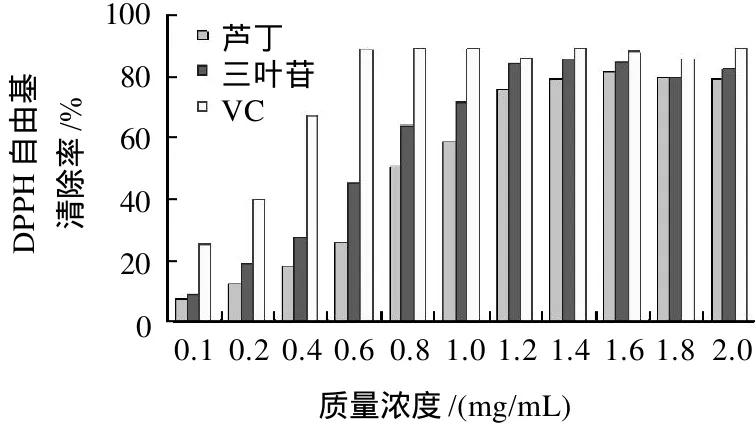
图7 三叶苷、芦丁、VC对DPPH自由基的清除率Fig.7 DPPH radical scavenging activity of VC,trilobation and rutin
由图7可见,随着质量浓度增加,三叶苷对DPPH自由基的清除活性也随之上升,质量浓度增加到1.2mg/mL时,清除DPPH自由基活性达到最高,与VC相当,高于芦丁,之后不再上升。这说明多穗柯黄酮三叶苷有较强的抗氧化活性,而且在一定范围内呈浓度依赖型。三叶苷、VC和芦丁清除DPPH自由基活性的IC50值分别为0.57、0.24、0.72mg/mL,三叶苷的IC50值虽然低于VC,但还是比芦丁高。因此多穗柯黄酮三叶苷是一种较好的天然抗氧化剂。
3 结 论
多穗柯黄酮三叶苷对α-葡萄糖苷酶和α-淀粉酶活性都有明显的抑制作用;与阿卡波糖一样有很强的抑制α-葡萄糖苷酶活性的作用,而对α-淀粉酶活性的抑制作用却明显弱于阿卡波糖;三叶苷还具有较强的抗氧化能力。从上述研究结果看,多穗柯黄酮三叶苷对α-葡萄糖苷酶和α-淀粉酶活性都有明显的抑制作用,与糖尿病治疗药物阿卡波糖比较,与阿卡波糖一样有很强的抑制α-葡萄糖苷酶活性的作用,而对α-淀粉酶活性的抑制作用却明显弱于阿卡波糖,加上三叶苷还具有较强的抗氧化能力,多穗柯黄酮三叶苷是一个值得进一步研究开发的抗糖尿病天然活性物质。
[1] MAHLER R J, ADLER M L. Type 2 diabetes mellitus: update on diagnosis, pathophysiology, and treatmeant[J]. Clinical Endocrinology Metabliosm, 1999, 84: 1165-1167.
[2] KRENTZ A J, BAILEY C J. Oral antidiabetic agents: Current role in type 2 diabetes mellitus[J]. Drugs, 2005, 65: 385-411.
[3] BRINK S, LAFFEL L. Sick day management in children and adolescents with diabetes[J]. Pediatric Diabetes, 2009, 12(10): 146-153.
[4] BROWNLEE M. The pathobiology of diabetic complications[J].Diabetes, 2005, 54: 1615-1625.
[5] DICARLI M F, JANISES J, GRUNBERGER J. Role of chronic hyperglycemia in the pathogenesis of coronary microvascular dysfunction in diabetes[J]. Am Coll Cardiol, 2003, 41: 1387-1393.
[6] HAFFNER S M. The importance of hyperglycemia in the nonfasting state to the development of cardiovascular disease[J]. Endocrine Rev,1998, 19: 583-592.
[7] YEE H S, FONG N T. A review of the safety and efficacy of acarbose in diabetes mellitus[J]. Pharmacotherapy, 1996, 16: 792-805.
[8] GRAY D M. Carbohydrate digestion and absorption-role of small intestine[J]. New England Journal of Medicine, 1995, 29: 1225-1230.
[9] HORII S, FULASSE K, MATSUA T. Synthesis and α-D-glucosidase inhibitory activity of N-substituted valiolamine derivatives as potent oral antidiabetic agents[J]. Journal of Medicinal Chemistry,1987, 29:1038-1046.
[10] KWON Y I, VATTEM D A, SHETTY K. Clonal herbs of Lamiaceae species against diabetes and hypertension[J]. Asia Pacific Journal of Clinical Nutrition, 2006, 15: 107-118.
[11] 中国科学院植物研究所. 中国高等植物图鉴(第一册)[M]. 北京: 科学出版社, 1972: 434-445.
[12] 全国中草药汇编编写组. 全国中草药汇编(下册)[M]. 北京: 人民卫生出版社, 1987: 526-527.
[13] 周文华,水谷健二,田中治. 湖南甜茶的甜味成分研究[J]. 食品科学, 1992, 13(4): 17-19.
[14] DONG Huaqiang, NING Zhengxiang,YU Lijing, et al. Preparative separation and identification of flavonoid phloridzin from the crude extract of sweet tea (Lithocarpus polystachyus Rehd)[J]. Molecules, 2007, 12:552-562.
[15] 董华强, 宁正祥, 崔志新. 微波辅助提取多穗柯嫩叶黄酮工艺研究[J]. 农业工程学报, 2007, 23(2): 213-217.
[16] 董华强, 宁正祥, 于立静. 多穗柯黄酮根皮苷对糖尿病小鼠的降血糖血脂效果[J]. 食品科学, 2006, 27(12): 714-717.
[17] KWON Y I, APOSTOLIDIS E, SHETTY K. in vitro studies of eggplant (Solanum melongena) phenolics as inhibitors of key enzymes relevant for type 2 diabetes and hypertension[J]. Bioresource Technology,2008, 99: 2981-2988.
Inhibitory Potential of Trilobatin from Lithocarpus polystachyus Rehd against Key Enzymes Linked to Type ⅡDiabetes and Its Antioxidant Activity
ZHANG Yi1,NING Zheng-xiang1,*,DONG Huang-qiang2
(1. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China;2. Department of Food Science, Foshan University, Foshan 528231, China)
The inhibitory effects of trilobatin separated from Lithocarpus polystachyus Rehd on the activities of α-glucosidase and α-amylase were determined and compared with those of the anti-diabetic drug acarbose as a positive control and the type of the enzymatic inhibition on α-amylase was investigated. Also, rutin was used as a positive control to measure the ability of the trilobatin from Lithocarpus polystachyus Rehd to scavenge DPPH free radicals. The results showed that α-glucosidase activity was inhibited remarkably by the trilobatin, and the inhibition was noncompetitive and did not exhibit a significant difference when compared to acarbose. Its inhibition rate against α-amylase, however, was lower than that of acarbose despite of having stronger DPPH free radical scavenging effect than rutin. From these experimental results, a conclusion could be drawn that the trilobatin from Lithocarpus polystachyus Rehd is a potential anti-diabetic compound.
trilobatin;Lithocarpus polystachyus Rehd;α-glucosidase;α-amylase;diabetes
Q946.83
A
1002-6630(2011)05-0032-04
2010-07-05
广东省自然科学基金项目(8152800001000023)
张毅(1985—),女,硕士研究生,研究方向为食品化学。E-mail:zhangyi85518@yahoo.com.cn
*通信作者:宁正祥(1957—),男,教授,博士,研究方向为食品生物化学。E-mail:fezhning@scut.edu.cn
