钝顶螺旋藻在不同光照条件下的放氧特性
2011-09-29薛升长张庆华吴霞丛威
薛升长,张庆华,吴霞,丛威
1 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
2 中国科学院研究生院,北京 100049
钝顶螺旋藻在不同光照条件下的放氧特性
薛升长1,2,张庆华1,吴霞1,丛威1
1 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
2 中国科学院研究生院,北京 100049
钝顶螺旋藻在持续照光和中等频率 (0.01~20 Hz) 的光/暗交替照光下的放氧特性对光生物反应器的设计和操作具有重要意义。构建了一套可实现光/暗交替的光生物反应器系统对此进行研究,结果显示:根据与放氧速率的关系,可以将光强分为 4 个区:光限制区 (0~335 µmol/(m2·s)),过渡区 (335~875 µmol/(m2·s)),光饱和区 (875~2 775 µmol/(m2·s))以及光抑制区 (2 775 µmol/(m2·s)以上)。提高光/暗频率能否提高微藻光合速率取决于所采用的光强和光比例:低光强、低光比例下无明显提高;在光比例处于0.1~0.6之间时,光强越高,提高光/暗频率所带来的光合速率提高的幅度越大。研究结果对于实际生产的指导意义是,在午间高光强下提高藻液混合程度所带来的光合速率的提高相对于早晚低光强下更加明显,经济上更加可行。
微藻,螺旋藻,光生物反应器,光/暗交替,光合放氧
Abstract:The knowledge of oxygen evolution characteristics, which is a symbol of photosynthetic activity, under various light conditions is important for photobioreactor design and operation. In this study, we constructed a device to investigate oxygen evolution characteristics of Spirulina platensis under two different light regimes: 1) continuous illumination of various light intensities (14−6 500 µmol/(m2·s)); 2) medium frequency L/D cycles of four different light intensities (69, 505, 1 330,4 265 µmol/(m2·s)). Light limited region, intermediate region, light saturated region and light inhibited region of light intensity were recognized according to their relationship with oxygen evolution rate (OER) under continuous illumination. Investigation of S. platensis under L/D cycles showed whether photosynthetic efficiency could be increased with increasing L/D frequency largely depended on the light intensity applied. The higher the light intensity, the larger the photosynthetic enhancement could be expected with the increase of L/D frequency. The largest light integration effect was found under L/D cycles of high light intensity(4 265 µmol/(m2·s)) and medium light fraction (k=0.6), while light integration effect was totally absent under low light fractions(k<0.2). We also discussed their implications to the practical aspects of microalgae cultivation.
Keywords:microalgae, Spirulina, oxygen evolution rate, photobioreactor, light/dark cycles
微藻能利用相对廉价的物质,如 CO2、碳酸盐等作碳源,将太阳能转变成化学能储存在生物质中,同时富集有用的代谢产物,对解决人类社会所面临的资源、环境、能源和食品等方面的问题具有广阔的前景[1-2],受到了越来越多的关注。室外培养微藻通常采用2种方式:开放池和密闭式光生物反应器。无论以何种方式培养,光能的获得都是微藻生长的一个限制性因素[3]。由于微藻细胞之间的相互遮挡,光强在反应器内的分布沿着光照面呈指数级衰减。距离反应器光照面近的地方,光强比较高,微藻的生长速率较快,这部分区域属于反应器的光区;在远离光照面的反应器内部,光强比较低或者完全黑暗,微藻基本不生长或者生长速率为负值,这部分属于反应器的暗区。由于反应器内藻液的流动、混合,造成微藻细胞来回穿梭于反应器的光区和暗区,即微藻细胞经历一定的光/暗交替。因此,研究微藻在不同光/暗交替下的响应特性对于指导光生物反应器的设计和操作具有重要意义。
前期关于微藻对不同光/暗交替响应的研究[4-6]多数都集中在高频范围 (>100 Hz,频率是指光/暗交替周期的倒数)。实际上,在反应器中更常见的是中等频率 (0.01~20 Hz) 的光/暗交替[7]。这方面的研究不多,仅有的几篇研究得到的结论也不一致。一种观点认为,中等频率光/暗交替可以显著提高光合速率[8];另一种观点认为中等频率光/暗交替对微藻的光合速率影响不大[9]。另外,前期的研究中所使用的光源由于技术的原因所能达到的光强不高,不足以覆盖微藻在室外培养时所经历的光强范围。
螺旋藻作为一种营养保健食品已经得到广泛的应用,从螺旋藻中提取的活性物质还是药品和化妆品行业的重要原料;此外,螺旋藻还可以用于废水处理或者回收其中的重金属离子[10]。然而,迄今为止关于螺旋藻对不同光/暗交替的响应的研究仍然是一个空白。光合放氧是微藻光合作用的一个指标,因此,本研究首先构建了一套可用于研究光合生物在不同光照条件下放氧特性的装置,它可以提供的光强高达 5 000 µmol/(m2·s)以上,与夏日午间日光强度相当;光/暗频率的范围为 0.01~20 Hz;光比例(光周期在整个光/暗周期中所占的比例,k) 在 0~1内任意可调。此套装置提供的光照条件可以最大限度地模拟户外培养时微藻细胞所经历的光照历程。然后,我们在此装置上研究了钝顶螺旋藻 Spirulina platensis在不同光强下的持续照光和中等频率(0.01~200 Hz) 的光/暗交替照光两种不同光照条件下的放氧特性,为螺旋藻培养及其反应器的设计和操作提供参考。
1 材料与方法
1.1 藻种和培养基
实验藻种为钝顶螺旋藻Spirulina platensis F3品系,烟台大学惠赠。使用Zarrouk培养基,组成如下:NaHCO3(16.601 g/L),K2HPO4(0.647 g/L),NaNO3(2.470 g/L),NaCl (0.988 g/L),MgSO4(0.096 g/L),K2SO4(0.988 g/L), CaCl2(0.040 g/L), FeSO4(0.005 g/L),EDTA-Na2(0.080 g/L);微量元素溶液:H3BO3(2.860 mg/L),MnCl2·4H2O (1.145 mg/L),CuSO4·5H2O (0.080 mg/L),(NH4)6Mo7(0.019 mg/L),ZnSO4(0.123 mg/L)。培养基120 ℃灭菌15 min,冷却后使用。
1.2 实验装置
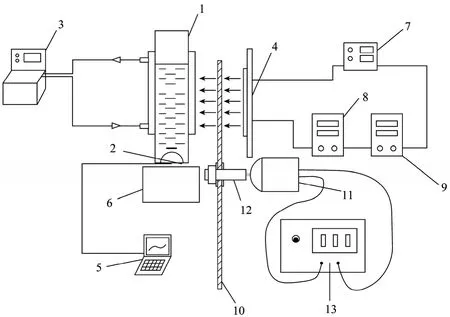
图1 测定螺旋藻在不同光照条件下放氧特性的实验装置图Fig. 1 Experimental setup for oxygen evolution measurement under different light conditions. 1: sample chamber; 2: oxygen electrode; 3: thermal-stat water batch; 4: light source; 5: data logger; 6: stirrer; 7: DC power supply; 8: timer 1; 9: timer 2; 10: partly darkened rotating disc; 11: motor; 12: rotating shaft; 13: speed regulator.
测定微藻在不同光照条件下放氧特性的装置如图1所示。其中,氧电极2 (DW2/2,英国Hansatech仪器公司) 用于测定样品室1 (有效体积约2.5 mL)中藻液氧浓度,测得的数据通过记录仪5实时监测;样品室内藻液通过搅拌获得良好的混合;样品室本身配有排气和封盖装置,可使得其内藻液不与外界进行气体交换;因此,样品室中溶氧浓度的变化即反映了微藻细胞光合作用放氧和呼吸作用耗氧对溶氧浓度的影响。微藻光合作用所需的光强由大功率白光LED阵列 (10×10) 4 (半导体发光二极管,100 W,深圳鹏运发光电有限公司) 提供,最高可达5 000 µmol/(m2·s)以上,与夏日午间日光强度相当。光照系统可以给样品室提供 3种不同的光照条件:1) 持续照光;2) 小于1 Hz的光/暗交替照光,通过直流稳压电源7、时间继电器1和2 (DH48S-S,北京华北一开电器有限公司) 组成的电路控制光源的输出来获得;3) 大于或等于1 Hz的光/暗交替照光通过部分透光的转盘10的转动来获得。在实验过程中通过恒温水浴3 (SC-15,宁波市海曙天恒仪器厂)控制样品室温度恒定。
本装置测定微藻在不同光照条件下放氧速率的原理如下:
1) 持续照光时,转盘 10保持全透光或者将其透光面置于光源和样品室之间,电磁继电器 1输出一个3 min/3 min (双延时来回循环) 的光/暗交替,电磁继电器2保持常闭。在3 min的光周期内,微藻细胞进行光合作用放出氧气,藻液中氧浓度升高;在3 min的暗周期内,微藻进行呼吸作用消耗氧气,藻液中氧浓度降低 (在实际操作中,也可以适当调整暗周期的长度使得藻液中氧浓度降低到大致与光周期开始之前相同的水平,使得每一个光照条件下起始氧浓度大致相同,同时也可以保证藻液中氧浓度不致升高到超出氧电极的测量范围)。测定完一个光强下的放氧情况之后,调整直流稳压电源的输出进行下一个光强下的放氧实验。实验过程中藻液中氧浓度的变化通过记录仪实时在线监测,得到一条“氧浓度-时间”曲线,实验结束后对曲线在光照时间段内的斜率取平均值即可得到此光照条件下的放氧速率。
2) 在小于1 Hz的光/暗交替照光条件下,转盘10保持全透光或者将其透光面置于光源和样品室之间,电磁继电器1同样输出一个3 min/3 min的光/暗交替,电磁继电器2输出一个欲测定的光/暗比 (比如2~8 s,双延时)。两个继电器串联控制的结果是,在3 min的光周期内,微藻细胞接受的是一定频率和光比例的光/暗交替照光。除此之外,测定原理的其他方面都与持续照光相同。
3) 在大于或等于 1 Hz的光/暗交替照光条件下,电磁继电器1输出一个3 min/3 min的光/暗交替,电磁继电器2保持常闭,部分透光的转盘在电机的带动下转动,由此实现样品室表面的光/暗交替受光。此处,部分透光的转盘是通过在全透光的有机玻璃板上粘贴上一定角度的黑色扇形不干胶纸来获得,不同光比例通过调节不干胶纸的扇形角度获得;转盘可以布置 1个透光区,也可以均匀的布置多个透光区,通过调速器13调节转盘转速,可以获得各个不同的光/暗频率。
1.3 实验方法
过滤收集培养至对数期的螺旋藻细胞,以新鲜培养基稀释至特定浓度 (OD560为 0.15左右),加入氧电极样品室,将样品室内空气排出并密封。通过恒温水浴控制培养室温度在35 ℃,样品室搅拌转速50 r/min。分别测定以下两种光照条件下的放氧速率:1) 持续照光,光强范围 14~6 700 µmol/(m2·s);2) 4种不同光强下的光/暗交替照光,光比例0.05~0.9,频率0.01~20 Hz。
1.4 分析方法
1.4.1 PFD-电压曲线
样品室中光强 (以光量子通量密度表示,photo flux density,PFD) 通过光合有效辐射光量子计 (波长范围400~700 nm,英国Hansatech仪器公司) 测定,PFD与电源输出电压的关系如图2所示。实验过程中通过调节电源的输出电压来获得不同的PFD。
1.4.2 氧浓度
有关氧电极测定藻液中氧浓度的原理和方法参照Hansatech仪器公司提供的使用说明书。
1.4.3 放氧速率
作为光合作用速率的重要指标,放氧速率(Oxygen evolution rate,OER) 以单位质量的叶绿素在单位时间内放出的氧气量 (µmol O2/(mg Chl·h))来表示。氧电极可以直接测出氧浓度,叶绿素含量采用文献[11]的方法测定。根据测得的结果经过换算即可得到放氧速率。
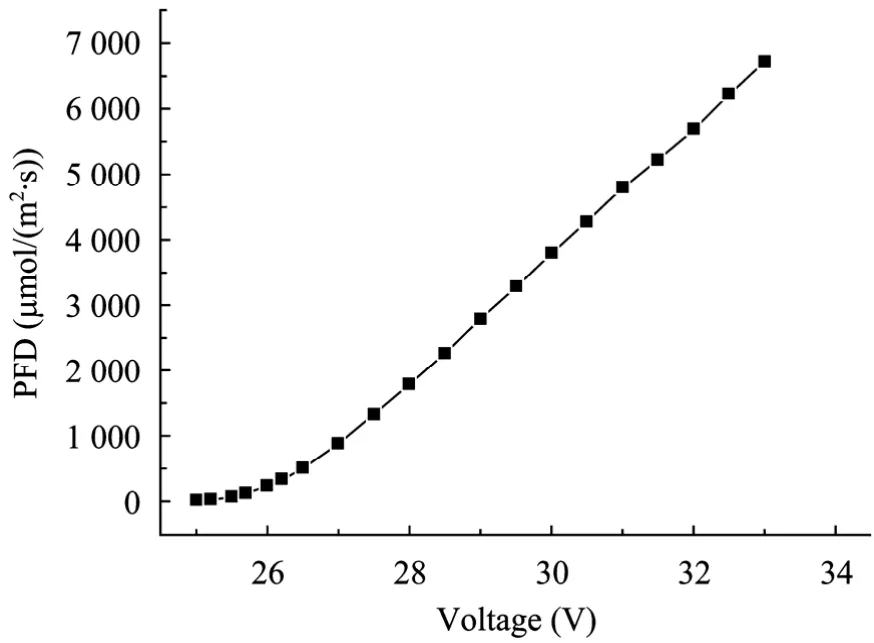
图2 样品室中PFD与电源的输出电压之间的关系Fig. 2 Dependence of photo flux density (PFD) in the sample chamber on the power output.
2 结果
2.1 持续照光下的放氧特性
不同光强、持续照光下放氧速率如图3所示。
根据同放氧速率之间的关系,可以把光强分为4个区:1) PFD 小于 335 µmol/(m2·s) 时,OER 随着PFD线性增加,螺旋藻在此光强范围内处于光限制区;2) PFD 在 335~875 µmol/(m2·s) 之间时,OER随着PFD缓慢增加,螺旋藻介于光限制和光饱和之间;3) PFD 在 875~2 775 µmol/(m2·s) 之间时,OER近似保持不变或者稍有减低,螺旋藻处于光饱和区;4) PFD 大于 2 775 µmol/(m2·s) 之间时,OER随PFD的增加迅速降低,螺旋藻在此光强范围内处于光抑制区。
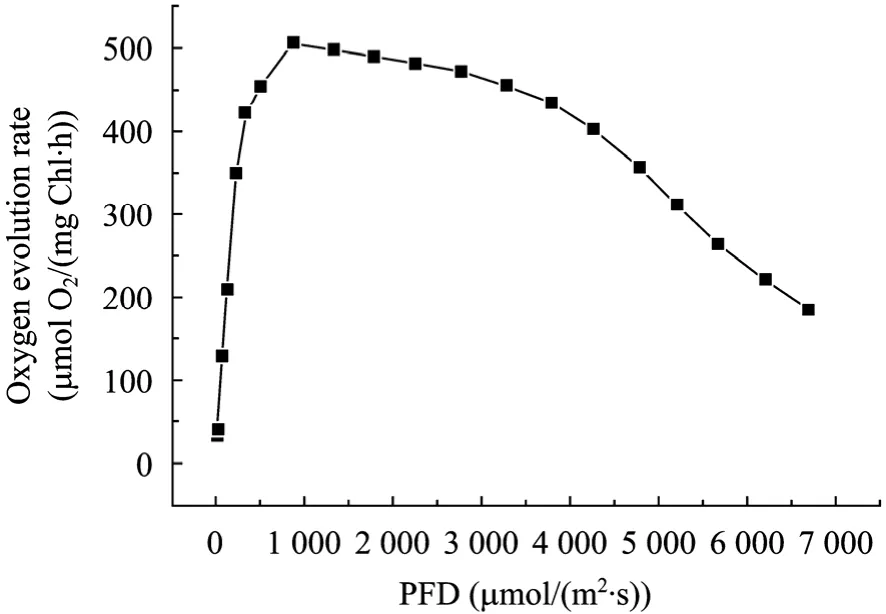
图3 螺旋藻在持续照光下的放氧速率随光强的变化Fig. 3 OER of S. platensis under continuous illumination of different PFDs. PFD: photo flux density.
2.2 光/暗交替照光条件下的放氧特性
根据持续照光下的研究结果,选取了 4个不同光强 (69、505、1 330、4 265 µmol/(m2·s),分别代表4个不同的光照区),来研究光/暗频率对螺旋藻放氧速率的影响,结果如图4所示。
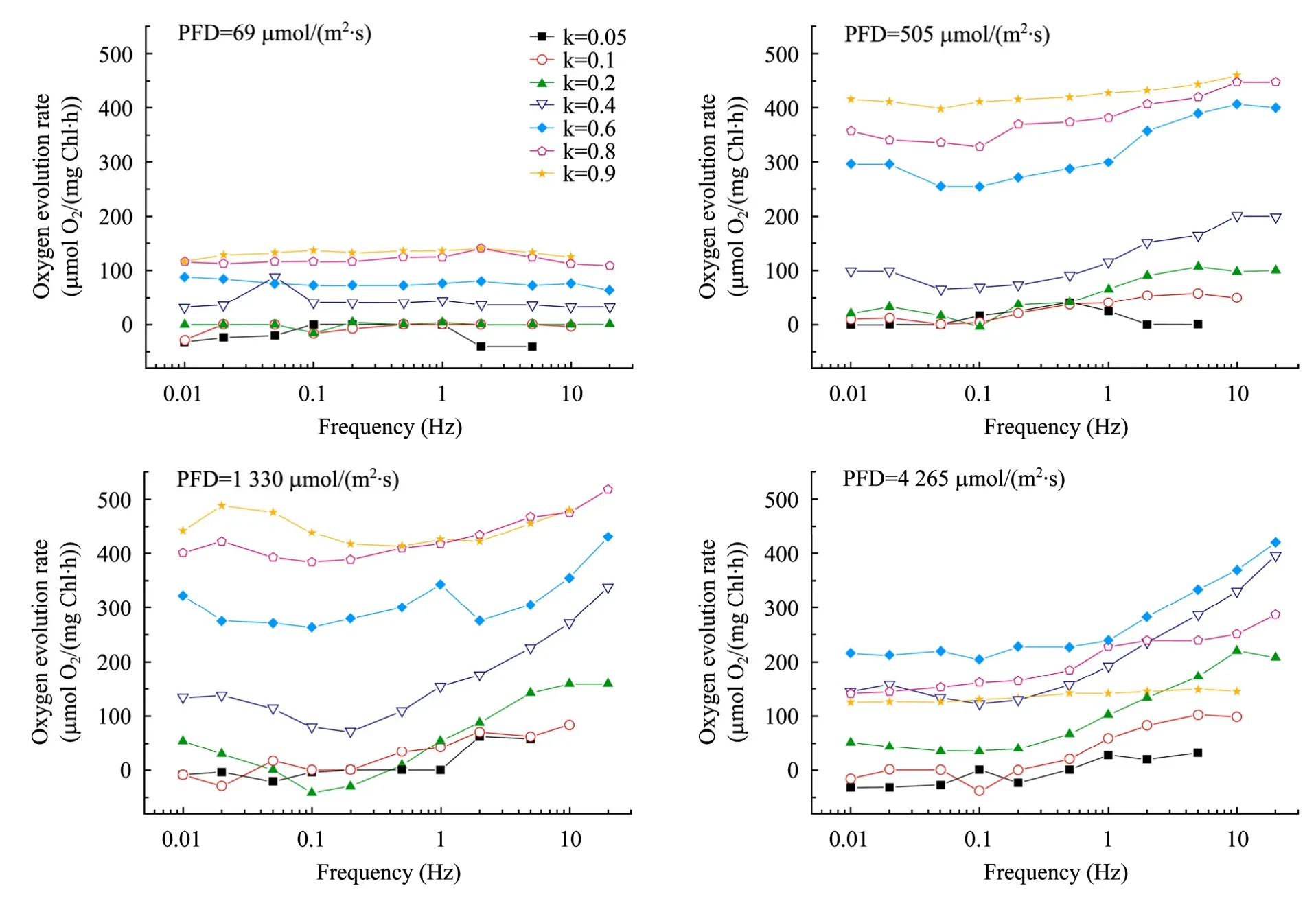
图4 光/暗交替照光下螺旋藻的放氧速率随光/暗频率的变化Fig. 4 OER of S. platensis under L/D cycles of different frequencies.
研究光/暗交替对螺旋藻光合放氧的影响的主要目的是据此来提高螺旋藻的光合速率、增加产量,从图中可以看出:1) 在低光强 (PFD=69 µmol/(m2·s))光/暗交替照光条件下,螺旋藻放氧速率基本不受光/暗频率的影响,表明在光限制条件下,螺旋藻的放氧速率仅与细胞接收到的光子绝对数量有关,而与接收光子的频率无关;当螺旋藻在此光强下培养时,增加搅拌、强化混合不会导致光合速率的提高;2) 在接近光饱和 (PFD=505 µmol/(m2·s)) 的光/暗交替照光条件下,螺旋藻的放氧速率随着光/暗频率的增加有少量的增加,表明光/暗频率开始对螺旋藻的光合作用发挥影响;3) 在高光强 (PFD=1 330和4 265 µmol/(m2·s))、中低光比例 (k≤0.6) 条件下,提高光/暗频率,螺旋藻放氧速率迅速增加。因此,在户外午间高光强下培养螺旋藻时,提高藻液的混合频率会明显提高螺旋藻的光合效率、增加单位面积产量。本实验室前期在平板式光生物反应器中的研究结果[12]表明,室内光限制条件下强化培养液混合对螺旋藻光能利用率影响不大;在室外高光强下,提高培养液混合程度会明显提高螺旋藻的光能利用率,这与本文的研究结果是一致的。而在高光强、高光比例 (k≥0.8) 条件下,由于螺旋藻在单位时间内接收的光量子密度 (k·PFD) 已经饱和,因此,提高光/暗频率对螺旋藻放氧速率影响不大。
光照对微藻光合作用的影响通过 3个指标来体现:光强、光/暗频率、光比例,它们分别决定了藻细胞接受光照时的光量子密度、接受光照的频率、每次接受光照的时间占光/暗周期的比例。持续光照可视为光比例为1的光/暗交替照光,此时光/暗频率对微藻光合作用无影响;光比例越高,其结果越接近于持续光照下的情况。因此相对于中低光比例,高光比例下光/暗频率对微藻光合作用的影响较小。
另外,在较低的光比例 (k<0.2) 下,螺旋藻的放氧速率比较低,特别是在低光强、低光/暗频率下,此速率接近于零,甚至为负值;此时光合效率低,实际生产中应尽量避免这种情况的出现。增加光强、提高光/暗频率可以有效缓解此现象。在室外培养螺旋藻时,所采用的反应器光照方向上厚度越大、藻细胞培养密度越高,光区在整个反应器中所占的比例就越低,微藻细胞所经历的光/暗交替的平均光比例也越低。此时为了保证光能的利用效率,必须提高光强、提高光/暗频率。
从 PFD=4 265 µmol/(m2·s) 的研究结果还可以看出,最高的放氧速率出现在光比例 k=0.6处,表明当光比例小于 0.6时,螺旋藻的光合作用受到光的限制,而光比例大于 0.6时过多的光能输入对螺旋藻产生了抑制,造成放氧速率下降。另外,整体上 PFD=505 µmol/(m2·s) 和 PFD=1 330 µmol/(m2·s)的放氧速率都比 PFD=4 265 µmol/(m2·s) 的放氧速率高,这也说明了过多的光能输入会对螺旋藻的光合作用产生抑制,这时如果能够对反应器表面进行部分遮光则会明显提高光合速率、增加产量。
2.3 光集成效应
为了解释光/暗交替对微藻光合放氧或者生长的影响,Terry[13]提出了光集成效应 (Light integration effect) 的概念,定义如下:在连续光照下,微藻的生长或者放氧速率 (以 µ表示) 与输入的光量子通量密度 (PFD) 呈饱和动力学关系 (类似酶促反应动力学),以 µ=f (PFD) 表示;在光比例为 k的光/暗交替下,完全光集成时µ=f (k·PFD),完全无光集成时则有µ=k·f (PFD);由于f为饱和动力学方程,必有 f (k·PFD)>k·f (PFD);一般的情况下,光/暗交替对微藻的影响介于完全光集成和完全无光集成之间,即 k·f (PFD)<µ<f (k·PFD)。本文以光/暗频率为1 Hz的结果为例比较了各个不同光强、不同光比例下的光集成效应。结果如图5所示。横坐标为光比例,纵坐标是相对于指定光强、持续照光下的结果进行归一化的放氧速率。图中虚线是连接k=0和k=1两点的一条斜率为 1的直线,实验点落在虚线上表明完全无光集成,光合效率与相同光强下的持续照光相同;实验点落在虚线的上方代表存在光集成效应,光合效率高于持续照光;距离虚线越远,光集成效应越大;实验点落在虚线下方代表不仅不存在光集成效应,而且光合效率低于相同光强下的持续照光。
从图中可以看出,在光强较低时 (图5A~5C),光比例小于 0.4时基本上不存在光集成效应,光合效率低于相同光强下的持续照光;光比例大于 0.6时存在光集成效应,但是光集成的程度不高。在高光强 (PFD=4 265 µmol/(m2·s)) 下,各种光比例下都存在光集成效应,光集成的相对程度取决于光比例,光集成效应最强的点出现在 k=0.6处。根据本文的研究结果可以看出,微藻在光/暗交替下是否存在光集成效应和光合增益效应取决于所采用的光强和光比例,低光强、低光比例下不存在光集成效应和光合增益效应;光强越高,采用光/暗交替所带来的光集成效应和光合增益效应越明显。Janssen等[14]在中等光强、中等频率光/暗交替下的研究结果表明,微藻在光/暗交替下是否存在光集成效应和光合增益效应取决于所采用的光比例,光比例低于0.5时不存在光集成效应,这与本文的研究结果是比较吻合的。
3 讨论
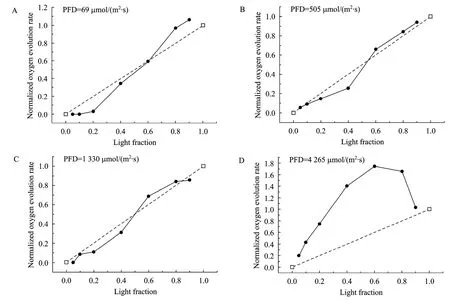
图5 螺旋藻归一化的放氧速率随光比例的变化Fig. 5 Normalized OER of S. platensis influenced by light fraction of L/D cycles.
本文研究了钝顶螺旋藻 S. platensis在各种不同光照条件下的放氧特性,所采用的光照条件基本覆盖了微藻在室外培养时可能碰到的情况。结果表明:1) 根据持续照光下与放氧速率关系,可以把光强分成 4 个区:光限制区 (0~335 µmol/(m2·s)),过渡区 (335~875 µmol/(m2·s)),光饱和区 (875~2 775 µmol/(m2·s)) 以及光抑制区 (2 775 µmol/(m2·s)以上);2) 在光限制条件下,提高光/暗频率不能提高放氧速率和光能利用率;在高光强下,提高光/暗频率能够大幅提高螺旋藻的放氧速率,从而明显提高其光能利用率;3) 在低光强、低光比例下,光合放氧接近于零甚至为负值,说明在此条件下光能利用效率低,实际生产中应尽量避免此种情况的出现;4) 最大的光集成效应出现在高光强、中等的光比例条件下,其他情况下不存在光集成效应或者光集成效应不明显。
本文的研究结果对实际生产具有一定的指导意义。为了提高光/暗频率,需要强化藻液的混合,因此需要增加额外的能量输入,这在经济上是否可行主要取决于由此带来的光合速率提高的幅度。由研究结果可以明显看出,在午间高光强时强化混合带来的经济效益明显大于早晨和傍晚时较低光强的情况。因此,可以分时段采用不同搅拌强度操作,在午间高光强时强化搅拌混合。另外,培养密度过高或者反应器厚度过大会造成反应器中微藻细胞整体的光比例较低,这在光强不高时对于生产并不经济,在螺旋藻培养和反应器设计时应尽量避免。
REFERENCES
[1] Raja R, Hemaiswarya S, Kumar NA, et al. A perspective on the biotechnological potential of microalgae. Crit Rev Microbiol, 2008, 34(2): 77−88.
[2] Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae. J Biosci Bioeng, 2006, 101(2):87−96.
[3] Richmond A. Principles for attaining maximal microalgalproductivity in photobioreactors: an overview.Hydrobiologia, 2004, 512(1/3): 33−37.
[4] Phillips JN, Myers J. Growth rate of chlorella in flashing light. Plant Physiol, 1954, 29(2): 152−161.
[5] Matthijs HCP, Balke H, van Hes UM, et al. Application of light-emitting diodes in bioreactors: flashing light effects and energy economy in algal culture (Chlorella pyrenoidosa). Biotechnol Bioeng, 1996, 50(1): 98−107.
[6] Nedbal L, Tichý V, Xiong FS, et al. Microscopic green algae and cyanobacteria in high-frequency intermittent light. J Appl Phycol, 1996, 8(4/5): 325−333.
[7] Grobbelaar JU. Tubulence in mass algal cultures and the role of light/dark fluctuations. J Appl Phycol, 1994, 6(3):331−335.
[8] Lee YK, Pirt SJ. Energetics of photosynthetic algal growth: influence of intermittent illumination in short(40 s) cycles. J Gen Microbiol, 1981, 124(1): 43−52.
[9] Grobbelaar JU. The influence of light/dark cycles in mixed algal cultures on their productivity. Bioresour Technol, 1991, 38(2/3): 189−194.
[10] Converti A, Lodi A, Del Borghi A, et al. Cultivation of Spirulina platensis in a combined airlift-tubular reactor system. Biochem Eng J, 2006, 32(1): 13−18.
[11] Boussiba S, Vonshak A. Astaxanthin accumulation in the green algae Heamatococuus pluvialis. Plant Cell Physiol,1991, 32(7): 1077−1082.
[12] Su ZF, Xue SZ, Kang RJ, et al. Influence of the mixing intensity on the Spirulina platensis flat-plate photo-bioreactor culturing. China Biotechnol, 2009, 29(3):51−56.
苏贞峰, 薛升长, 康瑞娟, 等. 平板式光生物反应器培养液混合强度对螺旋藻生长的影响. 中国生物工程杂志, 2009, 29(3): 51−56.
[13] Terry KL. Photosynthesis in modulated light: quantitative dependence of photosynthetic enhancement on flashing rate. Biotechnol Bioeng, 1986, 28(7): 988−995.
[14] Janssen M, Janssen M, de Winter M, et al. Efficiency of light utilization of Chlamydomonas reinhardtii under medium-duration light/dark cycles. J Biotechnol, 2000,78(2): 123−137.
Oxygen evolution characteristics of Spirulina platensis under various light conditions
Shengzhang Xue1,2, Qinghua Zhang1, Xia Wu1, and Wei Cong1
1 National Key Laboratory Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
2 Graduate School of the Chinese Academy of Sciences, Beijing 100049, China
Received: August 10, 2010; Accepted: November 23, 2010
Supported by: National Key Technology R&D Program of China (No. 2006BAD09A12).
Corresponding author: Wei Cong. Tel: +86-10-82627060; Fax: +86-10-82627074; E-mail: weicong@home.ipe.ac.cn
国家科技支撑计划 (No. 2006BAD09A12) 资助。
