高通量脂肪酶稳定性测定法-ANS法的建立
2011-09-29冯蔚宗林俊涵菜少丽邹有土陈国仁黄平林雅静王冰冰林琳
冯蔚宗,林俊涵,菜少丽,邹有土,陈国仁,黄平,林雅静,王冰冰,林琳
福建师范大学生命科学学院,福州 350108
高通量脂肪酶稳定性测定法-ANS法的建立
冯蔚宗,林俊涵,菜少丽,邹有土,陈国仁,黄平,林雅静,王冰冰,林琳
福建师范大学生命科学学院,福州 350108
根据蛋白质变性后结构变化的特点和荧光探针8-苯胺基-1-萘磺酸 (8-Anilino-1-naphthalenesulfonic acid,ANS)的特性,建立了一种快捷而准确的脂肪酶热稳定性 (Tm) 测定的新方法——ANS脂肪酶稳定性测定法,即将脂肪酶在25 ℃~65 ℃的不同温度下保温30 min后,加入到ANS反应体系 (0.2 mg/mL酶蛋白,0.05 mmol/L ANS,20 mmol/L Tris-HCl(pH 7.2),100~500 mmol/L NaCl) 中。在激发波长378 nm,发射波长465 nm下测定荧光值。通过GraphPad Prism软件分析得出脂肪酶的 Tm。利用该方法测定了野生型扩展青霉脂肪酶及其突变体的Tm值,结果与传统的 NaOH滴定和平板透明圈法的测定结果相似。同时,利用该方法可在96孔板上快速完成数十个样品的Tm测定,从而成为一种快速、可靠、可用于高通量的酶稳定性的测定方法。
脂肪酶,热稳定性,8-苯胺基-1-萘磺酸 (ANS)
Abstract:We have developed a rapid and high throughput lipase-ANS (8-Anilino-1-naphthalenesulfonic acid) assay to evaluate the thermo-stability of lipases based on the ANS fluorescence signal’s increasing and shifting when this small fluorescence probes binds to lipase. The testing lipase samples were incubated at a temperature range of 25 °C to 65 °C for 30 min before mixed with ANS solution (0.20 mg/mL lipase and 0.05 mmol/L ANS in the buffer of 20 mmol/L Tris-HCl, 100 mmol/L NaCl, pH 7.2) in a cuvette or microplate. Fluorescence signals of the samples were measured at EX 378 nm, EM 465 nm with a fluorescence photometer or a plate reader, and Tmwas calculated with the software of GraphPad Prism5.0. The Tmvalues of several mutants of Penicillium expansum lipase (PEL) were measured with this ANS assay and conventional method simultaneously and the results show that Tmvalues are comparative and consistent between these methods, suggesting that the lipase-ANS assay is a reliable,rapid and high throughput method for lipase thermo-stability measurement.
Keywords:lipase, thermostability, 8-anilino-1-naphthalenesul-fonic acid (ANS)
脂肪酶的热稳定性一直是困扰脂肪酶的生产和应用的一个大问题,热稳定性好意味着使用寿命长、作用效果好、易生产、保存和运输。因此,研究其热稳定性具有十分重要的科学及实践意义。目前,脂肪酶的热稳定性通常采用脂肪酶温浴后测定其酶活的变化来确定,耗时繁琐,测定几个样品需要2~3 d。特别是目前人们常用基因随机突变、DNA Shuffling等技术来提高酶的热稳定性,在含有成千上万突变体的突变库中筛选出热稳定性高的突变体。寻找和建立一种快捷、准确的脂肪酶热稳定性测定方法是目前脂肪酶研究迫切需要的。
天然水溶性蛋白的内部大多数为疏水氨基酸,分子表面则常为极性亲水氨基酸,蛋白质受热吸收能量后开始解折叠,内部疏水基团逐渐暴露,在某种程度上,疏水基团的暴露程度随着温度的升高而增大。若能找到某种方法测出这种变化,并排除外界因素的影响,则能快速揭示蛋白的热稳定性。
ANS (8-苯胺基-1-萘磺酸,8-Anilino-1-naphthalenesulfonic acid) 是一种性质特殊且稳定的荧光探针,它可与蛋白质的疏水基团紧密结合,在378 nm激发光的激发下能强烈地发出荧光并导致产生发射波长的移动。理论上,未变性脂肪酶的疏水基团包裹在分子内部,添加ANS后仅发出微弱的荧光;热变性的脂肪酶疏水基团暴露,添加ANS后将发出强烈的荧光,荧光强度与脂肪酶的热变性程度呈正相关[1-2]。据此,有研究将脂肪酶在一系列温度条件下温浴后,加入一定量的 ANS,利用荧光检测仪器检测其荧光强度,作出荧光强度值与温度的函数关系图[2-3],分析得到脂肪酶的 Tm值,从而了解酶的热稳定性。本文报道了这种快捷和有效的脂肪酶热稳定性测定方法——ANS脂肪酶热稳定性测定法。
1 材料与方法
1.1 材料与试剂
脂肪酶酶液为本实验室发酵的基因工程脂肪酶,ANS和Braford assay试剂盒购自上海生工生物工程有限公司,DE52阴离子交换树脂为GE公司产品。
1.2 仪器
恒温水浴锅 (上海一恒DK-8D型),荧光分光光度计 (HITACHI F-4600),多功能酶标仪 (BioTek Synergy HT),蛋白质纯化设备 (上海琪特,HD-21-88型),超滤浓缩装置 (AMICON,Model 8050) 等。
1.3 方法
1.3.1 酶液的处理
含色素粗酶液:基因工程扩展青霉脂肪酶产生菌甲醇诱导摇瓶发酵96 h,10 000 r/min离心20 min获得发酵上清;发酵上清用60%硫酸铵沉淀8 h,10 000 r/min离心20 min,沉淀用20 mmol/L Tris-HCl缓冲液 (pH 7.2) 溶解并透析除盐,每4小时换一次透析缓冲液,共3次。透析后的酶液有较深的色素。
脱色素粗酶液: 含色素粗酶液通过一个除色素短柱,获得除去色素的酶液。
纯酶液:将含色素粗酶液过DE52离子交换柱,以 20 mmol/L Tris-HCl (pH 7.2),250 mmol/L NaCl洗脱液洗脱,获得纯化的酶液。
1.3.2 荧光光谱分析
荧光分光光度计测定:用20 mmol/L Tris-HCl、100 mmol/L NaCl缓冲液 (pH 7.2) 配制含0.2 mg/mL脂肪酶、0.04 mmol/L ANS的测试液600 µL。设置荧光分光光度计的参数如下:EX WL 378 nm,EX slit 5 nm,EM slit 5 nm,PMT Voltage 750 V,反应时间0.5 s,扫描范围:400~700 nm,扫描模式:Emission。进行发射光谱的扫描,以确定合适的发射波长。
多功能酶标仪测定:用20 mmol/L Tris-HCl、500 mmol/L NaCl缓冲液 (pH 7.2) 配制含0.2 mg/mL脂肪酶、0.05 mmol/L ANS的测试液,置于96孔板中,设置多功能酶标仪的参数为:EX:360 nm/20 nm,EM:460 nm/20 nm,sensitivity:55,读取荧光强度值。
1.3.3 ANS脂肪酶Tm测定
将酶液在 25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃下保温 30 min后,与40 µmol/L ANS溶液混合,缓冲体系采用20 mmol/L Tris-HCl,100 mmol/L NaCl (pH 7.2) 以激发波长378 nm,发射波长 465 nm (酶标仪下为 EX:360 nm/20 nm,EM:460 nm/20 nm,sensitivity:55),读取荧光值。GraphPad Prism软件分析得出脂肪酶的Tm。软件分析套用Boltzmann sigmoid公式,如下:
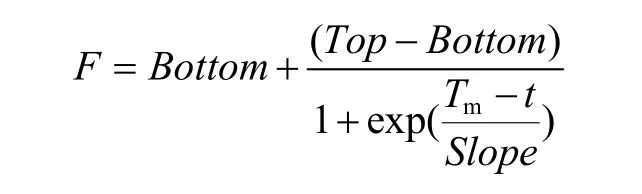
其中,F值为荧光强度值,t值指温度,Bottom指测试窗口的低平台,Top指测试窗口的高平台,Slope指曲线的陡度。所谓测试窗口的低 (高) 平台是指S型曲线中与横坐标轴近似平行的平稳部分。
2 结果与分析
2.1 脂肪酶与ANS的荧光发射光谱
为探讨ANS与脂肪酶结合后荧光光谱的变化,将脂肪酶液在不同温度下 (25 ~65℃ ℃) 处理,与ANS混合后用荧光分光光度计测出荧光强度值。结果显示:低温 (25 ~35℃ ℃) 处理的脂肪酶与ANS结合后不会引起荧光强度的明显变化,最大波长出现在450 nm处 (图1A)。高温 (40 ~65℃ ℃) 处理的混合液的最大发射波长由450 nm移至465 nm处,红移[4]约15 nm,且伴随着荧光强度的大幅提高。如65 ℃处理的脂肪酶与 ANS结合后的荧光强度约为25 ℃处理脂肪酶-ANS的6倍 (图1),荧光强度的变化幅度可产生足够大的测试窗口。
2.2 ANS法测定脂肪酶Tm的影响因素
2.2.1 脂肪酶纯度对ANS法测定Tm的影响
本实验采用的脂肪酶是毕赤酵母基因工程菌发酵表达的脂肪酶,表达产物单一,脂肪酶占 95%[5]以上,SDS-PAGE电泳呈单一条带,但发酵液含有色素。分别利用ANS法对发酵上清、脱色素粗酶液、纯酶液 (蛋白浓度均采用 0.2 mg/mL) 进行了Tm值测定。结果显示:纯酶液和脱色素粗酶液的测试窗口 (曲线高荧光值平台-低荧光值平台) 较大,测出的Tm值分别为38.81 ℃和38.76 ℃,与NaOH滴定(38.7 ℃) 和橄榄油检验板测定残余酶活的结果一致。发酵上清的测试窗口较小,测出的Tm为42.19 ℃(图2A)。明显高于NaOH滴定和橄榄油检验板的测定结果。因此,应采用脱色素粗酶液或纯酶液来进行Tm的测定。而毕赤酵母发酵表达的酶液脱色素只需要通过少量的吸附色素的凝胶,简单快速,可设置高通量方法快速完成。
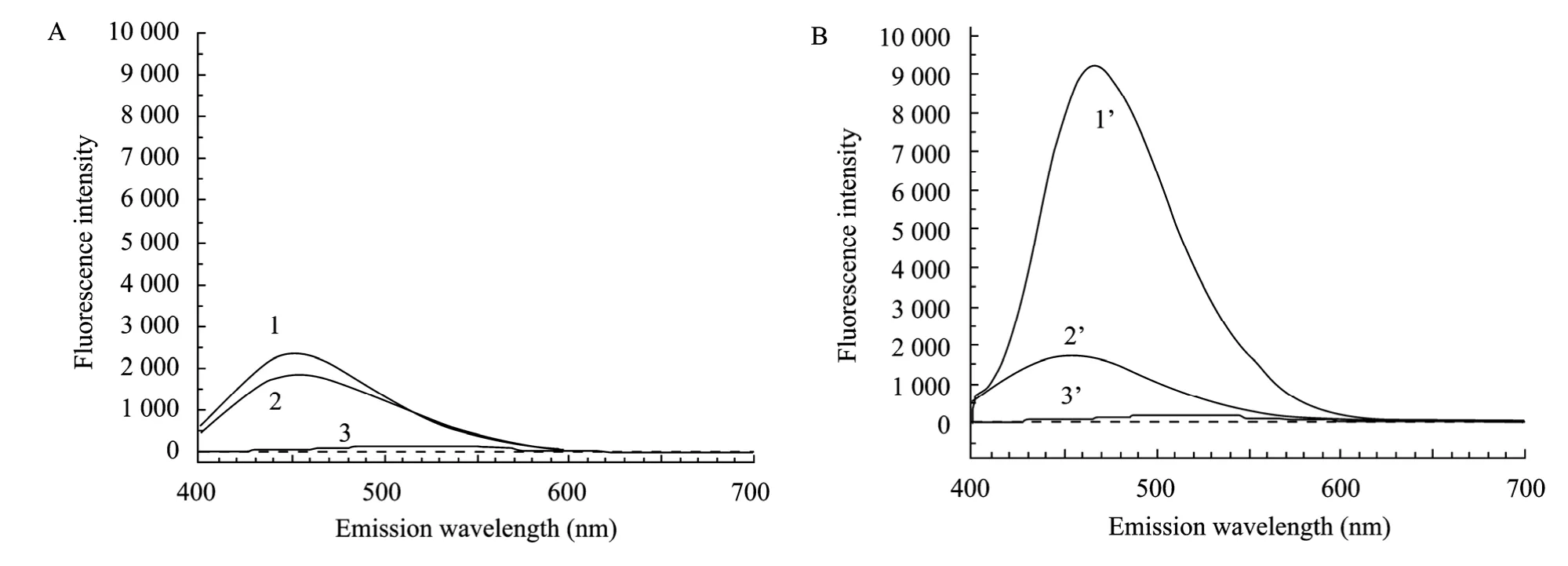
图1 脂肪酶-ANS荧光发射光谱分析. (A) 脂肪酶 (25 °C, 30 min). (B) 脂肪酶 (65 °C, 30 min)Fig. 1 Emission spectrum of lipase-ANS fluorescence. (A) Lipase (25 °C, 30 min). (B) Lipase (65 °C, 30 min). Curve 1 and 1’, 2 and 2’, 3 and 3’are represent the fluorescence emission spectrum of lipase-ANS, lipase, ANS.
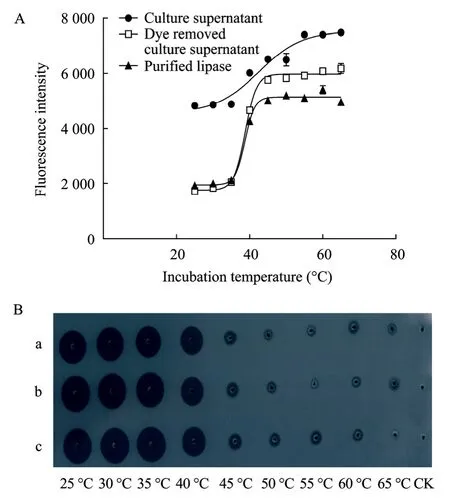
图 2 脂肪酶纯度对 Tm测定值的影响. (A) 脂肪酶-ANS测定. (B) 橄榄油检验板测定Fig. 2 Effect of the enzyme purity on Tmmeasurement. (A)Lipase-ANS assay. (B) Olive oil agar plate assay. a: culture supernatant; b: dye removed culture supernatant; c: purified lipase.
2.2.2 色素对ANS法测定Tm的影响
为探讨色素对ANS法测定结果的影响,本研究分别测定了含色素酶液 (PEL发酵上清用硫酸铵沉淀浓缩得到的酶液) 和脱色素的酶液 (含色素酶液通过脱色素柱处理后得到的酶液) 的Tm值。结果显示:大量色素存在的条件下,荧光值明显增高,Tm值为53.89 ℃,大大高于NaOH酶活测定等其他方法测出的 Tm。去除色素后,测定的脂肪酶的 Tm值为 38.80 ℃ (图 3A),与 NaOH滴定法 (38.7 ℃) 及橄榄油平板法 (图3B) 的测试结果相符合。可见,发酵液含有的色素对脂肪酶Tm的测定有很大的影响。
2.2.3 脂肪酶蛋白和ANS浓度对ANS法测定Tm的影响
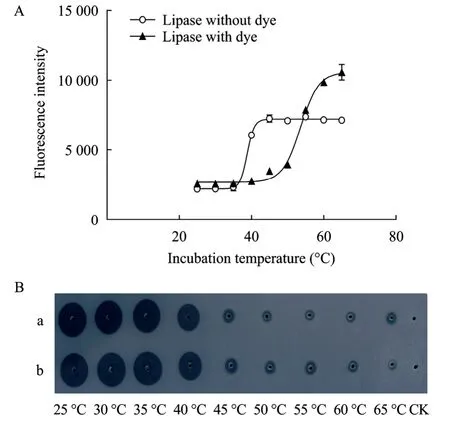
图3 色素对ANS法测定脂肪酶Tm的影响. (A) 脂肪酶-ANS测定. (B) 橄榄油检验板测定Fig. 3 Effect of dye on Tmmeasurement with ANS assay. (A)Lipase-ANS assay. (B) Olive oil agar plate assay. a: lipase without dye; b: lipase with dye.
为探讨ANS法采用的脂肪酶蛋白和ANS的浓度,将反应体系的ANS浓度固定为0.04 mmol/L,变化脂肪酶浓度;将脂肪酶浓度固定为0.2 mg/mL,变化 ANS浓度,进行脂肪酶 Tm值的测定。结果表明:在蛋白浓度为0.29 mg/mL,0.145 mg/mL,0.0725 mg/mL,0.058 mg/mL,0.0029 mg/mL时,测试窗口分别为3 643、1 657、792、618、270,Tm值分别为 38.89 ℃、38.98 ℃、39.05 ℃、40.08 ℃、42.09 ℃ (图4A)。可见:用ANS法测定Tm时,蛋白浓度为0.145~0.29 mg/mL时可以获得较大的测试窗口和得出准确的Tm。因此决定在以后的反应体系中采用的脂肪酶浓度为0.2 mg/mL。
当固定脂肪酶蛋白浓度为0.2 mg/mL,ANS的浓度为 0.01、0.02、0.03、0.04、0.05、0.06、0.08、0.16 mmol/L时,测试窗口分别为 1 451、2 647、3 037、3 572、5 101、4 038、4 132、3 970,Tm值分别为 38.65 ℃、38.73 ℃、38.77 ℃、38.79 ℃、38.78 ℃、38.83 ℃、38.20 ℃、38.15 ℃ (图 4B)。可见,ANS的浓度为0.01~0.16 mmol/L时,测出的Tm值相近,当ANS浓度为0.05 mmol/L时,可产生相对最大的测试窗口。因此,当固定脂肪酶蛋白浓度为0.2 mg/mL时,ANS的浓度采用0.05 mmol/L。
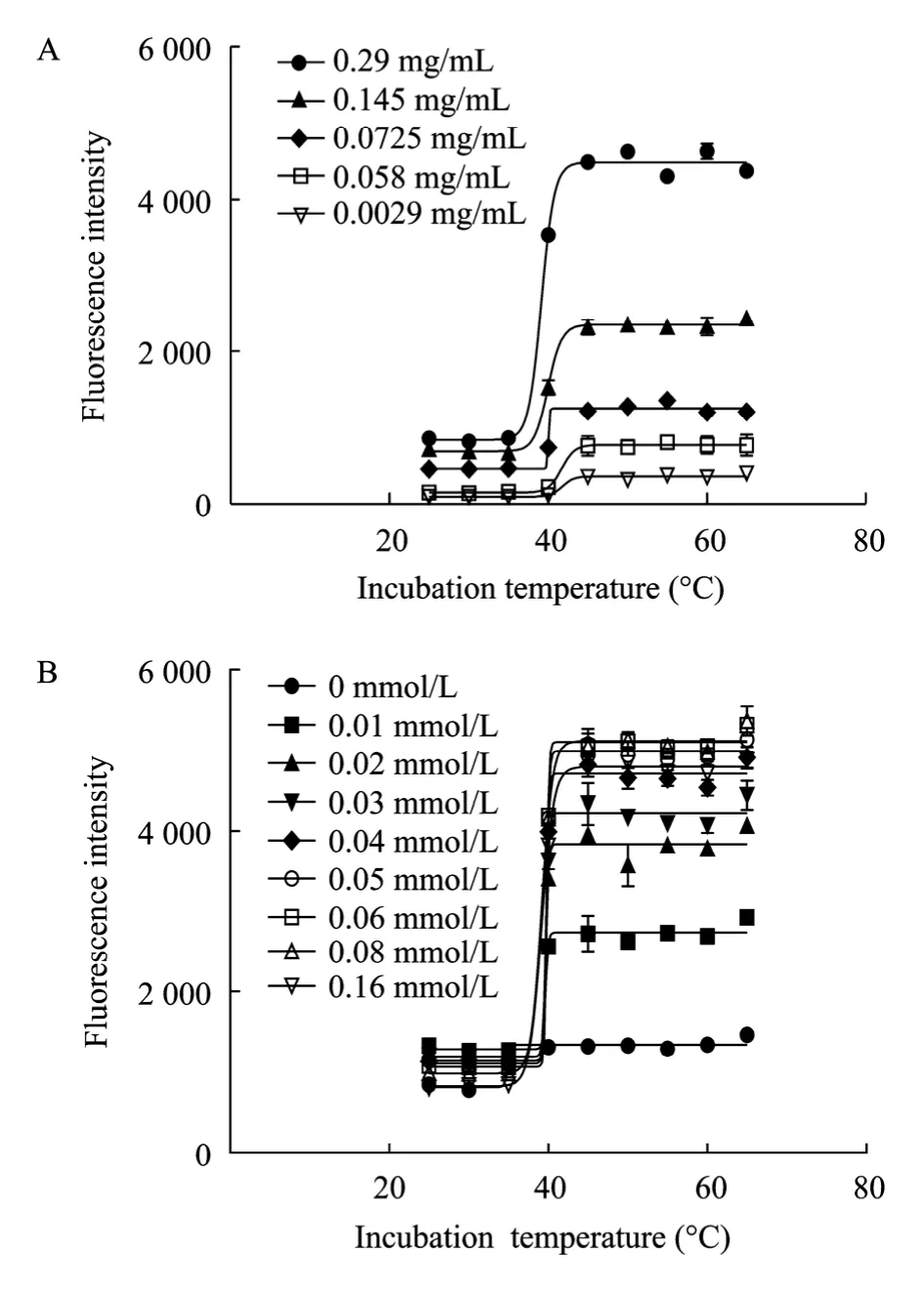
图4 脂肪酶浓度 (A) 和ANS浓度 (B) 对ANS法测定脂肪酶Tm的影响Fig. 4 Effect of lipase and ANS concentration on Tmmeasurement with ANS assay. (A) Effect of lipase concentration on assay. (B) Effect of ANS concentration on assay.
2.2.4 NaCl浓度对ANS法测定Tm的影响
纯化保存和进行测定的过程中,酶液一般是存在于含有一定浓度的NaCl的缓冲液中。为探讨NaCl浓度对ANS法测定Tm的影响,在含0~1 000 mmol/L NaCl的20 mmol/L Tris-HCl (pH 7.2) 的反应体系中加入不同温度温浴的 0.2 mg/mL的纯酶液和0.05 mmol/L的ANS,测定脂肪酶的Tm值。
结果显示 (图5):当反应体系中加入0、100、200、500、1 000 mmol/L的NaCl时,测试窗口分别为3 325、3 904、4 003、4 829、5 988,测试得出的脂肪酶Tm值分别为38.86 ℃、39.37 ℃、38.93 ℃,39.08 ℃、39.15 ℃。可见,反应体系中的NaCl浓度对脂肪酶 Tm值的测定影响不大. 而一定量的 NaCl有利于测试窗口的增大。这一结果与用尼罗红作荧光探针时显示的结果[6]一致。
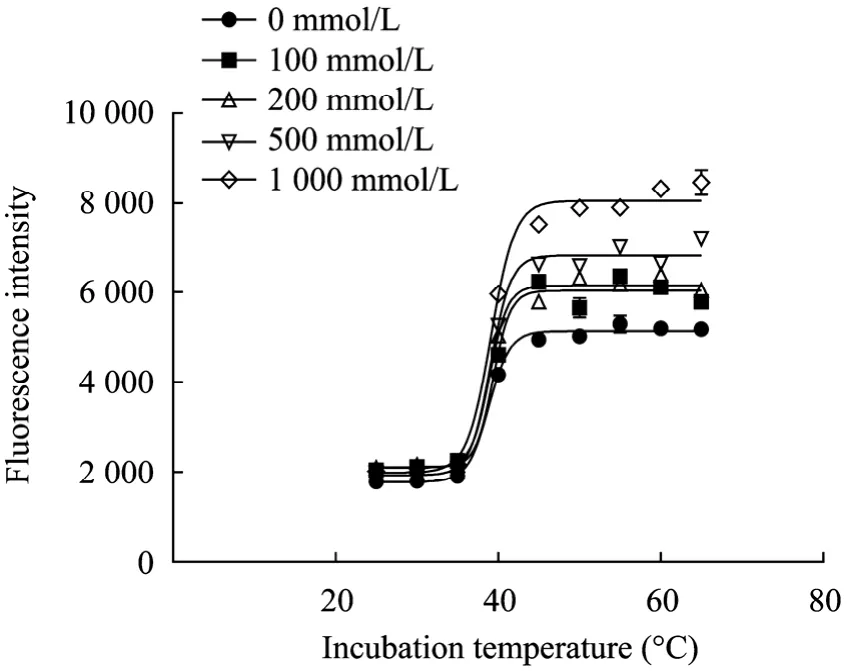
图5 NaCl浓度对ANS法测定脂肪酶Tm的影响Fig. 5 Effect of NaCl on Tmmeasurement with ANS assay.
2.3 利用ANS法测定脂肪酶突变体的Tm值
根据上述结果我们确定了ANS法测定脂肪酶Tm值的方案如下:将发酵酶液去色素获得脱色素酶液;将酶液在25 ℃~65 ℃下温浴30 min;以0.05 mmol/L ANS,0.2 mg/mL脂肪酶,20 mmol/L Tris-HCl,100 mmol/L NaCl,pH 7.2为反应体系,于378 nm激发波长,465 nm发射波长下测定荧光值;用GraphPad Prism数理统计与分析软件分析出Tm值。
运用上述方法对野生型脂肪酶 PEL[5]和 5种突变脂肪酶 PEL-ep8-K115R、PEL-ep8-K202A[7]、PEL-K226R、PEL-PXD和PEL-ep8-K55R以及PEL3拷贝工程菌进行了 Tm值的测定。结果表明:ANS法测得的 Tm值 (图 6A-G):PEL 为 38.86 ℃;PEL-ep8-K115R为 42.14 ℃;PEL-ep8-K202A为43.63 ℃;PEL-K226R为 39.91 ℃;PEL-PXD为39.73 ℃;PEL-ep8-K55R为43.61 ℃;PEL 3拷贝工程菌为 38.38 ℃。与 NaOH的测定结果 (PEL为38.7 ℃,PEL-ep8-K115R 为 42.2 ℃,PEL-ep8-K202A为 41.66 ℃,PEL-K226R为 35.4 ℃,PEL-PXD为42.3 ℃,PEL-ep8-K55R 为 41 ℃,PEL 3lip为38.5 ℃),和透明圈法测定结果相似 (图6H)。
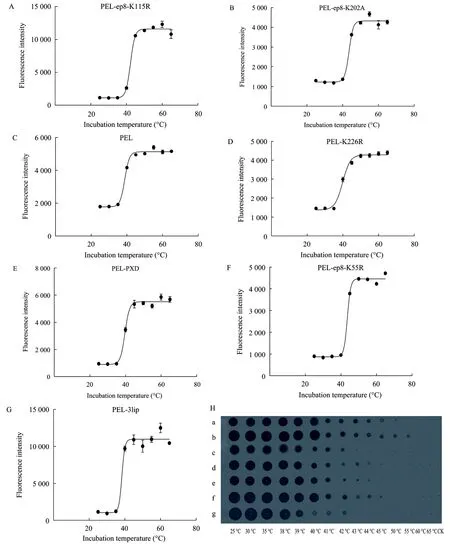
图6 ANS法测定脂肪酶Tm值. (A−G) ANS测定. (H) 橄榄油检验板测定Fig. 6 Measurement of lipase Tmwith ANS assay. (A−G) ANS assay. (H) Olive oil agar plate assay. a: PEL-ep8-K115R; b:PEL-ep8-K202A; c: PEL; d: PEL-K226R; e: PEL-PXD; f: PEL-ep8-K55R; g: PEL-3lip.
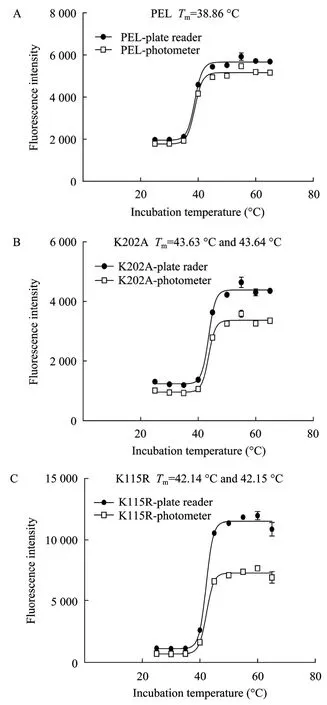
图7 读板机和分光光度计测定的各脂肪酶的TmFig. 7 Comparison of lipases Tmmeasured with plate reader and photometer.
2.5 ANS法用于高通量脂肪酶Tm测定
以往采用的各种酶热稳定性测定一般都是一次只能测一个样品的耗时和复杂的测定方法。为将ANS法测定脂肪酶热稳定性方法运用于高通量的稳定性突变体筛选,本研究将温浴处理的野生型脂肪酶PEL、突变体脂肪酶PEL-ep8-K202A和PEL-ep8-K115R和 ANS测定缓冲液混合后用 HITACHI F-4600荧光光度计 (一次读取一个样品) 和 Biotek synergy HT荧光读板机 (同时读取多个样品) 分别读取其荧光值。结果表明各突变体在两种荧光值的读取模式中得到了非常一致的结果,见图7。因此,在进行高通量 Tm值测定时,可用读板机取代HITACHI F-4600分光光度计进行ANS热稳定性测定的荧光值的读取,从而实现在几分钟内完成多达96个样品的高通量分析。
3 小结
目前脂肪酶的热稳定性问题是生产实际和科学研究的研究热点,稳定性强意味着易保存 (保存期长)、运输方便、使用效率高、意味着应用范围的扩大、也意味着低成本和高产出。酶热稳定性的高低常用酶活性半衰期和Tm值来衡量。酶活性半衰期是指在一定温度下,酶活降低到原来一半时所需要的时间,即残余酶活为50%时的时间。而Tm值指酶在不同温度下温浴一定时间后残余酶活为50%时的温度。目前脂肪酶热稳定性测定主要采用碱式(NaOH) 滴定法和平板透明圈法,NaOH滴定法测定热稳定性工作量巨大,测定几个样品的热稳定性要花上2~3 d,耗时耗力。此外,因测试时底物是乳化液,乳化液的乳化程度、滴定终点的判断、滴定终点的读数误差等影响了其测量精确度。平板透明圈法的热稳定性测定的优点在于直观、操作简便,但只是定性的方法,平板的厚薄、底物乳化分布均匀程度等,以及测量直径时的人为误差会影响到结果。本研究确立的ANS法测定脂肪酶的热稳定性是基于蛋白质结构的变化来进行的,当酶蛋白受热吸收能量后开始解折叠,内部疏水基团暴露,导致ANS与暴露的疏水基团结合而发出强烈荧光。该方法灵敏度较高,实验过程简单,操作时间短,数据可信度较大,样品需求量少,可用96孔板同时进行多个样品的高通量的脂肪酶热稳定性测定,完成几十个样品的测定仅需几小时。该方法的操作步骤简单,样品仅需简单脱色素处理,从实验结果看,该方法实验误差,重现性均好于以酶活测定为基础的 NaOH滴定法。
通过对实验影响因素:色素、底物浓度、缓冲体系中 NaCl离子强度等的研究,我们确立了 ANS脂肪酶热稳定性测定的反应体系:100 mmol/L NaCl,20 mmol/L Tris-HCl (pH 7.2),0.05 mmol/L ANS和0.2 mg/mL脂肪酶。设定激发波长为378 nm,发射波长465 nm,读取荧光值,用GraphPad Prism数理统计与分析软件分析结果。利用该方法我们测定了本实验室的基因工程 PEL-GS野生型脂肪酶及其突变体的Tm。测定结果与传统的NaOH滴定法和平板透明圈法的测试结果一致。
酶的热稳定性测定还常采用差示扫描量热法(Differential scanning calorimetry,DSC)[8]、圆二色性法 (Circular dichroism,CD)[9-10]等方法,CD法和DSC法利用光学和热学原理衡量脂肪酶的热稳定性,两者均有专门的测试仪器,但这些方法无法一次完成很多样品的测定,不能用于高通量的酶热稳定性测定。而ANS脂肪酶热稳定性测定法则是一种快速准确的、适合于短时间大量样品高通量的热稳定性测定方法。
REFERENCES
[1] Yadav JK, Prakash V. Thermal stability of α-amylase in aqueous cosolvent systems. J Biosci, 2009, 34(3):377−387.
[2] Lavinder JJ, Hari SB, Sullivan BJ, et al. High-throughput thermal scanning: a general, rapid dye-binding thermal shift screen for protein engineering. Amer Chem Soc,2009, 131(11): 3794−3795.
[3] Zhang YL, Pan XM, Zhou JM. Surface hydrophobicity and thermal aggregation of adenylate kinase. Biochem Mol Biol Int, 1998, 44(5): 949−960.
[4] Khan MS. Bilqees B. Mechanism of unfolding of goat lung cystatin during urea and guanidine hydrochloride induced denaturation. Int J Peptide Res Therap, 2009,15(1): 81−86.
[5] Yuan C, Lin L, Shi QQ, et al. Overexpression of Penicillium expansum lipase gene in Pichia pastoris. Chin J Biotech, 2003, 19(2): 231−235.
袁彩, 林琳, 施巧琴, 等. 扩展青霉碱性脂肪酶基因在毕赤酵母中的高效表达. 生物工程学报, 2003, 19(2):231−235.
[6] Slobodanka DM, Marianne PC, Peter B. Effect of pH and ionic strength on the cytolytic toxin Cyt1A: a fluorescence spectroscopy study. Biochim Biophys Acta, 2004,1699(1/2): 123−130.
[7] Zou YT, Wu YZ, Lin L, et al. Effect of K202A mutation in the thermostability of Penicillum expansum lipase. China Biotechnol, 2007, 27(12): 52−56.
邹有土, 吴义真, 林琳, 等. K202A突变对扩展青霉脂肪酶热稳定性的影响. 中国生物工程杂志, 2007,27(12): 52−56.
[8] Pham VT, Ewing E, Kaplan H, et al. Glycation improves the thermostability of trypsin and chymotrypsin.Biotechnol Bioeng, 2008, 101(3): 452−459.
[9] Figueroa M, Hinrichs MV, Bunster M, et al. Biophysical studies support a predicted superhelical structure with armadillo repeats for Ric-8. Protein Sci, 2009, 18(6):1139−1145.
[10] Ahmad S, Rao NM. Thermally denatured state determines refolding in lipase: mutational analysis. Protein Sci, 2009,18(6): 1183−1196.
Rapid and high throughput measurement of lipase thermo-stability through ANS fluorescence signal assay
Weizong Feng, Junhan Lin, Shaoli Cai, Youtu Zou, Guoren Chen, Ping Huang, Yajing Lin,Bingbing Wang, and Lin Lin
College of Life Science, Fujian Normal University, Fuzhou 350108, China
Received: November 8, 2010; Accepted: January 26, 2011
Supported by: Industrial Microbe Collection and High Throughput Screening Platform Establishment (No. 2006H0085), Natural Science Foundation of Fujian Province (Nos. C0410009, B0120001), National Natural Science Foundation of China (No. 30270033).
Corresponding author: Lin Lin. Tel/Fax: +86-591-22868209; E-mail: benbo_00@yahoo.com
工业微生物高通量选育与保藏技术研发平台建设 (No. 2006H0085),福建省自然科学基金 (Nos. C0410009, B0120001),国家自然科学基金(No. 30270033) 资助。
