耐力训练引起大鼠免疫机能低下及补充中药多糖的干预效果研究
2011-08-20周丽丽伊木清王启荣高红许葆华杨则宜
周丽丽 伊木清 王启荣 高红 许葆华 杨则宜
国家体育总局运动医学研究所(北京 100029)
长期高强度训练增加运动员上呼吸道感染的危险性,这与运动员免疫功能下降有关[1]。神经内分泌系统具有重要的免疫调节功能[2],下丘脑室旁核(PVN)是下丘脑-垂体-肾上腺(HPA)轴活动的直接控制部位[3],下丘脑-垂体-肾上腺(HPA)轴激活引起的外周效应为糖皮质类固醇(主要为皮质醇)分泌增加,这是机体主要的应激反应体系之一[4],高浓度的糖皮质激素可选择性抑制细胞免疫功能[5,6]。运动可诱发机体多种细胞因子发生变化,许多细胞因子有激活HPA轴活动的作用,IL-1、IL-6等对HPA轴有强兴奋作用[4]。本研究采用流动水池建立大鼠递增负荷游泳训练模型,观察6周耐力训练后大鼠血清和外周血单核细胞(PBMC)培养后上清液IL-1β含量变化、下丘脑室旁核IL-1R表达和血清皮质酮含量的变化,探讨IL-1及其受体与HPA轴活化的可能关系和意义,同时选用牛膝多糖和黄芪多糖进行干预,为改善耐力训练引起的免疫低下寻找干预措施。
1 材料与方法
1.1 动物分组与饲养
6周龄、体重110~130g的SPF/VAF级雄性Wistar大鼠48只(购自北京维通利华实验动物技术有限公司,质量合格证号0043356),在清洁级动物房常规饲养近1周后,通过游泳能力筛检筛选出40只大鼠,按体重随机分为安静对照组、耐力训练组、训练+黄芪多糖组、训练+牛膝多糖组4组,每组10只。清洁级动物房室内温度为20℃~26℃,湿度50% ~70%,昼夜节律用日光灯控制,每日光照时间12小时(早8点~晚8点),大鼠分笼饲养,每笼最多5只,自由进食和饮水。
1.2 中药多糖补充方案
黄芪多糖(APS)提取物(购自浙江霍夫曼德公司)和牛膝多糖(APBS)提取物(购自上海实久科技有限公司)用双蒸水配制。从正式实验开始,每日上午训练开始前60分钟对大鼠进行灌胃1次。训练+黄芪多糖组按2 g·kg-1剂量(相当于黄芪多糖1 g·kg-1)灌服黄芪多糖提取物,训练+牛膝多糖组按1 g·kg-1剂量(相当于牛膝多糖0.7·kg-1)灌服牛膝多糖提取物,安静对照组和耐力训练组灌服等量安慰剂(双蒸水)。
1.3 训练方案
安静对照组不运动,其他3组在流动游泳水池中进行训练。水深50~60 cm(约为大鼠体长的1.5~2倍),水温32±2℃,水流量4 m3/h。每天上、下午各训练1次,每周训练5天,共6周,训练时间由40 min/d逐渐增加到160 min/d,具体训练方案见表1。

表1 大鼠游泳训练方案(时间×次数)
1.4 取材
最后一次训练结束36小时后取材。采用25%乌拉坦按0.5 m l·100g-1体重的剂量进行腹腔麻醉,真空肝素锂抗凝采血管腹主动脉取血,用于外周血单个核细胞(PBMC)的分离与培养,带分离胶全血真空管制备血清后放于−80℃低温冰箱,用于测定IL-1β、睾酮、皮质醇。酒精消毒腹部后剖开腹腔,行左心室至主动脉插管,经4%多聚甲醛约150m l灌注固定后,取出脑组织,每组取3只大鼠脑组织测定下丘脑IL-1R。因测试试剂和采血量限制,部分指标测试样本数有所减少。
1.5 检测指标和方法
1.5.1 血清指标
采用ELISA方法测定血清IL-1β,试剂盒为美国Biosource公司产品。采用放射免疫分析法测定血清睾酮和皮质酮,试剂盒均为美国DSL公司产品。
1.5.2 PBMC分泌IL-1β的测定
在超净台上按无菌操作分离PBMC细胞。分离方法及其无菌细胞悬液的制备方法见文献[6],最后用RPmi1640将细胞悬液浓度调整到2×106个细胞/m l。
在24孔板上每个样品设2孔,每孔加细胞悬液1 m l,加入有丝分裂原 ConA(终浓度为 5 μg/m l),将培养板置于37℃、5%CO2培养箱中培养36小时后收获培养上清液,2000 r/min离心10分钟,上清移出置-80℃冻存,用ELISA方法测定上清液IL-1β(试剂盒为美国Biosource公司产品)。
1.5.3 下丘脑IL-1R表达测定
取脑组织放入30%蔗糖溶液浸泡,4℃过夜。经干冰-正己烷(−70℃)骤冷,参照大鼠脑图谱进行下丘脑室旁核定位,做额状面连续切片(20 μm),将4张切片裱于同一张玻片上。
脑组织Nissl染色:Nissl染液20分钟,蒸馏水洗,50%酒精分色,无水乙醇脱水,二甲苯透明,树胶封固。
脑组织免疫化学染色:冷冻切片经冷风吹干后,用PV-6001/6002二步法显示下丘脑室旁核IL-1R。加入3%H2O2孵育10分钟,阻断内源性过氧化氢酶;加入兔抗鼠多克隆抗体(1:100),37℃放置1 h,4℃冰箱过夜,第2日取出,室温放置1 h,用0.01MPBS冲洗;滴加羊抗兔IgG抗体-HRP多聚体(1:100),37℃,1 h,用0.01MPBS冲洗;加入DAB复合物显色5~10分种,用0.01MPBS冲洗,蒸馏水终止反应;50%、70%、80%、95%酒精脱水各5分钟,100%酒精脱水5分钟2次,二甲苯透明,树胶封固。
光密度测定:免疫组织化学染色后,每组取3只动物,每只动物取2~3张片子,每张片子随机取3个视野,在相同的光学和光源条件下,采用Leica公司Q550CW图像分析系统采集图像和Qw in图像分析软件分析测定观察部位的平均光密度值(AOD)。
1.6 统计学分析
使用SPSS for Windows 11.0统计分析软件完成,用One-Way ANOVA进行方差分析,方差齐次性时,采用LSD法进行多组之间比较;方差不齐次性时,用Tamhane’s T2法复选项进行多组之间比较。统计数值用mean±SD表示,显著性差异水平 α = 0.05。
2 结果
2.1 血清和PBMC培养后上清液IL-1β含量
表2显示,耐力训练组血清IL-1β含量最高,与安静对照组相比有显著性差异(P < 0.01)。2个补充组大鼠血清IL-1β显著低于耐力训练组(P <0.05),而与安静对照组水平接近(P > 0.05)。
耐力训练组大鼠PBMC培养后上清液IL-1β含量最高,与安静对照组相比有显著性差异(P <0.01)。2个补充组PBMC生成IL-1β能力高于安静对照组(分别高26.1%、21.3%),低于耐力训练组(分别低10.2%、13.6%),但均无统计学意义。
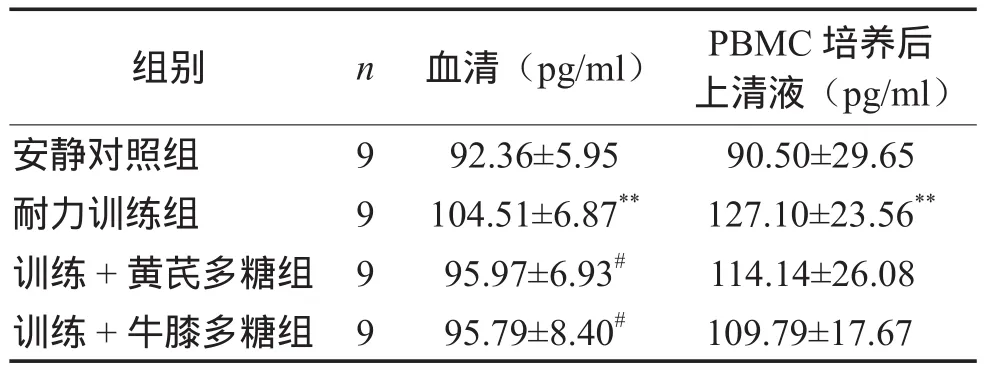
表2 各组大鼠血清和PBMC培养后上清液IL-1β含量比较
2.2 下丘脑室旁核IL-1R表达
由表3可见,耐力训练组大鼠下丘脑室旁核IL-1R表达最高,与安静对照组相比有显著性差异(P< 0.05)。补充牛膝多糖组大鼠下丘脑室旁核IL-1R表达与安静对照组相同,显著低于耐力训练组(P< 0.01)。补充黄芪多糖组高于安静对照组,略低于耐力训练组,但均无统计学意义。
2.3 血清皮质酮和总睾酮含量
表4显示,耐力训练组大鼠血清皮质酮含量最高,与安静对照组相比有显著性差异(P < 0.05)。补充牛膝多糖组血清皮质酮与安静对照组相同,但显著低于耐力训练组(P < 0.01);补充黄芪多糖组血清皮质酮低于耐力训练组(低17.3%),高于安静对照组(高26.5%)。

表3 各组大鼠下丘脑室旁核IL-1R表达比较
耐力训练组大鼠血清总睾酮最低,与安静对照组相比有显著性差异(P < 0.05)。2个补充多糖组血清总睾酮分别高于耐力训练组54.3%和54.4%,低于安静对照组21.4%和21.2%。
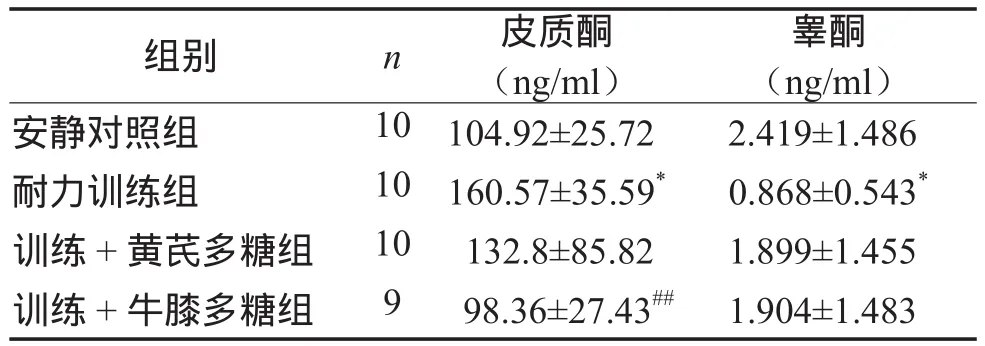
表4 各组大鼠血清睾酮和皮质酮含量比较
3 讨论
目前,关于高强度、长期运动影响机体免疫功能的确切机制尚不清楚。高强度、长期运动训练是一种刺激,会引起机体的应激反应,机体出现的应激反应首先涉及中枢神经系统机能,继而出现内分泌和免疫系统机能的改变。研究发现,细胞因子不但是重要的免疫调节因子,而且具有广泛的中枢调节作用[7]。从细胞因子-神经-内分泌调节角度探讨训练对免疫功能的影响已经引起一些学者的关注。
我们以前的研究发现,6周耐力训练可引起大鼠T细胞数量和功能变化,主要表现为活化的T淋巴细胞数量下降、T细胞亚群中CD4+细胞数量下降及CD4+/CD8+比值下降、T淋巴细胞增殖转化能力降低等[8-10],这些变化提示6周的耐力训练可引起大鼠细胞免疫功能下降。
研究显示运动训练能引起体液中细胞因子的改变[11,12]。一次运动或长期训练均可使血浆或血清IL- 1水平或单核/巨噬细胞产生IL-1的能力显著提高[13,14]。有学者提出,长时间剧烈运动时,由于内脏器官与运动器官之间血液重新分配,机体高代谢反应以及其它未确定的原因,肠腔内革兰氏阴性菌的胞壁成份LPS穿过肠粘膜屏障移位进入血液,运动者会出现类内毒素血症反应。LPS进入血液后可以刺激单核-巨噬细胞合成与分泌IL-1等细胞因子,推测这是运动后血浆IL-1等细胞因子浓度增加的一个主要原因[15]。同时IL-1被认为是运动应激刺激释放的首批细胞因子之一[16],被分类为促炎性细胞因子,通过与相应高亲和力受体IL-1R结合发挥作用,有致热和介导炎症的作用,与机体免疫反应有密切关系。本研究结果显示,6周耐力训练能引起大鼠血清IL-1β含量和PBMC生成IL-1β的能力提高,而训练同时补充黄芪多糖提取物或牛膝多糖提取物可防止血清中IL-1β含量明显升高以及PBMC生成IL-1β过多的趋势。
在生理情况下,脑内的血管内皮细胞、小胶质细胞、星形细胞和神经细胞均具有合成IL-1的能力。外周血中少量IL-1可经脑室周围组织如正中隆起、终板血管器等进人中枢神经系[17]。IL-1有IL-1α和IL-1β两种亚型,均须与IL-1R结合后才发挥作用。IL-1和IL-1R在中枢神经系统定位于下丘脑和脑干等部位,下丘脑弓状核、室旁核等均有IL-1β的免疫阳性细胞,下丘脑、海马、小脑、大脑皮质等部位均有IL-1R及受体mRNA表达[18-20]。下丘脑室旁核是HPA轴活动的直接控制部位[21,22],IL-1对HPA轴主要是兴奋作用,引起的外周效应为糖皮质类固醇(主要为皮质醇)分泌增加,具体表现为IL-1作用于下丘脑神经元,通过HPA轴引起促肾上腺皮质激素(ACTH)及其前体阿黑皮原mRNA表达,最终血浆糖皮质激素(如皮质酮)升高[4,7,23]。IL-1 还能抑制下丘脑-垂体-性腺轴功能(HPG),从而抑制促性腺激素诱导的睾酮分泌,表现为血液睾酮含量下降[24],下丘脑室旁核IL-1R表达升高将有利于IL-1发挥对HPA轴的激活和对HPG轴的抑制作用[4]。本研究结果显示,6周耐力训练引起大鼠下丘脑室旁核IL-1R表达升高,同时耐力训练大鼠血清中皮质酮含量增加、总睾酮含量明显下降,提示下丘脑IL-1R表达升高、血清中IL-1增高及血清皮质酮升高、睾酮下降这些在耐力训练中的改变与IL-1及IL-1R对HPA轴的激活和对HPG轴的抑制作用表现的外周效应一致。本实验关于2种中药多糖的干预研究显示,训练同时补充牛膝多糖或黄芪多糖有防止大鼠下丘脑室旁核IL-1R过多表达的作用,而且牛膝多糖较黄芪多糖更明显。训练同时补充牛膝多糖或黄芪多糖有防止血清皮质酮含量明显升高、总睾酮含量显著下降的趋势。
4 总结
耐力训练引起细胞免疫功能下降可能与血清及PBMC中IL-1β升高和下丘脑室旁核IL-1R表达增加并激活HPA轴有关。训练补充牛膝多糖或黄芪多糖有防止血清IL-1β升高、降低大鼠下丘脑IL-1R表达过高的作用或趋势,补充牛膝多糖、黄芪多糖的免疫保护作用可能与其防止HPA轴的过度激活有关。
[1] Martin SA,Pence BD,Woods JA. Exercise and respiratory tract viral infections. Exerc Sport Sci Rev,2009,37(4):157-164.
[2]Habib KE,Gold PW,Chrousos GP. Neuroendocrinology of stress. Endocrinol Metab Clin North Am,2001,30(3):695-728.
[3] 邓旻,田国燕,史亦谦. 中药多糖的免疫调节作用研究进展. 医学研究杂志,2007,36:26-28.
[4] 杨权. 下丘脑-垂体-肾上腺皮质轴应激反应的中枢控制. 生理科学进展,2000,31(3):222-226.
[5] 徐唯. 糖皮质激素与免疫功能的关系及在运动免疫学中的作用. 中国组织工程研究与临床康复,2008,12(5):954-957.
[6]Zen M,Canova M,Campana C,et al. The kaleidoscope of glucorticoid effects on immune system. Autoimmun Rev,2011 Jan 9.[ Epub ahead of print]
[7] Ga dek-michalska A, Bugajski J. Interleukin-1(IL-1) in stress-induced activation of limbic-hypothalamic-pituitary adrenal axis. Pharmacol Rep,2010,62:969-982.
[8] 周丽丽,王启荣,伊木清,等. 中药多糖对耐力训练大鼠外周血T淋巴细胞亚群及活化T细胞数量的影响.西安体育学院学报,2006,23:63-67.
[9] 周丽丽,王启荣,伊木清,等. 补充中药多糖对耐力训练大鼠淋巴细胞免疫功能低下的预防作用. 天津体育学院学报,2005,20:18-25.
[10]周丽丽,王启荣,伊木清,等. 耐力训练及补充中药多糖对大鼠PBMC分泌细胞因子和血清中细胞因子含量的影响. 中国免疫学杂志,2006,22:1119-1123.
[11] S uzukiK,Nakaji S,Yamada M,et al. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev,2002,8:6-48.
[12] S uzukiK,Nakaji S,Yamada M,et al. Impact of a competitive marathon race on systemic cytokine and neutrophil responses. Med Sci Sports Exerc,2003,35 :348-55.
[13]Suzuki K,Nakaji S,Yamada M,et al. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev,2002,8:6-48.
[14]Baum M,K löpping-Menke K,Müller-Steinhardt M,et al. Increased concentrations of interleukin 1-beta in whole blood cultures supernatants after 12 weeks of moderate endurance exercise. Eur J Appl Physiol Occup Physiol,1999,79(6):500-3.
[15]岳学状,张蕴琨,王雪梅. 运动与促炎性细胞因子.南京体育学院学报(自然科学版),2002,1(2):5-13.
[16]陈佩杰 . 运动免疫学研究进展 . 体育科学,2000,20(6):41-46.
[17]张国荣,张月华,吴希如. 白细胞介素-1在中枢神经系统中的作用. 神经科学,1997,4(1):44-48.
[18]Friedman WJ. Cytokines regulate expression of the type I interleukin-1receptor in rat hippocampal neurons and glia.Exp Neurol,2001,168(1):23-31.
[19]Sairanen TR,Lindsberg PJ,Brenner M,et al. Global forebrain ischemia results in differential cellular expression of interleukin-1beta and its receptor at mRNA and protein level. J Cereb Blood Flow Metab,1997,17(10):1107-1120.
[20]刘国法,吕证宝,安林. 大鼠脑内白细胞介素1I型受体mRNA的分布. 解剖学杂志,1999,22(1):27-30.
[21]Habib KE,Gold PW,Chrousos GP. Neuroendocrinology of stress. Endocrinol Metab Clin North Am,2001,30(3):695-728.
[22]Silverman MN,Pearce BD,Biron CA,et al. Immune modulation of the hypothalamic-pituitary-adrenal(hpa)axis during viral infection. Viral Immunol,2005,18 :41-78.
[23] W ieczorekM,Dunn AJ. Relationships among the behavioral,noradrenergic,and pituitary-adrenal responses to interleukin-1 and the effects of indomethacin. Brain Behav Immun,2006,20(5):477-487.
[24]Besedovsky HO and Rey AD. Immune-neuro-endocrine interactions:facts and hypotheses. Endocrine Reviews,1996,17(1):64-102.
