非小细胞肺癌长春瑞滨加顺铂方案化疗敏感性与XPC基因多态性及单体型的关系
2011-07-13中国医科大学附属第一医院肿瘤研究所110001翟雅娜洪成雨
中国医科大学附属第一医院肿瘤研究所(110001) 翟雅娜 徐 倩 洪成雨 张 晔 袁 媛
作者:翟雅娜,中国医科大学研究生在读,现工作单位辽宁省肿瘤医院。
基因多态作为肿瘤遗传易感性的分子标志,及肿瘤化疗敏感性的预测指标有很大的发展前景。基因多态分为单核苷酸多态(SNP)、插入/缺失多态、可变数目重复序列多态等,SNP是单个碱基在DNA序列上存在的不同于原来碱基的差别。随着单体型是指位于染色体上某一区域的一组相关联的SNP等位位点,且相邻人类基因组计划以及HapmapⅢ期数据的完成,标签SNP在众多SNP中倍受关注,它是基于连锁不平衡原理在某一基因区域分型得出的能捕捉其他大多数SNP的某个SNP。SNPs的等位位点倾向于以一个整体遗传给后代。基因多态以及单体型作为分子标志已成为近年来的研究热点。
非小细胞肺癌(NSCLC)患者占肺癌患者的80%以上,长春瑞滨加顺铂(NP)是治疗晚期NSCLC的首选方案。有临床研究显示,NSCLC患者对NP方案的反应不同,这种不同与DNA的修复能力有关[1]。DNA修复途径有很多种,如碱基切除修复、DNA双链断裂修复、错配修复、核酸切除修复。XPC基因是参与核酸切除修复过程中的一种重要基因,位于3p25,有16个外显子。DesprasE等人通过敲除众多DNA修复基因,发现只有XPC的敲除影响了机体对DNA的修复功能[2]。SaviozziS等人发现,DNA修复基因XPC参与了化疗药与肺癌细胞的相互作用,NSCLC患者化疗后组织中仅有含XPC、XPA、UBE2N3个基因的mRNA低表达,证实XPC蛋白在肺癌患者化疗反应中的重要作用[3]。目前多位学者关注的XPC多态位点有第8外显子Val499Ala(C/T,rs2228000)多态,第9内含子PAT(28795-28799缺失GTAAC且插入83bp的多AT序列者为 L等位基因者,未缺失28795-28799 GTAAC5bp者为S等位基因)多态,第15外显子Lys939Gln(A/C,rs2228001)多态,他们均是重要的标签 SNP。有研究发现,XPCVal499Ala、PAT、Lys939Gln单体型与膀胱癌、鼻咽癌的发病风险有关[4-5]。但 大 多 数 研 究 仅 局 限 于 XPC 基 因Val499Ala、PAT、Lys939Gln单体型与肿瘤遗传易感性的关系,其与肿瘤化疗敏感性关系的研究还很少,特别是NSCLC的化疗敏感性。
本研究严格控制了研究对象的入组标准,NSCLC患者均以统一的化疗药物(NP方案)做治疗,统计分析时调整了年龄、性别、吸烟、病理类型、临床分期等因素对研究的影响。通过检测NSCLCNP方案不同疗效组患者的XPC基因第8外显子、第9内含子、第15外显子多态的信息,探讨XPC基因多态以及单体型对NSCLC患者NP方案化疗敏感性的影响,期望能为基因多态及单体型作为肿瘤个体化治疗的预测指标提供实验依据。
1 对象和方法
1.1 研究对象 研究对象分别来自中国医科大学附属第一医院肿瘤内科、辽宁省肿瘤医院肿瘤内科2006年10月至2008年5月收治的晚期NSCLC患者163例。男98例,女65例。年龄27~84岁,中位年龄61岁。所有患者均经病理学或细胞学诊断,有可测量评价的病变,并且均采用NP方案化疗。化疗前与患者签署知情同意书,采集患者空腹静脉血5mL装入抗凝试管内,分离血清和凝血块后-20℃保存。
1.2 XPC基因多态性检测 以限制性内切酶片断长度多肽(PCR-RFLP)方法进行XPC基因Val499Ala、PAT、Lys939Gln3个位点的基因型分析。从-20℃冰箱中取出凝血块500μL大小,置于2mL离心管中用于DNA提取。加入800μL的TE液,混匀;于室温下,10000rpm离心10分钟,重复5~6次,直至血凝块全部溶解在 TE中。加 400μLTE,25μL10%SDS,5μL20mg/mLPK,37℃消化过夜;吸上清,加等体积酚,震荡15分钟,10000rpm离心10分钟,吸上清,加等体积酚∶氯仿(1∶1),震荡 15分钟,10000rpm离心10分钟,吸上清,加等体积的氯仿,震荡15分钟,10000rpm离心10分钟,吸上清,加2倍体积无水乙醇和1/10体积3M乙酸钠,-20℃沉淀1小时,10000rpm离心10分钟,弃上清,沉淀加75%乙醇,10000rpm离心5分钟,弃上清,干燥,100μLTE溶解,置于-20℃冰箱待用。XPC基因Val499Ala、PAT、Lys939Gln3个位点多态的检测:PCR反应体系(50μL):10×PCR缓冲液(含MgCl225nmol/L)5μL;4种2.5mmol/LdNTP混合物4μL(50μmol/L);引物各 lμL(0.2μmol/L);Taq DNA聚合酶 0.5μL(2.5U);模板 DNA1μL(50~100ng);加双蒸水至 50μL。除 PAT多态直接于2.0%琼脂糖凝胶电泳外,取12μLPCR产物分别与限制性核酸内切酶5U(MBI公司)于37℃温育过夜。XPCVal499Ala多态取5μL酶切产物于10%聚丙烯酰胺凝胶电泳120V1小时;XPCLys939Gln多态全部酶切产物于2.0%琼脂糖凝胶电泳150V45分钟。电泳凝胶于0.5μg/mLEB溶液中染色,用HVE50凝胶成像系统观察分析。将3个位点的PCR产物进一步纯化、测序。全部试剂购自大连宝生物公司,PCR引物及反应条件、酶切片段及对应的等位基因,见表1。

表1 PCR及RFLP的反应条件
1.3 NSCLC之NP及疗效评定
1.3.1 NP 长春瑞滨25mm/m2+0.9%盐水100mL静滴,第 1天、第 8天;顺铂 40mg+0.9%盐水500mL,第2天、第3天、第4天静滴。21天为1个周期,2个周期后对可测量病变进行疗效判定。
1.3.2 疗效判定 采用WHO标准(1981年):完全缓解(CR):可测量的病变完全消失;部分缓解(PR):可测量的病变缩小≥50%;无变化(NC):肿块缩小不及50%或增大未超过25%;进展(PD):1个或多个病变增大25%以上或出现新病变。CR+PR为有效,NC+PD为无效。
1.4 统计学方法 采用SPSS16.0软件进行统计学处理。计算等位基因频率。以多因素Logistic回归比较基因型在各分组间分布的差异,以比值比(OR)及其95%可信区间(CI)表示相对危险度。利用SHEsis分析软件[6]计算等位基因频率及单体型频率。P<0.05为差异有显著性。
2 结果
2.1 XPC基因型的鉴定 XPC第8外显子Val499Ala和第15外显子Lys939Gln多态的PCR扩增后产物经酶切电泳,分别产生C/C、C/T、T/T基因型和A/A、A/C、C/C 基因型(图 1A、图 1C);第 9内含子PAT多态经PCR后电泳产生266bpS/S基因型,以及含有缺失GTAAC5bp插入83bp多AT序列的L等位基因者(即L/S基因型,见图1B)。XPC3位点多态进一步经PCR产物测序证实,见图1D~F。


图1 PCR产物经限制性酶切后琼脂糖凝胶电泳图谱及PCR产物测序结果。
图1-A为XPC基因第8外显子Val499Ala多态经SacⅡ酶切后出现3个分子量不同的片段,分别是152bp、131bp、21bp;1道:150bp DNA marker,2、6、8:C/C 野生基因型;4、5、7:C/T 杂合子;3:T/T 突变基因型。9:100bp DNA marker。图 1-B 为 XPC基因第9内含子PAT多态,1道:150bp DNA marker,2:短片段为266bp(S/S基因型),3、4:短片段与长片段杂合子(L/S基因型)。图1-C为XPC基因第15外显子Lys939Gln多态经PvuⅡ酶切后出现3个分子量不同的片段,分别是765bp、585bp、180bp;1、3、4:A/A野生基因型;2、7:A/C杂合子;5、6:C/C突变基因型。8:100bp DNA marker。图 1-D为第 8外显子Val499Ala多态的测序图,图中箭头所指为多态位点的碱基。左至右分别为C/C基因型、C/T基因型、T/T基因型。图1-E为第9内含子PAT多态的测序图,上图和下图分别为缺失基因型(S/S,含插入GTAAC 5bp)和插入基因型(L/L,含S/S缺失的83bp)。图1-F为第15外显子Lys939Gln多态的测序图,图中箭头所指为多态位点的碱基。左至右分别A/A基因型、A/C基因型、C/C基因型。
2.2 XPC基因多态的分布频率及与其他数据库的比较 163例NSCLC患者XPC基因3位点多态的分布频率及与已知数据库的比较,见表2。

表2 XPC基因多态NSCLC分布频率及与已知数据库的比较(%)
2.3 研究对象的临床病理参数与化疗敏感性的关系
本组研究对象的年龄、性别、吸烟、病理类型、临床分期等资料的频率分布,见表3。采用多因素Logistic回归经其他临床病理参数调整,发现本组病例的临床病理参数对化疗敏感性均无影响(P>0.05)。
2.4 XPC Val499Ala、PAT、Lys939Gln3 个位点基因型与NSCLC化疗敏感性的关系 本研究发现,NSCLC患者XPCVal499Ala多态C/C、C/T、T/T基因型的分布频率分别为 32.5%、65.0%、2.5%;XPC Lys939Gln多态A/A、A/C、C/C基因型的分布频率分别为42.9%、47.2%、9.8%;XPC PAT多态L/L、L/S、S/S基因型的分布频率分别为9.2%、6.1%、84.7%。XPC3个位点在化疗有效组与无效组的频率分布,见表3。由于XPC Val499Arg位点T/T基因型例数较少(仅4例),我们将T/T基因型与C/T基因型合并分析。采用多因素Logistic回归,经年龄、性别、吸烟、病理类型、临床分期等因素的调整,发现XPC Val499Arg位点C/T+T/T基因型者的化疗有效率(40.0%)明显高于 C/C基因型者(24.5%),即与C/C基因型者相比,C/T+T/T基因型的NSCLC患者化疗敏感性增大到2.166倍(P=0.048,OR=1.008~4.655),见表4。

表3 NSCLC患者临床病理类型与化疗敏感性的关系
2.5 XPCVal499Ala、PAT、Lys939Gln3 个位点等位基因与NSCLC化疗敏感性的关系 本研究发现,NSCLC患者XPC8外显子Val499Ala多态C等位基因和T等位基因的分布频率分别为 65.0%、35.0%;XPC15外显子Lys939Gln多态C等位基因和A等位基因的分布频率分别为33.5%和66.5%;XPCPAT多态L等位基因和S等位基因的分布频率分别为12.2%、87.8%。采用SHEsis软件分析XPCVal499Ala、PAT、Lys939Gln3 个位点等位基因频率与NSCLC化疗敏感性的关系,发现XPCPAT多态S等位基因的化疗有效率(37.1%)明显高于L等位基因的化疗有效率(20.0%),即与携带L等位基因者相比,携带S等位基因的个体化疗敏感性增大到2.353倍(P=0.034,OR=1.047~5.291),见表5。
2.6 XPCVal499Ala、PAT、Lys939Gln 单 体 型 与NSCLC化疗敏感性的关系 采用SHEsis软件分析XPCVal499Ala、PAT、Lys939Gln单体型与NSCLC 化疗敏感性的关系。XPC3种多态的单体型组合为8种,将最小频率阈值(LFT)设为0.03,因T-L-A和TL-C2种单体型的分布频率<3%,因此不计入统计分析。结果发现,以其他单体型者为参照,携带CL-A(Val499Ala-PAT-Lys939Gln)单体型的个体在化疗无效组的比率(6.7%)显著高于有效组(0.0%),差异具有显著性(P=0.007),即携带XPCC-L-A(Val499Ala-PAT-Lys939Gln)单体型患者对NSCLCNP方案化疗应答差,见表6。
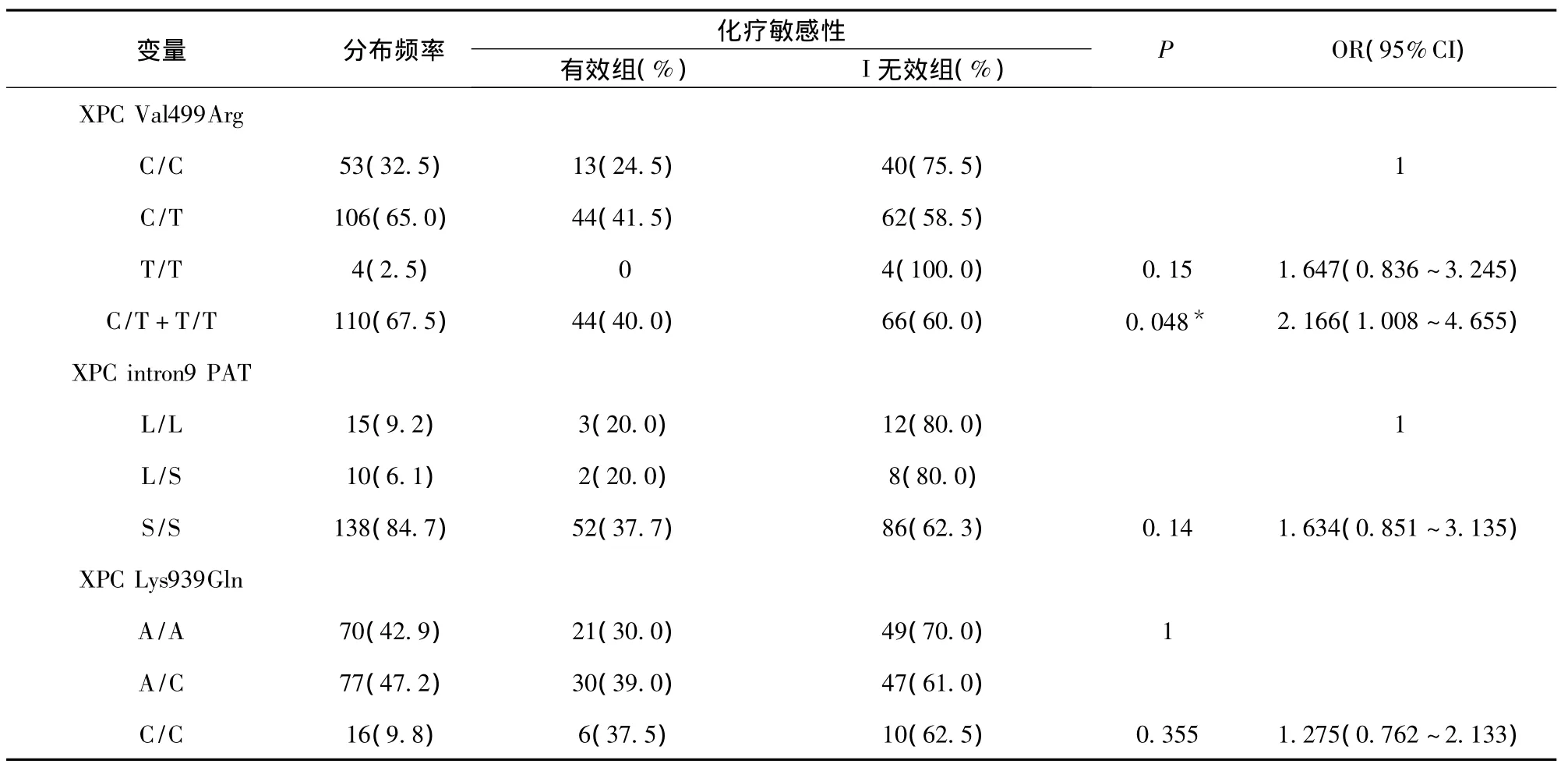
表4 XPC基因型与NSCLC患者化疗敏感性的关系

表5 XPC等位基因频率与NSCLC化疗敏感性的关系
3 讨论
近年来,基因多态性与肿瘤患者化疗敏感性的研究引起研究者高度重视。化疗方案前进行基因型的预测分析,对优化治疗方案,实现个体化治疗具有重要作用。但是,由于干扰因素众多,研究结果的真实性受到质疑。我们采用NP统一化疗方案,以排除其他化疗方案对结果的影响。病例分析前,我们考虑了年龄、性别、吸烟、病理类型和临床分期等因素,使之达到平衡,消除了上述因素对本研究结果的影响。本研究报道了NSCLC患者XPC3种多态的基因型分布频率(见表2),将本组数据与人类基因组Hapmap计划公布的中国北京的45名汉族人的分布频率数据进行比较,发现 NSCLC患者的 XPC Val499Ala和Lys939Gln多态的基因型和等位基因分布频率与北京人群基本相似,未见明显差异(分别为65.0%和70.0%,33.5%和37.8%)。而XPC第9内含子PAT多态在Hapmap数据库中未见数据报道,本研究中关于第9内含子PAT多态在中国NSCLC患者的分布频率报道尚属首次。LeeGY等人研究了韩国432名健康人群XPCPAT多态的频率分布,发现L/L、L/S、S/S基因型分别为13.2%、48.1%、38.7%,L等位基因和S等位基因的分布频率分别为34.8%和65.2%[7]。而本研究发现,L/L、L/S、S/S基因型的分布频率分别为9.2%、6.1%、84.7%,L等位基因和S等位基因的分布频率分别为12.2%、87.8%。虽然 Hapmap数据库并没有PAT多态分布频率的数据,但是韩国人群可以代表亚洲人。我们发现,本组病例中NSCLC患者中第9内含子的分布频率与亚洲正常人群有很大差别。因此,我们推测S等位基因参与了NSCLC的致癌过程,这一推论今后需要大样本实验证实。
本研究中发现,XPC第8外显子Val499Ala多态C/T+T/T基因型的NSCLC患者化疗敏感性增大到2.166倍;携带XPC第9内含子PAT多态S等位基因的个体化疗敏感性增大到2.353倍,而XPC 15外显子多态与化疗敏感性未见明显相关。我们猜测,由于第8外显子与第9内含子在基因的物理位置上相隔较近,在与化疗药物作用上可能有一定的相互作用。另有学者发现,XPC的第9外显子有一14bp缺失/25bp插入的多态,其使XPCmRNA表达下降,XPC蛋白表达减少,与皮肤癌的发生有关[8]。基因在进行转录时,第9内含子对第8、9外显子转录剪接的调控影响可能较大,而第15外显子相距甚远,是否存在相互作用还尚待进一步研究。
肿瘤的遗传易感性的风险基因型与化疗敏感性的有效基因型是否一致,目前还存在争议。NP方案中,长春瑞滨是一种阻断细胞周期的特异性药物,抑制微管的形成同时能促进微管解聚。顺铂通过形成顺铂-DNA混合物,与DNA结合发挥其细胞毒作用。这些DNA链内或链间的交联导致的DNA损伤,可以介导肿瘤细胞死亡。NP方案化疗与DNA修复基因多态的作用机制可能主要以顺铂的作用为主。有学者认为,多态的突变基因型由于一种保护机制而比野生基因型更容易发动凋亡[9-10],而携带XPC容易发生凋亡的等位基因个体,DNA修复能力下降,对化疗药的反应下降而化疗敏感性提高。XPC基因第8外显子突变基因型(T/T)降低了原发性肝癌的发病风险,是保护因素。我们也发现,C/T+T/T基因型个体化疗敏感性提高,这2项结果均与以上观点一致。而有学者发现,XPC第9内含子杂合子L/S基因型降低了白人食道癌的发病风险[11]。同时我们发现,S等位基因者比L等位基因者的化疗敏感性提高了2.353倍。因此,我们假设变异等位基因S可能依以上观点,由于一种保护机制更易凋亡,而导致机体DNA修复能力下降,致化疗敏感性提高。虽然目前有研究报道,XPC15外显子Lys939Gln多态与XPC蛋白表达有关,中国人群肝癌及日本人群前列腺癌有关[12-13],但我们尚未观察到XPC第15外显子与NSCLC化疗敏感性的相关性。
单体型作为药物疗效及基因诊断及预测的研究是近年来研究的热点。由于单体型包含多个SNP的遗传信息,其以比单个SNP具有更好的统计分析效果和应用价值而在统计分析中倍受学者青睐。有学者发现,XPC Val499Ala-PAT-Lys939Gln的几种单体型组合与膀胱癌和鼻咽癌的发病风险有关[4-5]。Rondelli CM等认为,XPC的某些单体型可以改变吸烟者的DNA修复能力,导致染色体畸变从而改变了肿瘤的发病风险[14]。本研究发现,携带 C-L-A(Val499Ala、PAT、Lys939Gln)单体型的个体在化疗无效组(6.7%)的比率显著高于有效组(0.0%),即携带C-L-A单体型患者对NP化疗应答差。此单体型均由3个多态位点的野生等位基因组成,其化疗无效,可能因其更不容易发生凋亡,而DNA修复能力过强,导致对化疗药的反应过强而化疗敏感性下降。这一结果与上述观点亦一致。
本研究探讨了携带XPC3个基因多态位点基因型及单体型的患者采用NP方案化疗后敏感性的差别,首次报道了XPC PAT多态在中国NSCLC患者的分布频率,初步认为XPC基因多态可能是预测NP化疗敏感性的有效分子标志物。今后还需要大样本的病例研究以验证此结果,并需要多基因多位点的研究以全面探讨铂类化疗药物敏感性的机制。

表6 XPCVal499Ala、PAT、Lys939Gln 单体型与NSCLC化疗敏感性的关系#
[1] Reed E.Platinum-DNA adduct,nucleotide excision repair and platinum based anti-cancer chemotherapy[J].Cancer Treat Rev,1998,24(5):331
[2] Despras E,Pfeiffer P,Salles B,et al.Long-term XPC silencing reduces DNA double-strand break repair[J].Cancer Res,2007,67(6):2526
[3] Saviozzi S,Ceppi P,Novello S,et al.Non-small cell lung cancer exhibits transcript overexpression of genes associated with homologous recombination and DNA replication pathways[J].Cancer Res,2009,69(8):3390
[4] Zhu Y,Lai M,Yang H,et al.Genotypes,haplotypes and diplotypes of XPC and risk of bladder cancer[J].Carcinogenesis,2007,28(3):698
[5] Yang ZH,Liang WB,Jia J,et al.The xeroderma pigmentosum group Cgene polymorphisms and genetic susceptibility of nasopharyngeal carcinoma[J].Acta Oncol,2008,47(3):379
[6] Shi YY,He L.SHEsis a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005,15(2):97
[7] Lee GY,Jang JS,Lee SY,et al.XPC polymorphisms and lung cancer risk[J].Int JCancer,2005,115(5):807
[8] Emmert S,Wetzig T,Imoto K,et al.A novel complex insertion/deletion mutation in the XPCDNA repair gene leads to skin cancer in an Iraqi family[J].J Invest Dermatol,2006,126(11):2542
[9] Bowen AR,Hanks AN,Allen SM,et al.Apoptosis regulators and responses in human melanocytic and keratinocytic cells[J].J Invest Dermatol,2003,120(1):48
[10] Miller KL,Karagas MR,Kraft P,et al.XPA,haplotypes,and risk of basal and squamous cell carcinoma[J].Carcinogenesis,2006,27(8):1670
[11] Pan J,Lin J,Izzo JG,et al.Genetic susceptibility to esophageal cancer:the role of the nucleotide excision repair pathway[J].Carcinogenesis,2009,30(5):785
[12] Long XD,Ma Y,Zhou YF,et al.Polymorphism in xeroderma pigmentosum complementation group C codon 939 and aflatoxin B1-related hepatocellular carcinoma in the Guangxi population[J].Hepatology
[13] Hirata H,Hinoda Y,Tanaka Y,et al.Polymorphisms of DNA repair genes are risk factors for prostate cancer[J].Eur JCancer,2007,43(2):231
[14] Rondelli CM,El-Zein RA,Wickliffe JK,et al.A comprehensive haplotype analysis of the XPC genomic sequence reveals a cluster of genetic variants associated with sensitivity to tobacco-smoke mutagens[J].Toxicol Sci,115(1):41
