急性大、中强度运动对大鼠骨骼肌p38 MAPK、NF-kappaB活性,IL-6、MRFs mRNA的影响
2011-05-12王今越丁树哲王小虹胡志刚范尧
王今越 丁树哲 王小虹 胡志刚 范尧
1 佛山大学体育学院(佛山 528000) 2 华东师范大学体育与健康学院 3 东北师范大学体育学院 4 江西师范大学体育学院
运动是骨骼肌重塑主要诱因,肌肉发生是骨骼肌重塑的重要生物学基础。狭义的肌肉发生仅指胚胎发育过程中,体节细胞经历增殖、迁移、分化,最终形成肌肉组织的过程;广义上,肌肉发生还包括成体肌肉干细胞增殖、分化、融合、成熟及肌纤维本身蛋白表达的增强。一直以来,成体肌肉发生机制都是运动学领域的热点内容。目前对成体肌肉发生的细胞外事件的研究较深入,而对细胞内事件仍知之不多[1],p38、NF、IL-6在肌肉发生中的作用值得关注。
p38控制多种细胞发生进程[2-4],肌肉发生亦有其参与。通常认为,p38激活有助肌肉发生,通过特异性抑制剂SB203580抑制p38活性可阻止成肌细胞融入肌管,降低肌肉特异性基因的水平,而通过MKK6的突变激活p38会诱导肌肉分化标志物的表达和多核肌管的形成[5-8];NFB在不同条件下可能发挥截然相反的作用——对肌肉发生和肌肉降解均有作用[2,8-10];IL-6是信号转导研究的新内容,它与糖代谢密切相关,对肌肉发生也有作用,IL-6-/-小鼠卫星细胞的增殖和肌核的增加均被抑制,肌肉发育迟缓[3,4,11]。近年来,C2C12细胞研究显示,p38激活会上调NF-B活性、IL-6、-actin mRNA含量、MCK依赖性荧光酶活性,而应用NF-B抑制剂BAY11-7085降低了IL-6、-actin mRNA水平及MCK依赖性荧光酶活性,提示p38、NF-B、IL-6三者构成通路调控肌肉发生[4]。成肌因子MRFs(MyoD、MyoG、MRF4、Myf-5)是肌肉发生的主要效应因子,但急性运动诱导下各因子的动力学特征及其功能的异同缺乏深入研究,成肌增强因子MEF2(主要是MEF2c)是MRFs增强因子,其变化应与MRFs有关,而运动对其影响的报道鲜见。
1 材料和方法
1.1 动物分组及运动方案
66只10周龄体重270~300 g的清洁级雄性SD大鼠。饲养环境温度23℃,湿度40~60%,采用人工灯光模拟自然昼夜变化,光照时间早上8:00至下午5:30。自由进食,国家标准啮齿类动物常规饲料喂养。所有大鼠正式实验前5 d均进行3 d适应性跑台训练(1次/d、40 min/次、倾角10%、27 m/min),休息2 d,再开始正式实验。将大鼠随机均分为11组,具体分为安静组(C组)、急性大强度运动后0、1、6、16、24 h组(H-0、1、6、16、24 h组,运动方案:1 h、27 m/min、倾角10%,运动30 min后休息5 min,同样强度再跑25 min)、急性中等强度运动后0、1、6、16、24 h组(M-0、1、6、16、24 h组,运动方案:1h、20 m/min、5%,运动30 min后休息5 min,同样强度再跑 25 min)。依文献[12],27 m/min、倾角 10% 约相当于81 ±3.5%VO2max,跑速20 m/min、倾角5%约相当于 64 ±2% VO2max。
1.2 取材
根据分组,分别在运动后相应时段(0、1、6、16、24 h)以断颈椎方式分别处死大鼠取腓肠肌,用4℃预冷生理盐水清洗去除血污,滤纸吸干水分,称重后切分成数段,锡箔纸包裹,做好标签,浸入液氮30 min后放入-80℃超低温冰箱冷冻待测。C组大鼠在处死运动组大鼠当天以同样方法处死取材并保存。
1.3 主要试剂及试剂盒
p38 MAPK多克隆抗体(小鼠来源,43kD):Santa Cruz公司;Phospho-p38 MAPK多克隆抗体(Thr 180/Tyr 182、小鼠来源,43kD):Santa Cruz公司;tubulin多克隆抗体(小鼠来源,50kD):Cell Signal;Trizol总RNA提取试剂:Tiangen公司;Biort rt-pcr assasy kit:博日公司;NF-B assay kit:KC™生物公司。
1.4 测试方法
1.4.1 Phospho-p38(Thr180/Tyr182)、p38
细胞蛋白提取:取50~100 mg腓肠肌放入小烧杯中,加入1 ml提前预冷的匀浆介质(210 mM甘露醇,70 mM蔗糖,5 mM Tris-HCl,1 mM EDTA,0.1 mM PMSF,0.5 mM DTT,10 mM NaF);剪碎肌组织,去除结缔组织、脂肪等;电动匀浆,转速1500 ~ 1800 r/min,使组织匀浆化;匀浆液倒入离心管,1400g 4℃离心10 min;吸取上清即蛋白样品,BCA法定量。
western blotting 测定 Phospho-p38(Thr180/Tyr182)和p38。一般步骤略。关键步骤条件:聚丙烯酰胺凝胶浓度10%;20V稳压转移1.5 h;一抗p38、P-p38为1:800、tubulin为1:1000;稀释,二抗为1:1000。蛋白表达值为条带的灰度值,以tubulin内参校正。
1.4.2 Phospho-p65(Ser237)、p65
1.4.3 IL-6、MRFs、MEF2c mRNA
按照Trizol Reagent液说明书提取总RNA,检测总RNA质量和纯度采用变性琼脂糖凝胶电泳和紫外分光检测OD260/OD280比值,依据质量和纯度选取符合RT-PCR要求的RNA进行逆转录反应。按照Biort RT-PCR kit说明书进行cDNA的逆转录,总RNA经RT反应后进行PCR扩增,采用25 µl体系。PCR循环条件 :(1)95℃ 5 min,(2)95℃30 s,(3)(IL-6:58℃;MYOD:60℃;MyoG:62 ℃;MYF-5:60 ℃;MRF4:60℃;MEF2c:62℃)40 s,(4)72℃ 1 min,(5)回至第 2 步,25个循环 ,(6)72℃ 10 min,(7)保持在 4℃。PCR产物加样于2%琼脂糖凝胶、电泳(上样量12 µl,6×DNA loading buffer 2 µl,电压 150V,电泳 35 分钟)。mRNA含量为条带的OD值,以-actin内参校正。引物见表1,由上海生工生物工程技术服务有限公司合成。

表1 PCR引物
1.5 统计学分析
以WB、PCR、ELISA各指标的测试结果除以该指标对照组均数,进行同倍比的标准化处理。实验数据由SPSS12.0统计软件处理,计算平均值和标准差(± s),采用独立样本t检验分析组间差异显著性,显著性水平定为0.05。
2 结果
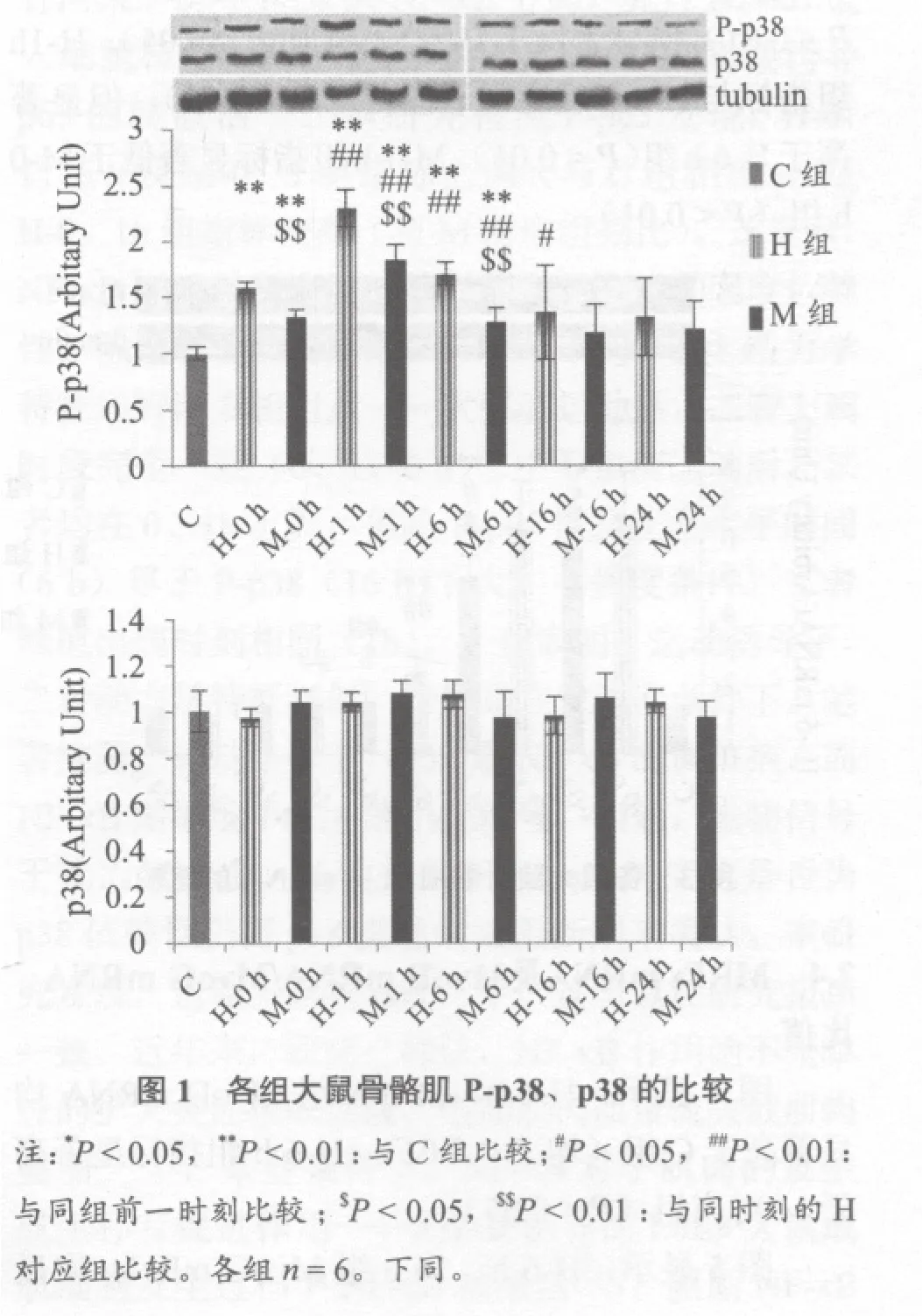
2.1 Phospho-p38和p38
图1显示,H-0、1、6 h 及M-0、1、6 h组Phospho-p38 均显著高于C组(均 P < 0.01),M-0、1、6 h组指标均显著低于H对应组(均P < 0.01),H-1h组显著高于H-0、6 h组(均P < 0.01),M-1 h组显著高于M-0、6 h组(均P < 0.01)。各组p38与C组均无显著性差异(P > 0.05)。
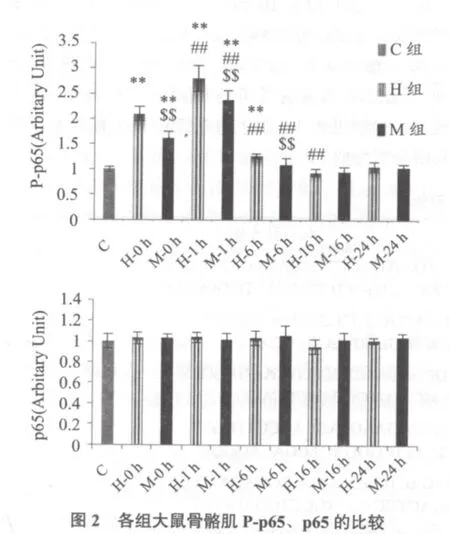
2.2 Phospho-p65和p65
图2显示,H-0、1、6 h组Phospho-p65均显著高于C组(均P < 0.01),M-0、1 h组指标均显著高于C组(均P < 0.01),但均显著低于H对应组(均P < 0.01)。H-1 h组指标显著高于H-0、6 h组(均P < 0.01),M-1 h组指标显著高于M-0、6 h组(均P < 0.01)。各组p65与C组均无显著性差异(P > 0.05)。
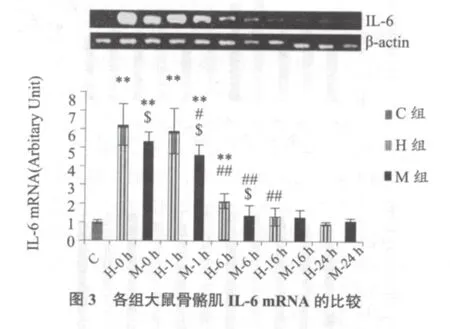
2.3 IL-6 mRNA
图3显示,H-0、1、6 h组指标均显著高于C组(均P < 0.01),M-0、1 h组指标均显著高于C组(均P < 0.01),但显著低于H对应组(均P < 0.05)。H-1h组指标与H-0 h组无显著差异(P > 0.05),但显著高于H-6 h组(P < 0.01)。M-1 h组指标显著低于M-0 h 组(P < 0.01)。
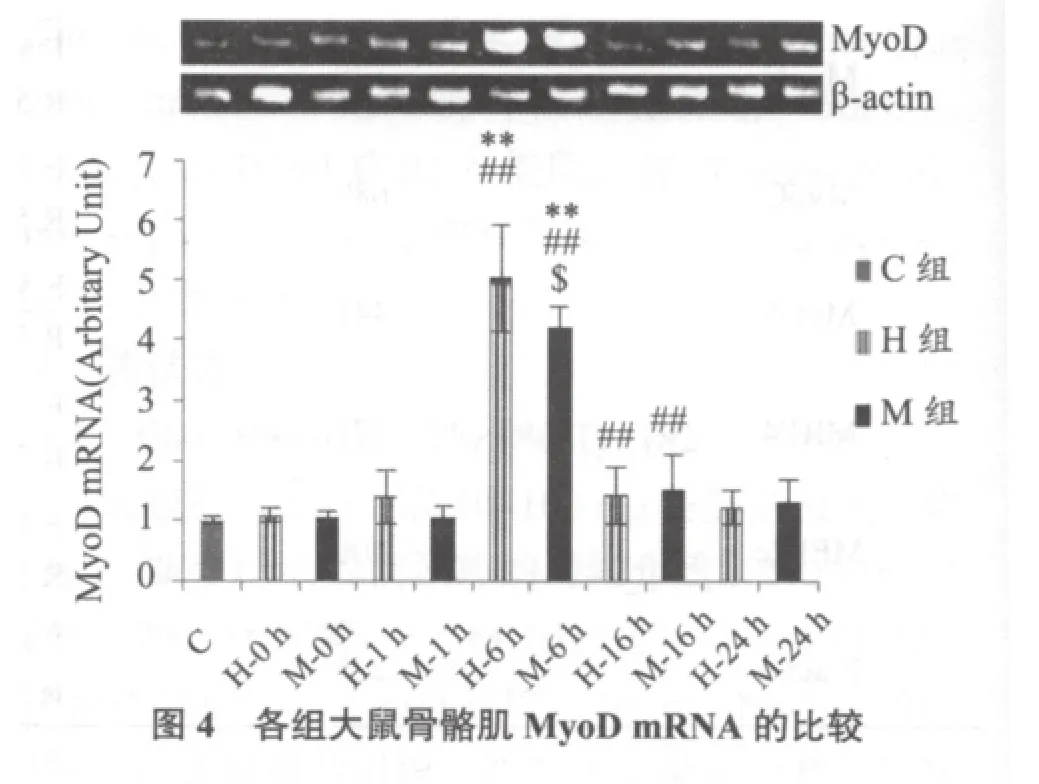
2.4 MRFs mRNA及MyoD mRNA/MyoG mRNA比值
图4显示,H-6 h、M-6 h 组MyoD mRNA均显著高于C组(均P < 0.01),H-6 h 组指标显著高于M对应组(P < 0.05)。
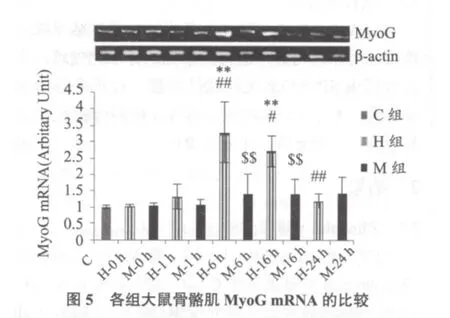
图5显示,H-6 h、16 h组MyoG mRNA均显著高于C组(均P < 0.01),M各组与C组均无显著性差异(P > 0.05)。
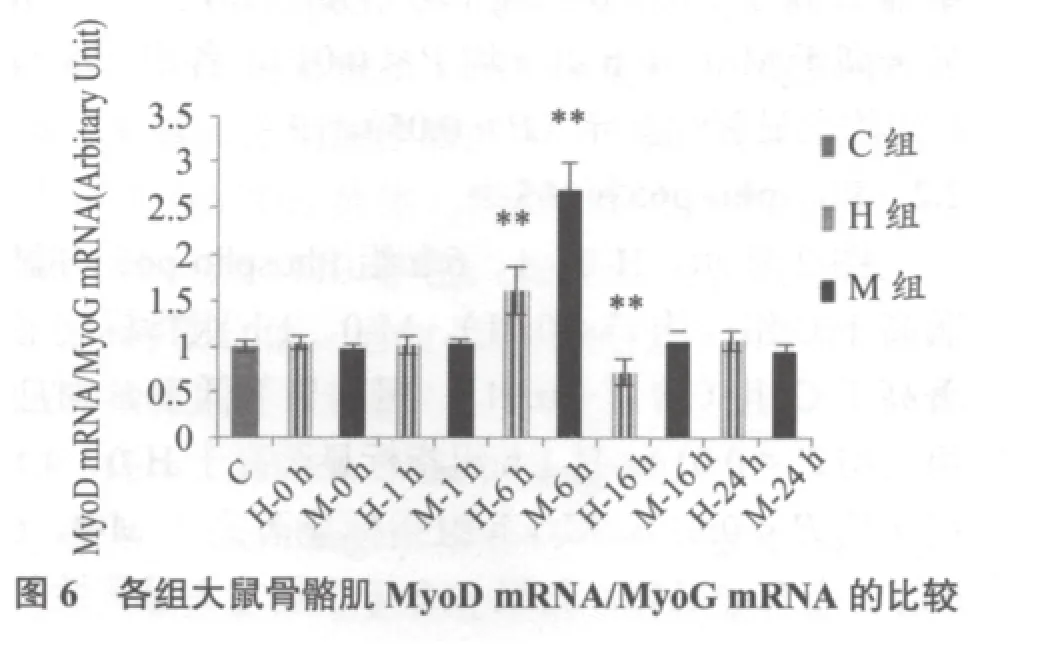
图6显示,H-6h、M-6h组MyoD mRNA/MyoG mRNA比值显著高于C组(均P < 0.01)。H-16组显著低于C组(均P < 0.01)。
图7显示,各组Myf-5 mRNA均与C组无显著性差异(P > 0.05)。
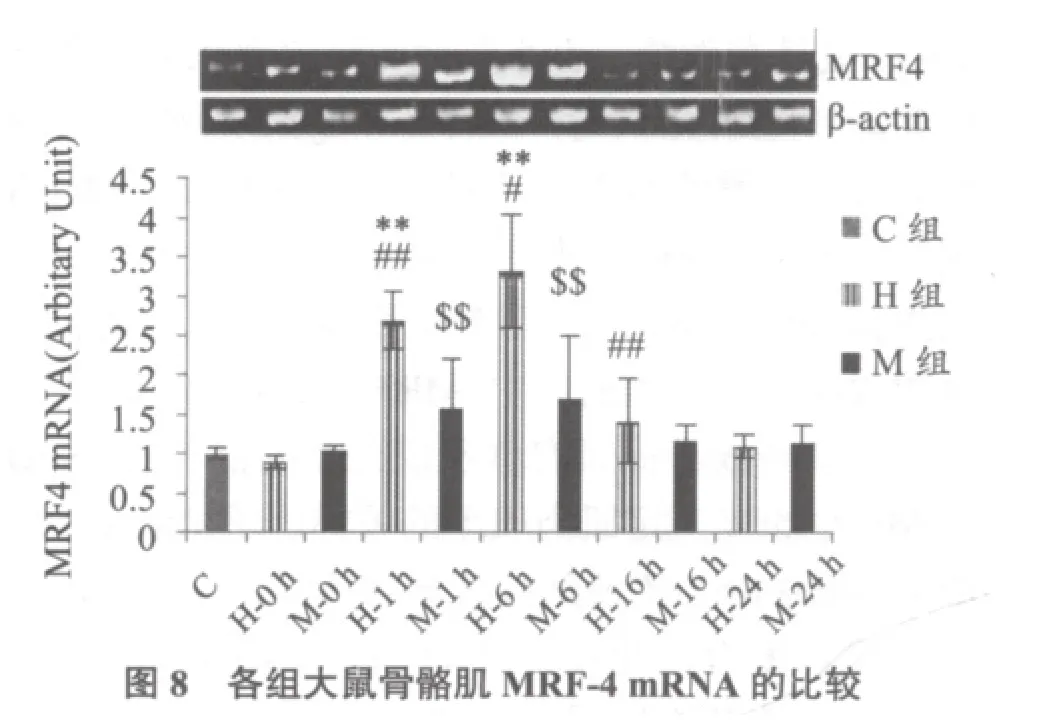
图8显示,H-1、6 h组MRF4 mRNA均显著高于C组(均P < 0.01),H-6 h组指标显著高于H-1组(P < 0.05)。M各组指标均与C组无显著性差异(P > 0.05)。

2.5 MEF2c mRNA
图9显示,H-0、1、6 h组和M-0、1h组MEF2c mRNA显著高于C组(均P < 0.01),且M-0、1 h组指标显著低于H对应组(均P < 0.05)。H-1h组指标显著高于H-0h组(P < 0.05)和H-6h组(P< 0.01),M-0、1 h组之间无显著性差异(P > 0.05)。

3 讨论
3.1 运动对p38、NF-B活性、IL-6 mRNA的影响
多数研究认为p38有助肌肉发生,但也有研究提出,p38对肌肉的发生作用取决于其所处的肌肉发生阶段。Weston报道,肢芽培养过程抑制p38却促进了肌管的形成,该研究认为,p38在肌肉发生的分化和分化后阶段起到相反作用,p38会促进肌肉干细胞的分化,但随后为了避免形成早熟的肌管,又抑制了已分化细胞的延长、极化、聚集和融合[5]。目前,对肌肉发生分化后阶段的分子事件了解还很匮乏,Weston的结果也有待更多证据来支持。本研究发现,M-0、1、6 h组及H-0、1、6h组P-p38上调(与C组相比),且H-0、1、6h组上调幅度较大(与M对应组相比),而p38始终未变。结果提示,p38在急性运动后早期即可激活,激活幅度有强度依赖性,急性运动不影响p38总水平。考虑到运动对于肌肉发生和存活是有益的,因此激活的p38作用应与此一致而非相悖,p38激活的运动强度依赖性也与已知的“运动强度越大,肌肉发生效果越好”相符。已知p38调节肌肉发生有多个途径[6-8],调节MRFs及MEF2活性或含量是其中之一,有报道,p38可以直接磷酸化并增强MEF2a、2c的转录活性,也能诱导Myf-5、MyoG等成肌因子及MEF2表达,具体机制未知[8-11],但可能该调节存在 NF-κB 依赖性[4]。
体外研究显示,p38调控NF-κB的途径主要有两条:诱导IκBa从NF-κB分离,允许NF-κB进入细胞核与DNA结合;通过CBP/P300间接诱导p65的转激活[4]。本研究检测P-p65发现,H-0、1、6 h及M-0、1组指标上调(与C组相比),且H-0、1h组指标较高(与M对应组相比)。这提示,NF-B激活的幅度及持续时间都具有运动强度依赖性。除运动强度依赖性外,P-p65与P-p38动力学特征还有诸多相似点——大强度运动后,二者上调时段完全一致(0、1、6 h);中等强度运动后,二者均在0、1h上调,但是P-p65恢复正常水平时间(6 h)早于P-p38(16 h);大、中强度条件,二者峰值出现时刻相同(1h)。上述表明,运动诱导下,二者动力学特征相似,特别是在大强度条件下。笔者推测,运动条件下,p38是NF-κB的调节剂,而NF-κB则承继了p38的生物信号。当然,生物信号干扰因素众多,运动条件下NF-κB 的变化是否为p38依赖性仍需p38激动剂或阻断剂来确认。本研究发现,运动不影响p65水平,这与以往研究报道一致。近年来,研究已确认,NF-κB作用绝不是单纯的扩大炎症级联反应、引起肌肉质量流失或肌肉萎缩[13-15],某些条件下,NF-κB对于肌肉的发生或生存有促进作用——IGF-II诱导的L6E9大鼠成肌细胞发生过程中NF-κB被激活[16],阻断NF-κB下调C2C12细胞某些结构蛋白和功能蛋白的表达[4],经过运动训练,老年大鼠肌肉NF-B活性提高、衰老引起的肌肉流失减缓、肌肉功能得到改善[2]。本研究采用的是对肌肉发育和存活有益的向心收缩运动,因此NF-B激活作用也应该与此一致而不太可能是促进炎症或肌肉流失。对于NF-B矛盾的功能,Ho提出,持续的NF-B激活可能导致肌肉损伤和流失(如伤病),间歇式的NF-B激活可能促进正常肌肉发育(如运动)[16],但Ho只明确了现象而未解释其机理。转录因子最终效用依赖于激活的基因,因此笔者认为,病理性反应中NF-B激活与运动性NF-B激活作用差异实际提示了不同条件下,转录因子NF-B将选择性激活编码不同功能蛋白的基因。基因选择性激活的机制将是未来研究的具体方向。NF-B靶基因中不包括肌肉特异性基因,也不包括肌肉发生核心调控因子MRFs或肌肉发生增强因子MEF2的基因,它对肌肉发生调节可能部分与其靶基因IL-6有关[3]。
IL-6与IL-1等炎症因子不同,与损伤及炎症关联并不大,并且有助于多种细胞的发生,如造血干细胞的增殖、B细胞的分化与成熟、T细胞的增殖与分化、肝细胞分化、神经细胞的分化、神经胶质细胞的增生等[9]。IL-6也是肌肉发生所必需的,IL-6-/-小鼠的肌肉发育明显迟缓[3]。本研究发现,M-0、1 h组及H-0、1、6 h组IL-6 mRNA上调(与C组相比),且H-0、1 h组IL-6 mRNA较高(与M对应组相比)。对比P-p65与IL-6的动力学特征,发现二者很相似——在大强度和中等运动强度下,P-p65上调时段均与IL-6 mRNA上调时段完全一致;二者上调幅度和时间均具有运动强度依赖性。研究提示,运动条件下,NF-B激活是IL-6基因表达重要诱因。
3.2 运动对MRFs、MEF2c mRNA的影响
MRFs是肌肉发生通路主要效应因子,能够促进肌肉特异性基因(如-actin、烟碱乙酰胆碱受体、-原肌球蛋白、MHC、结蛋白、肌钙蛋白C、CK、MCK等)表达、激活,引导肌肉成体干细胞增殖或分化。MEF2则是MRFs的增强子。本研究发现:H-6 h、M-6 h组MyoD mRNA上调(与C组相比),H-6 h组上调较大(与M对应组比);H-6、16 h组MyoG mRNA上调、M组未变;H、M组Myf-5 mRNA均未变;H-1、6 h组MRF4 mRNA上调、M组未变;H-0、1、6 h组MEF2c mRNA上调、M-0、1 h组上调,且H-0、1h组较高(与M对应组比较)。结果提示,MyoD、MEF2c mRNA对大、中强度运动刺激均敏感,MyoG、MRF4基因表达只对较高强度运动刺激有反应,Myf-5对运动刺激不敏感,推测它对运动诱导肌肉重塑的意义不大。与MRFs mRNA相比,H、M组MEF2c mRNA上调均较早(0 h),作为MRFs的辅助因子,它在运动早期的上调目的可能在于为MRFs激活肌肉特异基因的表达做好准备。已知MRFs表达具有一定时空特征,时间上,Myf-5、MyoD在卫星细胞激活、增殖生成成肌细胞过程中开始上调,而MRF4与MyoG在成肌细胞分化为肌管期开始上调;空间分布上,MyoD高表达于快肌,MyoG高表达于慢肌[17];功能上,MRFs成员有重叠,也有差异,目前尚未完全研究清楚。一些研究认为,MyoD、Myf-5引导卫星细胞的激活(增殖形成成肌细胞),而MRF4、MyoG则引导分化(成肌细胞分化为肌管)[18],也有研究认为MyoD与MRF4均参与了肌肉干细胞增殖与分化的调控[19,20]。本研究中,MRFs mRNA 结果表明,急性运动释放了促肌肉增殖或分化的信号。MyoD与MyoG也是决定肌肉表型的关键因子,MyoD可激活MHC IIb、X及某些酵解酶基因转录,促进快肌生成和发育,相反,MyoG有助MHC I、IIa和某些氧化酶基因转录,促进慢肌的生成发育[16],因而,二者比值变化反映了肌肉表型转化的波动。本研究发现,H-6 h组MyoD mRNA/ MyoG mRNA比值上升、H-16 h组比值下降、H-24 h恢复正常(与C组相比),提示,大强度运动后早期,肌肉类型变化为慢—快,后期则相反,为快—慢型转化,不难看出,这个波动特征与超量恢复类似,在恢复过程中会有个变化的“反转”,然后再回到正常水平。M-6 h组该比值上升、M-16h组恢复正常(与C组相比),显然,中等强度后,该比值恢复正常(16 h)比大强度(24 h)要早,提示,急性中等运动后早期,肌肉类型转换也为慢—快,类型转化过程在较短时间即恢复运动前水平。研究中,我们没有观察到中等强度后,类似大强度运动后出现的比值变化的“反转”,考虑到中等强度对肌肉的快—慢转化效果更强于大强度运动,“反转”应该存在,推测“反转”应该发生在6-16 h之间。大强度运动后,MRFs mRNA上调顺序是MRF4、MyoD及MyoG,中等强度后,只有MyoD上调,MRFs基因表达次序与不同特征的肌肉的塑造有何联系值得进一步调查。需要指出,MRFs、MEF2c均为转录因子,判断其功能最佳指标是DNA结合活性而非mRNA或蛋白水平,未来研究还需要补充这方面的数据。
3.3 IL-6与MEF2c及MRFs的联系
本研究中,MRFs及MEF2 mRNA的变化体现了急性运动对肌肉发生进程的干预,它的上游机制为何?细胞生物学研究发现,IL-6-/-能够抑制肌肉发生[3],以往研究也有报道提出,IL-6可能是介导p38、NF-B肌肉发生信号的重要环节[4],是否急性运动诱导下, IL-6通过上调肌肉发生主要效应因子MRFs或MEF2c的基因表达来加强肌肉生物发生进程?它们之间关系是否密切?本研究对IL-6 mRNA及MRFs、MEF2 mRNA的动力学特征进行了比较。
本研究发现,大、中强度运动后,IL-6与MEF2c mRNA 上调期完全相同(分别是 0、1、6 h;0、1 h),并如前文所述,二者上调幅度和时间均为运动强度依赖性的;中等强度后,IL-6 mRNA上调(0、1 h)早于 MyoD mRNA上调(6 h),并且二者上调时段无交集,其余MRFs mRNA未改变,因此无需比较;大强度运动后,IL-6 mRNA上调(0、1、6 h)早于 MyoD mRNA(6 h)、MyoG mRNA(6、16 h)、MRF4 mRNA(1、6 h),即上调时段有部分一致。将指标变化时段的相似程度视为衡量因子之间关联程度密切与否的标尺,本研究推断,运动条件下,IL-6可能对MEF2c基因表达有比较直接的作用,中等强度运动下,它与MyoD、MyoG、MRF4的基因表达可能无直接关联,然而,这个关联在运动强度增大时可能变得紧密。IL-6与MRFs及MEF2c的关系仍需通过IL-6基因敲除等手段来验证,特别需要指出,MRFs成员之间、MRFs与MEF2c会相互影响,如MyoD与Myf-5能够上调MyoG[21],MRF4 可 以 上 调 MyoG 和 MEF2[22],但又会引起MyoD的降解[21],未来研究方案设计如何排除指标相互干扰,确认IL-6等因子与MRFs各成员具体关系还是个难点。
4 总结
[1]Le Grand F,Rudnicki A. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol,2007,19(6):628-633.
[2]Song W,Kwak HB. Exercise training attenuates ageinduced changes in apoptotic signaling in rat skeletal muscle. Antioxid Redox Signal,2006,8(3-4):517-528.
[3]Serrano A,Baeza-Raja B,Perdiguero E,et al. Interleukin-6 is an essential regulator of satellite cell-mediated skeletal muscle hypertrophy. Cell Metab,2008,7(1):33-44.
[4]Baeza-Raja B,Munoz-Canoves P. p38 MAPK-induced Nuclear Factor-B Activity Is Required for Skeletal Muscle Differentiation:Role of Interleukin-6. Mol Biol Cell,2004,15(4):2013-2026.
[5]Weston AD,Sampaio AV,Ridgeway AG,et al. Inhibition of p38 MAPK signaling promotes late stages of myogenesis. J Cell Sci,2003,116(14):2885-2893.
[6]Lluís F,Perdiguero E,Nebreda A,et al. Regulation of skeletal muscle gene expression by p38 MAP kinases.Trends Cell Biol,2006,16(1):36-44.
[7]Cuenda A,Rousseau S. p38 MAP-Kinases pathway regulation,function and role in human diseases. Biochimica et biophysica acta. Mol Cell Res,2007,1773(8):1358-1375.
[8]Briata P,Forcales S,Ponassi M,et al. p38-dependent phosphorylation of the mRNA decay-promoting factor KSRP controls the stability of select myogenic transcripts.Mol Cell,2005,20(6):891-903.
[9]Bodell PW,Kodesh E,Haddad F,et al. Skeletal muscle growth in young rats is inhibited by chronic exposure to IL-6 but preserved by concurrent voluntary endurance exercise. J Appl Physiol,2009,106(2):443-453.
[10]Ono T,Maekawa K,Watanabe S,et al. Muscle contraction accelerates IL-6 mRNA expression in the rat masseter muscle. Arch Oral Biol,2007,52(5):479-486.
[11]Pedersen BK,Steensberg A,Fischer C,et al. The metabolic role of IL-6 produced during exercise: is IL-6 an exercise factor? Proc Nutr Soc,2004,63(2):263-267.
[12]Bedford TG,Tipton CM, Wilson NC,et al. Maximum oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol,1979,47(6):1278-1283.
[13]Kramer HF,Goodyear LJ. Exercise,MAPK,and NF-kappaB signaling in skeletal muscle. J Appl Physiol,2007,103(1):388-395.
[14]Cai D,Frantz JD,Tawa NE,et al. IKKbeta/NF-kappaB activation causes severe muscle wasting in mice.Cell,2004,119(2):285-298.
[15]Canicio J,Ruiz-Lozano P,Carrasco M,et al. Nuclear factorB-inducing kinase and IB kinase-signal skeletal muscle cell differentiation. J Biol Chem,2001,276(23):20228-20233.
[16]Ho RC,Hirshman MF,Li Y,et al. Regulation of IB kinase and NF-B in contracting adult rat skeletal muscle.Am J Physiol Cell Physiol,2005,289(4):794-801.
[17]苏艳红. 耐力训练对肌球蛋白重链的影响及 MyoD,Myogenin的调控作用. 体育学刊,2007,7(1):159-163.
[18]McCarthy JJ,and Esser KA. Counterpoint:Satellite cell addition is not obligatory for skeletal muscle hypertrophy.Am Physio Soc,2007,59(4):1100-1112.
[19]Yoshida T. MCAT elements and the TEF-1 family of transcription factors in muscle development and disease.Arterioscler Thromb Vasc Biol,2008,28(1):8-16.
[20]Hennebry A,Berry C,Siriett V,et al. Myostatin regulates fiber-type composition of skeletal muscle by regulating MEF2 and MyoD gene expression. Am J Physiol,2009,296(3):525-542.
[21]Legerlotz K,Smith HK. Role of MyoD in denervated,disused,and exercised muscle. Muscle Nerve,2008,38(3):1087-1100.
[22]Kassar-Duchossoy L,Gayraud-Morel B,Gomes D,et al. Mrf4 determines skeletal muscle identity in Myf5:Myod double-mutant mice. Nature,2004,431(7007):466-471.
