羧胺三唑与小剂量地塞米松合用对A549肺癌移植瘤生长抑制作用的研究
2011-04-10鞠瑞武丹威郭磊李娟叶菜英张德昌
鞠瑞,武丹威,郭磊,李娟,叶菜英,张德昌
·论著·
羧胺三唑与小剂量地塞米松合用对A549肺癌移植瘤生长抑制作用的研究
鞠瑞,武丹威,郭磊,李娟,叶菜英,张德昌
目的观察羧胺三唑(CAI)对 A549 肺癌移植瘤生长及肿瘤环境中肿瘤坏死因子-α 含量和血管生成的影响,研究小剂量地塞米松(DEX)是否能通过降低肿瘤环境中肿瘤坏死因子-α 含量和抑制血管生成增强 CAI 对移植瘤生长的抑制作用。
疾病模型,动物; 抗肿瘤药; 地塞米松;肿瘤坏死因子-α; 血管生成抑制剂
非细胞毒抗肿瘤药物羧胺三唑(carboxyamidotriazole,CAI)具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和抑制血管形成等作用[1-3]。而我们在之前的研究中新发现 CAI 在一系列急慢性炎症模型中表现出抗炎作用,能够显著抑制炎症介质——肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的释放[4]。因此在本文中,我们首先提出了 CAI 对肿瘤环境中 TNF-α 也有调控作用的假设。TNF-α 不仅是炎症反应中十分重要的一种细胞因子,在肿瘤发生阶段和侵袭转移阶段也扮演促进肿瘤发展的关键角色,是促进血管形成的一种重要的细胞因子,血管内皮生长因子(VEGF)的表达也依赖于 TNF-α 的调控[5]。地塞米松(dexamethasone,DEX)是一种皮质类固醇药物,具有很强的抗炎作用,能抑制巨噬细胞分泌包括TNF-α 在内的多种炎性细胞因子,在肿瘤的治疗中也十分常见[6]。在本项研究中,我们研究了 CAI 与小剂量 DEX 联合应用(combination,COM)是否能增强 CAI 对移植瘤生长的抑制作用以及是否能进一步降低 TNF-α 在肿瘤环境中的含量;给予TNF-α 特异性拮抗剂——英夫利昔单抗(TNF-α antibody,TAB)研究 TNF-α 在该模型肿瘤生长中的作用;并对肿瘤组织内的血管用 CD31 抗体进行染色以初步解释药物作用。目前的 CAI 单独应用或与化疗药物合用的临床试验数据表明,CAI 治疗肿瘤的疗效并不理想,合并用药方案也未能有效地使抗肿瘤作用增强[7-9]。优化 CAI 的抗肿瘤作用和发展新的联合用药方案具有重要意义。
1 材料和方法
1.1 材料
1.1.1细胞系 A549 肺癌细胞购自中国医学科学院基础医学研究所细胞中心。
1.1.2实验动物 40 只 6 ~ 8 周龄裸小鼠,体重18 ~ 20 g,合格证号:0156072,购自中国医学科学院动物所。在温度(22 ± 2)℃、湿度 40% ~ 70%、每日 12 h 光照环境下饲养。
1.1.3试剂 CAI 由中国医学科学院药物研究所提供;聚乙二醇 400(PEG 400)购自北京化学试剂公司;DEX 购自天津金耀氨基酸有限公司;RPMI1640 培养基购自中国医学科学院基础医学研究所细胞中心;胎牛血清购自美国 Gibco 公司;CD31 抗体(MEC13.3)购自美国 Biolegend 公司;OCT 包埋剂、FITC 标记的山羊抗大鼠 IgG 二抗购自北京中衫金桥生物技术有限公司;TNF-α ELISA 检测试剂盒购自美国 R&D 公司。
1.1.4实验仪器 ThermoForma Series II 水套CO2培养箱购自美国 Thermo 公司;CM1900 型冰冻切片机和 DM5000B 型荧光显微镜均购自德国徕卡公司;Synogen 4 酶标仪购自美国基因公司。
1.2 方法
1.2.1体外细胞培养 A549 细胞用 RPMI1640培养基(加入 10% 胎牛血清、1% L-谷氨酰胺、50 mg/ml 青霉素和 100 mg/ml 链霉素)在 37 ℃、5% CO2环境中培养。
其中,OD样本为加入荷叶发酵上清和细胞孔的吸光值,OD空白为不加入荷叶上清液和细胞孔的吸光值,OD对照为只加入细胞孔的吸光值。
1.2.2A549 移植瘤模型 收集处于对数生长期的 A549 细胞,用 PBS 调整细胞密度至 2 × 107个/ml,向每只裸小鼠右侧腋窝内注射 0.1 ml,即 2 × 106个/只。接种后将小鼠随机分为 5 组:溶剂 PEG 400 组、CAI 组、DEX 组、CAI 与 DEX合用(COM)组和英夫利昔单抗(TAB)组,每组8 只小鼠。接种 A549 细胞后第 2 天给药:PEG 400 组和 CAI 组小鼠每天灌胃给药一次,0.1 ml/ 10 g 体重,CAI 剂量为 20 mg/kg;DEX 组每周背部皮下注射给药两次,剂量为 1 mg/kg;CAI 和DEX 合用组给药方式和剂量为:CAI 每天灌胃给药一次,剂量为20 mg/kg,DEX 每周背部皮下注射给药两次,剂量为 1 mg/kg;英夫利昔单抗每周腹腔注射给药两次,剂量为 10 mg/kg。给药 40 d后处死小鼠,剥离肿瘤组织并称重。将一部分肿瘤组织浸入 OCT 包埋剂,在液氮液面上方冻成硬块,保存于 –80 ℃,以备制成冰冻切片;将一部分肿瘤组织保存于 –80 ℃,以备匀浆。
1.2.3肿瘤组织 CD31 血管染色 将 OCT 包埋的肿瘤组织用冰冻切片机制成 8 μm 冰冻切片,将切片立即置于甲醇中固定 2 min 后浸于 pH 7.4 PBS 中清洗,之后滴加 5% 牛血清白蛋白(BSA)在 37 ℃ 孵育 40 min。用 pH 7.4 PBS 清洗后滴加大鼠抗小鼠 CD31一抗(1∶200稀释)孵育,4 ℃ 过夜。第 2 天将切片在室温平衡 1 h 后,用 pH 7.4 PBS 清洗 5 min 并重复 3 次,然后滴加 FITC 标记的山羊抗大鼠 IgG 二抗,室温避光孵育 2 h 后,用 pH 7.4 PBS 清洗,5 min × 3。封片后用荧光显微镜观察照相。
1.2.4肿瘤组织内 TNF-α 含量检测 每组取4 个肿瘤组织,在液氮冷冻条件下用研钵将肿瘤组织研磨成粉末,然后收集于试管中称重,按 500 μl/g组织的比例向粉末中加入放射免疫沉淀裂解液(radio immuno precipitation assay,RIPA),其中含苯甲基磺酰氟(PMSF)1 mmol/L、二硫苏糖醇(DTT)1 mmol/L、亮抑酶肽(leupeptin)5 μg/ml、抑蛋白酶肽(aproptinin)5 μg/ml,置冰上使用组织匀浆器匀浆 30 s,将组织悬液在 4 ℃ 以 15 000 × g 超速离心 30 min。取离心上清,用 Bradford 方法对总蛋白进行定量。用 ELISA 试剂盒检测肿瘤组织蛋白匀浆中 TNF-α 的浓度,用 TNF-α 浓度/总蛋白浓度表示 TNF-α 在肿瘤组织蛋白匀浆中的含量。
1.3 统计学处理
应用 SPSS13.0 统计学软件进行数据处理,对照组与给药组检测结果的比较采用 Student’s t 检验,以 P < 0.05 为有统计学意义的差异。
2 结果
2.1 CAI 和(或)DEX 对 A549 移植瘤生长的抑制作用
A549 移植瘤模型建立 40 d 后,处死小鼠并剥离瘤组织,发现药物合用组的肿瘤组织体积明显小于溶剂对照 PEG 组(图 1)。各组瘤重分别为:PEG 组(0.23 ± 0.04)g;CAI 组(0.21 ± 0.02)g;DEX 组(0.17 ± 0.04)g;COM 组(0.12 ± 0.03)g;TAB 组(0.17 ± 0.04)g(图 2)。CAI 与 DEX 合用使瘤重降低了 49.1%。

图1 A549 移植瘤模型建立 40 d 后剥离的 PEG 组和COM 组的肿瘤组织,分别取 PEG 组和 COM 组 4 个肿瘤组织进行照相Figure 1 Tumor tissues isolated after 40 days of treatment in the A549 xenograft tumor model,4 tumor tissues in PEG or COM group were taken for photos
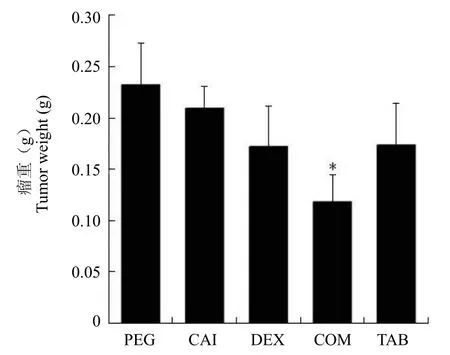
图2 A549 移植瘤模型建立 40 d 后各组瘤重,给药 40 d后处死小鼠,剥离肿瘤组织并称重(n = 8)。*,与 PEG 组相比P< 0.01Figure 2 Tumor weights after 40 days of treatment in the A549 xenograft tumor model. The tumors were isolated and weighed after 40 days of treatment (n = 8). *,P< 0.01,compared with PEG group.
2.2 CAI 和(或)DEX 对 A549 移植瘤组织内血管生成的抑制作用
我们对各组肿瘤组织冰冻切片进行 CD31 荧光染色观察血管数目的变化,发现 CAI 和 DEX均能减少血管生成,而药物合用组中的血管数目被降至更低水平(图 3)。
2.3 CAI 和(或)DEX 降低 A549 移植瘤组织TNF-α的含量
我们对各组肿瘤组织匀浆中 TNF-α 的含量进行了测定。PEG、CAI、DEX、COM 和 TAB 组肿瘤组织匀浆中 TNF-α 的含量分别为(933.9 ± 286.8)、(636.1 ± 157.4)、(684.9 ± 170.1)、(364.7 ± 0.1)和(606.8 ± 190.3)pg/mg 蛋白(图 4)。结果显示,CAI 和 DEX 单用均可下调 TNF-α 的含量,两药合用使 TNF-α 含量降至更低的水平。
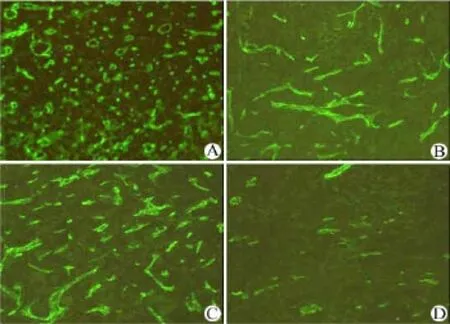
图3 各组肿瘤组织内血管染色,将肿瘤组织 8 μm 冰冻切片用大鼠抗小鼠 CD31 一抗和FITC 标记的山羊抗大鼠IgG 二抗依次孵育,封片后用荧光显微镜观察照相(10 ×)(A:PEG;B:CAI;C:DEX;D:COM)Figure 3 Immuno-fluorescent staining for CD31 in tumor tissues. The frozen sections (8 μm) were incubated with anti-mouse CD31 primary antibody and followed by FITC-conjugated second antibody. The photos were captured by a fluorescent microscope (10 ×) (A: PEG; B: CAI; C: DEX; D: COM)
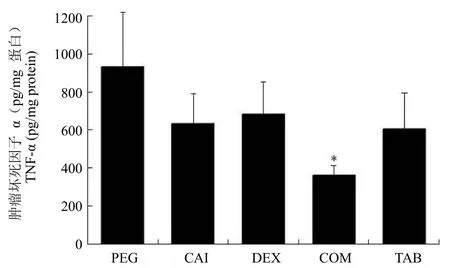
图4 各组肿瘤组织内 TNF-α 的含量。*,与 PEG 组相比P< 0.01Figure 4 TNF-α concentration in tumor tissues. *,P< 0.01,compared with PEG group.
3 讨论
本项研究表明,羧胺三唑(CAI)不仅能够直接影响肿瘤细胞[抑制增殖、诱导凋亡、抑制肿瘤细胞中血管内皮细胞生长因子(VEGF)的生成等],还能通过调控肿瘤环境中 TNF-α 控制肿瘤的发展。DEX 具有抗炎作用,对 TNF-α 的合成有较强的抑制作用,与 CAI 合用后使其抗肿瘤作用增强。
CAI 和 DEX 均能在一定程度上抑制 A549移植瘤的生长,合用之后的抗肿瘤作用被显著增强。我们在该移植瘤生长过程中给予 TNF-α 抗体药物英夫利昔单抗,发现拮抗TNF-α 能够使肿瘤生长减缓。一些临床试验数据确实表明,英夫利昔单抗能够稳定晚期癌症患者的病情,其单独应用和与化疗药物合用均取得了良好的疗效[10-12]。针对促肿瘤发展细胞因子 TNF-α 进行抗肿瘤治疗被广泛认可[13]。
TNF-α 在肿瘤的发生发展过程中作用较广,目前研究较多的是其促血管生成作用。在肿瘤微环境中,TNF-α 可能能够使骨髓系祖细胞向内皮细胞分化[14],VEGF 的变化也依赖于 TNF-α 的调控[5]。我们对 A549 移植瘤组织的冰冻切片进行血管染色后发现,CAI 能抑制血管的生成,这与目前文献[15]报道的 CAI 的血管抑制作用一致。由于在之前的研究中发现 CAI 在急慢性炎症中均表现出对TNF-α 释放的抑制作用,我们提出了 CAI 也能够调控肿瘤环境中 TNF-α 含量的假设。对肿瘤组织中 CD31 分子染色,观察各组血管数目的差异,结果显示 CAI 和 DEX 单用均能减少血管的数目,这与目前对两种药物的认识一致:CAI 能够抑制肿瘤细胞 VEGF 的释放,而 DEX 也在多种模型上被发现具有抗血管生成作用,如能够通过抑制 H22肝癌细胞中 VEGF 的表达抑制 H22 移植瘤的生长[16]。我们在本实验中发现两者合用组的血管数目降至极低的水平。由于两种药物均具有抗炎作用,且 VEGF 的表达受到 TNF-α 的调控,我们对各组肿瘤组织内 TNF-α 的含量进行了检测。结果显示,CAI 和 DEX 确实都对肿瘤组织内的 TNF-α 有下调作用,而两者合用对其抑制作用最为明显,其含量水平甚至低于英夫利昔单抗给药组。各组TNF-α 含量的差异与各组瘤重的差异吻合。
总之,本实验发现了小分子药物 CAI 与小剂量DEX 合用之后对肿瘤环境中 TNF-α生成和 A549移植瘤生长的强抑制作用,其作用可与 TNF-α 特异性拮抗剂英夫利昔单抗相比,甚至优于后者。在给药过程中,始终没有发现糖皮质激素相关的不良反应,此合用方案有着良好的耐受性。本项研究对于优化 CAI 的抗肿瘤作用有着重要的意义,并为肺癌治疗提供了一种可能的联合用药方案。
[1] Wasilenko WJ,Palad AJ,Somers KD,et al. Effects of the calcium influx inhibitor carboxyamido-triazole on the proliferation and invasiveness of human prostate tumor cell lines. Int J Cancer,1996,68(2):259-264.
[2] Guo L,Li ZS,Wang HL,et al. Carboxyamido-triazole inhibits proliferation of human breast cancer cells via G2/M cell cycle arrest and apoptosis. Eur J Pharmacol,2006,538(1-3):15-22.
[3] Oliver VK,Patton AM,Desai S,et al. Regulation of the pro-angiogenic microenvironment by carboxyamido-triazole. J Cell Physiol,2003,197(1):139-148.
[4] Guo L,Ye C,Chen W,et al. Anti-inflammatory and analgesic potency of carboxyamidotriazole,a tumorostatic agent. J Pharmacol Exp Ther,2008,325(1):10-16.
[5] Ryuto M,Ono M,Izumi H,et al. Induction of vascular endothelial growth factor by tumor necrosis factor alpha in human glioma cells. Possible roles of SP-1. J Biol Chem,1996,271(45):28220-28228.
[6] Eyre HJ,Ward JH. Control of cancer chemotherapy-induced nausea and vomiting. Cancer,1984,54(11 Suppl):2642-2648.
[7] Dutcher JP,Leon L,Manola J,et al. Phase II study of carboxyamidotriazole in patients with advanced renal cell carcinoma refractory to immunotherapy: E4896,an Eastern Cooperative Oncology Group Study. Cancer,2005,104(11):2392-2399.
[8] Johnson EA,Marks RS,Mandrekar SJ,et al. Phase III randomized,double-blind study of maintenance CAI or placebo in patients with advanced non-small cell lung cancer (NSCLC) after completion of initial therapy (NCCTG 97-24-51). Lung Cancer,2008,60(2):200-207.
[9] Mikkelsen T,Lush R,Grossman SA,et al. Phase II clinical and pharmacologic study of radiation therapy and carboxyamido-triazole (CAI) in adults with newly diagnosed glioblastoma multiforme. Invest New Drugs,2007,25(3):259-263.
[10] Jatoi A,Jett JR,Sloan J,et al. A pilot study on safety and pharmacokinetics of infliximab for the cancer anorexia/weight loss syndrome in non-small-cell lung cancer patients. Support Care Cancer,2004,12(12):859-863.
[11] Harrison ML,Obermueller E,Maisey NR,et al. Tumor necrosis factor alpha as a new target for renal cell carcinoma: two sequential phase II trials of infliximab at standard and high dose. J Clin Oncol,2007,25(29):4542-4549.
[12] Brown ER,Charles KA,Hoare SA,et al. A clinical study assessing the tolerability and biological effects of infliximab,a TNF-alpha inhibitor,in patients with advanced cancer. Ann Oncol,2008,19(7):1340-1346.
[13] Szlosarek PW,Balkwill FR. Tumour necrosis factor alpha: a potential target for the therapy of solid tumours. Lancet Oncol,2003,4(9):565-573.
[14] Li B,Vincent A,Cates J,et al. Low levels of tumor necrosis factor alpha increase tumor growth by inducing an endothelial phenotype of monocytes recruited to the tumor site. Cancer Res,2009,69(1):338-348.
[15] Bauer KS,Cude KJ,Dixon SC,et al. Carboxyamido-triazole inhibits angiogenesis by blocking the calcium-mediated nitric-oxide synthase-vascular endothelial growth factor pathway. J Pharmacol Exp Ther,2000,292(1):31-37.
[16] Zhai Y,Lü ZJ. Effect of dexamethasone on tumor growth and vascular endothelial growth factor expression in mouse H22 model. Cancer Res Prev Treat,2003,30(2):98-101. (in Chinese)翟羽,吕占军. 地塞米松对小鼠H22肿瘤生长及血管内皮生长因子表达的影响. 肿瘤防治研究,2003,30(2):98-101.
Carboxyamidotriazole and low dose dexamethasone significantly inhibit the growth of A549 xenograft tumors
JU Rui,WU Dan-wei,GUO Lei,LI Juan,YE Cai-ying,ZHANG De-chang
ObjectiveTo investigate the effect of carboxyamidotriazole (CAI) on the A549 xenograft tumor growth as well as the tumor necrosis factor-α (TNF-α) level and angiogenesis in tumor microenvironment; to investigate whether the antitumor effect of CAI could be enhanced by low dose dexamethasone (DEX) via further decreasing the TNF-α level and inhibiting angiogenesis.MethodsA549 xenograft tumor model was established by injecting A549 cells into the subcutaneous tissue of the right axillary fossa of nude mice. The tumor bearing mice were divided into 5 groups and treated with CAI and/or DEX (PEG400 vehicle group: intragastric administration daily by 0.1 ml/10g bodyweight; CAI group: intragastric administration daily by 20 mg/kg; DEX group: subcutaneous administration twice a week for 1 mg/kg; combination group (COM): CAI,intragastric administration daily by 20 mg/kg,DEX,subcutaneous injection twice a week for 1 mg/kg; TNF-α antibody group (TAB): peritoneal injection twice a week for 10 mg/kg) on the next day. After 40 days,the tumors were isolated and weighed. The tissues were immediately frozen for preparation of frozen sections or tissue homogenates. The frozen sections were stained for CD31 immuno-fluorescent test. TNF-α concentration in the tissue homogenates was determined by a specific ELISA kit. The involvement of TNF-α in this xenograft model was confirmed by specific TNF-α antagonist infliximab.ResultsCAI,DEX and infliximab could inhibit the growth of A549 xenograft tumors,and the combination of CAI and DEX was the most effective among the groups. The tumor weights of PEG,CAI,DEX,COM and TAB group were (0.23 ± 0.04),(0.21 ± 0.02),(0.17 ± 0.04),(0.12 ± 0.03) and (0.17 ± 0.04)g,respectively. Both CAI and DEX could decrease the number of blood vessels in tumor tissues,and the number decreased to a lower level in the combination group. CAI could inhibit the TNF-α production in tumor tissues,which could also be enhanced by DEX. TNF-α concentrations in tumor tissues of PEG,CAI,DEX,COM and TAB group were (933.9 ± 286.8),(636.1 ± 157.4),(684.9 ± 170.1),(364.7 ± 50.1) and (606.8 ± 190.3)pg/mg total protein,respectively.ConclusionCAI inhibits tumor growth not only by directly acting on tumor cells,but also by suppressing TNF-α production and angiogenesis in the tumor microenvironment,which may be a new antitumor mechanism of CAI. As those actions of CAI could be augmented by low dose DEX,the combination of CAI and low dose DEX may be further developed and applied clinically.
Disease models,animal; Antineoplastic agents; Dexamethasone; Tumor necrosis factor-alpha; Angiogenesis inhibitors
s:ZHANG De-chang,Email: zhangdechang45@vip.sina.com; YE Cai-ying,Email: caiyingye@126.com
10.3969/cmba.j.issn.1673-713X.2011.02.004
科技部“重大新药创制”科技重大专项(2009ZX09102-049、2009ZX09303-008);国家自然科学基金(30873075);中国医学科学院院所长基金(2009PY01、2010PY08)
100005 北京,中国医学科学院基础医学研究所药理学系
张德昌,Email:zhangdechang45@vip.sina.com;叶菜英,Email:caiyingye@126.com
2011-01-14
方法向裸鼠腋下接种 A549 肺癌细胞,建立 A549 肺癌移植瘤模型,接种第 2 天随机分5 组,并开始给药,分别是 PEG400 溶剂对照组(每天一次灌胃给药,0.1 ml/10 g 体重)、CAI 组(每天一次灌胃给药,20 mg/kg)、DEX 组(每周两次背部皮下注射给药,1 mg/kg)、CAI 与 DEX 合用组(CAI,每天一次灌胃给药,20 mg/kg;DEX,每周两次背部皮下注射给药,1 mg/kg)及英夫利昔单抗组(每周两次腹腔注射给药,10 mg/kg)。40 d 后剥离瘤组织,拍照并称重;将部分新鲜肿瘤组织速冻后制作冰冻切片,进行 CD31荧光染色;另一部分新鲜瘤组织制备匀浆后用 ELISA 方法对其 TNF-α 含量进行检测。
结果CAI、DEX 和 TNF-α 抗体(英夫利昔单抗)对移植瘤生长均有抑制作用,而 CAI与 DEX 的联合应用抑癌作用最强,PEG、CAI、DEX、COM 和 TAB 组瘤重分别为(0.23 ± 0.04)、(0.21 ± 0.02)、(0.17 ± 0.04)、(0.12 ± 0.03)和(0.17 ± 0.04)g。CD31 血管染色显示,CAI 和 DEX 均能减少肿瘤组织内的血管数目,两者合用在极大程度上抑制了血管的生成;CAI 能够降低肿瘤组织内 TNF-α 含量,与DEX 合用使 TNF-α 含量降至更低水平,PEG、CAI、DEX、COM 和 TAB 组肿瘤组织匀浆中 TNF-α 的含量分别为(933.9 ± 286.8)、(636.1 ± 157.4)、(684.9 ± 170.1)、(364.7 ± 50.1)和(606.8 ± 190.3)pg/mg 蛋白。
结论CAI 不仅能够直接影响肿瘤细胞的增殖和凋亡,还能通过调控肿瘤环境中的 TNF-α 抑制血管的生成,从而减缓肿瘤的生长,这可能是 CAI 发挥抗肿瘤作用一个新的机制。小剂量 DEX 与 CAI 联合用药对移植瘤生长的抑制作用明显增强,优化了 CAI 的抗肿瘤作用,可能成为一种新的联合用药方案。
Author Affiliation:Department of Pharmacology,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100005,China
www.cmbp.net.cn Chin Med Biotechnol,2011,6(2):101-105
