不同培养条件下对阿萨希毛孢子菌生物被膜影响的研究
2011-02-24任晓萍李海涛杨蓉娅
樊 昕,任晓萍,李海涛,杨蓉娅
(北京军区总医院·全军皮肤病诊治中心,北京 100125)
近年来,由生物被膜引起的微生物耐药明显增加,有学者认为大于80%的人类感染中有生物被膜的形成[1]。目前已经发现很多因素可以影响真菌生物被膜的形成,如物理性质:基质,碳源,唾液的存在,氧气的存在,表面限定,酸碱环境;环境因素:热,冷,紫外线;真菌的种类等[2]。本实验以不同培养条件下,如不同培养温度和培养基pH值观察其对T.asahii BF形成的影响,为临床研究真菌生物被膜提供理论依据。
1 材料与方法
1.1 材料 阿萨希毛孢子菌株1株,为本院皮肤科临床分离株(BZP07002),并经API20AUX生化鉴定及DNA序列分析验证(AS2.2174)[3];RPMI 1640培养基购自美国Sigma公司,XTT试剂购自美国AppliChem公司,PMS购自Sigma公司,倒置显微镜购自日本Olympus公司,全自动酶联免疫测定仪购自美国Bio-rad公司。
1.2 方法
1.2.1 生物被膜体外构建 将-80℃保存的阿萨希毛孢子菌菌种复苏,在沙氏培养基中转种培养2次,转入酵母蛋白胨葡萄糖肉汤(YPD)中过夜振荡培养,离心、收集后,重悬于 RPMI-1640中,稀释成106CFU/ml菌悬液。在培养板中预先放入无菌的聚苯乙烯(长宽各为1.0 cm)。将2m l该菌悬液加入到24孔培养板中,选择30℃培养 48-72 h。2 h时PBS缓冲液冲洗2次,重新加入2.0m lRPMI-1640培养液。之后每隔24 h更换一次培养液。设不加有阿萨希毛孢子菌的空白对照组。
1.2.2 生物被膜形成的定量分析 通过XTT还原比色测定法进行定量分析。测定依据通过代谢活性细胞使黄色的四唑盐XTT分裂成橘黄色的甲染料。RPM I1640培养液中加入XTT和电子耦合剂PMS使终浓度为12.5μmol/L。在预先洗涤培养的生物膜孔和空白对照孔中放入1.5 ml的XTT-PMS溶液,30℃避光培养2 h。离心上清液平分在96孔板中,微量滴定板492 nm下读数。同时将含有生物被膜的聚苯乙烯材料放入YPD液体培养基中,30℃培养48 h,通过细胞计数板计数评估总的活菌数。
1.2.3 倒置显微镜观察 将已构建生物被膜的聚苯乙烯用灭菌的PBS缓冲液冲洗2次,放置在载玻片上倒置显微镜下观察。
1.2.4 不同pH值培养基和吸光度检测 取菌悬液50μl加入含有不同pH培养基150μl/孔的96孔板,分3组不同pH:pH=5.0,pH=5.0-7.0(前24 h培养基ph=7.0,后48 h培养基ph=5.0),pH=7.0培养;实验过程中每组做3个平行孔,重复3次实验,以不含菌悬液的孔作为基线对照;48-72 h取出相应的96孔板。吸出孔内菌悬液,PBS清洗孔3次去除浮游菌,微孔板在室温下干燥30min;加入1%Crystal Violet200μl/孔染色,放置20min后吸出染液,PBS清洗孔3次去除孔壁染液,微孔板在室温下干燥30min;加入95%乙醇200μl/孔微量振荡器上震荡30min复吸染液,复吸液放入一新的96孔微孔板中;全自动酶联免疫仪测定630 nm处的吸光(OD)值,并绘制曲线。
1.3 统计学方法
用SPSS13.0统计软件分析。采用单因素方差分析(F检验)和LSD-t检验进行多个样本均数的两两比较。取α=0.01为检验水准,P<0.01为差异有统计学意义。
2 结果
2.1 不同培养温度下生物被膜的形成
以T.asahii聚苯乙烯表面形成生物被膜48 h为评价标准观察其20℃,25℃,30℃,35℃和40℃不同温度下生物膜形成的差异性。其随着温度不断升高,其生物被膜形成速度加快,但是超过40℃时稳定性逐渐降低。见表1,图1。

表1 不同培养温度下阿萨希毛孢子菌生物被膜的定量XTT测定(±s±s)和活菌计数温度 20℃ 25℃ 30℃ 35℃ 40℃XTT值 0.131±0.012 0.984±0.045 1.312±0.101 1.105±0.101 0.793±0.019活菌数 1.73×106 7.86×106 10.23×106 8.92×106 6.16×106

图1 不同培养温度下阿萨希毛孢子菌生物被膜的定量XTT测定和活菌计数
2.2 不同pH培养基下生物被膜的形成
用全自动酶联免疫测定仪630 nm可见光测定阿萨希毛孢子菌生物被膜OD值时发现,在体外pH=5.0时和pH=9.0不能形成生物被膜;pH=7.0时生物被膜形成表现为缓慢的非线性生长,24-48 h生物被膜开始成熟,48 h-56 h间出现一相对的生长停滞期,此后OD值下降,生物被膜老化,pH=5.0对已经形成24 h的阿萨希毛孢子菌生物膜生长有明显的抑制作用,但经历12 h的酸休克后生物被膜 均能恢复生长。见表2,图2,3。

表2 不同pH培养条件下阿萨希毛孢子菌生物膜的定量XTT测定(±s±s)和活菌计数pH值 5.0 6.0 7.0 8.0 9.0 XTT值 0.053±0.005 0.559±0.037 1.439±0.123 0.417±0.037 0.033±0.002活菌数 0.73×106 5.89×106 11.48×106 3.98×106 0.51×106
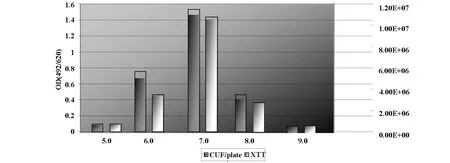
图2 不同pH培养条件下阿萨希毛孢子菌生物膜的定量XTT测定和活菌计数

图3 不同pH培养条件下阿萨希毛孢子菌生物膜形成情况
3 讨论
播散性毛孢子菌病呈世界性分布,是一种慢性、顽固、难治的系统性真菌病,其发病呈逐年上升的趋势[4],T.asahii是引起该病的重要致病菌。近年来各种医用材料(各种支架、导管、瓣膜、起搏器、人工关节等材料)的使用率很高,而微生物易于粘附于其表面且可形成生物被膜,导致耐药性增加而感染灶不易清除[5]。相对于其悬浮状态而言,被膜内菌细胞的形态常与浮游菌不同,且对药物的敏感性差[6]。我们发现真菌耐药现象越来越普遍,主要由于近年来抗真菌药物品种和临床使用量的增多,以及药物的选择性压力,特别是一些侵入性治疗如体外插管等操作致使耐药真菌数量及种类迅速增加,不仅影响药物的治疗效果,而且呈现出交叉耐药[7]。
既往我们的研究表明[8]:阿萨希毛孢子菌可以形成生物被膜,包括真菌表面粘附,微菌落形成,生物被膜成熟,生物被膜中阿萨希毛孢子菌的活性随培养时间延长而增加,当生长趋于成熟时,代谢的活性相对稳定,但仍保持在一个高水平。进一步研究我们发现[9]:成熟期T.asahii BF不同层面的活菌数和活性差别均无统计学意义,生物被膜中存在孔隙结构,活菌围绕在孔隙周围并被死菌包裹,使活菌一方面可直接从孔隙中获得营养,又可抵御环境中有害物质的破坏。但是不同的培养条件是否会影响生物被膜的形成,其主要变化趋势是什么,对于阿萨希毛孢子菌形成生物被膜的最佳培养条件是什么?
通过本研究发现:不同培养温度会明显影响生物被膜的形成。在聚苯乙烯表面形成生物膜48 h为评价标准观察其20℃,25℃,30℃,35℃和40℃不同温度下生物膜形成,其随着温度不断升高,其生物膜形成速度加快,但是超过40℃时稳定性逐渐降低,但是相对于浮游状态其对温度的耐受性更高。分析其生物膜形成主要是依靠真菌本身增殖情况和在合适的条件下才能聚集、黏附和逐渐形成生物膜,但是较低温度时真菌活性较低,增殖较慢无法形成生物被膜结构;但是在较高温度虽然真菌活性较高但是由于活菌量增多与死菌量增多不成比例导致菌体间黏附性明显改变,其表现为稳定性降低,其形成的生物被膜稳定性相应降低最终导致生物被膜活性降低等一系列变化[2]。我们认为30-35℃是 T.asahii BF形成的合适温度,这也是大部分真菌培养的合适温度。
本研究发现不同pH条件下生物被膜生长变化较大,在体外过酸pH=5.0或者过碱pH=9.0时不能形成生物被膜,分析其主要是有在这种条件下真菌活性明显受到影响,活力下降甚至死亡而不能生成生物被膜。我们的研究结果表明pH=7.0条件下生物被膜形成表现为缓慢的非线性生长,6 h生物被膜已经形成,12-24 h生物被膜成熟,24-36 h出现一相对的生长停滞期,此后由于生物被膜中死菌比例增加,易于脱落的死菌在检测前被洗涤弃去,提示生物被膜处于老化阶段。pH=5.0时菌株不能形成生物被膜,但已经成膜12h的生物膜却可耐受pH=5.0酸的影响,虽然酸对生物被膜生长有明显的抑制作用,但是经历12 h的酸休克后菌株的生物被膜均能在低pH条件下(pH=5.0)恢复生长。该现象证实生物被膜状态的阿萨希毛孢子菌具有更强的抗酸能力,能在较低pH条件下代谢生存,这可能与生物被膜特有的结构有关:生物被膜是由胞外基质包裹的相互黏附的真菌性群体组成的三维结构,该结构是生物膜真菌的保护装置,可有效抵御酸性的渗透[10]。在这种状态下,酸只能对表层真菌有影响,而无法对深层真菌发挥作用。其次生物膜中营养成分的浓度由外向内呈现梯度下降,致使深层真菌长期处于营养缺失状态而生长缓慢。生物膜深层真菌所处的这种缓慢生长状态,也称为饥饿状态,处于该状态的真菌对酸性的敏感性降低,这可能是生物被膜耐酸的另外一个原因。
总之,通过本研究发现30-35℃,培养基pH=7.0时 T.asahii BF的形成能力最强,但是其温度的影响机制特别是在酸性环境中能够恢复一定程度生长的具体调控机制尚待进一步深入研究,这也是我们今后研究的方向和主要内容。
[1]Romero R,Schaudinn C,Kusanovic JP,et al.Detection of a microbial biofilm in intraamniotic infection[J].Am JObstet Gynecol,2008,198(1):135.
[2]Luis R,Martinez,Casadevall A.Cryptococcus neoform ans biofilm formation dependson surface support and carbon sourceand reduces fungal cell suscep tibility to heat,cold,and UV light[J].Appl Environ M icrobiol,2007,73(14):4592.
[3]MathurT,Sihghal S,Khan S,et al.Detection of biofilm formation among the clinical isolates of staphylococci:an evaluation of three different screening methods[J].Indian Journal ofMedicalM icrobiology.2006,24(1):25.
[4]Tokimatsu I,Karashima R,Yamagata E,et al.Pathogenesis of Trichosporon asahii and strategies for infectious control of dissem inated trichosporonosis[J].Nippon Ishinkin Gakkai Zasshi,2003,44(3):181.
[5]MathurT,Sihghal S,Khan S,et al.Detection of biofilm formation among the clinical isolates of staphylococci:an evaluation of three different screeningmethods[J].Indian JMed Microbiol,2006,24(1):25.
[6]Mukherjee PK,Mohamed S,Chandra J,et al.Alcohol dehydrogenase restricts the ability of the pathogen Candida albicans to form a biofilm on catheter surfaces through an ethanol-based mechanism[J].Infect Immun,2006,74(5):3804.
[7]樊 昕,任晓萍,杜丽颖,等.重症监护室体外插管假丝酵母菌属鉴定及耐药性分析[J].中国感染控制杂志,2010,9(6):396.
[8]任晓萍,杨蓉娅,樊 昕,等.几种不同基质对阿萨希毛孢子菌形成生物膜影响的初步观察[J].中国真菌学杂志,2010,5(4):201.
[9]任晓萍,樊 昕,杨蓉娅,等.阿萨希毛孢子菌生物膜形成研究[J].中华皮肤科杂志,2010,43(8):16.
[10]Blankenship JR,M itchell AP.How to build a biofilm:a fungal perspective[J].Curr Opin Microbiol,2006,9(6):588.
