CNQX对截断尾末端后小鼠痛反应变化的影响
2011-02-03商丽宏代秋竹陈魁敏杨宇吴敏范
商丽宏,代秋竹,陈魁敏,杨宇,吴敏范
(沈阳医学院1.机能实验中心;2.生理学教研室,沈阳 110034)
CNQX对截断尾末端后小鼠痛反应变化的影响
商丽宏1,代秋竹2,陈魁敏1,杨宇2,吴敏范2
(沈阳医学院1.机能实验中心;2.生理学教研室,沈阳 110034)
目的研究谷氨酸受体拮抗剂6-氰基-7-硝基喹喔啉-2,3-二酮(CNQX)对截断尾末端后小鼠痛反应变化的影响,为深入研究截肢后中枢的可塑性变化及幻肢痛产生机制提供理论依据。方法 采用热板法分别于截断小鼠尾末端2.5cm前及截断后0.5h、1h、2h、3h、24h、168h(1周)测量断尾小鼠的痛阈,并观察尾静脉注射CNQX对断尾后小鼠痛阈变化的影响。结果与对照组及断尾前比较,小鼠断尾后0.5h、1h,痛阈无明显变化;小鼠断尾后2h,痛阈显著升高(P<0.01);断尾后3h,升高的痛阈开始恢复(P<0.05);断尾后24h、168h,小鼠痛阈基本恢复正常。CNQX拮抗了断尾诱发小鼠痛阈升高的反应。结论断尾后2~3h,小鼠后肢皮肤对温热性伤害刺激产生痛反应的阈值提高;谷氨酸AMPA/Kainate受体参与该痛阈提高的过程。
截肢;疼痛;AMPA/Kainate受体;小鼠
幻肢痛(phantom limb pain,PLP)是截肢后的常见并发症之一,50%以上的截肢患者术后伴有PLP[1]。PLP是指截肢者主观感觉已被切除的肢体仍然存在,并有不同性质、不同程度疼痛的现象[2]。研究表明,伤害性传入信息能够诱发中枢兴奋性氨基酸,特别是谷氨酸释放增多,并使其受体异常激活[3]。目前,尚缺少有关截肢后不同时间机体痛反应变化及其机制的系统研究。Susan等[4]报道,小鼠的断尾模型可用于研究截肢后中枢长期性可塑性变化。因此,本研究采用热板法观测了截断尾末端小鼠对疼痛反应的变化,并探讨了谷氨酸受体拮抗剂6-氰基-7-硝基喹喔啉-2,3-二酮(6-cyano-7-nitroquinoxaline-2,3-diketone,CNQX) 对这些变化的影响,以期为深入研究截肢后中枢的可塑性变化及PLP产生机制提供理论依据。
1 材料与方法
1.1 实验动物及断尾手术方法
昆明种雌性小鼠,体质量(23±3)g。由沈阳医学院实验动物中心提供。小鼠自由进食水,维持室温在(15±3)℃。用热板法测量小鼠的痛反应潜伏期,选痛反应潜伏期<30s的小鼠为实验动物。实施断尾手术时,用手术剪刀截断小鼠尾末端2.5cm,用消毒棉包扎断尾止血。
1.2 热板法测定断尾后不同时间小鼠的痛阈
用热板法测量小鼠的痛反应潜伏期,以小鼠出现舔后足的时间为准,作为痛阈观察指标。热板温度(55±1)℃。将90只断尾小鼠随机分成6组,分别于截断小鼠尾末端前及截断后0.5h、1h、2h、3h、24h、168h(1周)测定断尾小鼠的痛阈。如痛反应潜伏期超过60s,则以60s计算,并结束实验。同时分别设空白对照组检测小鼠痛阈。
1.3 热板法测定尾静脉注射CNQX后断尾小鼠的痛阈
将48只小鼠随机分为空白对照组、小鼠尾末端截断2h实验组、小鼠尾末端截断+尾静脉注射生理盐水组及小鼠尾末端截断+尾静脉注射CNQX组,每组各12只。生理盐水或CNQX的注射时间是在小鼠尾末端截断后100~105min,注射剂量为1mg/kg。用热板法分别测定上述各组小鼠的痛阈。
1.4 统计学分析
2 结果
2.1 尾末端截断后不同时间小鼠痛阈的变化
与对照组及断尾前相比,小鼠在断尾后2h及3h时痛阈提高最显著(P<0.01,P<0.05),即尾末端截断后,小鼠后肢皮肤对温热性伤害刺激产生痛反应的潜伏期延长;断尾3h后至断尾168h,痛阈逐渐恢复到正常水平。见表1。

表1尾末端截断后不同时间小鼠痛反应潜伏期的变化(±s)T a b.1C h a n g e o f l a t e n c y o f mi c e p a i n r e s p o n s e t o n o c i c e p t i v e h o t p l a t e i n v a r i o u s p e r i o d a f t e r t a i l a mp u t a t i o n(±s)Latency of pain response to nociceptive hot plate(s)Control(n=15) Pre-amputation(n=15) Amputation 0.5 17.64±4.97 17.22±5.46 17.80±5.29(n=14)120.75±5.98 20.40±5.46 21.45±7.24(n=13)218.24±5.06 18.40±5.42 23.78±3.57(n=15)2)317.31±6.72 17.13±6.62 22.42±6.71(n=15)1)24 17.14±5.01 15.41±4.59 19.56±7.34(n=14)168 18.44±5.48 17.81±6.02 17.69±5.64(n=14)1)P<0.05,2)P<0.01vs control and pre-amputation.Period after amputation(h)
2.2 静脉注射CNQX对尾末端截断后2h小鼠痛阈变化的影响
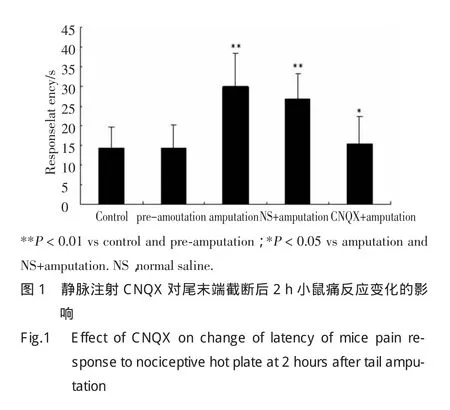
如图1所示,尾末端截断后2h小鼠后肢皮肤对温热性伤害刺激产生反应的痛阈[(29.88±8.52)s],较对照组[(14.23±5.38)s]及断尾前[(14.00±5.59)s]明显升高(P<0.01);且显著高于小鼠尾末端截断+尾静脉注射 CNQX 组痛阈[(15.71±5.15)s](P<0.05);而与小鼠尾末端截断+尾静脉注射生理盐水组[(26.80±6.50)s]相比,则未见统计学差异。提示静脉注射CNQX拮抗了该小鼠痛阈的提高(P<0.05)。
3 讨论
Susan等[4]报道,手术截断尾末端5周后,小鼠的后肢和残留的尾端出现痛敏反应;而应用低剂量吗啡可诱发截断尾末端5周后小鼠产生热板的易化反应;这些可塑性变化可以延长至5周。因此,可用小鼠的截尾模型研究截肢后中枢性长期性的可塑性变化。我们的前期研究发现,手术截断尾末端2周后的小鼠痛觉敏感性存在明显的升高趋势[5]。目前,尚缺少有关截肢后不同时间机体痛反应变化及其机制的系统研究。本研究结果显示,与断尾前及对照组比较,断尾后2h小鼠痛阈显著升高(P<0.01);断尾后3h小鼠痛阈升高(P<0.05),但较2h时有所恢复。提示截断尾末端对小鼠的痛阈有明显的影响。断尾后2~3h小鼠正常的后肢皮肤受到温热性伤害刺激后不易产生痛反应,这可能是由于断尾这个强烈的伤害性刺激引起痛觉中枢神经元反应过强,导致其兴奋性短时间内降低造成的。该现象产生的机制及其与PLP的关系有待于今后深入研究。
研究表明,谷氨酸在伤害性信息的传递中起重要作用[6]。本研究结果显示,静脉注射谷氨酸受体拮抗剂CNQX拮抗了断尾后2h小鼠出现的痛阈提高的反应。提示α-氨基3-羟基5-甲基4-异恶唑丙酸/海人藻氨酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid/Kainate,AMPA/Kainate)受体参与了断尾诱发小鼠痛阈提高的过程。文献报道,CNQX不易通过血脑屏障[7],因此,我们认为CNQX可能是通过作用外周AMPA/Kainate受体而产生作用的。本研究结果表明,AMPA/Kainate受体在疼痛的调控中有重要的作用,可以作为镇痛药物作用的候选靶分子之一,为临床防治截肢后中枢的可塑性变化及PLP提供了理论依据。
[1]Ketz AK.The experience of phantom limb pain in patients with combat-related traumatic amputations [J].Arch Phys Med Rehabil,2008,89(6):1127-1132.
[2]Schley MT,Wilms P,Toepfner S,et al.Painful and nonpainful phantom and stump sensations in acute traumatic amputees [J].J Trauma,2008,65(4):858-864.
[3]郭新华,刘凌云,李清君.不同类型的谷氨酸受体在脊髓痛觉过敏产生中的作用及其信号转导机制[J].河北医科大学学报,2005,26(3):218-220.
[4]Susan JK,Zhuo M.Biphasic modulation of behavioral nociceptive responses by Morphine in adult mice after amputation[J].Acta Physiologica Sinica,2004,56(4):436-443.
[5]杨宇,郭轶男,商丽宏,等.手术截断尾末端对小鼠疼痛反应昼夜节律的影响[J].中国医科大学学报,2010,39(2):155-156.
[6]Zhou HY,Zhang HM,Chen SR,et al.Increased nociceptive input rapidly modulates spinal GABAergic transmission through endogenously released glutamate [J].J Neurophysiol,2007,97(1):871-882.
[7]Yoshiyama M,Roppolo JR,de Groat WC.Effects of GYKI 52466and CNQX,AMPA/kainate receptor antagonists,on the micturition reflex in the rat[J].Brain Res,1995,691(1-2):185-194.
(编辑王又冬,英文编辑郑华川)
Effect of CNQX on the Change of Pain Response after the Tail Extremity Amputation in Mice
SHANG Li-hong1,DAI Qiu-zhu2,CHEN Kui-min1,YANG Yu2,WU Min-fan2
(1.Center of Functional Experiment;2.Department of Physiology,Shenyang Medical College,Shenyang 110034,China)
ObjectiveTo investigate the effect of glutamic acid receptor antagonist CNQX on the change of pain responses of mice after amputation of extremity of the tail.MethodsThe distal 2.5cm length of the mouse tail was removed as an experiment model of amputation.Hot plate experiment was used at 0.5h,1h,2h,3h,24h,168h after the amputation,respectively.The latencies of the mice′s licking their hindpaws on the hot plate(55±1℃)were recorded and used as an index of pain threshold by hot plate method.Mice were removed from the chamber if they did not respond within 60s,and the response latency was recorded as 60s.The change of pain response was observed after CNQX was injected by the caudalis vein.ResultsThere was no significant change in pain threshold between control or preamputating and amputating groups at 0.5h or 1h after the amputation (P>0.05).Pain threshold of 2h or 3h groups after the amputation was significantly higher than that of their control groups or before the amputation (P<0.01).There was no significant change in pain threshold between 24h or 168h groups after the amputation,compared with that of their control groups or before the amputation(P>0.05).The intravenous injection of glutamic acid receptor antagonist CNQX antagonized the increase in mice′s pain threshold at 2h after the amputation.ConclusionThreshold of pain responses of the mice to the hot plate is significantly increased at 2to 3h after the amputation of extremity of the tail in mice.The AMPA/Kainate receptor is involved in the increase in pain threshold induced by the amputation.
amputation;pain;AMPA/Kainate receptor;mice
R338.3;Q432
A
0258-4646(2011)01-0048-03
商丽宏(1963-),女,高级实验师,本科.
吴敏范,E-mail:minfanwu0594@sina.com.cn
2010-08-22
