复合菌系RSS-4腐解稻秆过程中的菌系动态变化
2011-01-12沈德龙刘甲锋李力陈慧君关大伟姜昕李俊
沈德龙,刘甲锋,李力,陈慧君,关大伟,姜昕,李俊
(中国农业科学院农业资源与农业区划研究所,北京100081)
秸秆腐熟菌剂是有机物料腐熟剂中的一个重要品种,它指采用现代化学和生物技术,经过特殊的生产工艺生产的、能够加速农作物秸秆腐熟、分解的活体微生物制剂。近年的研究和实践证明,应用具有快速降解秸秆物料的腐解菌剂,是解决秸秆还田问题的关键。目前,研制开发理想的作物秸秆快速腐熟剂已成为微生物制剂研发的一个热点。同时发现,研究腐解过程中微生物区系的演替对于深入了解腐解的机理、优化复合菌系生产工艺具有重要意义。采用传统平板分离方法只能对复合菌系中的可培养微生物组成进行研究,而复合菌系中还含有不可培养的微生物,分子生物学技术的出现使之研究变为可能,PCR-DGGE适于准确分析腐解过程中微生物区系的动态变化[1-2]。1993年,在Muyzer等[3]首次将该技术应用于微生物生态的研究后,其迅速被应用于环境微生态方面的研究。徐大勇等[4]采用传统培养方法和PCR-DGGE技术研究了人工接种堆肥和自然堆肥微生物群落的演变过程;李国媛等[5]采用分子生物学方法和传统平板分离方法对秸秆腐熟菌剂细菌菌群及在腐熟过程中的变化进行分析;而王小芬等[6]也以苜蓿为原材料,研究了乳酸菌复合系A12在苜蓿青贮过程中微生物区系动态变化。本课题组曾分离筛选了具有降解水稻秸秆能力的复合菌系RSS-4[7],并对其在传代过程中的腐解特性进行了研究[8]。本文采用平板计数法和PCR-DGGE技术对腐解过程中微生物区系的演变进行了研究,旨在明确稻秆腐解过程中微生物菌群的组成与变化,为秸秆腐解菌剂的菌系筛选优化与菌剂生产及应用提供分子微生态学依据。
1 材料与方法
1.1 材料
1.1.1 菌种为本实验室自行筛选构建的稻秆腐解复合菌系RSS-4。
1.1.2 培养条件固体发酵培养基:稻秆粉(粉碎后过60目筛)75 g,麸皮(粉碎后过60目筛)30 g,营养盐溶液100 mL,水50 mL,搅拌均匀,自然pH,不对其进行灭菌,接菌后22℃静置培养。
1.1.3 腐解过程中微生物数量的变化菌落平板计数按照中华人民共和国国家标准GB20287-2006的规定执行。
1.2 方法
1.2.1 腐解过程中细菌的DGGE分析①基因组DNA的提取:在腐解过程的第2、4、6、8、10、12、14、16、18天分别取样,采用Bead-beater法提取基因组DNA,其操作步骤见文献[9];②细菌基因组16S rDNA V3可变区的扩增:16S rDNA V3区PCR扩增见文献[10]。扩增引物分别为P2:5'-attaccgcggctgctgg-3';P3:5'-cgcccgccgcgcgcggcgggcggggcgggggcacggggggcctacgggaggcagcag-3'。25 mL的PCR扩增体系:10×buffer(不含Mg2+)2.5 μL,dNTP(2.5 mmol/L)2 μL,氯化镁(25 mmol/L)2 μL,引物(10 pmol/μL)1 μL,Taq酶(2.5 U/μL)0.15 μL,稀释模板1 μL,dd H2O补足至25 μL。PCR反应条件:94℃,4 min;94℃,1 min;65→56℃,1 min;72℃,1 min(每个温度2个循环);94℃,1 min;55℃,1 min;72℃,1 min(10个循环);72℃,6 min。扩增产物以1%琼脂糖凝胶电泳检测;③Reconditioning PCR及产物纯化:取16S rDNA V3区PCR扩增产物的十分之一作模版,以与16S rDNA V3区PCR扩增相同的反应体系和条件,再次进行PCR扩增,但是把循环数减少到3;④16S rDNA V3可变区的多态性DGGE分析:制作变性剂尿素和甲酰胺梯度胶,用梯度生成仪灌胶。胶板大小为16 cm×16 cm,聚丙烯酰胺的浓度为8%,变性剂的浓度范围为30%~60%(100%变性剂浓度为7 mol/L尿素,40%甲酰胺)。样品上样量为30 μL,电压75 V,电泳16 h后,EB染色20 min,用GEL DOC EQ凝胶成像系统成像。对于典型的条带,从胶中切出,再经PCR扩增后供碱基序列测定。
1.2.2 腐解过程中真菌的DGGE分析①18S rDNA区PCR扩增:基因组DNA的提取见1.2.1①。18S rDNA区PCR扩增见文献[11]。扩增引物分别为R1616:5'-gcggtgtgtacaaagggcaggg-3';F1427:GC5'-cgcccgccgcgccccgcgcccggccgccgcccccgcccct-ctgtgatgcccttagatgttctggg-3'。25 μL的PCR扩增体系见1.2.1②。PCR反应条件:94℃,5 min;94℃,0.5 min;52℃,1 min;68℃,1.5 min,25个循环;68℃,10 min。扩增产物以1%琼脂糖凝胶电泳检测;②18S rDNA区的多态性DGGE分析:具体的操作步骤见1.2.1④。
2 结果与分析
2.1 腐解过程中微生物数量的动态变化
用平板计数法测定复合菌系RSS-4在对稻秆分解过程中细菌和真菌的数量动态变化,结果见图1和图2。由图1可知,在腐解的0~4 d内细菌借助易分解利用的可溶性糖和淀粉等物质急剧增加,细菌数量最高达到10.0×1011cfu/g,此后随着易利用物质的减少,细菌的数量发生区系更替,真正起腐解作用的细菌开始起作用,其整体数量虽然有所下降,但基本保持在4.0×1011cfu/g以上,这一阶段正是木质纤维素被快速腐解的时期。8 d后随着底物的利用越来越难加之产物反馈抑制,细菌的数量略有下降,但基本稳定在2.0×1011cfu/g以上。
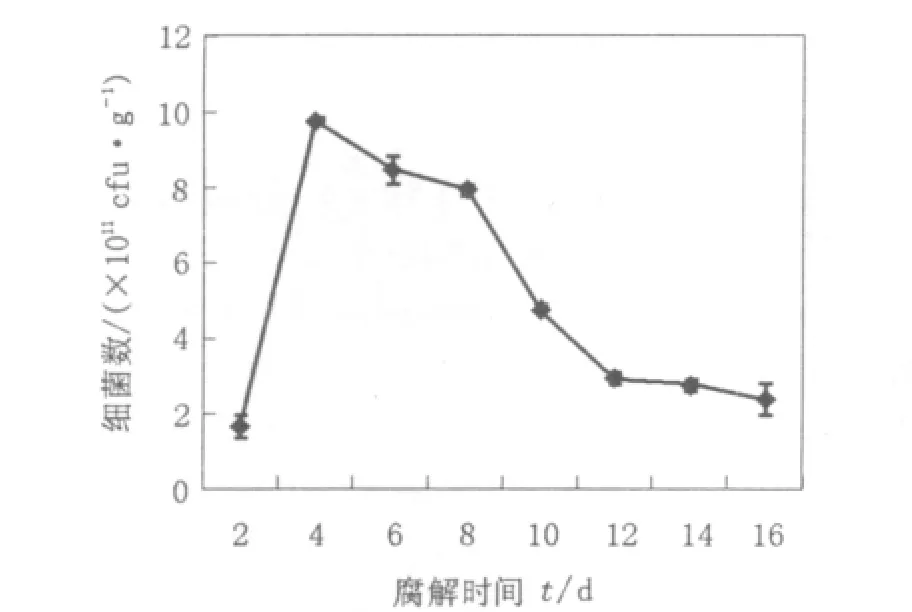
图1 稻秆腐解过程中细菌生长曲线Fig.1 Growth curve of bacteria during the straw's decomposition
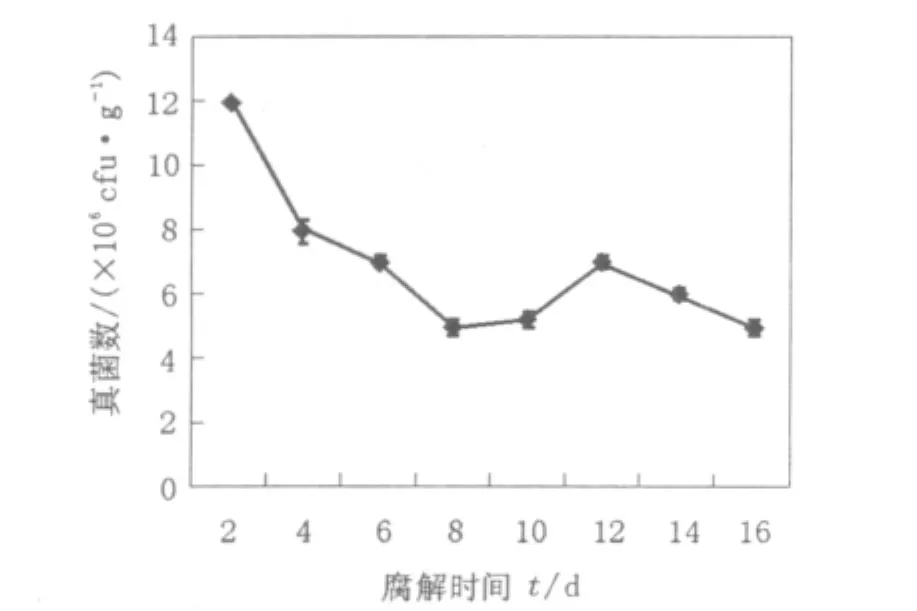
图2 稻秆腐解过程中真菌生长曲线Fig.2 Growth curve of fungi during the straw's decomposition
由图2可知,在腐解过程中真菌的含量与细菌相比要少得多,其生长曲线也与细菌有所不同,在腐解初期即呈下降趋势,它在腐解的8~10 d内含量最低,在腐解的第12天有小幅上升,然后趋于稳定。由图2可见,在整个腐解过程中真菌的数量变化不是很剧烈,这说明真菌可能在腐解全程都在发挥作用。
2.2 腐解过程中细菌的DGGE分析结果
2.2.1 样品总DNA提取结果本实验采用珠式细胞破碎器(Bead-beader)的方法提取复合菌系RSS-4基因组DNA。采用该法提取的基因组DNA片段主要集中在3.0~10.0 kb之间,虽然有少量的弥散带存在,但是最长DNA可达10.0 kb以上,能够满足实验需要;且由于此方法主要依靠物理方法破壁,受微生物种类差异的影响较小,故样品中DNA的提取较为全面。此方法简洁高效,适用于大批量DNA的提取。
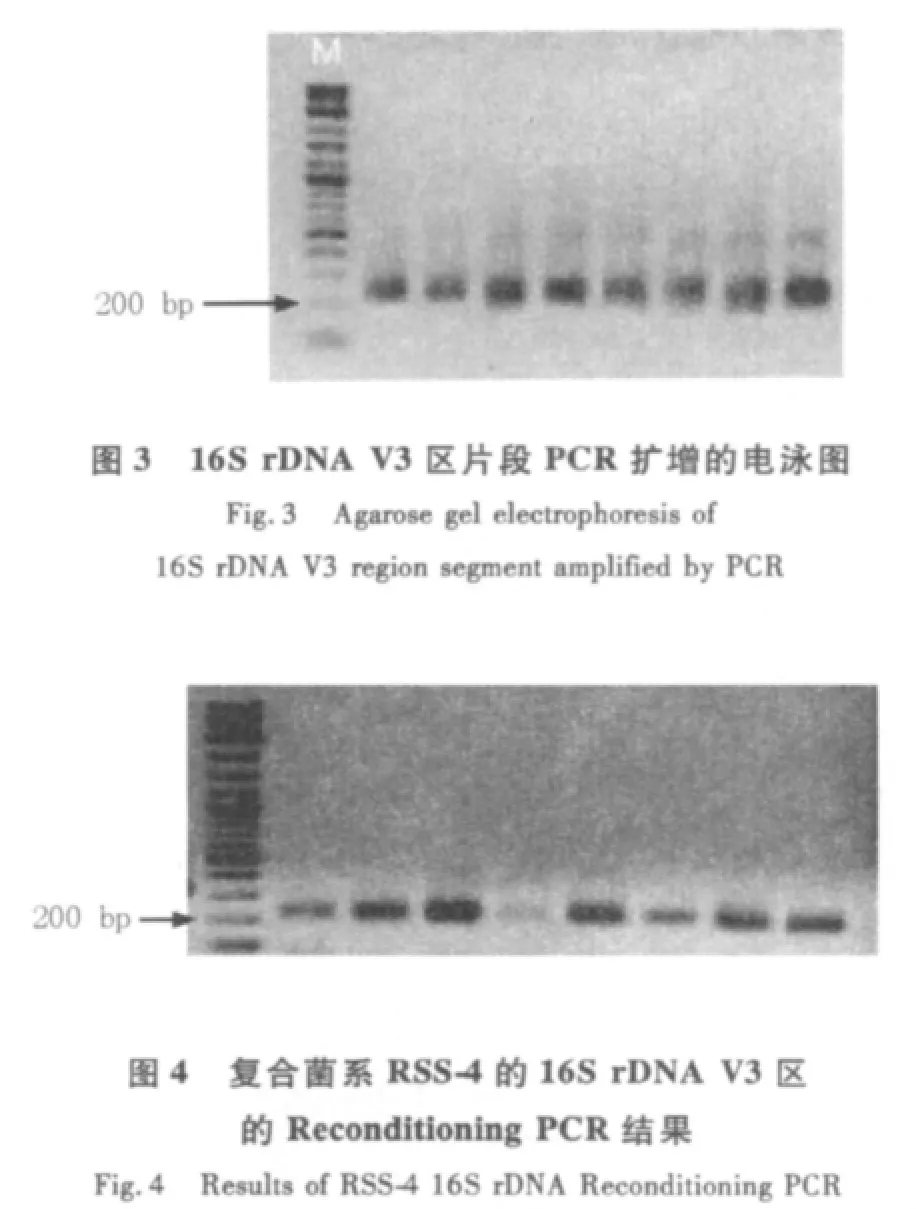
2.2.2 PCR扩增结果将样品的DNA进行COMMUNITY PCR扩增,得到了与预期大小相符的扩增片断,片段大小约为250 bp,琼脂糖电泳检测结果见图3。Reconditioning PCR结果见图4。
2.2.3 16SrDNA-DGGE结果复合菌系在腐解不同时期的16S rDNA V3区-DGGE见图5。由图5可知,在稻秆腐解过程中,不同腐解时期细菌的组成呈现出多样性,变化差异也较为明显。条带1、4、7、8、9和10在整个腐解过程内一直存在,为优势菌,而其中又以1、9和10条带更亮,说明其含量应该更高,为主要优势菌种;条带3在腐解初期没有出现,到第4天开始出现并一直维持到腐解结束;类似的还有条带11和13;而条带12只在腐解的初期出现,之后迅速消失;条带6除在第6~8天不明显外,其余时期均存在;而条带2却是交叉出现的,其含量变化不定。将以上条带割胶回收,克隆并测序,在GeneBank中比对后得出结果见表1。比对结果显示最高同源性的菌株大部分为不可培养的细菌。
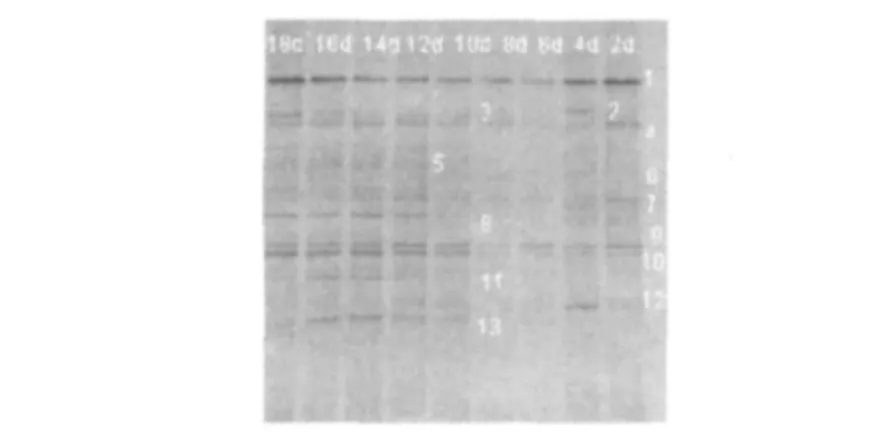
图5 复合菌系RSS-4在不同腐解时期的16S rDNA PCR-DGGE图Fig.5 16SrDNA PCR-DGGE profile of fungus components of CMS during the straw's decomposition
表1 复合菌系的细菌变性梯度胶电泳图中各条带的近缘菌株Table 1 Identities of DGGE bands of microbial community
其中,纯培养所得的Pseudomonas sp.对应DGGE图谱中的条带1;其中优势菌株条带1(Pseudomonas stutzeri)、条带8(Bacillus sp.)和非优势菌株条带5(Alcaligenes sp.)均已证实具有降解秸秆的功能。如余金勇等[12]通过刚果红法初步证明从白蚁肠分离的菌株(Bacillus sp.)能产生纤维素酶,表明其具有分解纤维素的能力。
2.3 腐解过程中真菌的DGGE分析结果
2.3.1 PCR扩增结果将样品的DNA进行COMMUNITY PCR扩增,得到了与预期大小相符的扩增片断,片段的大小约为260 bp,琼脂糖电泳检测结果见图6。
图6 18SrDNA区片段PCR扩增的电泳图Fig.6 Agarose gel electrophoresis of 18S rDNA region segment amplified by PCR
2.3.218 S rDNA-DGGE DGGE结果复合菌系在腐解不同时期的18S rDNA DGGE见图7。
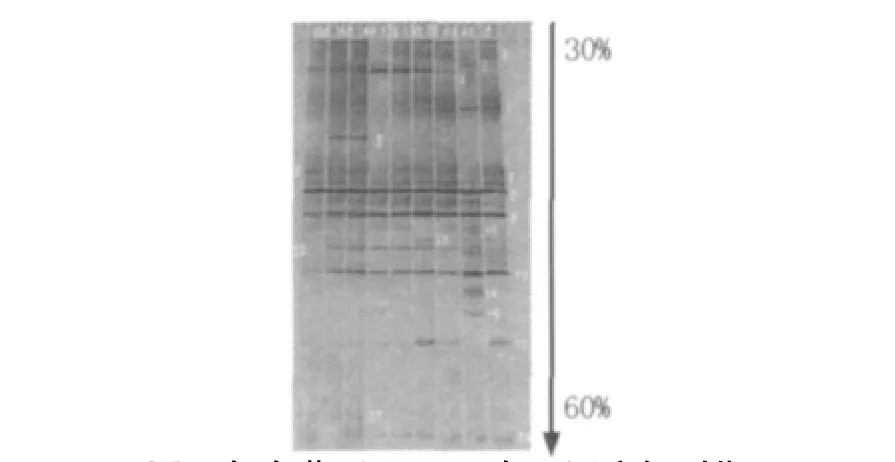
图7 复合菌系RSS-4在不同腐解时期的18S rDNA PCR-DGGE图Fig.718 S rDNA-DGGE profile of fungus components of CMS during the straw's decomposition
由图7可知,复合菌系在腐解不同时期的18S rDNA DGGE如图中3~9所示,在稻秆腐解过程中,不同腐解时期真菌的组成呈现出多样性,变化差异较为明显。其中,条带6、7、8、9、12、13、16和18在整个腐解过程内一直存在,为优势菌,而其中又以8、9和13条带更亮,说明其含量应该更高,为主要的优势菌种;条带10和11在腐解的初期没有出现,到第4天开始出现并一直维持到腐解结束;条带3直到第6天才开始出现,但是直到腐解结束一直存在;类似的还有条带17,它仅在腐解的第14天才开始出现;条带16除了第4天不明显外,其余时间均出现;而条带1、2、4、5、14和15均在腐解的不同时期偶尔出现一段时间后迅速消失。将以上条带割胶回收,克隆并测序,在GeneBank中比对后得出结果见表2。

表2 复合菌系的真菌变性梯度胶电泳图中各条带的近缘菌株Table 2 Identities of DGGE bands of microbial community
由表2可知,复合菌系RSS-4中的克隆子与GenBank数据库中已知真菌的18S rDNA序列相似性最高的为100%,最低的为96%;其中可培养的真菌条带数共有11个,占库容总量的61.1%。这表明文库中大部分真菌为可培养真菌。其中,纯培养所得的Graphium penicillioides、Mucor circinelloides分别对应DGGE图谱条带中的13和10。根据已有报道,主要条带中有纤维素分解功能的菌株有条带10(Mucor circinelloides)和木质素分解功能的条带13(Graphium penicillioides),如王岚等[13]通过实验发现拟青霉所产的木聚糖酶和木糖苷酶协同作用可将桦木木聚糖完全降解成木糖;而有些至今还未发现其具有腐解秸秆的能力,但是它们的存在很可能会帮助消除腐解产物,起到协同作用,从而共同促进了稻秆的腐解。
3 结论
本研究采用传统培养方法和PCR-DGGE技术研究了水稻秸秆腐解复合菌系RSS-4在腐解过程中菌种区系变化情况。
传统培养方法显示,在稻秆腐解过程中,微生物的数量均呈现出先升后降的变化趋势,在整个腐解过程中细菌的数量占优势,真菌的数量动态变化不明显。其中,细菌数量在腐解第4天高达10.0×1011cfu/g,在稻秆腐解第8天依然保持在4.0×1011cfu/g以上,这一阶段正是木质纤维素被快速腐解的时期,说明在稻秆腐解前期中细菌可能起主要作用。
16S rDNA-DGGE结合克隆测序共得到12个测序结果。在稻秆腐解过程中,不同腐解时期细菌的组成也呈现出多样性,变化也较为明显。其中,Pseudomonas stutzeri(X98607.1)、Uncultured bacterium clone R2J3M4_C5(GQ467097.1)、Rhodanobacter sp.LAA-2009-i12(FN298498.1)、Uncultured planctomycete clone Jx19-28(GQ443676.1)、Bacillus sp.IWF41(GU120654.1)、Uncultured bacterium clone A-6(EF579784.1)和Uncultured bacterium clone areia_48(GQ996480.1)为优势菌株,它们贯穿于稻秆腐解的整个过程;Pseudotrichomonas sp.2003-5005(DQ412644.1)在腐解的前期起作用,而后迅速消失;Alcaligenes sp.(FJ531636.1)和Klebsiella pneumoniae(EU078621.1)在腐解的后期才出现而起作用,而Uncultured bacterium clone C_M_03_11(FJ470745.1)则是交叉出现的。
复合菌系RSS-4的18S rDNA-DGGE结合克隆测序的结果显示,最少有18种真菌参与到稻秆的腐解。在稻秆腐解过程中,不同腐解时期真菌的组成呈现出多样性,变化差异也较为明显。其中,Telotrochidium matiense strain CCAP 1655/2(AY611065.1)、Uncultured eukaryote clone EC72(AY817011.2)、Uncultured eukaryote clone EUKDPK69(DQ104585.1)、Telotrochidiummatiense(EF417835.2)、Petalomonas cantuscygni CCAP 1259/1(AF386635.1)、Graphiumpenicillioides strain HSAUP042563(FJ914664.1)、Bodo sp.coconut/BRA/1988(FJ839605.1)和18 Ochromonadaceae environmental sample clone Elev_18S_1192(EF024705.1)为优势菌株;而Uncultured eukaryote clone EC37(AY817000.2)、Uncultured eukaryote clone DLN-J-70(FJ848498.1)、Leukarachnion sp.ATCC PRA-24(FJ356265.2)、Honigbergiella ruminantium strain KOJ14(AY319280.1)和Geomyces destructans isolate 20674-10(FJ231102.1)在腐解的前期起作用,而后迅速消失;Uncultured fungus(AB262844.1)、Uncultured fungus clone T3_II_2a_21(EF628587.1)、Mucor circinelloides(AM745433.1)、Unculturedeukaryoteclone D2P04B10(EF100248.1)和Spumella sp.Mbc_3C(AB425951.1)在腐解的后期才出现而起作用。
以上结果表明采用传统培养方法和PCRDGGE技术可以较好地对水稻秸秆腐解复合菌系RSS-4在腐解过程中菌种区系变化情况进行分析。研究发现有多株细菌和多株真菌存在于稻秆腐解过程中,且区系变化较为明显。腐解过程中不同时期由不同优势菌株扮演重要角色共同促进了稻秆的腐解,所有这些结果为秸秆腐解菌剂工艺的生产和应用提供分子生态学依据。
[1] 翟振华,李艳双.变性梯度凝胶电泳技术在微生物分子生态学研究中的应用[J].生物技术通报—技术与方法,2009(5):55-58.
[2] Fishcer SG,Lerman LS.DNA fragments differing by single base-pair substitutions are separated in denaturing gradient gels:Correspondence with melting theory[J].Proc.Natl.Acad.Sci,1983,80(6):1579-1583.
[3] Muyzer G,De Waal EC,Uitterlinden AG.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl.envir.Microbiol.,1993,59(3):695-700.
[4] 徐大勇,黄为一.人工接种堆肥和自然堆肥微生物区系与分子多态性的变化[J].生态与农村环境学报,2006,22(1):29-33.
[5] 李国媛,李俊,姜昕,等.应用16S rDNA克隆文库法分析有机物料腐熟菌剂细菌组成[J].微生物学通报,2007,34(5):939-942.
[6] 王小芬,高丽娟,杨洪岩,等.苜蓿青贮过程中乳酸菌复合系A12的接种效果及菌群的追踪[J].农业工程学报,2007,23(1):217-222.
[7] 刘甲锋,李力,陈慧君,等.水稻秸秆腐解复合菌系RSS-4的选育及其腐解特性[J].微生物学通报,2010,37(9):1293-1298.
[8] 刘甲锋,沈德龙,李力,等.复合菌系RSS-4传代对水稻秸秆腐解的影响[J].微生物学杂志,2010,30(4):30-35.
[9] 高平平,赵立平.可用于微生物群落分子生态学研究的活性污泥总DNA提取方法研究[J].生态学报,2002,22(11):2015-2019.
[10] 李力.转植酸酶基因胶冻样芽胞杆菌(Bacillus mucilaginosus)NK-2的环境安全性及应用效果研究[D].北京:中国农业科学院,2005.
[11] Cahyani VR,Matsuya K,Asakawa S,et al.Succession and phylogenetic profile of eukaryotic communities in the composting process of rice straw estimated by PCR-DGGE analysis[J].Biol Fertil Soils,2004,40(5):334-344.
[12] 余金勇,吴跃开.两种产纤维素酶菌株分离的初步研究[J].贵州林业科技,2006,34(4):47-51.
[13] 王岚,江正强,杨绍青.嗜热拟青霉产胞外木糖苷酶发酵条件的优化[J].微生物学通报,2007,34(3):519-523.
