16个鱼腥草基因型遗传多样性的 SRAP分析
2010-12-05张丹丹曾维军
王 坤,钟 军,张丹丹,仇 萍,曾维军
(1湖南农业大学生物科学技术学院,长沙 410128;2湖南农业大学农学院,长沙 410128;3湖南正清制药集团股份有限公司,怀化 418000)
鱼腥草(Houttuynia cordata Thunb)是三白草科蕺菜属的宿根性多年生草本植物,在中国分布广泛,种质资源十分丰富。巨大的种质资源数量使得人们很难对其进行深入研究并加以有效利用,且不清楚其资源遗传多样性的程度又影响了种质资源的育种利用[1]。
相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)是一种新型的基于PCR的分子标记系统。其独特之处在于其引物设计上,上游引物和下游引物分别包含17和18个碱基,它们能优先对基因组DNA开放阅读框、内含子和启动子区域进行特异扩增,因不同基因型启动子、内含子和间隔序列长度不同而产生多态性[2],且该标记简单、高效、高共显性、易测序、扩增多态性高,所能提供的生物学信息更多,故而迅速在植物遗传多样性分析和比较基因组学研究等方面得到广泛应用[3]。目前,SRAP标记在农作物(棉花[4]、玉米[5]、油菜[6])及蔬菜作物 (豌豆[7]、南瓜[8]、马铃薯[9]、莲[10])上的应用报道较多;在果树柿属[11]植物、梨 属[12]、柑 橘[13]、核 桃[14]、石 榴[15]上 的 SRAPPCR的扩增体系也有报道。但是关于SRAP标记在中草药上的报道只有川党参[16]、玄参[17]、黄芪[18]等少数几种,而在鱼腥草上应用研究的报道至今未见。笔者以16份不同鱼腥草的资源为材料,在建立并优化其SRAP扩增反应的基础上,利用筛选的引物对材料进行了遗传多样性分析,以期为揭示鱼腥草资源间的系谱关系和遗传多态性提供新的依据。
1 材料和方法
1.1 材料
试验材料于2009年8月取自湖南正清制药集团股份有限公司怀化鱼腥草种质资源圃(表1)。
1.2 仪器与试剂
UV-55紫外分光光度计(Bio-RAD),Gel Doc2000凝胶成像系统(Bio-RAD),Eppendorf Mastercycle gradient梯度 PCR仪 (Eppendorf),DYCZ-24B型电泳槽(北京市六一仪器厂),DYY-6C型电泳仪(北京市六一仪器厂),s700三星数码相机。
琼脂糖(进口分装),SRAP引物(北京赛百盛基因技术有限公司 ),PVP(Sigma),β-巯基乙醇(Sigma),CT AB(Amresco),100 bpDNA laddermarker(TOYOBO),丙烯酰胺、甲叉-双丙烯酰胺、硝酸银、甲醛均为 BBI公司产品,T EMED、过硫酸铵为 Promega产品,Taq酶(TOYOBO),dNT Ps(TaKaRa),其余为国产分析纯试剂。
1.3 方法
(1)DNA的提取。鱼腥草叶片 DNA的提取采用钟军改良的CTAB法[19],并稍作改动。经 UV-55紫外分光光度计分析纯度和产率,用0.8%琼脂糖电泳检测其质量。
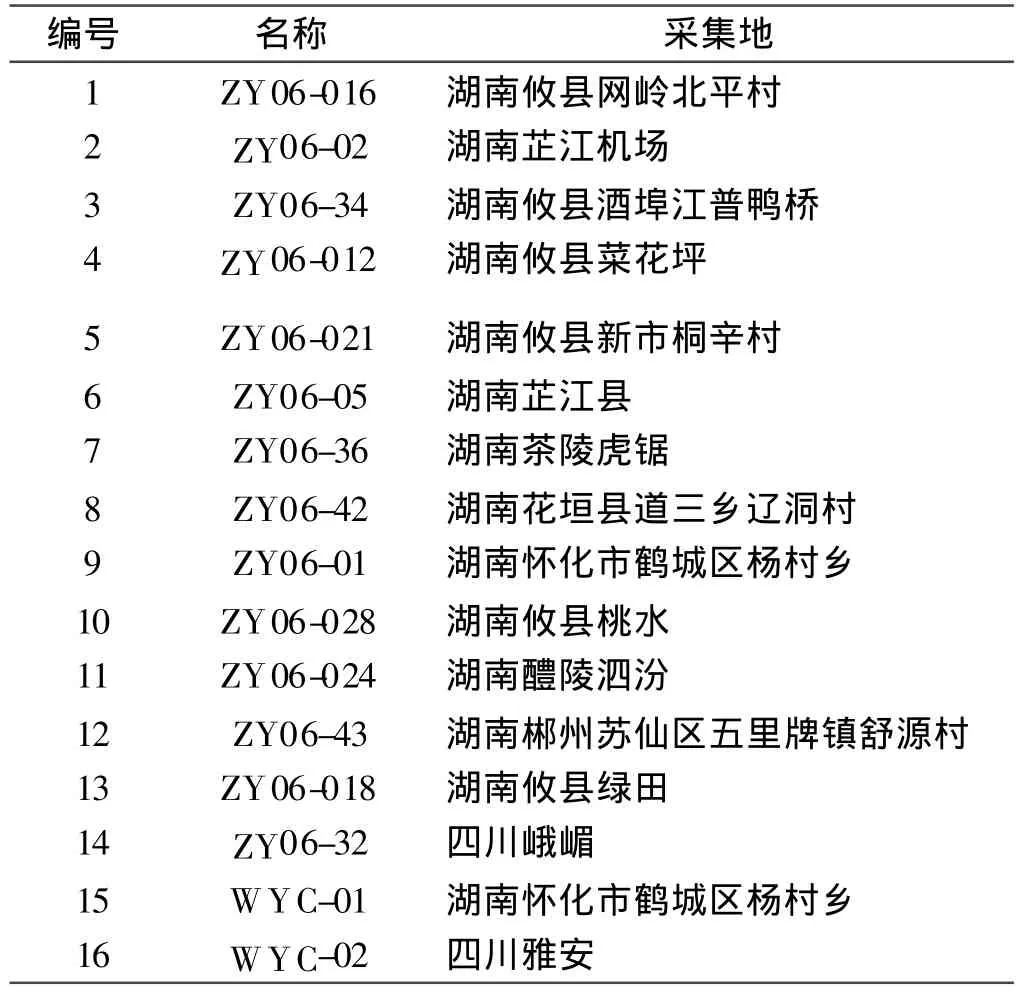
表1 鱼腥草材料编号及来源
(2)SRAP反应体系的优化。每一组均以 ZY06-012 DNA为模板,以 Me5— Em4为引物组合,分别对鱼腥草 PCR反应体系中5个主要影响因素(dNTPs的浓度、模板 DNA的浓度、引物浓度、Taq酶的用量和Mg2+浓度)和扩增体系中 2个主要影响因素(退火温度和循环数)进行正交设计优化。正交试验设计分别见表 2和表 3。
(3)筛选引物。选取已公布的 SRAP上游引物18条,下游引物20条(表4),组成360对引物组合,由北京赛百盛基因技术有限公司合成。筛选出扩增多态性好、条带清晰的引物对进行遗传多样性分析。

表2 鱼腥草SRAP-PCR反应体系正交试验设计表L16(45)

表3 鱼腥草SRAP-PCR扩增体系正交试验设计表L9(34)
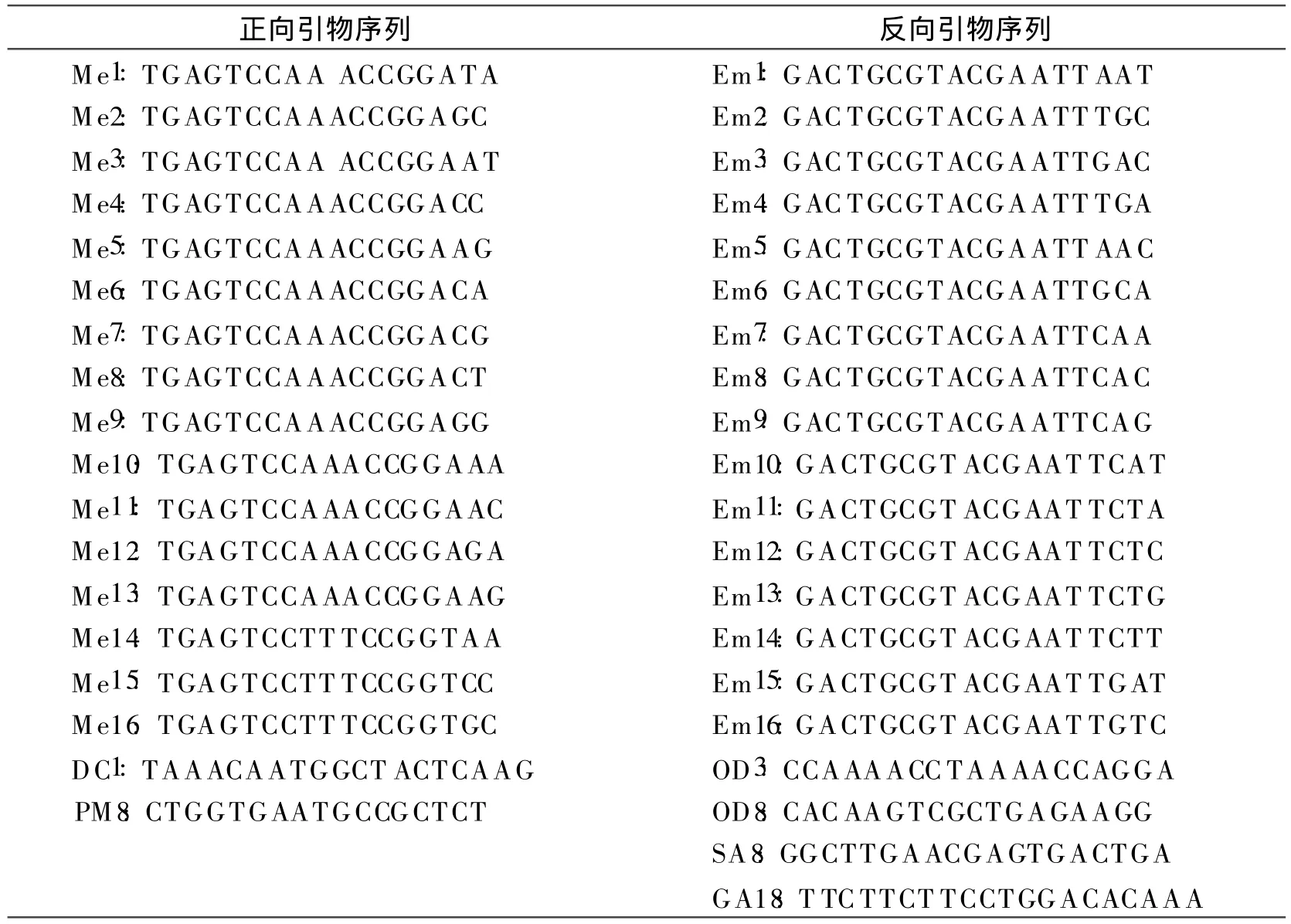
表4 试验中使用的SRAP引物
(4)SRAP扩增。以优化后的最佳反应体系和扩增体系进行,最后取2μL的扩增产物,8%丙烯酰胺凝胶电泳,电压 150 V,电泳1.5 h,然后固定、染色、显影、停显[20],最后用数码相机拍照并记录。
1.4 统计分析
选取同一引物在相同基因位点扩增重复性强和清晰的条带,根据条带的有无分别记做“1”和“0”。不同引物扩增的结果构成原始的“0,1”二元数据矩阵,用DPS分析软件计算鱼腥草各基因型之间的 Nei’s遗传距离,用 UPGMA程序构建聚类图。
2 结果与分析
2.1 SRAP-PCR反应体系及扩增体系正交试验优化分析
从图1中可以看出,在 16组反应中只有第 4组的电泳结果最为清晰可辨且扩增条带数最多,第 3组稍次之,即适合于鱼腥草 SRAP最优的反应体系为:25 μL的反应体系中,模板 DNA量 40 ng、Mg2+浓度 2.0 mmol/L、上下游引物 37.5 ng/L、dNTPs0.1 mmol/L以及 2 U Taq酶。从图 2结果来看,第 9组的条带比其他组更清楚,条带数更多,所以适合于鱼腥草SRAP最优的扩增体系为第 9组扩增体系,即退火温度 53℃,循环数为 35。
2.2 遗传多样性分析
从360对引物组合中筛选出118对扩增条带清晰、重复性好的引物组合进行 PCR扩增,共扩增出 7 582个条带,其中多态性条带 6 590个,多态率 86.92%。SRAP标记的多态性见表5,扩增产物的分子量为50~2 500 bp。 其中引物组合 Me9-GA18共扩增出 79个基因位点,多态性位点63,多态位点比率为79.75%;引物组合Me16-Em9共扩增出基因位点105个,其中多态性位点73个,多态位点比率为 69.52%。
2.3 鱼腥草基因型SRAP特异性缺失标记及特异性标记
在 16个鱼腥草基因型中,ZY06-028鱼腥草在Me9-GA18(图3)引物对扩增时缺失一条250 bp左右扩增带,可以作为ZY06-028鱼腥草品种鉴定的特异标记。而 ZY06-016和 ZY06-028鱼腥草约在550 bp处共同缺失一条扩增带,其余品种均无缺失。在 Me8-Em10引物扩增产物中出现了两个特异性标记的条带,分别是 ZY06-42在 300 bp处的一条带和 ZY06-01在 450 bp处的一条带(图4)。这些特异性缺失标记和特异性标记都可以作为鱼腥草品种鉴定和形态学分类的重要依据。
图1 鱼腥草SRAP-PCR反应体系正交试验设计优化结果
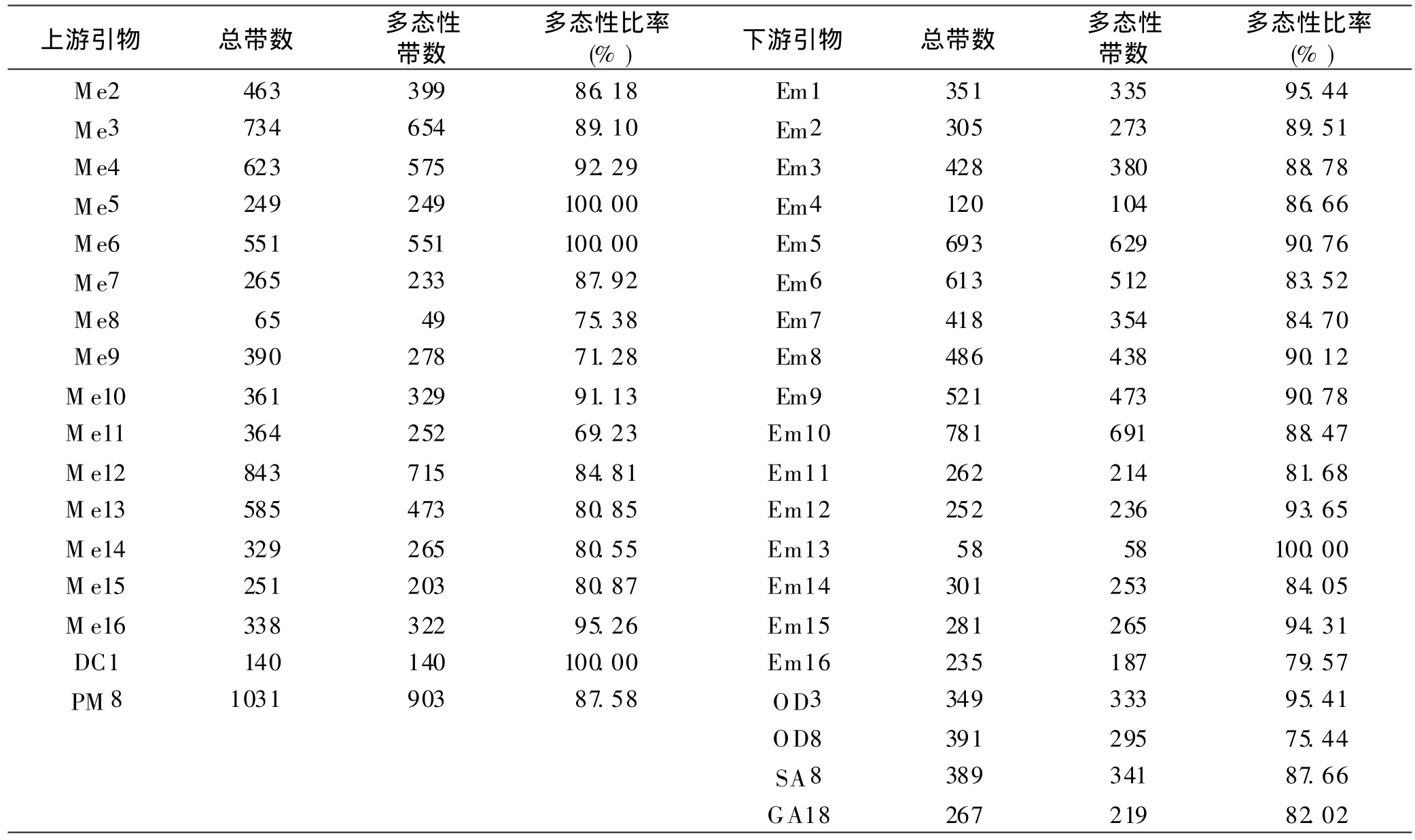
表5 SRAP上、下游引物、扩增总带数及多态性带数
2.4 基因型间的亲缘关系
应用 DPS软件,根据“0,1”数据矩阵,计算的遗传距离在 0.0536~0.4040。其中 ZY06-021和 ZY06-05之间的遗传距离最小为 0.0536,ZY06-016和 ZY06-024之间的遗传距离最远为0.4040。ZY06-016为在湖南攸县网岭北平村采集的材料,ZY06-024为在湖南醴陵泗汾采集的材料。图5为应用UPGMA程序建立的16个鱼腥草基因型的聚类图。根据聚类图可看出,在遗传距离 0.31处,可将 16份鱼腥草材料分为三大类,其中ZY06-024鱼腥草为第一类,ZY06-01为第二类,第三类包括了其余的14份材料,这14份材料包括了两个亚类,第一亚类中包含有 ZY06-016,ZY06-02,ZY06-021,ZY06-05,ZY06-36,ZY06-42,ZY06-028,共 7份材料;第二亚类中包含有 ZY06-34,ZY06-012,ZY06-43,ZY06-018,ZY06-32,WYC-01,WYC-02,也是 7份材料。在16份材料中遗传关系较近的有 ZY06-021和ZY06-05,ZY06-43和 ZY06-018,WYC-01和 WYC-02。从此结果可以看出,同一地区的品种,如湖南攸县的 4份资源:ZY06-016,ZY06-012,ZY06-021,ZY06-018并没有聚到一类,且同为红秆的ZY06-05和ZY06-01的遗传关系还比较远。这或许能够说明鱼腥草基因型间的遗传关系很复杂。

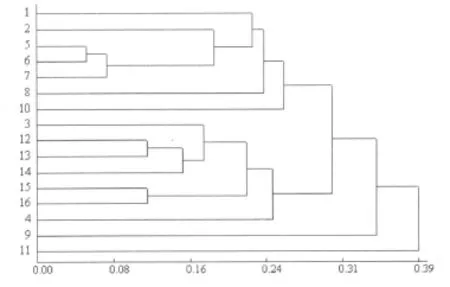
图5 16份鱼腥草品种资源的SRAP聚类图
3 讨 论
本试验中选择118对引物组合,对 16个鱼腥草品种资源进行了多样性分析,其揭示的多态性位点数高达 86.92%。由此可见,作为一种新型的分子标记,SRAP技术在鱼腥草资源的系统分类、亲缘关系鉴定、品种鉴别、亲本选择等方面具有潜在的应用前景。
SRAP标记是一种基于 PCR技术的分子标记,扩增结果易受到反应条件及扩增条件的影响,因此针对不同的试材及实验条件需要优化反应体系。本试验进行了不同影响因子的正交试验设计优化,试验结果表明,适合于鱼腥草 SRAP最优的反应体系为:25μL的反应体系中,模板DNA量40 ng,Mg2+浓度 2.0 mmol/L,上下游引物 37.5 ng/L,dNTPs0.1 mmol/L以及 2 U Taq酶;适合于鱼腥草SRAP最优的扩增体系为:退火温度 53℃,循环数为 35。此结果与南瓜[8]、柿子[11]、梨[12]等建立的 SRAP标准反应体系中的各参数相比,存在一定的差别。其原因可能是不同物种的基因组存在很大的差别,所需的反应体系也会有所不同,也可能是不同公司的药品仪器导致的差别。
本实验在对 16个鱼腥草品种的 SRAP分析中发现,有些品种用特定的引物对扩增以后,会出现一些特异性缺失的条带及特异性的条带,这些特异性缺失条带和特异性的条带可为鱼腥草的品种鉴定提供必要的依据。例如,引物对组合Me9-GA18-250 bp缺失条带是 ZY06-028鱼腥草的特异缺失标记,Me9-GA18-550 bp缺失条带是ZY06-016和ZY06-028鱼腥草的特异缺失标记,在引物对组合Me8-Em10中ZY06-42和 ZY06-01分别在 300 bp和 450 bp处出现了一条特异性的条带。
16个鱼腥草基因型中 ZY06-016和 ZY06-024的遗传关系最远,ZY06-021和 ZY06-05,ZY06-43和ZY06-018,WYC-01和 WYC-02遗传关系较近,同时可在遗传距离0.31处分为3个类群,其中 ZY06-024和ZY06-01鱼腥草与其它基因型显著不同,分别单独聚为一类,其余的 14个鱼腥草品种聚为一大类,而这一大类又可在遗传距离0.28处分为两个亚类。从聚类结果中可以发现,同一地区的品种(如湖南攸县的 4个品种:ZY06-016,ZY06-012,ZY06-021,ZY06-018)没有聚到一起,不仅如此,与形态学指标茎秆颜色、茎秆长度等分类也有很大不同。吴卫[1]等人对四川地区92份鱼腥草材料进行研究,发现鱼腥草染色体数目的变化范围很大,在 36~126之间变化,且即使在同一地区不同村镇上的鱼腥草染色体数目亦有很大差别。例如,同是四川剑阁的鱼腥草材料,但染色体数目就有 72条,82条,84条,86条之别。这一结论或许能对上述结果做出较好的解释,即鱼腥草基因型间的遗传关系非常复杂。
4 结 论
SRAP分子标记能够很好的用于鱼腥草基因型遗传多样性分析。 ZY06-024和 ZY06-01与其他 14份材料的基因型显著不同,且这 16份材料的分子标记结果表明,在同一地区引进的材料并没有很好聚到一类中,这或许能够说明鱼腥草的基因型受生态环境的影响比较小。同时各品种间聚类结果与按照茎秆颜色、茎秆长度等形态学指标分类也不太一致(未发表),表明了鱼腥草各基因型遗传关系的复杂性。
[1]吴 卫.鱼腥草种质资源研究 [D].雅安:四川农业大学,2002.
[2]Li G,Quiros CF.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:Itsapplication tomapping and gene tagging inBrassica[J].Theor Appl Genet,2001,103:455-460.
[3]李 莉,彭建营,白瑞霞,等.SRAP与 TRAP标记及其在园艺植物研究中的应用[J].西北植物学报,2006,26(8):1749-1753.
[4]李 武,林忠旭,张献龙.海岛棉遗传多样性的 SRAP标记分析 [J].作物学报,2007,34(7):634-638.
[5]姜树坤,马 慧,刘 君,等.利用 SRAP标记分析玉米遗传多样性[J].分子植物育种,2007,5(3):412-415.
[6]Riaz A,Li G,Quresh Z,et al.Genetic diversity of oilseed Brassica napus inbred lines based on sequence-related amplified polymorphism and its relation to hybrid performance[J].Plant Breeding,2001,120(5):411-415.
[7]Espostio M A,Martin EA,Cravero V P,et al.Characterization of pea accessions by SRAP markers[J].Scientia Horticulture,2007,113(4):329-333.
[8]Ferriol M,Pioo B,Nuez F.Genetic diversity of a germplasm collection of Cucurbita pepousingSRAP and AFLP markers[J].Theor Appl Genet,2003,107:271-276.
[9]何凤发,杨志平,张正圣,等.马铃薯遗传资源多样性的SRAP分析 [J].农业生物技术学报,2007,15(6):1001-1006.
[10]瞿 桢,魏英辉,李大威 ,等.莲品种资源的 SRAP遗传多样性分析[J].氨基酸和生物资源,2008,30(3):21-24.
[11]郭大龙,罗正荣.部分柿属植物 SRAP-PCR反应体系的优化[J].果树学报,2006,23(1):138-142.
[12]张妤艳,吴 俊,张绍铃.梨 SRAP-PCR反应体系的建立与优化 [J].农业生物技术学报,2007,15(5):909-914.
[13]吴 鑫,雷天刚 ,何永睿,等.柑桔 SRAP和 ISSR分子标记技术体系的建立与优化 [J].分子植物育种,2008,6(1):170-175.
[14]马 明,杨克强,刘晓菊 ,等.核桃 SRAP标记反应体系建立的研究[J].山东农业大学学报,2007,38(2):189-194.
[15]张四普,汪良驹,曹尚银 ,等.23个石榴基因型遗传多样性的 SRAP分析 [J].果树学报,2008,25(5):655-660.
[16]陈大霞,彭 锐 ,李隆云,等.利用 SRAP和 ISSR标记分析川党参的遗传多样性 [J].中国中药杂志,2009,34(3):257-262.
[17]陈大霞,李隆云,彭 锐,等.玄参3种栽培类型遗传关系和遗传多样性的 SRAP研究[J].中国中药杂志,2009,34(2):140-146.
[18]钱 丹,黄璐琦,崔光红,等.不同产地蒙古黄芪遗传关系的 SRAP分析 [J].中国中药杂志,2009,34(4):384-389.
[19]钟 军.芸芥抗油菜菌核病分子基础的研究 [D].长沙:湖南农业大学,2003.
[20]赵 培,王振英,彭永康,等.琼脂糖和聚丙烯酰胺凝胶电泳技术检测小麦基因组 DN ARAPD扩增产物的方法学比较[J].中国生物工程杂志,2003,23(8):99-104.
