含双哌啶基手性β-氨基醇的合成及其在二乙基锌与芳香醛加成中的手性诱导作用*
2010-11-26冉维津张月成赵继全
王 芳, 冉维津, 张月成, 赵继全
(河北工业大学 化工学院,天津 300130)
手性氨基醇催化的二烷基锌对醛的不对称加成反应是C-C链增长和生成光学活性仲醇的一种有效方法[1]。单体二烷基锌对羰基化合物是惰性的,通过引入合适的配体才能使反应温和平稳地进行。研究发现,手性β-氨基醇类化合物是此类反应最有效的配体。目前,大部分手性氨基醇类配体都是由天然产物修饰得到[2],如天然樟脑衍生物[3]、氨基酸衍生物[4]、麻黄碱和降麻黄碱衍生物[5]等。经过二十多年的研究,手性β-氨基醇配体催化的二烷基锌与醛的不对称加成反应得到了很大的发展,不断涌现出许多优秀的配体。Waldmann等[6]首先合成了具有双哌啶结构的手性β-氨基醇配体,该配体在二乙基锌与苯甲醛的不对称加成反应中取得了较好的催化效果。





CompabcdRi-Prn-PrMeEt
Scheme1
本文以N-异丙基(或正丙基)-4-哌啶酮(1a或1b)和手性β-氨基醇为原料,合成了五个带有双哌啶基的手性β-氨基醇类化合物(2a,2b,4b~4d, Scheme 1),其结构经1H NMR,13C NMR, IR和MS表征,其中4b~4d未见文献报道。将2和4用于二烷基锌对醛的不对称加成反应中,考察了双哌啶结构的引入及不同结构双哌啶氨基醇对反应对映选择性的影响。
1 实验部分
1.1 仪器与试剂
WZZ-2S/2SS型数字式自动糖度/旋光仪;Bruker AC-P 300型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Vector 22型傅立叶变换红外光谱仪(KBr压片);SP-6800A型气相色谱仪(SE-30毛细管柱,30 m×0.25 mm I.D., 0.25μm; Cyclodex-β手性柱,30 m×0.25 mm I.D., 0.25μm);薄层层析硅胶板GF-254。
多聚甲醛、80%水合肼、冰乙酸、一缩二乙二醇、甲醇、苯甲醛,天津科锐思精细化工有限公司;对甲基苯甲醛、对氟苯甲醛、对氯苯甲醛、对溴苯甲醛,百顺(北京)化学科技有限公司;(R)-2-氨基-1-丁醇(Ⅱ),光学纯度98%,上海氟德化工有限公司;1 mol·L-1二乙基锌正己烷溶液,宁波集运化学有限公司;甲醇用前用普通方法除水。1和(R)-3-(2-羟基-2-苯基)乙基-7-异(正)丙基-3,7-二氮杂双环[3.3.1]壬烷(2a或2b)按文献[7]方法合成。
1.2 4的合成
(1)3的合成(以3b为例)[7,8]
在单口瓶中加入1b14.1 g(100 mmol)和甲醇100 mL,冰水浴控制温度在10 ℃~20 ℃,搅拌下缓慢滴加冰乙酸6.6 g(110 mmol)和甲醇50 mL的混合液,滴毕制得溶液A。
氮气保护,在四口瓶中加入Ⅱ 10.68 g(120 mmol)和甲醇200 mL,冰水浴冷却,搅拌下缓慢滴加冰乙酸7.45 g(124 mmol)(低于20 ℃),滴毕,撤去冰水浴,加入94%多聚甲醛7.98 g(250 mmol),加热至回流;缓慢滴加溶液A(约6 h),反应至GC检测反应液组分基本无变化时停止反应。减压蒸除溶剂得深红色黏稠液体,加水25 mL,用40%KOH溶液调至pH>13,用CH2Cl2(4×50 mL)萃取,无水Na2SO4干燥,减压蒸除溶剂得红棕色黏稠液体,经硅胶柱层析[洗脱剂:B=V(乙醇) ∶V(石油醚) ∶V(三乙胺)=1 ∶30 ∶1,Rf=0.60]分离得黄色油状液体(R)-3-(1-羟甲基)丙基-7-正丙基-3,7-二氮杂双环[3.3.1]壬烷-9-酮(3b)7.68 g,收率31.1%,纯度97.2%(GC,下同);1H NMRδ: 0.89(t,J=7.4 Hz, 6H, CH3), 1.20(m, 1H, 3′-H), 1.39(m, 1H, 3′-H), 1.55(m, 2H, CH2CH3), 2.14(m, 1H, NCH2), 2.26(m, 1H, NCH2), 2.40(s, 2H, 1,5-H), 2.54(dd,J=10.8 Hz, 2H, NCH2), 2.75(m, 1H, 2′-H), 2.86(d,J=11.2 Hz, 1H, NCH2), 3.19(d,J=11.2 Hz, 1H, NCH2), 3.32(d,J=10.5 Hz, 2H, NCH2), 3.40(m, 2H, NCH2, 1′-H), 3.50(m, 2H, NCH2, 1′-H), 6.15(s, 1H, OH); IRν: 3 240, 2 961, 2 876, 2 810, 1 733, 1 463, 1 079 cm-1。
用类似方法合成黄色油状液体(R)-3-(1-羟甲基)丙基-7-甲基-3,7-二氮杂双环[3.3.1]壬烷-9-酮(3c)(洗脱剂:B=1.00 ∶1.00 ∶0.02,Rf=0.54)10.14 g,收率44.0%,纯度98.1%;1H NMRδ: 0.88(t,J=7.6 Hz, 3H, CH3), 1.23(m, 1H, 3′-H), 1.42(m, 1H, 3′-H), 2.24(s, 3H, NCH3), 2.38(s, 2H, 1,5-H), 2.64(d,J=11.6 Hz, 2H, NCH2), 2.78(m, 1H, 2′-H), 2.87(d,J=11.6 Hz, 1H, NCH2), 3.20(d,J=15.6 Hz, 2H, NCH2), 3.29(d,J=12.4 Hz, 2H, NCH2), 3.36(m, 1H, 1′-H), 3.41(m, 2H, NCH2, 1′-H), 6.50(s, 1H, OH); IRν: 3 241, 2 936, 2 791, 1 732, 1 465, 1 075 cm-1。
用类似方法合成黄色油状液体(R)-3-(1-羟甲基)丙基-7-乙基-3,7-二氮杂双环[3.3.1]壬烷-9-酮(3d)(洗脱剂:B=1.0 ∶20 ∶0.5,Rf=0.45)12.10 g,收率49.1%,纯度97.4%;1H NMRδ: 0.89(t,J=7.4 Hz, 3H, CH3), 1.12(t,J=7.2 Hz, 3H, NCH2CH3), 1.21(m, 1H, 3′-H), 1.40(m, 1H, 3′-H), 2.28(m, 1H, NCH2), 2.39(m, 3H, 1,5-H, NCH2), 2.52(dd,J=11.6 Hz, 2H, NCH2), 2.76(m, 1H, 2′-H), 2.86(d,J=11.2 Hz, 1H, NCH2), 3.19(d,J=11.2 Hz, 1H, NCH2), 3.30(d,J=11.2 Hz, 2H, NCH2), 3.36(m, 2H, NCH2, 1′-H), 3.43(m, 2H, NCH2, 1′-H), 6.22(s, 1H, OH); IRν: 3 223, 2 965, 2 933, 2 809, 1 733, 1 460, 1 077 cm-1。
(2)4的合成(以4b为例)



1.3 二乙基锌与醛的加成反应
以2b催化二乙基锌与苯甲醛的加成反应为例。在充分干燥并通入氮气的两口瓶中加入2b28.8 mg(0.10 mmol)和新鲜蒸馏的无水甲苯4 mL,搅拌下冷至0 ℃以下,用注射器加入1 mol·L-1二乙基锌的正己烷溶液4 mL(4 mmol),继续搅拌至-10 ℃,缓慢滴加新鲜蒸馏的苯甲醛0.21 g(2.0 mmol),滴毕,反应24 h;缓慢升至室温继续反应4 h。于0 ℃加入1 mol·L-1HCl 10 mL淬灭反应,用无水乙醚(3×10 mL)萃取,合并萃取液,用无水硫酸钠干燥,旋蒸浓缩得淡黄色液体,经硅胶柱层析[洗脱剂:V(正己烷) ∶V(乙酸乙酯)=4 ∶1,Rf=0.42]纯化得无色透明液体(R)-1-苯基-1-丙醇。
2 结果与讨论
2和4的结构经1H NMR,13C NMR, IR和MS表征,与Scheme 1预期吻合。经旋光测定,且均具有旋光性。
分别以2a, 2b,4b~4d和Ⅱ共6种手性氨基醇为催化剂,反应条件同1.3,在-10 ℃下考察了其在二乙基锌对苯甲醛的不对称加成反应中的催化性能,实验结果见表1。从表1可以看出,不同结构的催化剂,对加成反应对映选择性的影响不同。在相同条件下,具有双哌啶结构的2和4作催化剂比Ⅱ取得了更好的催化效果,说明在氨基醇上连上双哌啶骨架有利于提高氨基醇的催化性能。这可能与双哌啶的刚性结构及两个氮一个氧的三齿结构能更好的与金属离子配位有关。2b相对2a的对映选择性更好(93.1%ee);4b~4d比较可以看出,4c的对映选择性为90.0%ee,高于4b和4d。这说明当手性中心相同时,双哌啶N上的取代基的位阻越小,越有利于不对称加成反应的对映选择性。这可能与取代基位阻越大越不利于配体与金属离子配位有关。通过将旋光方向与文献[9]结果比较,这6种氨基醇作催化剂均得到(R)-1-苯基-1-丙醇过量的不对称加成产物。

表 1 手性氨基醇催化二乙基锌与苯甲醛的不对称加成反应*Table 1 Asymmetric addition of diethylzinc to benzaldehydes using chiral aminoalcohols as catalysts
*二乙基锌4 mmol,n(二乙基锌) ∶n(苯甲醛)=2 ∶1,甲苯4 mL,催化剂5 mol%,于-10 ℃反应28 h;产物为(R)-1-苯基-1-丙醇

表 2 反应条件对2b催化不对称加成反应的影响*Table 2 Effect of reaction conditions on the asymmetric addition of diethylzinc to benzaldehyde using 2b as catalyst
*二乙基锌4 mmol,其余反应条件同表1;**溶剂与二乙基锌正己烷溶液中的正己烷构成混合溶剂(等体积比);产物为(R)-1-苯基-1-丙醇
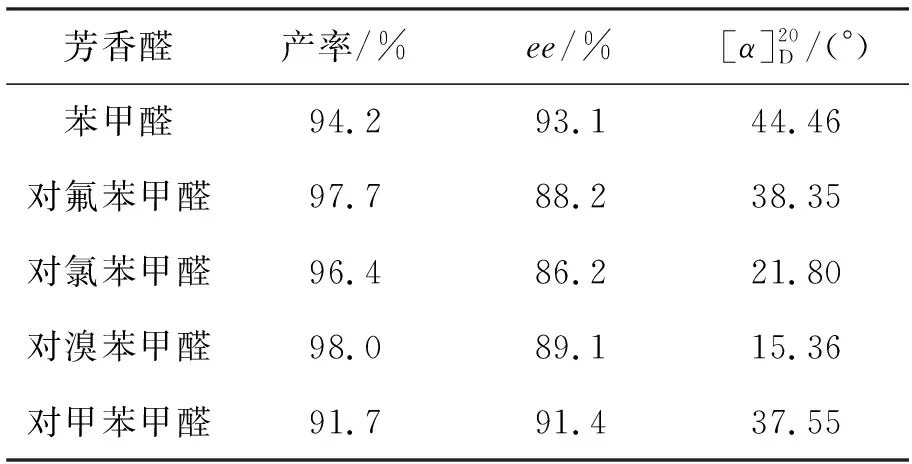
表 3 2b催化二乙基锌与芳香醛的不对称加成反应*Table 3 Asymmetric addition of diethylzinc to aldehydes using 2b as catalyst
*2b5 mol%,其余同表1
以2b为催化剂进一步考察了反应温度、催化剂用量、溶剂对苯甲醛与二乙基锌加成反应对映选择性的影响,结果见表2。由表2可见,在-10 ℃反时应产率最高,对映选择性最好;催化剂用量由2%增加到8%时,苯甲醛的转化率以及产物的ee值变化不大;以甲苯做溶剂时反应的选择性最好。
由此确定以2b为催化剂,不对称加成反应的较适宜反应条件为:二乙基锌4 mmol,n(二乙基锌) ∶n(苯甲醛)=2 ∶1,甲苯4 mL, 2b5 mol%,于-10 ℃反应28 h。在此条件下考察了5种芳香醛与二乙基锌的不对称加成反应,产物的旋光度及旋光方向与文献[9,10]值作了比较,结果见表3。从表3可以看出,所有加成产物均为R-构型,与催化剂2b的构型一致。
3 结论
合成了五个具有双哌啶结构的手性氨基醇化合物2和4,其中4b~4d未见文献报道。考察了2和4在二烷基锌和芳香醛的不对称加成反应中的催化性能。与不具有双哌啶结构的(R)-2-氨基-1-丁醇相比,2和4均取得了较好的手性诱导催化结果。
[1] Soai K, Niwa S. Enantioselective addition of organozinc reagents to aldehydes[J].Chem Rev,1992,92(5):833-856.
[2] 翁文,周宏英,傅宏祥,等. 手性氨基醇在不对称催化中的应用及新进展[J].有机化学,1998,18(6),509-520.
[3] Kozakiewicz A, Ullrich M, Welniak M,etal.C2-symmetrical bis(camphorsulfonamides) as chiral ligands for enantioselective addition of diethylzinc to benzaldehyde[J].J Mol Catal A:Chem,2008,286(1-2):106-113.
[4] Da C S, Ni M, Han Z J,etal. Novel non-azacyclo 1,2-aminoalcohols derived from L-Phe and highly enantioselective addition of diethylzinc to aryl aldehydes[J].J Mol Catal A:Chem,2006,245(1-2):1-7.
[5] Mao J C, Wan B S, Zhang Z J,etal. Reversal of enantioselectivity by adding Ti(OiPr)4:Novel sulfamide-amine alcohol ligands for the catalytic asymmetric addition of diethylzinc to aldehydes[J].J Mol Catal A:Chem,2005,225(1):33-37.
[6] Spieler J, Huttenloch O, Waldmann H. Synthesis of chiral amino alcohols embodying the bispidine framework and their application as ligands in enantioselectively catalyzed additions to C=O and C=C groups[J]. Eur J Org Chem,2000,2000:391-399.
[7] 冉维津,张月成,王芳,等. 具有手性中心的双哌啶衍生物的合成[J].合成化学,2010,18(3):310-313.
[8] Berlin K D, Scherlag B J, Clarke C R,etal. Salts of 3-azabicyclo(3.3.1) nonanes as antiarrhythmic agents and precursors thereof[P].US 5 110 933,1992.
[9] Dai W M, Zhu H J, Hao X J. Chiral ligands derived from abrine.Part 6:Importance of a bulkyN-alkyl group in indole-containing chiralβ-tertiary amino alcohols for controlling enantioselectivity in addition of diethylzinc toward aldehydes[J].Tetrahedron:Asymmetry,2000,11(11):2315-2337.
[10] Yang X F, Hirose T, Zhang G Y. Synthesis of novel chiral tridentate aminophenol ligands for enantioselective addition of diethylzinc to aldehydes[J].Tetrahedorn:Asymmetry,2008,19(14):1670-1675.
