短发夹状RNA靶向抑制HaCaT细胞Hax-1基因的表达研究*
2010-10-30翟志芳钟白玉
翟志芳,王 莉,钟 华,钟白玉,郝 飞
(第三军医大学西南医院皮肤科,重庆400038)
短发夹状RNA靶向抑制HaCaT细胞Hax-1基因的表达研究*
翟志芳,王 莉,钟 华,钟白玉,郝 飞
(第三军医大学西南医院皮肤科,重庆400038)
目的 观察短发夹状干扰RNA靶向抑制 Hax-1基因诱导 HaCaT细胞凋亡的作用。方法 构建特异性抑制 Hax-1的shRNA表达载体并转染 HaCaT细胞;分别采用半定量PCR以及Western blot从mRNA和蛋白水平检测干扰效果;流式细胞术检测HaCaT细胞的凋亡。结果 Hax-1基因mRNA水平以及蛋白水平的表达均得到显著抑制,HaCaT细胞凋亡率明显升高。结论 靶向 Hax-1的shRNA显著抑制了 Hax-1基因在 HaCaT细胞中的表达,并明显诱导 HaCaT细胞凋亡。
短发夹状干扰RNA;Hax-1;HaCaT细胞;细胞凋亡
Hax-1是Suzuki等[1]于1997年首先发现的与 HS-1基因结合的一种蛋白。近年来,Hax-1在细胞凋亡中的调节作用引起很多学者的关注,本课题组前期的实验研究发现 Hax-1在系统性红斑狼疮(systemic lupus erylhemalosus,SL E)患者外周血T细胞中明显高表达,并通过体内外实验证实了 Hax-1可能通过抗凋亡机制参与淋巴细胞凋亡过程,参与了SL E的发生、发展过程[2-3]。本研究拟构建靶向 Hax-1基因的shRNA表达载体,观察 siRNA靶向抑制 Hax-1基因表达,诱导HaCaT细胞凋亡的生物学效应,进一步阐明 Hax-1基因在人角质形成细胞凋亡调节中的作用。
1 材料与方法
1.1 主要试剂 质粒pSilencer2.0-U6(Ambion公司)、脂质体Limpofectamine2000(Invitrogen公司)、Hax-1鼠抗鼠单克隆抗体(BD biosciences公司)、HRP-GAM-IgG二抗(北京中杉公司)、Heochst33342及 PI(Sigma公司)等。
1.2 靶向 Hax-1基因shRNA表达载体的构建
1.2.1 模板序列设计 根据 GenBank中编码 Hax-1的cDNA序列(ID BC098225),按照 shRNA设计原则,参照文献[4],在Hax-1全长序列中选取含19个核苷酸靶序列的两条短反向重复序列,两端分别加上pSilencer2.0-U6对应的Bam HⅠ及 HindⅢ酶切黏性末端以及终止识别序列,序列全长65 bp(图1)。同时设计对照shRNA。shRNA模板由北京三博生物公司合成。

图1 Hax-1的shRNA模板序列
1.2.2 表达载体的构建 分别取1μL(3μg/μL)正反义表达模板,加入48μL退火缓冲液,95 ℃、2min,75 ℃、10min,缓慢冷却至4℃。将退火形成的双链定向克隆至用Bam HⅠ及HindⅢ线性化的pSilencer 2.0-U6载体中,转化后经 EcoRⅠ和 HindⅢ酶切鉴定,最后测序鉴定。阳性克隆命名为pSilencer-Hax-1。含无关序列的阴性对照质粒为pSilencer-none。
1.3 细胞培养和转染 常规培养 HaCaT细胞株至细胞达80%~90%汇合时,按Lipofectamine2000说明书进行转染。实验分为转染pSilencer-Hax-1组、pSilencer-none组及未转染组3组。转染后的细胞经 G418筛选,阳性克隆扩增培养备用。
1.4 Hax-1基因mRNA表达 用 Tripure法提取总 RNA,逆转录后各取2μL DNA行PCR反应β,-actin为内参照。Hax-1特异性引物序列,F′5′ATG CGA TTC CAC GGC AAC TT 3′,R′5′CCA CTG TCC CAT CTG GCT TA 3′,扩增片断 454 bpβ;-actin(618 bp)特异性引物序列,F′5′CGG GAC CTG ACT GAC TAC CTC 3′,R′5′CAA GAA AGG GTG TAA CGC AAC 3′。PCR反应产物经琼脂糖凝胶电泳并采用Quantity One软件进行半定量分析。
1.5 Western blot检测 Hax-1蛋白表达 收集转染后的HaCaT细胞,提取胞质蛋白,用 Tricine-甘氨酸系统电泳、转染后,3%BSA封闭,加1∶250稀释的一抗,4℃过夜,清洗后加1∶5 000稀释的二抗室温下孵育2 h,清洗后,经 ECL发光试剂盒显影,X光胶片记录结果。用Quantity one软件测定蛋白条带的积分密度(IOD)。
1.6 流式细胞仪检测 HaCaT细胞凋亡 各组取约1×105细胞制备成单细胞悬液,加入 Heochst33342,终浓度1μg/mL;37 ℃孵育10min,弃去染液,加入1 mL(5μg/mL)PI染液,4℃避光染色15min。用流式细胞仪检测凋亡细胞阳性率。
1.7 统计学处理 应用SPSS11.0软件进行统计学分析,结果以±s表示组间比较采用χ2和t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 靶向 Hax-1基因shRNA表达质粒的鉴定
2.1.1 酶切鉴定 结果与pSilencer2.0-U6质粒图谱分析一致(图2),实验所得阳性克隆扩增并提取质粒后,经 EcoRⅠ、Bam HⅠ双酶切后获得约3.1 kb和335 bp两条带,经 EcoRⅠ、HindⅢ双酶切后获得3.1 kb和400 bp两条带,相差的大小正好是插入片段的长度(图3)。未插入片段的线性化pSilencer2.0-U6质粒经双酶切后获得的短片段大小均为335 bp。

图2 pSilencer2.0-U6质粒示意图
2.1.2 测序分析 经酶切初步证实插入正确的质粒进行测序,结果证明其中插入片段序列完全正确。
2.2 转染pSilencer-Hax-1后 HaCaT细胞中 Hax-1表达变化
2.2.1 Hax-1 mRNA表达 半定量 PCR检测结果(图4)显示,转染pSilencer-none组 Hax-1 mRNA表达量与未转染组差异无统计学意义(P>0.05),转染pSilencer-Hax-1组 Hax-1 mRNA表达量比未转染组显著降低(P<0.01),Hax-1 mRNA表达的抑制率达82%。
2.2.2 Hax-1蛋白表达 Western blot检测显示(图5),转染pSilencer-Hax-1组中 Hax-1蛋白的表达[(0.254 6±0.030 1)IOD]较未转染组[(0.765 0±0.043 8)IOD]显著降低(P<0.05),Hax-1蛋白表达的抑制率达67%;pSilencer-none组中Hax-1蛋白的表达量[(0.882 2±0.019 4)IOD]与未转染组比较差异无统计学意义(P>0.05)。
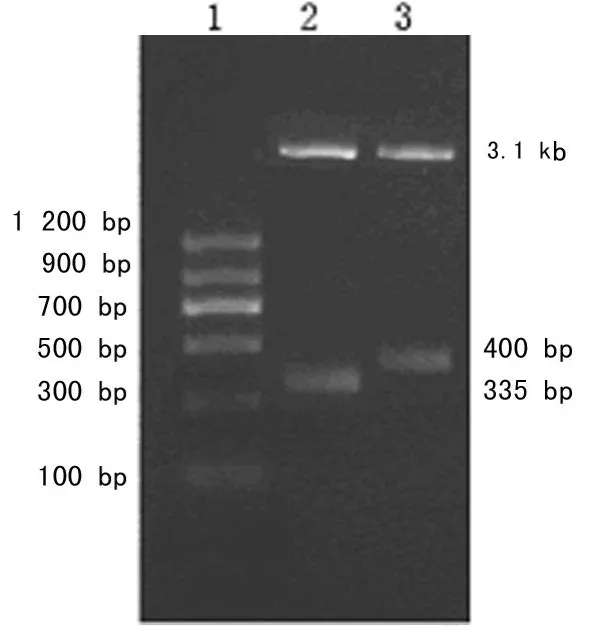
图3 Hax-1基因shRNA表达质粒的酶切鉴定

图4 Hax-1 siRNA对HaCaT细胞mRNA表达的影响

图5 Hax-1 siRNA对HaCaT细胞蛋白表达的影响
2.3 流式细胞仪检测 HaCaT细胞凋亡 未转染组、pSilencer-none组、转染pSilencer-Hax-1组HaCaT细胞凋亡率分别为10.7%、9.2%、4.5%;与未转染组相比,转染 pSilencer-Hax-1组凋亡率减少了6.2%(P<0.05),pSilencer-none组凋亡率减少了1.5%(P>0.05)。
3 讨 论
Hax-1基因相对分子质量为35 kD、广泛表达于多种组织及细胞中。主要分布于线粒体内、少量分布于内质网和核膜、可以与多种蛋白相互作用发挥不同生物学作用的蛋白质[5-7]。已经证实它是一种新的细胞凋亡调节蛋白,具有强大的凋亡抑制作用[8-10]。Hax-1调节细胞凋亡的作用机制目前尚不明确。近年来,Mirmohammadsadegh等[11]发现 Hax-1在银屑病的皮损中过表达,而且在银屑病模型中,Hax-1反义 mRNA的表达,增加了紫外线诱导的细胞凋亡。推测可能由于 Hax-1的表达增加,干扰表皮细胞的分化并因此促进了对末端分化的抵抗,这种抗凋亡机制是对银屑病发病机制的一种新的理解。HaCaT细胞株源于人类表皮的角质形成细胞,也是研究人类表皮角质形成细胞生物学的理想模型,在银屑病等疾病的研究中具有重要意义。
本研究采用的RNA干扰技术是一种由双链RNA引发的特异性高效基因表达抑制途径,与传统的反义技术相比,RNAi能够更高效、更特异的抑制靶基因表达,产生类似基因敲除的效果[12-13]。shRNA表达载体转染的细胞经历稳定、长期的mRNA抑制作用,提供了比转染化学合成的siRNA更经济有效的方法。本实验选用pSilencer2.0-U6作为表达载体,成功构建出靶向Hax-1基因的siRNA表达载体。该载体通过U6启动子在体内表达shRNA,shRNA在细胞中降解为类似siRNA的分子,引发 RNAi过程[14-15]。本研究结果表明,pSilencer-Hax-1载体能够有效在 HaCaT细胞中引发 RNAi效应,通过下调 Hax-1基因表达阻断其介导的凋亡抑制作用,使HaCaT细胞凋亡率增加。该结果为进一步评价siRNA表达载体对 Hax-1基因的抑制效应和诱导凋亡效应,为进一步探讨Hax-1的凋亡调节作用在银屑病等角质形成细胞生长或功能异常相关性疾病中的作用,并开发基于RNAi的治疗新策略提供了理论依据。
[1]Suzuki Y,Demoliere C,Kitamura D,et al.HAX-1,a novel intracellular protein,localized on mitochondria,directly associates with HS1,a substrate of Src family tyrosine kinases[J].J Immunol,1997,158(6):2736.
[2]翟志芳,郝飞,钟白玉,等.HAX-1在活动期 SL E患者外周血单一核细胞中的表达及其亚细胞定位[J].中华皮肤科杂志,2008,41(1):8.
[3]翟志芳,周春丽,钟白玉,等.HAX-1对 MRL/lpr小鼠狼疮活动性影响的实验研究[J].中华医学杂志,2008,88(6):406.
[4]Velculescu VE,Zhang L,Vogelstein B,et al.Serial analysis of gene expression[J].Science,1995,270(5235):484.
[5]Gallagher AR,Cedzich A,Gretz N,et al.The polycystic kidney disease protein PKD2 interacts with HAX-1,a protein associated with the actin cytoskeleton[J].Proc Natl Acad Sci USA,2000,97(8):4017.
[6]Sharp TV,Wang HW,Koumi A,et al.K15 protein of Kaposi′ssarcoma-associated herpesvirus is latently expressed and binds to HAX-1,a protein with antiapoptotic function[J].J Virol,2002,76(2):802.
[7]Boyd JM,Malstrom S,Subramanian T,et al.Adenovirus E1B 19 kDa and Bcl-2 proteins interact with a common set of cellular proteins[J].Cell,1994,79(2):341.
[8]Matsuda G,Nakajima K,Kawaguchi Y,et al.Epstein-Barr virus(EBV)nuclear antigen leader protein(EBNA-LP)forms complexes with a cellular anti-apoptosis protein Bcl-2 or its EBV counterpart BHRF1 through HS1-associated protein X-1[J].Microbiol Immunol,2003,47(1):91.
[9]Yedavalli VS,Shih HM,Chiang YP,et al.Human immunodeficiency virus type 1 Vpr interacts with antiapoptotic mitochondrial protein HAX-1[J].J Virol,2005,79(21):13735.
[10]Cilenti L,Soundarapandian MM,Kyriazis GA,et al.Regulation of HAX-1 anti-apoptotic protein by Omi/HtrA2 protease during cell death[J].J Biol Chem,2004,279(48):50295.
[11]Mirmohammadsadegh A,Tartler U,Michel G,et al.HAX-1,identified by differential display reverse transcription polymerase chain reaction,is overexpressed in lesional psoriasis[J].J Invest Dermatol,2003,120(6):1045.
[12]Rye PD,Stigbrand T.Interfering with cancer:a brief outline of advances in RNA interference in oncology[J].Tumour Biol,2004,25(5-6):329.
[13]Verma NK,Dey CS.RNAOmediated gene silencing:mechanisms and its therapeutic applications[J].J Clin Pharm Ther,2004,29(5):395.
[14]Wadhwa R,Kaul SC,MiyagishiM,et al.Vectors for RNA interference[J].Curr Opin Mol Ther,2004,6(4):367.
[15]Nahreini P,Hanson AJ,Andreatta CP,et al.Altering cellular signaling pathways enhance gene silencing activity of shRNA,shRNA.ribozyme,and shRNA.antisense in neuroblastoma cells[J].Cell Mol Neurobiol,2004,24(6):781.
Study on expression of Hax-1 human keratinocyte line HaCaT by Hax-1 short hairpin RNA*
ZHAI Zhi-fang,WANG Li,ZHONG Hua,et al.
(Department of Dermatology,Southwest Hospital,Third Military Medical University,Chongqing400038,China.)
Objective To study the function of HS1-associated protein X-1(Hax-1)shRNA in inducing apoptosis of human keratinocyte line HaCaT.Methods ShRNA expression vector pSilencer-Hax-1 was constructed.Reverse transcription-polymerase chain reaction(RT-PCR)technique and Western blot were used to analyze mRNA and protein expressions of Hax-1 in transfected HaCaT cells.And then apoptotic HaCaT cells were detected by flow cytometry.Results Expression of the mRNA and protein of Hax-1 was down-regulated and obvious apoptosis of HaCaT was induced.Conclusion siRNA mediated by pSilencer-Hax-1 significantly inhibited the expression of Hax-1 in HaCaT cells and obviously induced the apoptosis of HaCaT cells.
short hairpin RNA;HS1-associated protein X-1;HaCaT cells;apoptosis
10.3969/j.issn.1671-8348.2010.23.021
Q522;R758.63
A
1671-8348(2010)23-3202-03
国家自然科学基金资助项目(30671886)。
2010-06-14
2010-07-20)
