UV-B辐射增强对链格孢菌(Alternaria alternata)生长、生理及致病力的影响
2010-06-12祖艳群陈海燕
冯 源, 祖艳群, 陈海燕, 李 元
(云南农业大学资源与环境学院,昆明 650201)
在过去30多年间,随着工业的发展,大量氯氟烃类合成物、氮氧化合物等向大气逸散,致使平流层中臭氧层的破坏不断加速,导致到达地表的UV-B辐射(280~320nm)显著增加[1]。虽然 UV-B辐射在太阳短波辐射中所占量较小,但却能有效地被一些生物大分子,如核酸、蛋白质等物质吸收,从而对生物造成伤害。UV-B辐射不仅对植物、动物及人类产生显著影响,也会导致微生物数量和生命活动发生明显变化。UV-B辐射可影响植物病原菌的生长发育、生理生化特性,导致植物病原菌对植物的致病力发生改变,从而间接影响植物病害严重度及病害循环过程[2]。UV-B辐射增强对植物病菌生长、生理及致病力等方面的显著影响已在烟草苷菌(Plectosporiumalismatis)[3]、西瓜炭疽病菌(Colletotrichumorbiculare)[4]等病菌的研究中得到证实。而且,同植物一样,病菌也表现出不同的UV敏感性差异[5]。
灯盏花[Erigeronbreviscapus(Vant.)Hand.-Mazz.]是菊科飞蓬属多年生草本植物,以全草入药,具有散寒解表、活血舒筋、止痛、消积等功效[6]。近年来,随着大面积的人工栽培,灯盏花叶斑病日益严重。对云南省几个主要的灯盏花栽培区进行调查结果表明,链格孢菌[Alternariaalternata(Fr.)Keissler]为灯盏花叶斑病的致病菌[7]。目前,国内外对于链格孢菌的研究报道较多,多偏重于分类和系统发育研 究[8-9],有的已深 入 到 分子水平[10-11],而对于链格孢菌的UV光生物学研究较少。本文首次将环境因子UV-B辐射与灯盏花叶斑病致病菌——链格孢菌相联系,研究UV-B辐射增强对该菌生长、生理及致病力的影响,初步探讨链格孢菌对UV-B辐射增强的响应机制,为灯盏花绿色无污染防病技术的完善与发展提供一定的理论依据。
1 材料与方法
1.1 供试菌种
2007-2008年的6-9月,在云南生物谷灯盏花药业有限公司的灯盏花繁育基地进行灯盏花叶斑病的病情调查。同时,采集受害植株样本,于实验室内进行病原真菌的分离、纯化及种类鉴定。根据病菌的形态特征及柯赫氏法则的致病性检验,并参照《真菌鉴定手册》[12]与《中国真菌志第十六卷链格孢属》[13],确 定 其 为 链 格 孢 菌 [Alternariaalternata(Fr.)Keissler]。
1.2 UV-B辐射处理
模拟UV-B辐射使用40WUV-B灯管(280~320nm,上海),灯管用0.08mm乙酸纤维素膜包被,以去除小于290nm的短波辐射。用紫外辐射仪(北京师范大学光电仪器厂生产)测定UV-B辐射强度。设3个 UV-B辐射水平:0、5.0、10.0kJ/m2;3个 UV-B辐射处理时间:0、40、60min。根据培养皿与灯管之间的高度调节UV-B辐射强度。每处理5个重复。
用灭菌打孔器(d=6mm)在已活化的链格孢菌菌落边缘打取菌饼,接入马铃薯葡萄糖琼脂培养基(PDA)中央,置于25℃的培养箱中培养5d。之后,将敞开盖的培养皿置于UV-B灯管正下方,对链格孢菌进行UV-B辐射处理。辐射前,预开紫外灯30min,使其稳定。用灭菌打孔器(d=6mm)从经UV-B辐射处理过的菌落上打取菌饼,接入PDA培养基中央,用黑布包裹培养皿防止光复活,置于25℃培养箱中黑暗培养。
1.3 菌丝生长率测定与形态观察
分别在UV-B辐射后培养第1、3、5、7天按照十字交叉法测量菌落直径,计算菌丝生长率(%),并记录菌落形态变化。挑取培养7d的链格孢菌菌丝,于干净的载玻片上,加蒸馏水用盖玻片盖紧,于40倍显微镜下观察菌丝形态。
1.4 产孢量测定
用血球计数法[14]测定经UV-B辐射处理后培养7d的链格孢菌的产孢量。产孢量标准如下:100~102个/mL为稀少、103~105个/mL为中等、106~108个/mL为丰富,分别以“+、++、+++”表示。
1.5 菌丝干重测定
用灭菌打孔器(d=6mm)从经UV-B辐射处理过的菌落上打取菌饼,每个100mL PDA液体培养基的三角瓶中放入1块菌饼,置于25℃,140r/min条件下,每日定时振荡3次,每次2h,避光培养。培养7d后,培养液用已知重量的干燥定量滤纸过滤,最后于(80±2)℃烘干,测定菌落干重。同时,分别在培养后第1、3、5、7天取培养液,用2层无菌纱布过滤。滤液在3 000r/min离心20min,取上清液即粗酶液,置于4℃冰箱中保存,进行酶活测定。
1.6 纤维素酶活性测定
参考Abu-Sarra[15]的测定方法。以葡萄糖为材料绘制标准曲线(y=0.989 5x+0.027,R2=0.989 6)。反应体系包括0.5mL粗酶液和1.5mL的0.05mol/L柠檬酸缓冲液(含有0.5%羧甲基纤维素钠,pH=4.8),50℃下反应30min后,立即加入1.5mL二硝基水杨酸试剂(DNS)。反应液置于沸水浴中反应5min,冷却后加0.5mL去离子水,在540nm波长处测定吸光值。根据葡萄糖标准曲线计算生成的还原糖浓度。以上述反应条件下1min生成1mg葡萄糖所需的酶量为一个酶活单位(U),用U/mg·min表示。
1.7 过氧化氢酶(CAT)活性测定
参考 Aebi的测定方法[16],反应液体系包括30μL粗酶液、1.5mL 10mmol/L 磷酸缓冲溶液(pH=7.6)和1mL 20mmol/L H2O2,在240nm波长处测定吸光值。以上述反应条件下每min吸光值变化0.1为一个酶活单位(U),用 U/mg·min表示。
1.8 可溶性蛋白含量测定
参考Bardford[17]的测定方法。以牛血清白蛋白为材料绘制标准曲线(y=0.434 5x-0.014 3,R2=0.997)。反应体系包括0.5mL粗酶液和5mL考马斯亮蓝G-250蛋白质染色液,反应15min后,在595nm波长处测定吸光值。根据标准曲线计算样品中蛋白质含量(mg/mL)。
1.9 致病力测定
接种材料为云南生物谷灯盏花药业有限公司灯盏花繁育基地的灯盏花栽培品种。挑选具10~15片真叶、长势一致、健壮的灯盏花苗进行接种试验。用灭菌打孔器(d=6mm)在UV-B辐射处理后的链格孢菌菌落上打取菌饼,贴附在灯盏花的叶片中央。每片叶接种1块菌饼,每株接种8片叶。每处理3个重复,每重复测定10株。植株接种后置于25℃下,套袋保湿培养24h。之后,除去保湿袋,继续培养7d后测定病斑直径。
灯盏花叶斑病分级标准参考小麦链格孢叶枯病的病害分级[18]:0级,无症状;1级,病斑直径≤2mm;2级,病斑直径2.1~4mm;3级,病斑直径4.1~7mm;4级,病斑直径7.1~11mm;5级,病斑直径11mm以上。

1.10 统计分析
采用SPSS11.0软件,进行显著性差异分析(Duncan 检 验,p<0.05)。 利 用 Excel(Office 2003)软件作图。
2 结果与分析
2.1 链格孢菌菌落及菌丝形态的变化
经不同UV-B辐射处理过的链格孢菌在7d后的菌落形态变化见图1。经UV-B辐射增强处理的链格孢菌菌丝分布变得致密、紧凑;气生菌丝大量减少;黑色素增多,菌落颜色加深,逐渐变为黑褐色;菌落变薄。
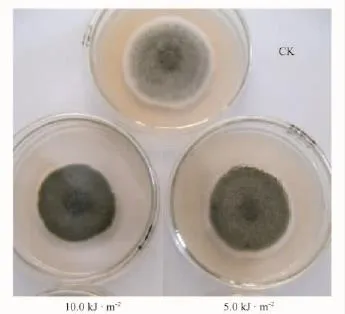
图1 经不同UV-B辐射处理的链格孢菌菌落形态变化
UV-B辐射增强对链格孢菌的菌丝形态可产生显著影响。如图2b所示,经UV-B辐射处理后的链格孢菌菌丝内颗粒状沉积物质增多,菌丝体变粗,颜色加深,菌丝表面凸凹不平,呈结节状。而正常生长的菌丝均匀透明,呈珊瑚状,细长而平滑(图2a)。
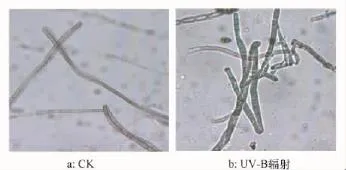
图2 UV-B辐射增强对链格孢菌菌丝形态的影响(40×)
2.2 链格孢菌菌丝生长率的变化
表1显示经UV-B辐射处理后1~7d内链格孢菌的菌丝生长变化。UV-B辐射增强导致菌丝生长明显滞后,对照组病菌的菌丝生长率最大值出现在辐射后培养第5天,而经UV-B辐射处理过的病菌菌丝生长率峰值出现在辐射后培养第7天。经UV-B辐射处理后1~5d内,随UV-B辐射增强,菌丝生长率显著下降(p<0.05)。在UV-B辐射后培养第7天,5.0kJ/m2辐射强度处理过的链格孢菌的菌落直径同对照之间没有显著差异(p>0.05),而高强度的 UV-B辐射(10.0kJ/m2)处理后的病菌菌落直径则显著下降(p<0.05)。同一UV-B辐射强度下,20~60min的辐射时间对菌丝生长的影响没有显著性差异(p>0.05)。
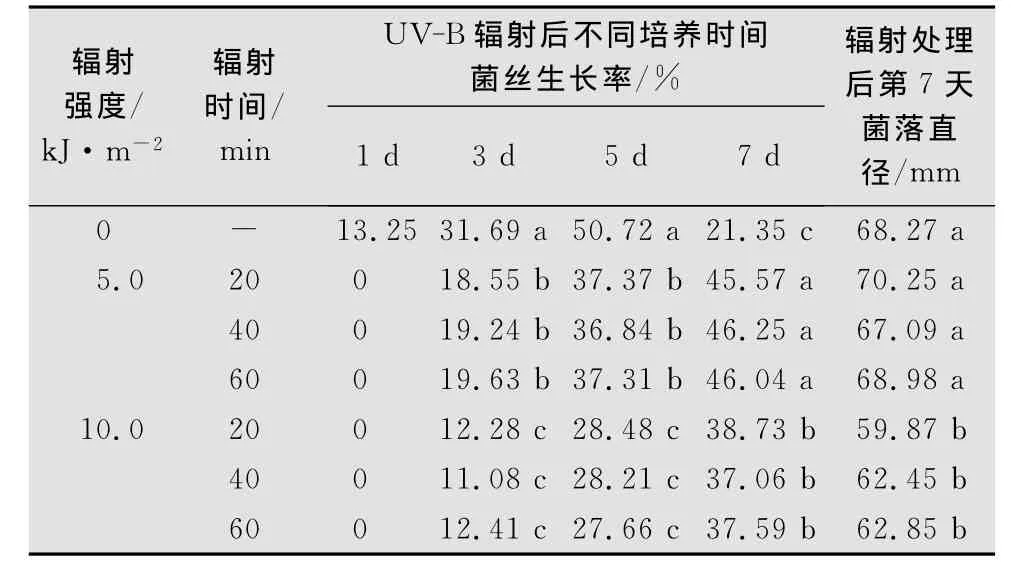
表1 UV-B辐射对链格孢菌菌丝生长率的影响1)
2.3 链格孢菌菌丝干重与产孢量的变化
由表2可知,随UV-B辐射强度的增加,链格孢菌的菌丝干重显著增加(p<0.05);病菌产孢量明显下降。同一UV-B辐射强度下,20~60min的处理时间对链格孢菌菌丝干重与产孢量的影响没有显著差异(p>0.05)。
2.4 链格孢菌纤维素酶活性的变化
在UV-B辐射增强条件下,病菌纤维素酶活性显著下降(p<0.05)(表3)。随处理后培养时间的延长,病菌纤维素酶活性逐渐升高。在处理后培养第7天,5.0kJ/m2强度处理过的链格孢菌纤维素酶活性同对照之间没有显著差异(p>0.05),经10.0kJ/m2强度处理过的病菌酶活显著降低(p<0.05)。同一UV-B辐射强度下,经20~60min的辐射处理,病菌酶活没有显著变化(p>0.05)。
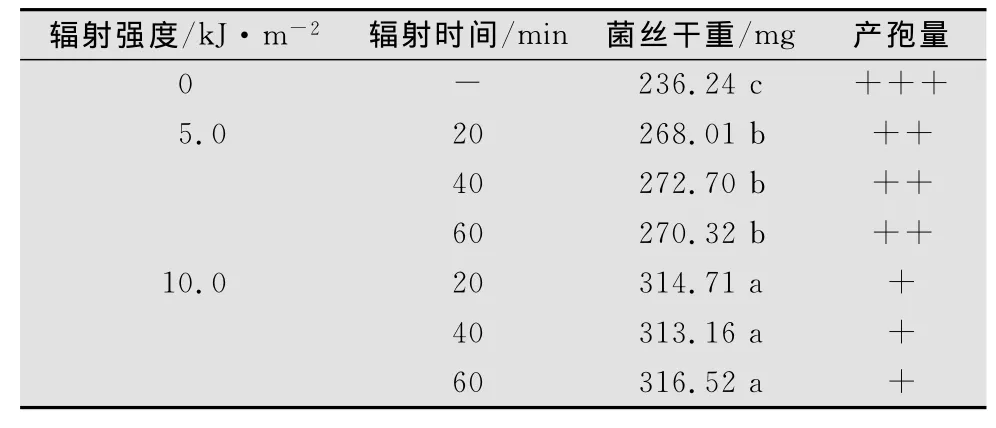
表2 UV-B辐射对链格孢菌菌丝干重与产孢量的影响1,2)
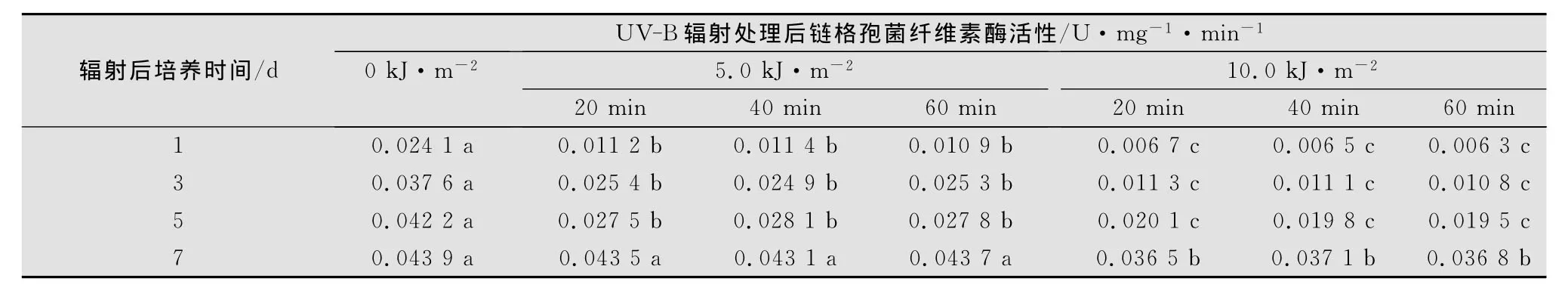
表3 UV-B辐射对链格孢菌纤维素酶活性的影响1)
2.5 链格孢菌过氧化氢酶(CAT)活性的变化
链格孢菌CAT活性表现出与纤维素酶活性不一致的UV-B辐射增强响应(表4)。随UV-B辐射强度的增加,病菌CAT活性显著升高(p<0.05)。随处理后培养时间的延长,病菌CAT活性表现出先上升后下降的变化规律,对照组酶活则持续升高。经10.0kJ/m2强度处理的病菌酶活高峰出现在处理后第3天;经5.0kJ/m2强度处理的链格孢菌CAT活性高峰出现处理后第5天。在处理后第7天,链格孢菌的CAT活性与对照之间没有显著差异(p>0.05)。同一UV-B辐射强度下,20~60min的辐射处理对链格孢菌的CAT活性没有显著影响(p>0.05)。
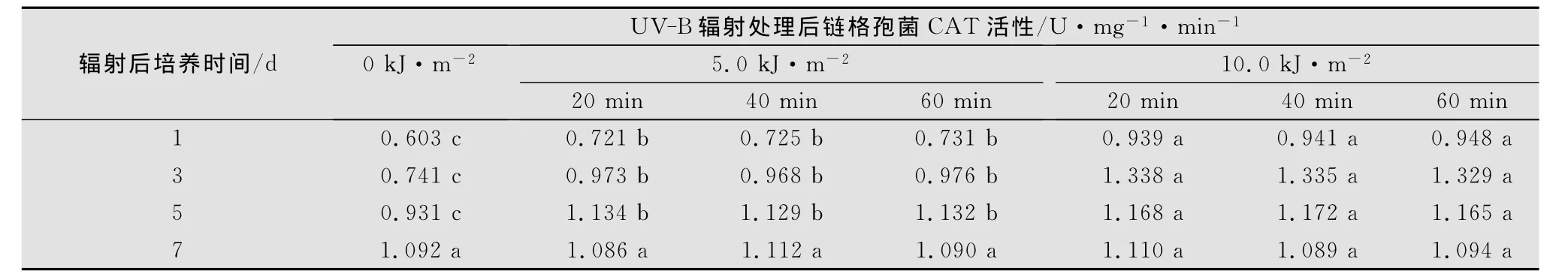
表4 UV-B辐射对链格孢菌CAT活性的影响1)
2.6 链格孢菌可溶性蛋白含量的变化
如表5所示,UV-B辐射增强条件下,链格孢菌可溶性蛋白含量显著降低(p<0.05)。随处理后培养时间的延长,病菌可溶性蛋白含量逐渐升高,但始终低于对照水平(p<0.05)。在处理后培养第5天,5.0kJ/m2与10.0kJ/m2辐射强度处理后的病菌可溶性蛋白含量之间没有显著差异(p>0.05)。同一 UV-B辐射强度下,经20~60min的辐射处理,链格孢菌的可溶性蛋白含量未发生显著变化(p>0.05)。
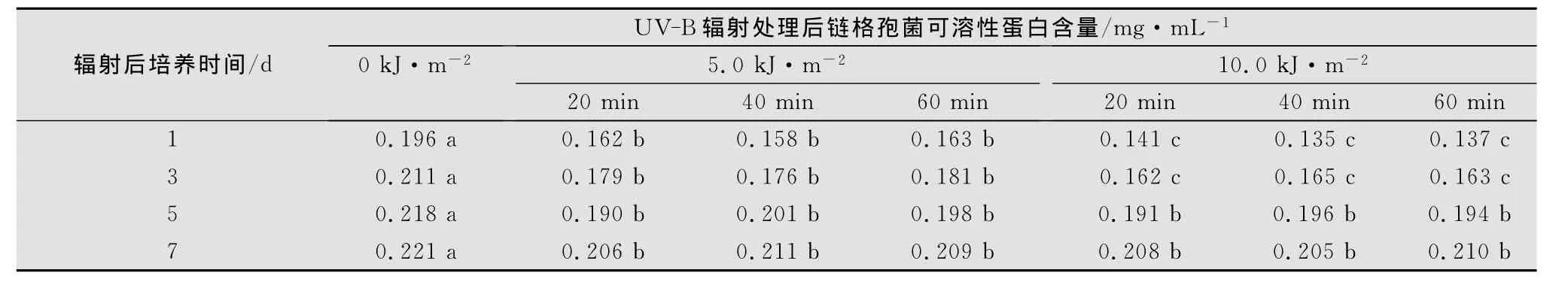
表5 UV-B辐射对链格孢菌可溶性蛋白含量的影响1)
2.7 链格孢菌致病力的变化
用经UV-B辐射增强处理过的链格孢菌进行人工接种试验,结果表明,灯盏花叶斑病的病情指数随UV-B辐射增强而显著下降(p<0.05)(图3)。这表明UV-B辐射增强导致链格孢菌的致病力显著下降。同一UV-B辐射强度下,对链格孢菌进行20~60min的辐射处理,对病菌的致病力没有显著影响(p>0.05)。
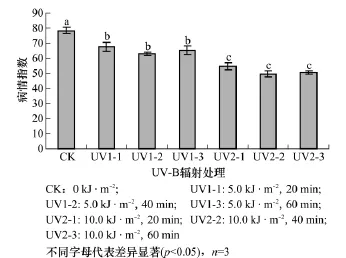
图3 UV-B辐射增强对灯盏花叶斑病病情指数的影响
3 结论与讨论
3.1 UV-B辐射增强对链格孢菌生长、生理及致病力的影响及机理
本试验发现,UV-B辐射增强可延缓链格孢菌的菌丝生长,导致病菌菌落及菌丝形态显著改变,菌落直径及产孢量显著下降。在对番茄早疫病菌(Alternariasolani)[19]、禾旋孢腔菌(Cochliobolussativus)[20]等病菌的研究中也得到了相似的结论。链格孢菌的纤维素酶活性、CAT活性及可溶性蛋白含量均产生不同程度的UV-B辐射增强响应。UV-B辐射对病菌生理生化特性的影响是导致其生长发生显著变化的主要原因之一[21]。纤维素酶是植物病菌重要的胞壁降解酶之一,链格孢菌纤维素酶活力的减弱也会对病菌的致病力产生显著的影响。链格孢菌CAT活性的变化是UV-B辐射下活性氧积累所致,链格孢菌的UV-B辐射损伤可能与活性氧引起的氧化胁迫有关[22]。紫外线作为诱变剂主要对生物大分子DNA产生诱变作用,造成基因突变,这必然影响蛋白质的合成,引起蛋白质含量的变化[21]。UV-B辐射增强对链格孢菌的生长及生理的损害作用是导致病菌致病力显著下降的主要原因。
病菌对UV-B辐射的响应同时受UV-B辐射强度与辐射时间两因素的影响,相同波长的UV-B作用效应主要取决于其剂量率(单位时间内的UV-B辐射强度)[22]。UV-B辐射对病菌的作用具有一定的累积效应,只有当剂量率达到或超过一定的阈值,UV-B辐射对链格孢菌的损伤效应才表现出显著的变化。而且,这也同链格孢菌自身的UV-B敏感性有关[2]。
3.2 链格孢菌对UV-B辐射增强的响应机制
链格孢菌采取形态学上的变化来抵御UV-B辐射增强的伤害。病菌通过改变菌落面积与菌丝密度,促进菌丝内颗粒状沉积物的分泌,增加菌丝干重,来调节 UV-B辐射对其的穿透力[22-23]。在逆境中,黑色素化的细胞壁层是病菌与环境间的一道屏障。病菌通过在体内合成大量黑色素来有效地吸收紫外光,将光能量转移到其分子结构中,使细胞免受紫外光的伤害[24]。UV辐射主要通过促进黑色素合成基因的表达与转录,来调控病菌体内黑色素的合成[25]。
同植物一样,病菌也会产生生理生化上的适应机制,来抵御UV-B辐射的伤害。UV-B辐射增强导致链格孢菌体内CAT活性显著上升,清除体内活性氧自由基,降低UV-B造成的光氧化伤害。病菌抗氧化酶活性的变化与UV-B剂量率呈正相关[22]。病菌的DNA在受到UV-B损伤的同时,也在进行自我修复。从链格孢菌的菌丝生长率、纤维素酶及CAT活性的时间变化可以看出,经UV-B辐射后予以一定的恢复时间,链格孢菌的生长及其生理活性均有一定程度的提高。链格孢菌对低UV-B辐射强度(5.0kJ/m2)损伤的自我修复作用更为明显。
[1]Caldwell MM,Bornman J F,Balla're C L,et al.Terrestrial ecosystems,increased solar ultraviolet radiation,and interaction with other climate change factors[J].PhotocheMPhotobiol Sci,2007,6(3):252-266.
[2]冯源,高召华,祖艳群,等.紫外辐射对植物病害影响的研究进展[J].植物保护学报,2008,35(1):88-92.
[3]Texier S,Davy M,Cliquet S.Culture age impactsPlectosporiumalismatispropagule yields and subsequent desiccation and UV-radiation tolerance[J].Biocontrol Sci Technol,2009,19(3):277-288.
[4]Ghajar F,Holford P,Cother E.Effects of ultraviolet radiation,simulated or as natural sunlight,on conidiuMgermination and appressoriuMformation by fungi with potential as mycoherbistats[J].Biocontrol Sci Technol,2006,16(5):451-469.
[5]Sandra A M,Kevin K N,Peter G A,et al.Variation in the responses of litter and phylloplane fungi to UV-B(290-315 nm)[J].Mycol Res,1999,103(11):1469-1477.
[6]董顺福,韩丽琴,刘建华,等.灯盏花总黄酮与微量元素含量分析及其药效机理的研究[J].时珍国医国药,2007,18(12):76-84.
[7]林丽飞,胡先奇,刘春国.灯盏花叶斑病病原物的分离与鉴定[J].植物保护,2006,32(4):92-93.
[8]Barry MP,Robert L G.Molecular phylogenetic relationships amongstAlternariaspecies and related fungi based upon analysis of nuclear ITS and mt SSU rDNA sequences[J].Mycol Res,2000,104(11):1312-1321.
[9]Roberts R G,Reymond S T,Andersen B,et al.RAPD fragment pattern analysis and morphological segregation of smallsporedAlternariaspecies and species groups[J].Mycol Res,2000,104(2):151-160.
[10]常缨,王义权,强胜.链格孢菌菌株致病性及其遗传差异[J].应用与环境生物学学报,2005,11(4):486-489.
[11]Peever T L,Su G,Carpenter-Boggs L,et al.Molecular systematics of citrus-associatedAlternariaspecies[J].Mycologia,2004,96(1):119-134.
[12]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:566.
[13]张天宇.中国真菌志第十六卷链格孢属[M].北京:科学出版社,2003:30-36.
[14]方中达.植病研究方法[M].北京:中国农业出版社,1998:153-154.
[15]Abu-Sarra A F.Changes in pectinesterase,polygalacturonase and cellulase activity during mangofruit ripening[J].J Hort Sci,1992,67(4):561-568.
[16]Aebi H.Catalase in vitro[J].Meth Enzymol,1984,105:121-126.
[17]Bardford MM.A rapid and sensitive method for the quatination of micrograMquantities of protein utilizing the principle of protein-dye-binding[J].Anal Biochem,1976,72:248-254.
[18]商鸿生,王春红,王树权.小麦链格孢叶枯病的病原学研究[J].植物病理学报,2000,30(2):129-132.
[19]Fourtouni A,Manetas Y,Christias C.Effects of UV-B radiation on growth,pigmentation,and spore production in the phytopathogenic fungusAlternariasolani[J].Can J Bot,1999,76(12):2093-2099.
[20]Arabi MI E,Jawhar M.Germinability ofCochliobolussativusconidia exposed to solar radiation[J].Phytopathol,2003,151(11-12):620-624.
[21]施翠娥,童贯和.紫外线对黑曲霉生长及某些生理活性的影响[J].淮南师范学报,2008,10(51):13-15.
[22]吴芳芳,郑有飞,胡正华,等.UV-B辐射增强对苹果炭疽菌生长特性及其过氧化氢酶活性的影响[J].生态环境,2008,17(1):158-162.
[23]Ruan L,Yu Z,Fang B,et al.Melanin pigment formation and increased UV resistance inBacillusthuringiensisfollowing high temperature induction[J].Syst Appl Microbiol,2004,27(3):286-289.
[24]Raviv M,Antignus Y.UV Radiation effects on pathogens and insect pests of greenhouse-grown crops[J].PhotocheMPhotobiol,2004,13(4):708-717.
[25]Junichi K.Studies on photomorphogenesis in a phytopathogenic fungus induced by near-ultraviolet radiation[J].Plant Pathol,2004,70(6):388.
