柔肝消癥饮对肝硬化大鼠结缔组织生长因子表达的影响
2010-06-01张一昕杨牧祥于文涛李保义崔永昌高玮
张一昕 杨牧祥 于文涛 李保义 崔永昌 高玮
肝纤维化的特征是肝细胞增殖和细胞外基质(ECM)聚集,并需转化生长因子 β1(TGF-β1)参与,CTGF是 TGF-β1的下游效应介质,具有介导TGF-β1促细胞外基质沉积的作用,阻断CTGF可抑制TGF-β介导的 ECM产生[1]。柔肝消癥饮是根据中医理论及多年临床观察筛选的治疗肝硬化的效方,既往药效学实验已证实柔肝消癥饮具有显著的保护肝功能、抗肝硬化作用[2,3]。为了探讨其作用机制,课题组观察了柔肝消癥饮对肝硬化大鼠肝组织CTGF表达变化的影响。
1 材料
1.1 实验动物 清洁级SD大鼠60只,雌雄各半,体重180~200 g,由华中科技大学同济医学院实验动物学部提供,动物合格证号:SCXK(鄂)2004-007。
1.2 药物 柔肝消癥饮组成:由香附、青皮、炙黄芪、炒白术、白芍、三棱、莪术、地鳖虫、郁金、姜黄、丹参等药物组成,水煎浓缩成所需浓度的药液。复方鳖甲软肝片:由内蒙古福瑞中蒙药科技股份有限公司生产,批号国药准字Z19991011,实验时用蒸馏水配制成所需浓度的药液。
1.3 主要试剂 CTGF抗体购自武汉博士德生物工程有限公司),3%H2O2液、0.01M枸橼酸缓冲液、二抗工作液、链酶素卵白素、DAB显色剂等均购自北京中杉生物技术有限公司。
1.4 主要仪器 LEICA RM2125型切片机、VANOXAHB-L型OLYMPUS万能显微镜、Nikon显微照相机、HPIAS-1000病理图像分析系统。
2 方法
2.1 模型制备 60只大鼠适应性喂养1周,随机分为造模组48只和正常组12只。参照相应文献[3,4]48只造模组大鼠首次予皮下注射40%CCL4花生油溶液0.5 ml/100 g体重,以后每周2次皮下注射0.3 ml/100 g体重,共9周。造模开始前2周均以20% 猪油、0.5%胆固醇、79.5%玉米面混合饲料(由河北医科大学动物实验中心加工)喂养,第3~9周以0.5%胆固醇和99.5%玉米面混合饲料(由河北医科大学动物实验中心加工)喂养。整个造模期间以30%乙醇作为饮料让大鼠自由饮用。正常组则以正常饲料和纯净水喂养。实验9周末确认造模成功后予以分组治疗。
2.2 分组与治疗 造模结束后,正常组随机抽取大鼠10只,将造模成功大鼠随机抽取40只,并分为4组,每组10只,雌雄各半。即:①正常对照组(简称正常组):灌服生理盐水;②模型组:灌服生理盐水;③柔肝消癥高剂量组(简称高剂量组):每日用药剂量为2.5 g/100 g体重;④柔肝消癥低剂量组(简称低剂量组):每日用药剂量为1.25 g/100 g体重;⑤复方鳖甲软肝片对照组(简称对照组):每日用药剂量为0.056 g/100 g体重。各治疗组均将药物配制成所需浓度,1次/d灌胃,每次用药体积均按1 ml/100 g计算,共4周。
2.3 动物取材 治疗4周末,于最后一次给药后禁食12 h麻醉状态下腹主动脉取血后切开腹部,迅速剖取肝脏,取少许肝组织,用4%多聚甲醛固定。
2.4 指标检测
2.4.1 肝组织病理形态学观察 取用4%多聚甲醛固定的肝组织,常规石蜡包埋切片,HE染色,光学显微镜观察。
2.4.2 肝组织CTGF表达的免疫组化观察 CTGF的免疫组化法依照SABC试剂盒操作步骤进行。免疫组化染色结果判定:经DAB显色后,细胞胞浆中出现棕黄色反应产物者为CTGF免疫阳性。反应产物颜色浅、颗粒稀疏者为阳性信号弱;反应产物颜色深、颗粒密集者为阳性信号强。用Nikon显微照相系统对肝组织切片进行观察、照相,采用HPIAS-1000高清晰度彩色病理图象分析系统,在100×视野下每张切片取8个视野,测定平均灰度值作半定量分析。
3 结果
3.1 肝组织病理形态学改变 正常组大鼠肝组织结构完整、清晰,肝小叶结构正常,肝细胞排列规则成索状,在中央静脉周围呈放射状分布。肝血窦结构清晰,无异常改变。肝细胞呈多边形,胞浆均匀,细胞核形态正常。模型组大鼠肝小叶正常结构消失,间质内弥漫性淋巴细胞浸润。肝细胞体积明显增大,局部肝细胞出现严重的脂肪变性,可见到再生的肝细胞(双核)。肝间质广泛纤维组织增生,将正常肝小叶分割成大小不等的肝细胞团(即假小叶形成)。高剂量组肝小叶结构轻度受损,少数肝细胞气泡样变性,较少炎性细胞浸润,偶见坏死细胞,少量纤维组织增生,但未见形成间隔。低剂量组肝小叶结构被破坏,部分肝细胞气泡样变性并伴有细胞坏死,较多淋巴、单核细胞浸润,纤维组织增生,但较少形成间隔。对照组与低剂量组基本相似。
3.2 柔肝消癥饮对肝硬化大鼠肝组织CTGF表达的影响
免疫组织化学染色可见:正常组大鼠肝组织CTGF有少量表达,而模型组大鼠肝组织阳性细胞的表达则呈弥散性分布,黄染颗粒主要位于细胞浆中。各用药组大鼠肝组织阳性细胞的表达则呈散在性分布,且分布明显少于模型组,而高、低剂量组大鼠肝组织阳性细胞的表达少于对照组。
半定量分析显示:模型组大鼠肝组织CTGF表达的光密度值明显高于正常组(P<0.01)。经用药干预后,各用药组大鼠肝组织CTGF表达的光密度值均低于模型组(P<0.01)。其中,高、低剂量组低于对照组(P<0.01);高剂量组低于低剂量组(P<0.05)。结果详见表1。
4 讨论
肝硬化在古代医籍中无此病名及相关的描述,根据其临床表现可归属于中医学的“胁痛”、“积聚”、“臌胀”等病证范畴。中医学认为本病多由酒食不节,损伤脾胃,脾失健运,壅阻气机,肝失条达,气血郁滞,或情志抑郁,肝失疏泄,气郁日久,血流不畅,瘀血停积,胁络痹阻所致。其病位在肝脾两脏,主要病机为肝郁脾虚、气滞血瘀。故当以疏肝健脾,行气活血,逐瘀消癥为主要治法。课题组经多年临床观察,精心筛选相关药物组成“柔肝消癥饮”。方中香附、青皮疏肝理气;炙黄芪、炒白术健脾益气;三棱、莪术、土鳖虫、丹参、郁金、姜黄,破血行气,逐瘀消癥;白芍养血柔肝,既可助香附、青皮疏肝解郁之力,又可防止破血太过之弊;诸药合用,共奏疏肝健脾,行气活血,逐瘀消癥之功效。
表1 各组大鼠肝组织CTGF的表达情况(±s)
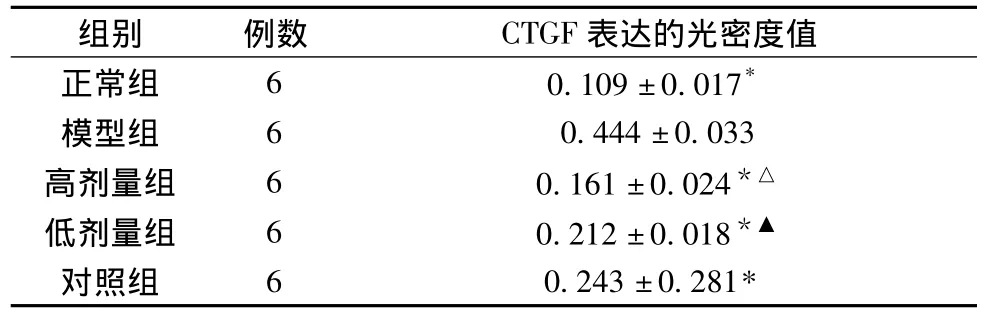
表1 各组大鼠肝组织CTGF的表达情况(±s)
注:与模型组比较:*P<0.01;与对照组比较:△P<0.01;与高剂量组比较:▲P<0.05
表达的光密度值正常组 6 0.109±0.017组别 例数 CTGF*模型组 6 0.444±0.033高剂量组 6 0.161±0.024*△低剂量组 6 0.212±0.018*▲对照组 6 0.243±0.281*
CTGF是一种C端富含半胱氨酸的分泌多肽,属即刻早期基因CCN家族,是一重要的促组织纤维化蛋白,具有有丝分裂原效应,促进血管平滑肌等细胞增殖;在其他细胞因子的协同作用下刺激细胞外基质的合成,抑制其降解,导致ECM的聚集及结构改建,表达细胞粘附分子。TGFβ1是导致组织纤维化形成的最重要的细胞因子之一,CTGF为其下游效应介质,TGF-β1作用于CTGF的启动子区域刺激CTGF的合成分泌,CTGF则通过直接作用于星形胶质细胞和结缔组织刺激细胞外基质的分泌介导 TGF-β1致纤维化的作用[5]。本实验结果表明,模型组大鼠肝组织CTGF的表达明显高于正常组,经药物治疗后的肝硬化大鼠肝组织内纤维组织减少,CTGF表达也随之减少,显示该方剂治疗肝硬化化可能与降低CTGF表达,抑制HSC活化增殖转化为成纤维细胞和肌成纤维样细胞,特异性地阻断TGF-β致纤维化的负面效应有关,这可能是其治疗肝硬化的作用机制之一。
[1]QiW,Chen X,Twigg S,et al.Tranilast attenuates connective tissue growth factor-induced extracellularmatrix accumulation in renal cells.Kidney Int,2006,69(6):989.
[2]杨牧祥,张一昕,王少贤,等.柔肝消癥饮对肝硬化大鼠肝功能的影响.中医药通报,2007,6(3):58-59.
[3]杨牧祥,张一昕,王少贤,等.柔肝消癥饮对肝硬化大鼠肝组织病理形态学和肝细胞超微结构的影响.中西医结合肝病杂志,2008,18(1):38-42.
[4]Shi B,Yang Z,Zhang L,et al.The association of expression CTGF in cirrhotic liver tissue and procogene c-fos,c-mand child-pugh grade.Chin J Surg,2001,39(6):466-468.
[5]Sun K,Wang Q,Huang XH.PPAR gamma inhibits growth of rathepatic stellate cells andTGF beta-induced connective tissue growth factor expression.Acta PharmacolSin,2006,27(6):715.
