SDS法和CTAB法提取蜡梅DNA质量的比较
2009-11-29周明芹
周明芹
(长江大学园艺园林学院,湖北 荆州,434025)
SDS法和CTAB法提取蜡梅DNA质量的比较
周明芹
(长江大学园艺园林学院,湖北 荆州,434025)
采集6个蜡梅(Chimonanthuspraecox(L.) Link.)单株的新鲜嫩叶,分别采用SDS和CTAB的微量法提取基因组DNA,取适量的该DNA进行琼脂糖凝胶电泳,并利用紫外分光光度计测定所提取的DNA在260 nm和280 nm的光密度值及比值,以及利用EcoR I和MseI双酶切后进行AFLP标记。结果表明,2种方法均能从蜡梅中提取出一定量的比较完整且纯度比较高的基因组DNA,但用CTAB法提取的蜡梅基因组DNA的纯度更高、质量更好。
蜡梅(Chimonanthuspraecox(L.) Link.);DNA的提取;SDS;CTAB
蜡梅(Chimonanthuspraecox(L.) Link.)为蜡梅科蜡梅属,是我国特有的名贵花木之一。冬令开花、黄冠晶莹、清丽淡雅、花香沁人、色香形俱佳,为人们所钟爱,是园林与庭院绿化、美化、香化以及室内装饰的名贵花木和特用经济树种之一。同时,蜡梅品种颇多,适应性强,分布和栽培广泛。然而,关于蜡梅的研究,国内外报道的不多,特别是在分子领域的研究更少。本研究采用十二烷基磺酸钠(SDS)和十六烷基三乙基溴化铵(CTAB)法分别提取了蜡梅的DNA,并对提取的DNA的质量进行比较分析,旨在为后续分子水平的研究奠定基础。
1 材料与方法
1.1 材料
所采用的6个样品的新鲜嫩叶均来源于长江大学校园内的蜡梅植株。
1.2 DNA的提取方法
(1)CTAB微量法 参照Loh等[1]的方法并加以改良来提取蜡梅叶片基因组DNA。具体步骤如下:①称取0.2 g新鲜的嫩叶片,于液氮中研磨至粉末,迅速转移到1.5 mL离心管中;②加入800 μL 65 ℃预热的2× CTAB提取液〔含有2%(w/v)CTAB、100 mmol/L Tris-HCl(pH 7.5)、50 mmol/L EDTA(pH8.0)、1.4 mol/L NaCl〕,65 ℃水浴45 min;③10 000 r/min离心12 min后,取上清液加入等体积的氯仿∶异戊醇(24∶1),充分混匀,冰上静置10 min;④重复步骤②;⑤10 000 r/min离心12 min,取上清液,加入等体积的异丙醇于-20 ℃沉淀DNA 20 min;⑥10 000 r/min离心10 min,取沉淀,用75%的乙醇清洗沉淀3次,每次30 min;⑦用适量的TE溶解DNA,并加入5 μL RNaseA于37 ℃水浴30 min消化RNA;⑧加入等体积的氯仿∶异戊醇(24∶1)抽提2次;⑨用2倍体积95%乙醇和1/10体积的3 mol/L醋酸钠沉淀DNA;⑩用75%的乙醇清洗DNA 3次;自然干燥后,加100 μL的TE溶解DNA。
(2)SDS微量法 步骤同上述CTAB法,只是改用SDS的提取缓冲液(0.1 mol/L NaAc(pH5.2)、0.05 mol/L EDTA、0.5 mol/L NaCl、2% PVP、1.4% SDS、0.5% β-巯基乙醇),抽提时加入2/3体积2.5 mol/L KAc(pH4.8),冰浴30 min。
1.3 DNA的质量检测
(1)取适量的DNA进行0.8%的琼脂糖凝胶电泳,检测DNA是否降解,并以λDNAHindIII/EcoR I为参照,估计DNA的分子量大小。
(2)用紫外分光光度计分别测定适量稀释的DNA样品在波长260、280 nm的光密度值D260、D280。利用D260计算DNA样品的浓度、D260/D280评价DNA样品的纯度。
(3)取500 ng CTAB法提取的总DNA,用EcoR I和MseI进行双酶切,然后进行AFLP(Amplified Fragment Length Polymorphism)标记。
2 结果与分析
2.1 DNA样品的纯度分析
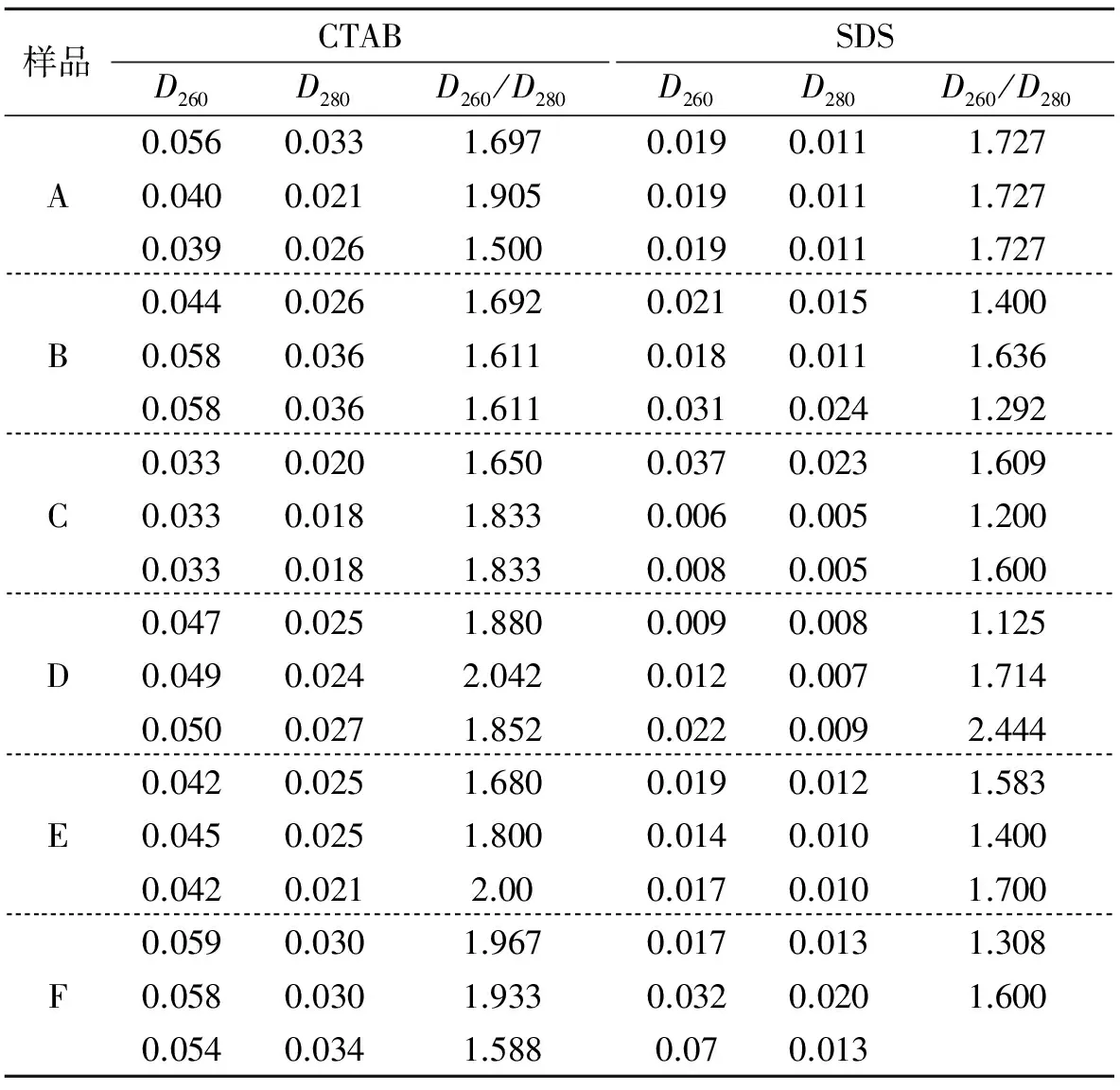
表1 SDS和CTAB法提取蜡梅DNA的D260、D280值及D260/D280Table 1 The values of D260,D280 and D260/D280 of the genomicDNA from Chimonanthus praecox extracted by SDS and CTAB respectively
注:表中列出的光密度值为所得DNA总量的光密度值
采用6个品种(A~F号样品),用SDS和CTAB法分别提取其DNA,并且设置3个重复,利用紫外分光光度计测定所得DNA的D260、D280值,并计算其D260/D280值。由表1可知,用CTAB法提取DNA的产率比采用SDS法要高许多,是SDS法的2~3倍;并且采用CTAB法提取DNA的D260/D280值相对较大,且多数在1.7与1.8之间,说明CTAB法更适合蜡梅DNA的提取,不仅提取的DNA产率较高,而且纯度也较高。
2.2 DNA的琼脂糖凝胶电泳分析
图1是采用CTAB法和SDS法提取的部分样品DNA在0.8%的琼脂糖凝胶上的电泳图谱。从图1可以看出,各个样品均有一条单一的信号强的均匀一致的主带,且几乎没有弥散现象,这表明2种提取方法均能得到一定量的比较完整总DNA。
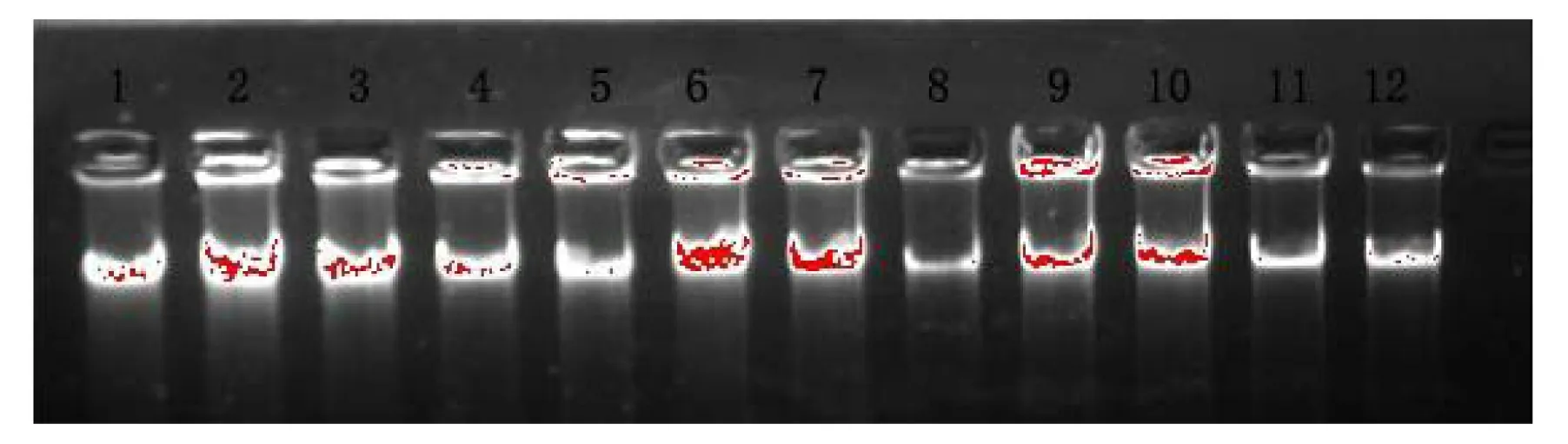
1~3、7~9道均为样品A的DNA;4~6、10~12道均为样品B的DNA;1~6道为CTAB法提取的DNA;7~12道为SDS法提取的DNA图1 部分样品DNA的琼脂糖电泳图谱Figure 1 The agarose gel electrophoresis for some DNA samples

图2 引物组合E-AAA/M-CAC对蜡梅种质的AFLP扩增结果Figure 2 The amplified bands of somesamples of Chimonanthus praecoxusing AFLP primer pairs E-AAA/M-CAC
2.3 酶切和AFLP标记结果分析
将酶切后的DNA样品连接接头后进行PCR扩增,然后取适量的扩增产物在1.5%的琼脂糖凝胶中电泳,每个样品均呈现出弥散的带型,这表明用CTAB法提取的总DNA能被EcoR I和MseI两种限制性内切酶完全切割,并且AFLP标记的聚丙烯酰胺凝胶电泳图谱条带清晰、带数多,大小主要集中在50~700 bp之间(图2)。
3 讨论
3.1 获得高纯度的DNA
在DNA水平的研究中,保证DNA的纯度很重要,也是最基本的,它直接影响到后续实验是否能顺利进行,影响到是否能获得最佳的可信的结果。多次使用氯仿抽提,能够有效地除去样品中的蛋白质,还能加速有机相与液相的分层,去除植物色素和蔗糖,在提取过程中能清楚地看到,采用CTAB法比SDS法能更有效地除去色素,液相由深绿色到绿色到无色。易干军等[2]在利用AFLP技术分析香蕉的种质资源时发现用SDS提取的DNA的纯度不CTAB法提取的高。王彩虹等[3]在利用AFLP技术研究苹果基因组时也报道用CTAB法提取的DNA的质量比SDS法好,产量也高些。于晓英[4]在研究大花萱草时也发现用SDS提取的DNA的纯度不如CTAB法提取的高。张潞生等[5]曾经报道弥猴桃叶片含多糖很多的植物,采用SDS法提取的DNA往往不能达到AFLP所要求的纯度,不仅内含杂质多,而且有部分发生降解,而采用较高浓度的CTAB(2%)和较高浓度的巯基乙醇(2%),通过氯仿的抽提,可以得到符合AFLP要求的DNA样品。在DNA沉淀过程中,沉淀的时间和温度对DNA的产率和质量也有很大的影响,沉淀的时间短会导致沉淀不完全,使产率下降,而低温与长时间的沉淀,很容易导致盐等杂质与DNA共沉淀,使DNA的纯度降低,从而影响以后的实验。本试验采用-20 ℃沉淀20 min,得到比较好的效果,既沉淀彻底又能保证质量。由于DNA是多聚阴阳离子的水溶性化合物,在沉淀时加入适量的NaAc有助于DNA析出,并且不会变性。
3.2 避免DNA的降解
在DNA的提取过程中,需要尽可能的保证DNA序列的完整性,主要从3个方面防止DNA的降解:(1)操作时动作要轻柔、温和,避免机械剪切,尽量在冰上操作,避免温度高导致降解;(2)防止Dnase的降解,通常采用加EDTA来螯合溶液中的镁离子、钙离子等来消除Dnase的活性;(3)防止有机溶剂如酚、氯仿等的降解。本试验的整个提取过程都是在冰上进行,不论是加入氯仿∶异物醇(24∶1)抽提还是加入异丙醇或95%的乙醇沉淀时,动作尽量温和,通过转动或上下颠倒离心管使之混匀。而且,实验中还发现,最终将DNA溶解在TE中比溶解在双蒸水中保存的时间长,不易降解些。
[1]Loh J P, Kiew R, Kee A,etal. Amplified fragment length polymorphism (AFLP) provides molecular markers for the identification ofCaladiumbicolorcultivars[J]. Ann Bot, 1999, 84: 155~161.
[2]易干军,于晓英,霍合强,等.香蕉种质资源的AFLP鉴别与分类中DNA模板的制备[J].果树学报,2001,18(6):345~348.
[3]王彩虹,王 倩,戴洪义,等.苹果基因组AFLP分析的DNA模板的制备及技术体系的建立[J].山东农业大学学报(自然科学版),2001,32(2):197~200.
[4]于晓英,吴铁明,彭尽睬,等.营草种质资源扩增片段长度多态性鉴别与分类的研究I.查草DNA模板的制备[J].湖南农业大学学报(自然科学版),2001,27(1):41~43.
[5]张潞生,李传友,贾建航,等.猕猴桃雌雄性别的AFLP鉴别中DNA模板的制备[J].果树科学,1999,16(3):171~175.
2009-04-15
周明芹(1978-),女,湖北荆州人,农学博士,讲师,主要从事园林植物种质资源的利用及分子生物学研究.
10.3969/j.issn.1673-1409(S).2009.03.013
Q503;Q959.747.2
A
1673-1409(2009)03-S042-03
