胃癌肝转移患者的预后分析及其生存列线图
2024-06-03李波王海玉何风霞张永臣郁金红
李波 王海玉 何风霞 张永臣 郁金红
[摘要] 目的 探討胃癌肝转移患者的临床特征和预后的危险因素。方法 从美国国家癌症研究所监测、流行病学和最终结果(Surveillance,Epidemiology and End Results,SEER)数据库选取2010—2015年7055例胃癌患者临床资料和生存情况,根据是否发生肝转移将患者分为胃癌肝转移组(901例)和胃癌无肝转移组(6154例),比较两组患者的基本临床特征。采用单因素和多因素Cox回归分析胃癌肝转移患者预后的影响因素,生存分析采用Kaplan-Meier法。结果 两组患者的年龄、性别、种族、T分期、N分期、原发灶手术、放疗、肿瘤直径比较,差异均有统计学意义(P<0.05);胃癌肝转移组患者的中位生存时间为6个月;胃癌无肝转移组为25个月。Cox回归分析证实,年龄(P=0.009)、肿瘤分化程度(P<0.001)、原发灶手术(P<0.001)及化疗(P<0.001)是影响胃癌肝转移预后的危险因素。结论 年龄、肿瘤分化程度、原发灶手术和化疗是胃癌肝转移的独立预后危险因素。基于年龄、肿瘤分化程度、原发灶手术、化疗构建的生存列线图对胃癌肝转移患者具有较好的预测意义。
[关键词] 胃癌;肝转移;预后分析;列线图
[中图分类号] R735 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.12.002
Analysis of prognostic factors of gastric cancer patients with liver metastases and establishment of a nomogram for survival prediction
LI Bo1, WANG Haiyu2, HE Fengxia3, ZHANG Yongchen1, YU Jinhong1
1.Department of Laboratory Medicine, the Second Hospital of Nanjing, Nanjing Hospital Affiliated to Nanjing University of Chinese Medicine, Nanjing 210003, Jiangsu, China; 2.Department of Oncology, the Second Hospital of Nanjing, Nanjing Hospital Affiliated to Nanjing University of Chinese Medicine, Nanjing 210003, Jiangsu, China; 3.Department of Pathology, the Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, Jiangsu, China
[Abstract] Objective To explore the clinical features and prognostic factors of gastric cancer patients liver metastasis. Methods Data from 7055 patients with gastric cancer were retrieved from Surveillance, Epidemiology and End Results (SEER) database between 2010 and 2015. The patients were divided into the liver metastases group (901 cases) and the non-liver metastases group (6154 cases) according to whether liver metastasis occurred. Univariate and multivariate Cox regression were used to analyze the prognostic risk factors, and the Kaplan-Meier method was used for survival analysis. Results There was a significant difference in age, gender, race, T stage, N stage, primary surgery, radiotherapy and tumor size between the two groups (P<0.05), and the median survival time of patients in the liver metastases group was 6 months, non-liver metastases group was 25 months. Cox regression analysis showed that age (P=0.009), tumor grade (P<0.001), surgery (P<0.001) and chemotherapy (P <0.001) were the main factors affecting the prognosis of gastric cancer with liver metastases. Conclusion Age, tumor grade, surgery and chemotherapy were the prognostic risk factors for gastric cancer with liver metastases. A nomogram based on age, tumor grade, surgery and chemotherapy has a good survival prediction significance for gastric cancer with liver metastases.
[Key words] Gastric cancer; Liver metastases; Prognostic analysis; Nomogram
目前,胃癌是世界上第五大常见肿瘤,是肿瘤相关死亡的第三大原因[1-2]。胃癌发病率最高的地区是东北亚、南美洲和中美洲及东欧地区[3-4]。在日本和韩国,胃癌是男性最常见的癌症;在中国,胃癌是癌症相关死亡的主要原因之一[3-5]。尽管目前的诊疗技术和治疗方法提高了胃癌的治疗效果,但未经系统化疗的胃癌肝转移患者的中位生存时间仅为2个月[6]。因此,分析胃癌肝转移的临床特征及危险因素对患者的治疗和预后具有一定的指导意义。本研究通过对美国国家癌症研究所监测、流行病学和最终结果(Surveillance,Epidemiology and End Results,SEER)数据库中胃癌患者的临床资料进行回顾性分析,探讨胃癌肝转移预后及相关危险因素,为进一步改善胃癌肝转移患者的预后提供参考。
1 资料与方法
1.1 一般资料
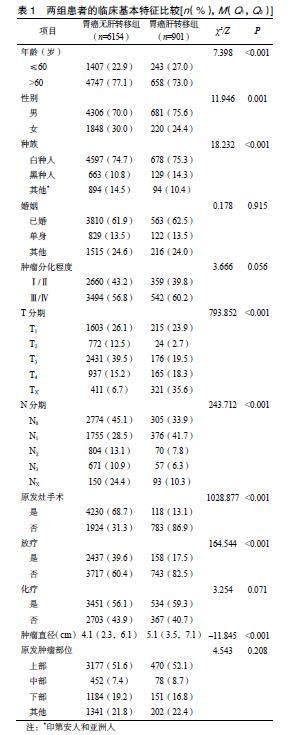
以ICD-O-3/WHO 2008中8140/3为标准,从SEER?Stat(8.4.0.1)软件中下载2010—2015年病理组织学诊断为胃癌的患者的临床数据。本研究共纳入7055例患者,根据是否发生肝转移,分为胃癌肝转移组(901例)和胃癌无肝转移组(6154例)。患者的诊断年份、年龄编码、种族编码、性别、婚姻状况、原发部位、诊断确认、AJCC T/N分期[7]、原发部位手术、肿瘤直径、放射治疗编码、化疗编码、转移情况、存活月数、生存状态编码均来源于数据库。
1.2 纳入及排除标准
纳入标准:①ICD-O-3编码为8140/3;②具有阳性病理报告;③肿瘤分化程度为Ⅰ、Ⅲ、Ⅲ、Ⅳ;④发生肝转移。排除标准:①生存时间及生存状态未知;②种族、年龄及婚姻状态未知;③肿瘤直径未知或无法获得;④发生肺转移、骨转移和脑转移。
1.3 研究變量与结局
本研究纳入的变量有年龄、性别、种族、婚姻、原发肿瘤部位、分化程度、T分期、N分期、原发灶手术、化疗、放疗、肿瘤直径。结局指标为总生存(overall survival,OS)。
1.4 统计学方法
采用SPSS 25.0、GraphPad Prism 8.0.2和STATA 15.0统计学软件对数据进行处理分析。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验;计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U非参数秩和检验。采用Kaplan-Meier法绘制生存曲线和Log-rank检验。采用单因素和Cox回归分析筛选胃癌肝转移患者预后的相关因素,并绘制列线图。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基本特征比较
胃癌肝转移组中男681例(75.6%);肿瘤分化程度Ⅲ/Ⅳ级542例(60.2%);无原发部位手术783例(86.9%);肿瘤以上部为主(52.1%)。胃癌无肝转移组中男4306例(70.0%);肿瘤分化程度以Ⅲ/Ⅳ级为主,无原发部位手术1924例(31.3%);肿瘤以上部为主(51.6%)。两组患者在婚姻状态、肿瘤分化程度、肿瘤位置及化疗方面比较,差异无统计学意义(P>0.05);性别、种族、年龄、T及N分期、原发灶手术、肿瘤直径和放疗基本特征比较,差异均有统计学意义(P<0.05),见表1。
2.2 生存分析
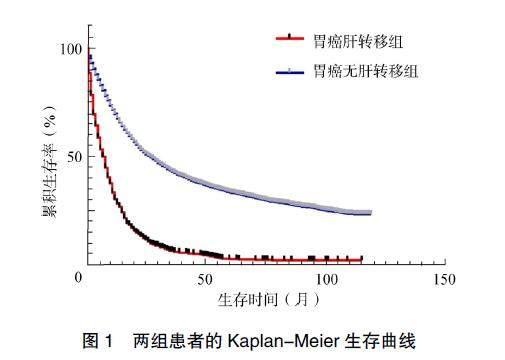
Kaplan-Meier生存分析显示,胃癌肝转移组患者中位生存时间6个月(95%CI:5.21~6.79);1年、3年和5年生存率分别为28.6%、5.4%、1.9%。胃癌无肝转移组患者中位生存时间为25个月(95%CI:23.67~26.33);1年、3年和5年OS率分别为68.5%、41.1%、25.7%。胃癌肝转移组患者OS率显著低于胃癌无肝转移组,差异有统计学意义(χ?=1072.308,P<0.001),见图1。
2.3 胃癌患者肝转移的预后危险因素分析
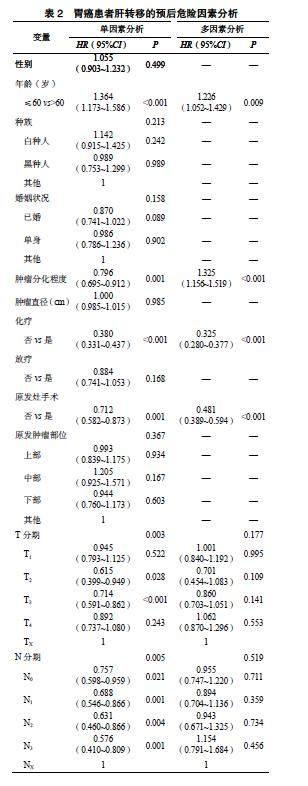
单因素分析结果显示,年龄、肿瘤分化程度、原发灶手术、化疗、T分期及N分期与胃癌肝转移患者的预后有关,差异均有统计学意义(P<0.05)。多因素分析显示,年龄、肿瘤分化程度、原发灶手术、化疗为胃癌肝转移预后的影响因素(P <0.05),见表2。
2.4 生存列线图建立及内部验证
根据多因素Cox回归分析结果中筛选的4个影响因素绘制列线图预测模型,见图2。通过列线图对每个变量进行评分后将每个变量的数值相加即得到总分,根据总分即可得出胃癌患者发生肝转移后1年和2年的OS率。胃癌肝转移预测的列线图显示化疗对胃癌肝转移的预后影响最大。模型组C指数为0.6621(95%CI:0.6406~0.6835),说明该模型具有良好的预测效能。1年和2年OS率校准曲线表明列线图预测的生存结果与实际生存结果一致。
3 讨论
胃癌是一种常见的恶性肿瘤,最常见的转移方式之一是肝转移[8-10]。肝转移是胃癌患者预后不良的重要因素[11-13]。Lee等[14]研究发现胃癌肝转移的患者在没有系统有效的治疗下生存率为3~5个月。
究發现胃癌患者肝转移的中位生存时间为6个月,其生存时间低于胃癌无肝转移组患者,与上述研究结果一致[14]。因此,通过构建胃癌患者肝转移预后的列线图有助于医生为患者提供更有效的治疗方案,提高患者的生存质量和生存率。
化疗主要通过药物的作用直接杀死或抑制癌细胞的生长,进一步控制胃癌肝转移的进展。同时,化疗也可减轻患者的症状,提高其生活质量。Li等[15]研究证实化疗在改善胃癌肝转移的预后中发挥重要作用。Qiang等[11]研究发现肝动脉灌注联合全身化疗对胃癌肝转移的治疗具有安全性,且可有效延长患者的生存时间。本研究发现未接收化疗的胃癌肝转移患者的预后较差,也说明系统化疗可有效延长患者的生存时间。
目前,外科手术切除在胃癌肝转移治疗中存在争议。Gao等[16]研究发现手术在胃癌肿瘤特异性生存(cancer-specific survival,CSS)和OS曲线上都具有显著的生存优势,手术组CSS均值为11个月,而非手术组为9个月。Marte等[6]研究结果显示肝切除术治疗胃癌肝转移可延长患者的生存时间,1年、3年和5年OS率分别为72%、37%和26%。但欧洲医学肿瘤学协会报告称,转移性切除对患者并没有好处[17]。本研究发现无手术是胃癌肝转移预后的危险因素。对于局限性的肝转移和适宜手术的患者,外科手术切除可提供根治的机会,并带来较好的生存率和生活质量,对广泛分布的转移和不适宜手术的患者,其他治疗方法如化疗、放疗和靶向治疗可能更为合适[18-20]。总之,外科手术切除在胃癌肝转移治疗中被认为是一种重要而有效的治疗方式。
有研究发现低分化是胃癌肝转移患者的预后影响因素[21-22]。此外,肿瘤分化程度是胃癌肝转移OS和CSS的独立预后因素[23]。低分化的胃癌细胞增殖能力强,对化疗和放疗的抵抗力高,因此治疗效果差,容易出现复发和转移,尤其是向肝脏转移的可能性较高,而肝转移则会缩短胃癌患者的生存期,预后较差[13]。本研究经多因素Cox回归分析发现肿瘤分化程度是胃癌肝转移预后的危险因素,与上述研究结果一致。因此,对胃癌患者的诊断和治疗,评估分化程度十分重要,可作为预测胃癌肝转移风险的指标,为相应的临床决策提供依据。
本研究发现年龄是胃癌肝转移的危险因素。随着年龄的增长,胃癌肝转移的风险也逐渐增加,成为预后不良的重要影响因素[24]。一项回顾性队列研究发现年龄>65岁是胃癌肝转移OS的独立预后影响因素[25]。Qiang等[11]研究证实年龄与胃癌肝转移患者的预后密切相关。这可能是因为随着年龄的增长,人体的免疫功能和细胞修复能力逐渐下降,使胃癌细胞更容易侵入肝脏,并形成肝转移病灶。
本研究存在一定的局限性:①在收集SEER数据库资料中,患者的吸烟史、饮酒史、肿瘤标志物等资料存在缺乏;②患者放疗及化疗的详细方案无法获取;③本研究中的手术方式无法获取;④本研究属于回顾性分析,由于没有进行外部验证,患者预后的分析存在一定的偏倚。后续应进行更大样本量的多中心研究,予以进一步验证。
综上,年龄、肿瘤分化程度、原发灶手术、化疗是胃癌肝转移的预后危险因素,基于其构建的列线图对胃癌肝转移的预后具有一定的准确度。一方面,有助于临床医生准确地评估患者的潜在危险因素,制定个体化的治疗方案;另一方面,可有效改善患者的生存时间。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209–249.
[2] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424.
[3] TORRE L A, SIEGEL R L, WARD E M, et al. Global cancer incidence and mortality rates and trends-an update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1): 16–27.
[4] ETEMADI A, SAFIRI S, SEPANLOU SG, et al. The global, regional, and national burden of stomach cancer in 195 countries, 1990-2017: A systematic analysis for the global burden of disease study 2017[J]. Lancet Gastroenterol Hepatol, 2020, 5(1): 42–54.
[5] ZHAO J K, WU M, KIM C H, et al. Jiangsu four cancers study: A large case-control study of lung, liver, stomach, and esophageal cancers in Jiangsu Province, China[J]. Eur J Cancer Prev, 2017, 26(4): 357–364.
[6] MARTE G, TUFO A, STECCANELLA F, et al. Efficacy of surgery for the treatment of gastric cancer liver metastases: A systematic review of the literature and Meta-analysis of prognostic factors[J]. J Clin Med, 2021, 10(5): 1141.
[7] EDGE S B, COMPTON C C. The American Joint Committee on Cancer: The 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471–1474.
[8] ZHANG Y, LIN Y, DUAN J, et al. A population-based analysis of distant metastasis in stage Ⅳgastric cancer[J]. Med Sci Monit, 2020, 26: e923867.
[9] GOTO K, MORIMOTO M, OSAKI M, et al. The impact of AMIGO2 on prognosis and hepatic metastasis in gastric cancer patients[J]. BMC Cancer, 2022, 22(1): 280.
[10] DIXON M, MAHAR A L, HELYER L K, et al. Prognostic factors in metastatic gastric cancer: Results of a population-based, retrospective cohort study in Ontario[J]. Gastric Cancer, 2016, 19(1): 150–159.
[11] QIANG W, SHI H, WU J, et al. Hepatic arterial infusion combined with systemic chemotherapy for patients with extensive liver metastases from gastric cancer[J]. Cancer Manag Res, 2020, 12: 2911–2916.
[12] LI Q, LI H, JIANG H, et al. Predictive factors of trastuzumab-based chemotherapy in HER2 positive advanced gastric cancer: A single-center prospective observational study[J]. Clin Transl Oncol, 2018, 20(6): 695–702.
[13] POLKOWSKA-PRUSZYNSKA B, RAWICZ-PRUSZYNSKI K, CISEL B, et al. Liver metastases from gastric carcinoma: A case report and review of the literature[J]. Curr Probl Cancer, 2017, 41(3): 222–230.
[14] LEE J W, CHOI M H, LEE Y J, et al. Radiofrequency ablation for liver metastases in patients with gastric cancer as an alternative to hepatic resection[J]. BMC Cancer, 2017, 17(1): 185.
[15] LI Q, XU X, SU D, et al. Long-term survival of an elderly patient with advanced gastric cancer after combination therapy: A case report and literature review[J]. BMC Cancer, 2019, 19(1): 459.
