N6-甲基腺苷阅读蛋白人类抗原R对结直肠癌细胞的迁移、侵袭和糖酵解的影响及其与磷酸果糖激酶1的关系
2024-05-11王一丹王泊雅褚菲菲吴慧丽
王一丹, 王泊雅, 李 璐, 张 勇, 褚菲菲, 吴慧丽
(郑州大学附属郑州中心医院 消化内科, 河南 郑州, 450000)
结直肠癌是消化系统最常见的恶性肿瘤之一,其发病率和病死率在各种恶性肿瘤中分别位居第3位和第2位[1]。目前针对结直肠癌的治疗取得了较大进展,但患者的5年生存率仍不足40%[2]。肿瘤细胞即使在有氧条件下也倾向于通过糖酵解途径来获取能量,这一现象被称为“Warburg效应”[3]。有氧糖酵解参与能量的快速合成、肿瘤微环境的改变和细胞信号通路的激活[4]。由基因肌肉磷酸果糖激酶(PFKM)编码的6-磷酸果糖激酶1(PFK1)在糖酵解途径中发挥重要作用。相关文献[5]显示下调PFK1抑制鼻咽癌的增殖、迁移和侵袭能力,促进细胞凋亡,但PFK1在结直肠癌中的研究鲜有报道。
N6-甲基腺苷(m6A)修饰受三类调节因子调控,包括甲基化酶、去甲基酶和m6A阅读蛋白[6]。决定m6A修饰命运的是m6A阅读蛋白,其可以识别并与含有m6A的RNA相互作用,调节其功能[7]。m6A阅读蛋白人类抗原R(HuR)是一种胚胎致死性视觉异常RNA结合蛋白,由基因ELAV样蛋白1(ELAVL1)所编码,可通过识别并结合靶基因上的m6A修饰位点增强mRNA稳定性[8]。HuR参与肺腺癌[9]、肝癌[10]、乳腺癌[11]的糖酵解过程,而目前关于HuR在结直肠癌糖酵解中的研究较少,作用机制尚不清楚。本课题组前期生物信息分析显示, PFK1上存在m6A修饰位点,且HuR与PFK1表达呈正相关,推测二者存在密切联系。本研究探讨HuR对结直肠癌细胞生物学行为的影响及其与PFK1的关系,现报告如下。
1 资料与方法
1.1 一般资料
纳入2022年4—12月就诊于郑州大学附属郑州中心医院的33例结直肠癌患者,收集其结直肠癌组织及其对应的癌旁组织,术后立即将标本冷冻保存于-80 ℃冰箱中待用。本研究经郑州大学附属郑州中心医院伦理委员会批准并监督(伦理号: 202242), 且获得所有患者的知情同意。纳入标准: ① 患者原发癌经组织病理学证实; ② 未接受放疗、化疗者; ③ 临床病历资料完整者。排除标准: ① 合并其他恶性肿瘤者; ② 已接受相关药物治疗者。
人正常肠上皮细胞NCM460及结直肠癌细胞系HCT8、SW480、SW620、HCT116、LoVo、RKO购自武汉普诺赛生命科技有限公司; Trizol试剂、RIPA裂解液、反转录试剂盒、BCA蛋白浓度测定试剂盒及ECL化学发光试剂盒均购自上海碧云天生物技术有限公司; 青霉素、链霉素、胎牛血清、基础培养基、完全培养基购自武汉益普生物公司; Transwell小室、基质胶、细胞培养瓶及6孔板购自Conring公司; 葡萄糖含量检测试剂盒、丙酮酸含量检测试剂盒购自北京索莱宝生物科技公司; HuR、PFK1、β-actin引物由上海华大基因科技有限公司合成; HuR小干扰RNA(si-HuR-1; si-HuR-2; si-HuR-3)及其阴性对照组(si-NC)由河南睿英生物公司提供; β-actin(兔源,稀释比例1∶10 000)、PFK1(兔源,稀释比例1∶1 000)一抗抗体和辣根过氧化物酶标记的山羊抗兔IgG二抗抗体均购自Proteintech公司。
1.2 方法
1.2.1 细胞培养: 将NCM460、HCT8、SW480、SW620、HCT116、LoVo、RKO和COLO205细胞置于含有1%青霉素、链霉素、10%胎牛血清的完全培养基中,在37 ℃、5%CO2培养箱内培养。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCT): 使用Trizol试剂提取RNA, 通过反转录试剂盒合成cDNA, 并使用SYBR Green法进行扩增反应,β-actin作为内参。反应条件为: 95 ℃预变性10 min, 95 ℃下10 s, 60 ℃下30 s, 共45个循环,采用2-△△Ct方法计算HuR、PFK1的相对表达量。PCR引物及序列见表1。

表1 qRT-PCR引物序列
1.2.3 蛋白免疫印迹实验(Western blot): 收集细胞后,使用RIPA裂解液、蛋白酶抑制剂从细胞中提取蛋白,通过BCA检测试剂盒进行定量,金属浴煮沸使蛋白变性。使用聚丙烯酰胺凝胶电泳分离蛋白质样本,并转移到PVDF膜上, 5%脱脂牛奶封闭1 h, TBST洗涤后,将PVDF膜与特异性一抗PFK1(1∶1 000)、β-actin(1∶10 000)在4 ℃下孵育过夜。再次TBST洗涤后,加入二抗(1∶10 000)在室温下孵育1 h; 将膜置于化学发光成像仪中,均匀加入ECL显色液,观察蛋白条带。β-actin作为内参,通过Image J软件分析蛋白灰度值。
1.2.4 细胞分组: 将si-NC、si-HuR-1、si-HuR-2、si-HuR-3分别转染处于对数生长期的HCT116、SW480细胞,命名为si-NC组、si-HuR-1组、si-HuR-2组、si-HuR-3组,转染48 h后进行后续实验。HuR siRNA序列见表2。

表2 siRNA序列
1.2.5 细胞划痕实验: 将1×105个细胞接种于6孔板中的每个孔中,并生长至100%汇合度,用无菌10 μL移液器枪头垂直划痕,磷酸盐缓冲液(PBS)洗涤后,加入不含FBS的基础培养基。计算细胞在第0、24小时的划痕面积。划痕愈合率(%)=(第0小时的划痕面积-第24小时的划痕面积)/第0小时的划痕面积×100%。
1.2.6 Transwell实验: 使用含有小室的24孔板(带或不带基质胶涂层)进行迁移和侵袭实验。在上层小室内加入含200 μL细胞悬浮液的无血清培养基(每孔2.5×105个细胞),并将600 μL含10%FBS的基础培养基加入下层小室中。培养48 h后,用棉签擦去上室的细胞和基质胶, 4%多聚甲醛固定细胞15 min, 0.5%结晶紫染色25 min, 空气风干。在显微镜下观察细胞并拍照,通过Image J软件分析细胞数。
1.2.7 RNA稳定性实验: 将1×105个细胞接种于6孔板中的每个孔中,转染48 h后,使用5 μg/mL放线菌素D处理细胞0、3、6 h, 分别收集上述时间点的细胞,提取细胞RNA, 通过qRT-PCR检测PFK1mRNA相对表达量。
1.2.8 糖酵解水平检测: 将1×105个细胞接种于6孔板中的每个孔中,转染48 h后,收集各组细胞,使用葡萄糖含量检测试剂盒、丙酮酸含量检测试剂盒检测细胞葡萄糖摄取量、丙酮酸生成量。
1.3 统计学方法
应用GraphPad Prism9.0软件进行数据分析,所有数据以均数±标准差表示。HuR、PFK1在结直肠癌及对应癌旁组织的表达量使用配对样本t检验,各细胞组间差异比较使用独立样本t检验进行分析。所有实验均重复3次,P<0.05为差异有统计学意义。
2 结 果
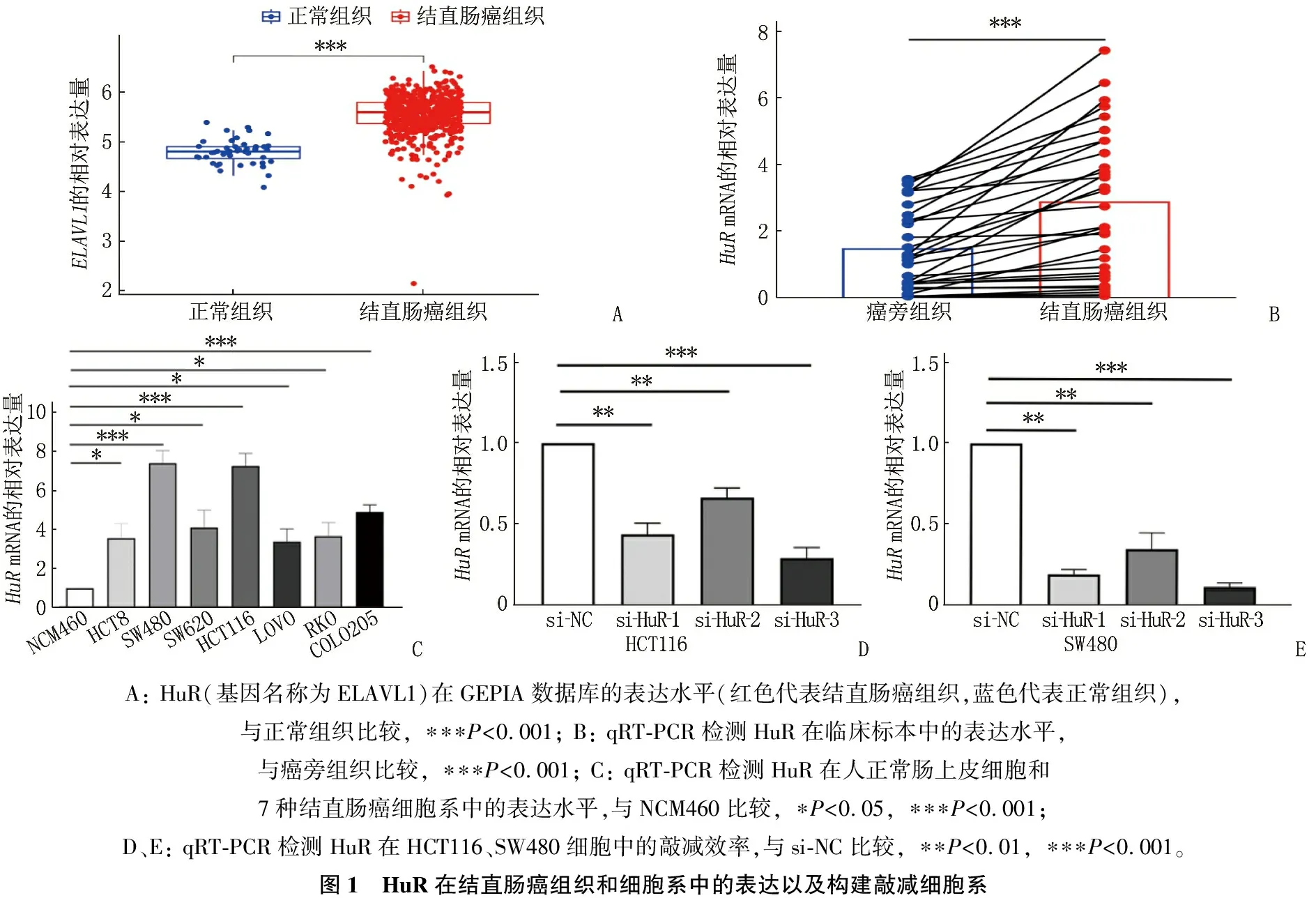
2.1 HuR在结直肠癌组织和细胞系中高表达
基于基因表达水平值的交互式分析平台(GEPIA)数据库分析显示,结直肠癌组织中的HuR表达水平高于正常组织,差异有统计学意义(P<0.001); 与癌旁组织相比,结直肠癌组织中HuRmRNA表达量升高,差异有统计学意义(P<0.001); 与人正常肠上皮细胞NCM460相比, HuR在人结直肠癌细胞系HCT8、SW480、SW620、HCT116、LoVo、RKO和COLO205细胞中的表达量升高,差异有统计学意义(P<0.05), 其中HCT116、SW480细胞的HuR表达水平相对较高,选择HCT116、SW480细胞进行后续实验。将3种实验组siRNA-HuR及阴性对照组转染到HCT116、SW480细胞中,相较于对照组,实验组HuRmRNA表达量显著下降,其中si-HuR-1和si-HuR-3的差异最为显著(P<0.01), 说明转染明显有效,选择si-HuR-1和si-HuR-3进行后续细胞功能试验。见图1。
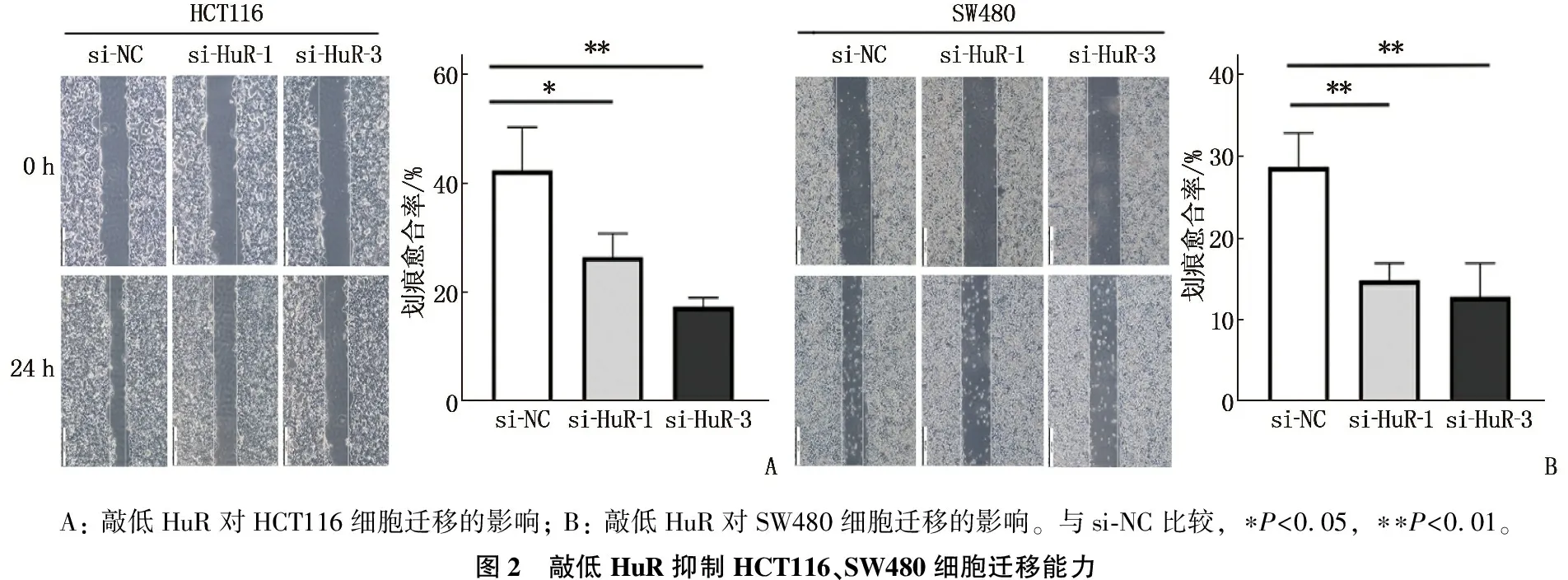
2.2 敲低HuR抑制结直肠癌细胞迁移和侵袭
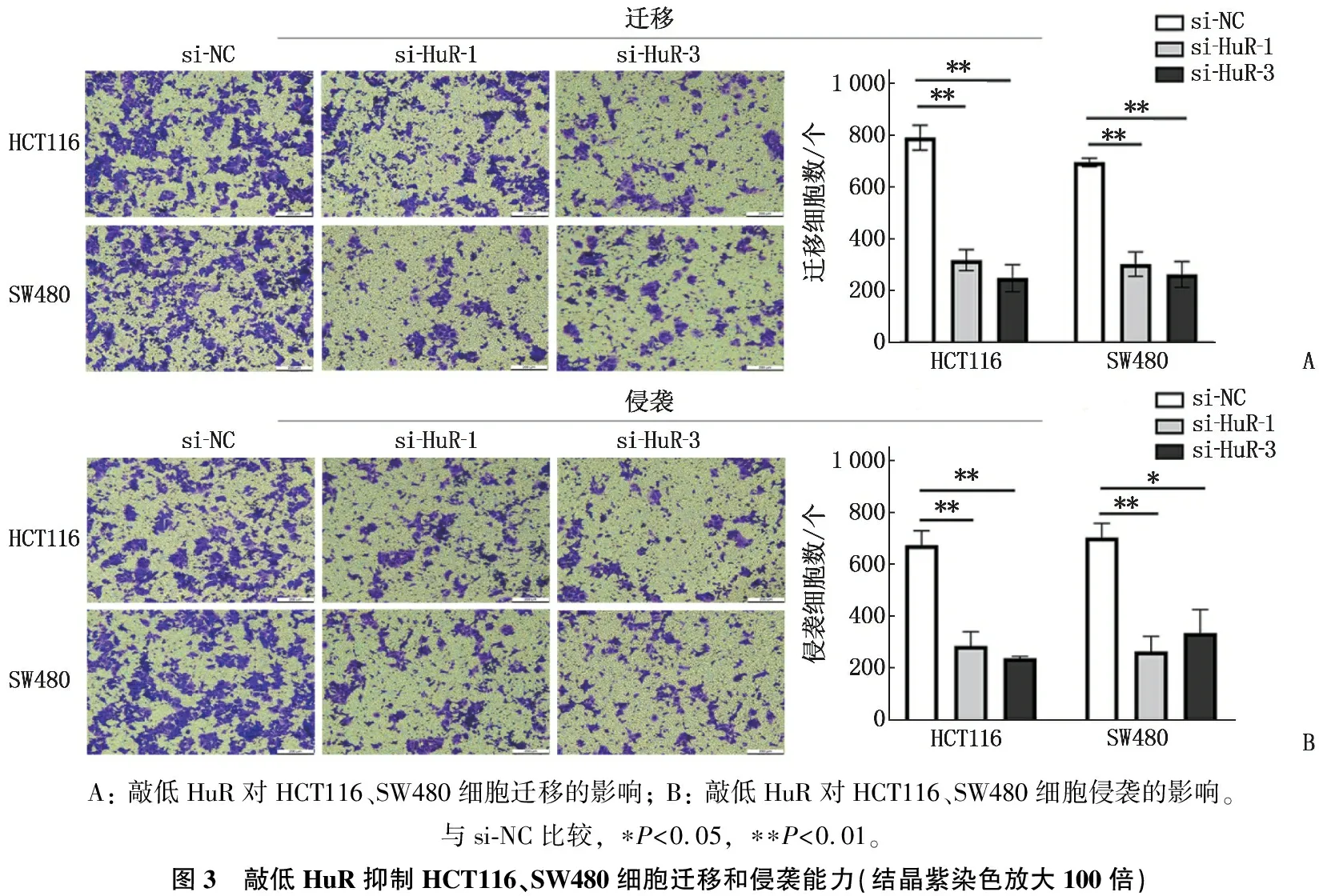
与对照组si-NC相比,实验组si-HuR-1、si-HuR-3的划痕愈合率下降,差异有统计学意义(P<0.05),见图2; 与对照组si-NC相比,实验组si-HuR-1、si-HuR-3的迁移细胞数、侵袭细胞数减少,差异有统计学意义(P<0.05), 见图3。
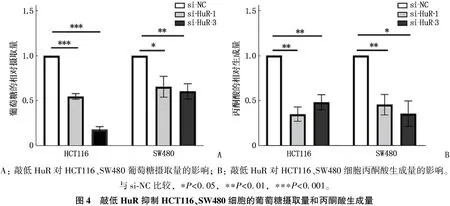
2.3 敲低HuR抑制结直肠癌细胞糖酵解
与对照组si-NC相比,实验组si-HuR-1、si-HuR-3的葡萄糖摄取量均降低,差异有统计学意义(P<0.05); 敲低HuR使HCT116、SW480细胞的丙酮酸生成量均降低,差异有统计学意义(P<0.05)。见图4。
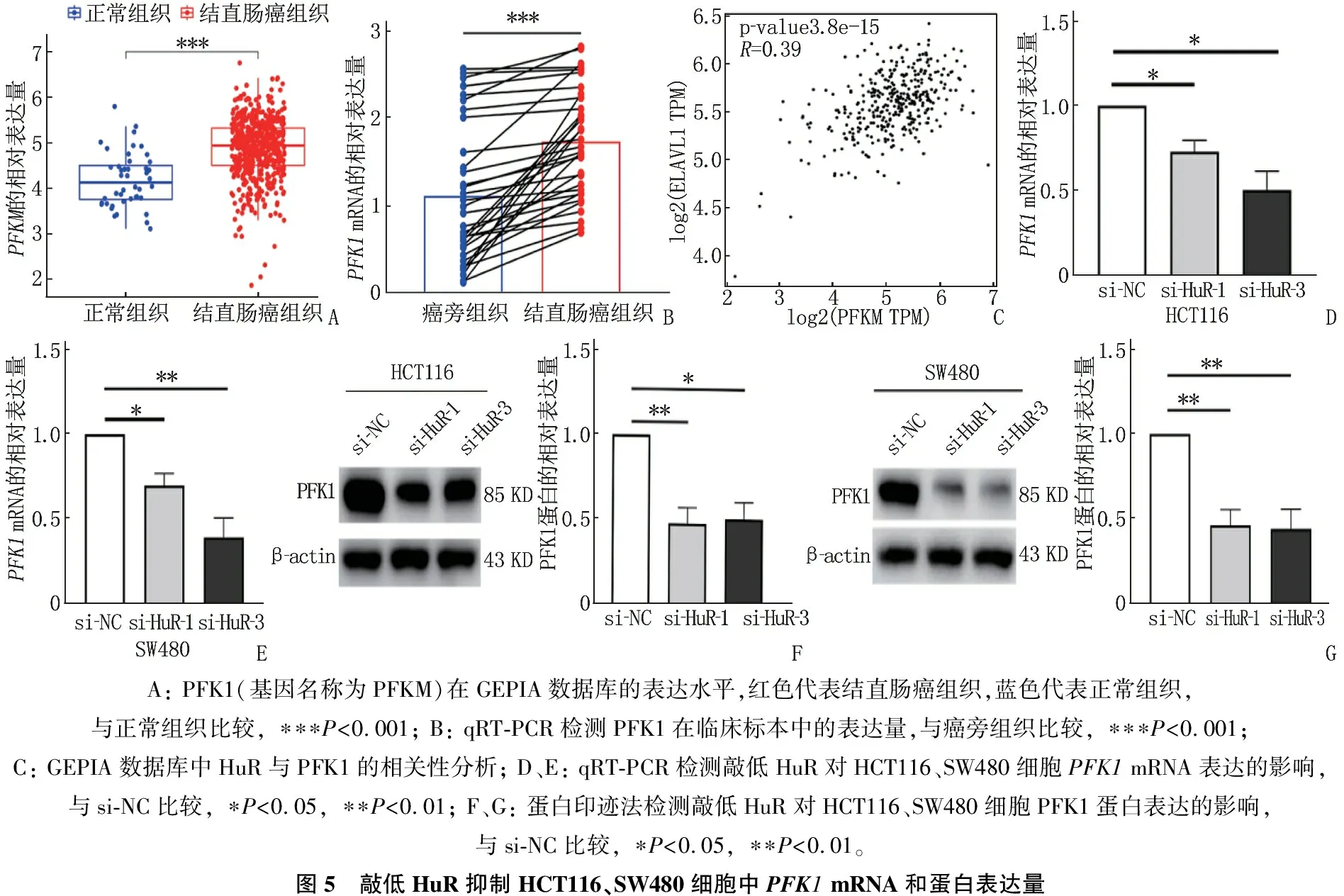
2.4 敲低HuR抑制结直肠癌细胞PFK1 mRNA和蛋白的表达量
GEPIA数据库分析显示PFK1在结直肠癌中高表达,差异有统计学意义(P<0.001);PFK1mRNA在结直肠癌组织中的表达量高于癌旁组织,差异有统计学意义(P<0.001); GEPIA数据库分析显示,结直肠癌组织中HuR与PFK1表达水平呈正相关; 与对照组相比,实验组PFK1mRNA及其蛋白的表达量均降低,差异有统计学意义(P<0.05)。见图5。
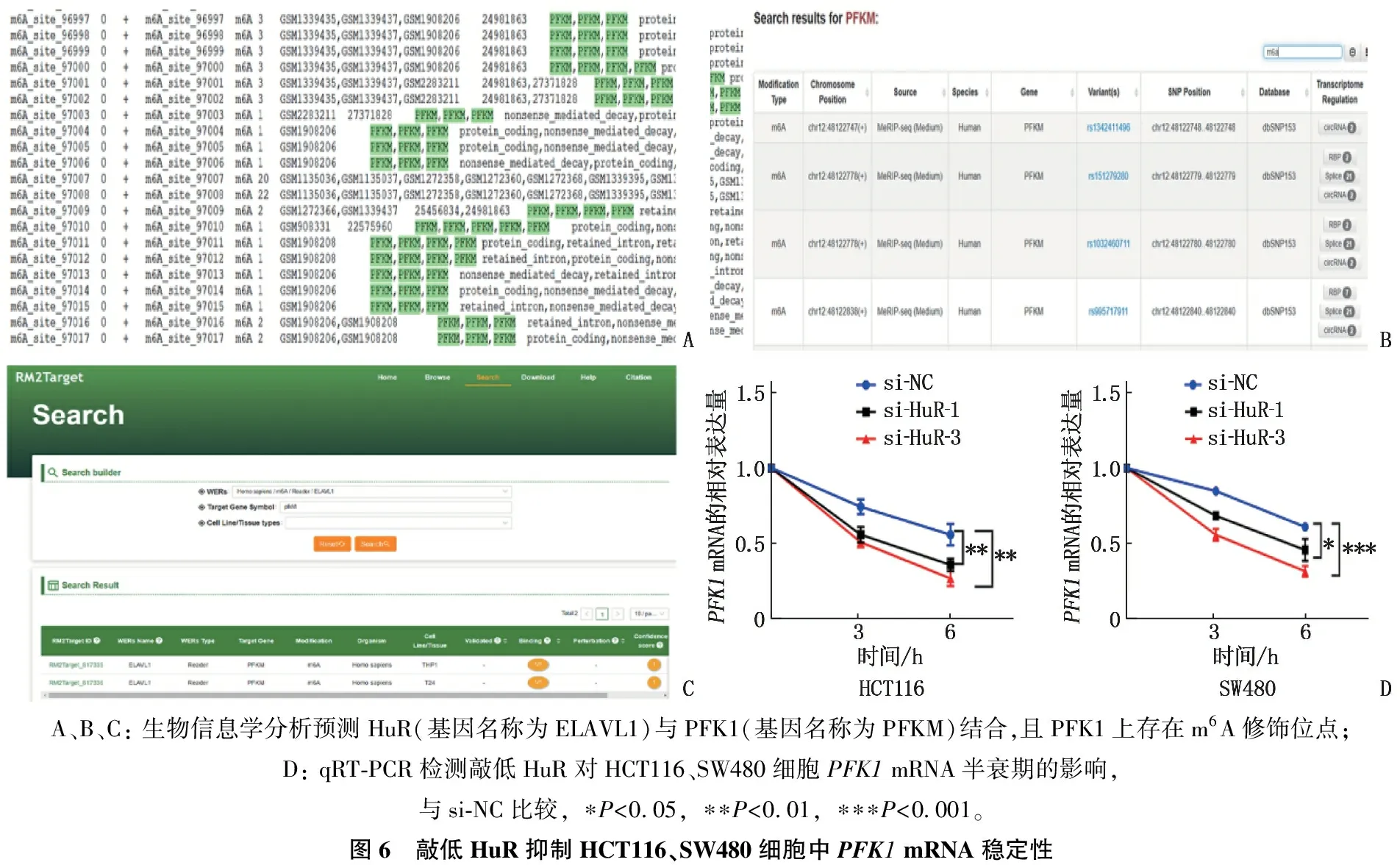
2.5 敲低HuR抑制PFK1 mRNA的稳定性
利用RMBase数据库分析发现PFK1上存在着m6A修饰的序列; 使用m6AVar数据库显示基因组上的功能变异能够使PFK1上的m6A修饰的序列发生改变,并且RM2Target算法预测PFK1能够与HuR存在直接结合; 敲低HuR降低了PFK1的mRNA半衰期,即抑制PFK1mRNA稳定性,差异有统计学意义(P<0.05)。见图6。
3 讨 论
m6A修饰是真核生物mRNA中最丰富的内部修饰,参与多种生物过程,如RNA剪接、稳定性和翻译[12]。HuR是m6A修饰中的重要成员,在癌症的进展中发挥重要作用[13]。DUAN X H等[14]发现敲低HuR可通过降低肺癌细胞FGFRL1mRNA的稳定性抑制化疗耐药性,进而诱导其凋亡。LIU H L等[15]研究显示HuR在肝癌中高表达,抑制HuR的表达能够降低MMP1mRNA的稳定性,进一步抑制肝癌细胞的增殖能力。上述研究结果显示, HuR可能可以成为提示肿瘤进展和预后的潜在分子靶点。目前国内外对HuR在结直肠癌中的研究较少,作用机制尚不清楚。本研究中, GEPIA数据库显示HuR(基因名称为ELAVL1)在结直肠癌组织中高表达,这一结果在临床样本中得到了验证, HuR在结直肠癌组织中的表达量显著高于癌旁组织。通过体外细胞实验发现HuRmRNA的表达量在HCT116、SW480细胞中升高,因此选择HCT116、SW480细胞作为研究对象进行后续功能学研究。敲低HuR后,实验组细胞划痕愈合率、细胞迁移数和细胞侵袭数均降低,提示敲低HuR能够抑制结直肠癌细胞的迁移、侵袭能力。
“Warburg效应”的特征是葡萄糖摄取和乳酸产生增强,乳酸的产生为肿瘤细胞提供了酸性环境,促使肿瘤细胞进一步增殖、迁移、侵袭以及抵抗凋亡,同时诱导分泌血管内皮生成因子为肿瘤细胞生长提供养料[16-17]。为探讨HuR是否参与结直肠癌糖酵解途径,通过检测葡萄糖摄取水平和丙酮酸生成水平,发现敲低HuR可以抑制HCT116、SW480细胞的葡萄糖摄取量、丙酮酸生成量,证明HuR参与并促进结直肠癌的糖酵解途径。
肿瘤细胞有氧糖酵解能力是正常细胞的20~30倍,为肿瘤代谢提供大量能量和中间产物[3]。研究[18]显示,抑制肿瘤细胞糖酵解途径能够有效抑制肿瘤细胞的增殖,甚至可以起到杀伤肿瘤细胞的作用。因此阻断有氧糖酵解目前被认为是一种有前景的肿瘤治疗策略,靶向糖酵解等异常环节的代谢酶也成为抗肿瘤治疗的重点[19]。PFK1是糖酵解的主要限速酶和主要调节点,催化6-磷酸果糖生成1, 6-二磷酸果糖(F2-6BP)[20]。既往研究[21]显示, PFK1不仅能够参与糖酵解过程,还在多种肿瘤中扮演着重要角色,如下调PFK1抑制肝癌细胞增殖能力,过表达PFK1可促进肺癌生长和转移[22]。本研究中, GEPIA数据库分析显示PFK1(编码基因PFKM)在结直肠癌组织中显著高表达,并且与HuR表达水平呈正相关; 进一步通过qRT-PCR验证显示PFK1在结直肠癌组织中的表达量显著升高; 敲低HuR后,HCT116、SW480细胞中PFK1mRNA和蛋白表达量降低,提示敲低HuR能够抑制PFK1表达。HuR是一种关键的m6A阅读蛋白,其发挥作用的机制可能为: 首先,通过生物信息学分析预测HuR与PFK1(编码基因PFKM)结合,且PFK1上存在m6A修饰位点; 其次,通过RNA稳定性实验发现敲低HuR可以抑制PFK1mRNA半衰期,即降低PFK1mRNA稳定性。本研究并未进行实验证明PFK1上存在m6A位点,后续将通过甲基化RNA免疫共沉淀实验(MeRIP)来验证。
综上所述, m6A阅读蛋白HuR在结直肠癌中高表达,可能通过识别结合PFK1上的m6A位点,降低PFK1mRNA稳定性,从而调控结直肠癌细胞的迁移、侵袭和糖酵解能力。
