脑胶质瘤组织lncRNA BCAR4、MMP-7表达变化及其临床意义
2024-05-07许海魏民杨德福张恒柱
许海,魏民,杨德福,张恒柱
1 扬州大学附属江都人民医院神经外科,江苏扬州 225202;2 扬州大学附属苏北人民医院神经外科
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,具有高复发率、高致残率、高病死率等特征。在我国脑胶质瘤的年发病率为5/10 万~8/10 万,5 年病死率仅次于肺癌和胰腺癌[1-2]。但目前脑胶质瘤发病的分子机制尚不完全清楚。研究表明,长链非编码RNA(lncRNA)虽然不具有蛋白编码功能,但其异常表达与肿瘤的发生、发展密切相关[3]。乳腺癌抗雌激素耐药基因4(BCAR4)是近年发现的一种lncRNA。有研究报道,lncRNA BCAR4异常表达与脑胶质瘤的恶性进展有关[4]。基质金属蛋白酶7(MMP-7)是一种分泌型蛋白,能够通过蛋白水解作用促进肿瘤细胞的增殖、侵袭和迁移等[5]。郭秀莲等[6]研究报道,上调MMP-7表达可促进脑胶质瘤细胞增殖和侵袭并抑制其凋亡。但目前lncRNA BCAR4、MMP-7表达与脑胶质瘤患者临床病理特征和预后的关系尚不完全清楚。鉴于此,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2018 年2 月—2020 年8 月扬州大学附属江都人民医院神经外科收治的脑胶质瘤患者98例。纳入标准:①经术后组织病理检查明确诊断为脑胶质瘤;②初诊,入院前未接受任何抗肿瘤治疗;③接受脑胶质瘤次全切除术或全切除术;④临床病理资料和术后随访资料完整。排除标准:①脑转移瘤者;②合并颅内其他疾病者;③合并其他部位恶性肿瘤者;④合并急慢性感染者;⑤合并免疫或血液系统损害者;⑥年龄<18 岁者。其中,男55 例、女43例,年龄23~82(60.54 ± 8.54)岁,肿瘤位置:额部41 例、颞部57 例,肿瘤最大径:<3 cm 48 例、≥3 cm 50 例,组织分化程度:低分化37 例、中高分化61例;WHO 分级[7]:Ⅰ级22 例、Ⅱ级34 例、Ⅲ级26例、Ⅳ级16 例。本研究经扬州大学附属江都人民医院伦理委员会批准(审批编号:2017 伦字1223),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 lncRNA BCAR4、MMP-7 mRNA 表达检测 取术中切除的新鲜脑胶质瘤组织及其配对的瘤旁组织(经术后组织病理检查明确为正常组织),液氮下速冻后研磨成粉末。采用TRIzol 法提取组织总RNA,经紫外可见分光光度计鉴定,OD260/OD280为1.8~2.0。按TaKaRa RNA PCR Kit 说明将总RNA 逆转录合成为cDNA。逆转录条件:37 ℃ 1 h,80 ℃ 5 s。以cDNA 为模板,按SYBR®Premix Ex TaqTM试剂盒说明进行PCR 扩增。引物序列由上海剑钝生物科技有限公司设计合成。lncRNA BCAR4 上游引物5'-GCCACAGGAGCTAGAGCAGT-3'、下游引物5'-GCAGAGTATTCAGGGTAAGGGT-3',MMP-7 上游引物5'-GAAGGGCCGAAGAGCTCAAT-3'、下游引物5'-GGCTCGCAAAGTGTCTGTTG-3',GAPDH 上游引物5'-AACGGATTTGGTCGTATTGGG-3'、下游引物5'-CGCTCCTGGAAGATGGTGAT-3'。PCR 反应体系共20 µL:cDNA 模板1 µL,2 × Hieff®PCR Master 8 µL,上下游引物各0.5 µL,SYBR Premix Ex Taq 5 µL,RNase-free ddH2O 5 µL;反应条件:95 ℃ 90 s,95 ℃ 30 s、63 ℃ 30 s、72 ℃ 15 s 共40 个循环。PCR扩增反应结束,绘制熔解曲线,获取循环阈值(CT)数。以GAPDH 为内参,采用2-ΔΔCT法计算lncRNA BCAR4、MMP-7 mRNA相对表达量。
1.3 随访 脑胶质瘤患者出院后通过电话或门诊复查形式定期随访3年,第1年每3个月随访1次,之后每半年随访1次。随访截至2023年8月31日,终点事件为患者死亡或至随访截至日期,统计患者生存时间。以脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA相对表达量的均值为临界值,将患者分为lncRNA BCAR4、MMP-7 mRNA 高表达者与低表达者,分析脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA表达与患者预后的关系。
1.4 统计学方法 采用SPSS28.0 统计软件。符合正态分布的计量资料以±s表示,结果比较采用独立样本t检验。计数资料比较采用χ2检验。相关性分析采用Pearson 相关分析法。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。危险因素分析采用多因素Cox 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 脑胶质瘤组织与瘤旁正常组织lncRNA BCAR4、MMP-7 mRNA 表达比较 脑胶质瘤组织与瘤旁正常组织lncRNA BCAR4 相对表达量分别为2.42± 0.67、1.13 ± 0.22,MMP-7 mRNA 相对表达量分别为1.00 ± 0.17、0.54 ± 0.10。脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA 相对表达量均高于瘤旁正常组织(t分别为18.094、22.594,P均<0.01)。
2.2 脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA表达的关系 Pearson 相关分析显示,脑胶质瘤组织lncRNA BCAR4 相对表达量与MMP-7 mRNA 相对表达量呈正相关关系(r=0.810,P<0.01)。
2.3 脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA表达与临床病理特征的关系 见表1。

表1 脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA表达与临床病理特征的关系
2.4 脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA表达与患者预后的关系 随访3年,98例脑胶质瘤患者失访4例、死亡45例,3年生存率为54.08%,平均生存时间为26.596 个月。lncRNA BCAR4、MMP-7 mRNA高表达者分别有48、51例,其低表达者分别有50、47例。lncRNA BCAR4、MMP-7 mRNA高表达者平均生存时间分别为22.047、22.234个月,其低表达者分别为30.148、30.609个月。lncRNA BCAR4、MMP-7 mRNA 高表达者平均生存时间均低于其低表达者(Log-rankχ2分别为11.357、11.666,P均<0.01)。
2.5 脑胶质瘤患者死亡的危险因素 脑胶质瘤患者死亡者与存活者临床资料比较见表2。以年龄(<60 岁=0,≥60 岁=1)、组织分化程度(中高分化=0,低分化=1)、WHO 分级(Ⅰ、Ⅱ级=0,Ⅲ、Ⅳ级=1)、lncRNA BCAR4 表达(原值录入)、MMP-7 mRNA 表达(原值录入)为自变量,以随访时间为时间变量,以生存状态(存活=0,死亡=1)为因变量,纳入多因素Cox 回归模型。结果显示,组织分化程度低分化和WHO 分级Ⅲ、Ⅳ级以及lncRNA BCAR4、MMP-7 mRNA 表达升高为脑胶质瘤患者死亡的独立危险因素(P均<0.05),见表3。
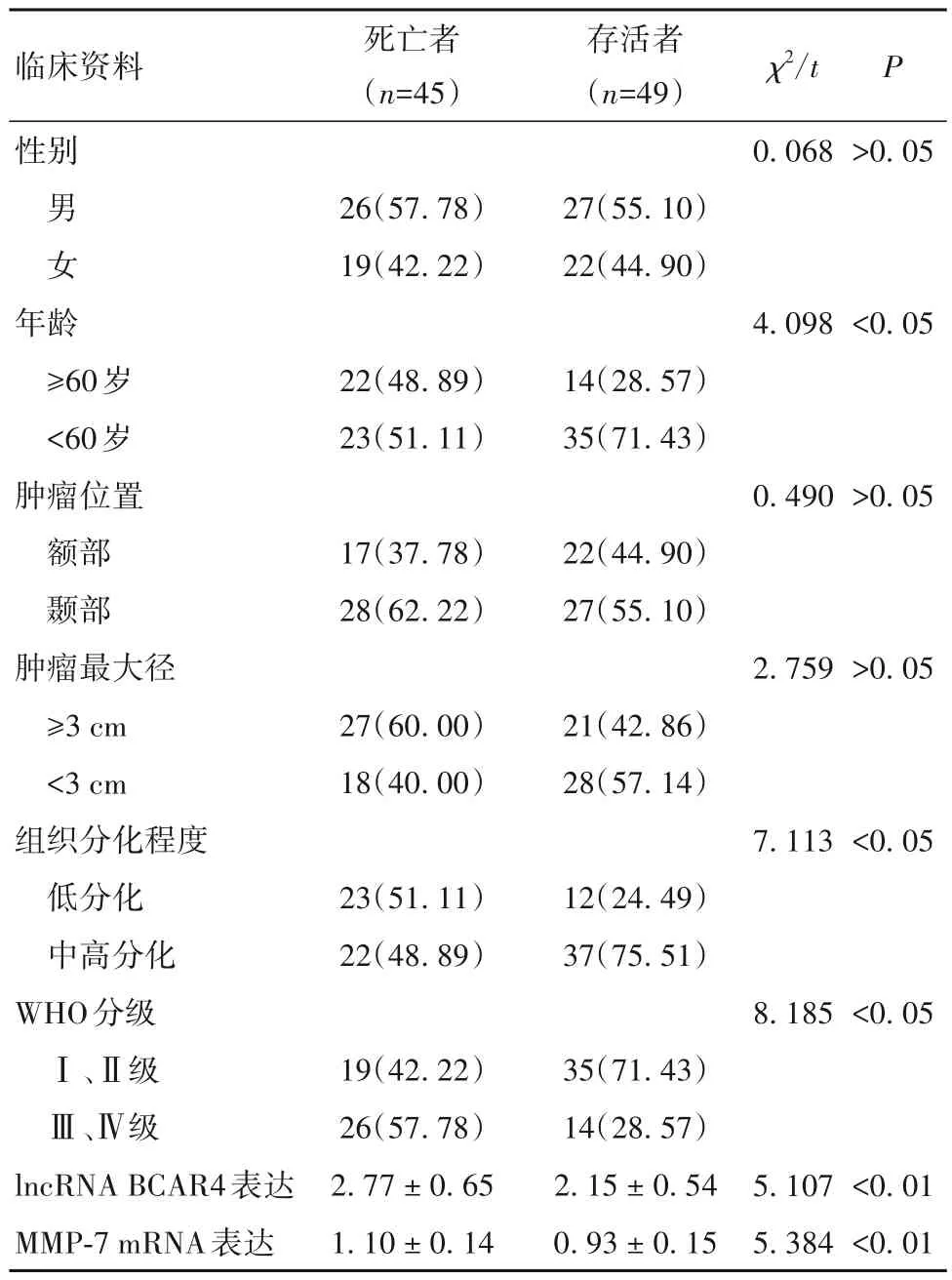
表2 脑胶质瘤患者死亡者与存活者临床资料比较[例(%)]

表3 脑胶质瘤患者死亡的多因素Cox回归分析结果
3 讨论
脑胶质瘤是起源于神经胶质细胞的颅内恶性肿瘤,以颅内压增高、神经功能障碍和癫痫发作为主要临床表现。迄今为止,脑胶质瘤的病因尚不完全清楚,可能与高外显率基因遗传突变、高剂量电离辐射、细菌或病毒感染等因素有关[1]。近年来,尽管以外科手术、放疗、化疗为主的综合治疗取得了一定进步,但由于脑胶质瘤细胞具有高度增殖和侵袭特征,很难达到根治效果,并且复发率较高,预后仍然较差,尤其是WHO 分级Ⅲ、Ⅳ级患者[8]。目前,脑胶质瘤发病的分子机制尚不完全清楚。因此,深入探索脑胶质瘤发病的分子机制,对寻找肿瘤特异性治疗靶点至关重要[9]。
表观遗传学在肿瘤的发生、发展中具有重要作用。lncRNA 作为新兴的表观遗传调控因子,能够通过直接或间接调控靶基因的表达,促进肿瘤的发生、发展[3]。lncRNA BCAR4定位于人染色体16p13.13,最初于乳腺癌抗雌激素耐药基因筛查时被发现,后进一步研究证实其与乳腺癌细胞的恶性生物学行为有关[10]。近年研究发现,lncRNA BCAR4 还可在其他恶性肿瘤中发挥致癌作用,如lncRNA BCAR4 能够靶向miR-181c-5p 上调LIM 和SH3 蛋白1,从而促进食管鳞癌细胞的增殖、侵袭和迁移[11];lncRNA BCAR4还能靶向大肿瘤抑制激酶2促进肝细胞癌细胞的增殖、迁移并抑制其凋亡[12]。但目前lncRNA BCAR4 与脑胶质瘤的关系尚不完全清楚。本研究结果显示,脑胶质瘤组织lncRNA BCAR4 表达上调,并且其表达变化与组织分化程度和WHO 分级有关。结果表明,lncRNA BCAR4 高表达能够参与脑胶质瘤的发生、发展。究其原因,lncRNA BCAR4 表达上调可激活胶质瘤相关癌基因同源蛋白2,而胶质瘤相关癌基因同源蛋白2是脑胶质瘤的重要致癌基因,其表达上调能够促进脑胶质瘤细胞的增殖、侵袭和迁移[13]。
细胞外基质是细胞微环境的核心组分,可为细胞提供结构和机械支持,能够参与细胞增殖、分化、迁移、侵袭等生物学过程。细胞外基质的降解则会破坏细胞结构导致癌变,同时变薄的细胞基底膜还会促进肿瘤细胞的侵袭和迁移[14]。MMP-7 是MMPs家族中最小的成员,其激活后可降解细胞外基质和基底膜,从而参与肿瘤的发生、发展。MMP-7 还能切割多配体蛋白聚糖-1-白细胞介素8复合物介导炎症反应,从而促进肿瘤的侵袭和转移[15]。例如,MMP-7 能够通过降解细胞外基质促进胰腺癌细胞的增殖、侵袭和迁移[16];MMP-7 还能通过蛋白激酶B/核因子κB 信号通路介导炎症反应,从而促进前列腺癌细胞的侵袭和迁移[17]。本研究结果显示,脑胶质瘤组织MMP-7 mRNA 表达上调,并且其表达变化与组织分化程度和WHO 分级有关。结果表明,MMP-7 高表达能够参与脑胶质瘤的发生、发展,与既往研究[6]报道一致。究其原因,MMP-7 高表达能够加速细胞外基质破坏和增强炎症反应,从而促进脑胶质瘤的恶性进展[18]。
本研究Pearson 相关分析显示,脑胶质瘤组织lncRNA BCAR4 相对表达量与MMP-7 mRNA 相对表达量呈正相关关系,提示lncRNA BCAR4 与MMP-7可能共同参与脑胶质瘤的发生、发展。最近WANG等[4]研究亦证实,lncRNA BCAR4能够靶向miR-2276上调MMP-7 表达,促进脑胶质瘤细胞的增殖和侵袭,进一步佐证了本研究结论。本研究结果还显示,lncRNA BCAR4、MMP-7 mRNA 高表达者平均生存时间均低于其低表达者,并且lncRNA BCAR4、MMP-7 mRNA 表达升高为脑胶质瘤患者死亡的独立危险因素。结果提示,lncRNA BCAR4、MMP-7 mRNA 高表达与脑胶质瘤患者预后不良密切相关,有可能成为脑胶质瘤患者预后的潜在预测指标。
综上所述,脑胶质瘤组织lncRNA BCAR4、MMP-7 mRNA 表达显著升高,二者表达变化与组织分化程度、WHO分级和预后密切相关。
