雷帕霉素核壳型pH敏感递药系统制备及其对乳腺癌细胞的体外作用
2024-05-06王金梅刘凡凡
王金梅,张 凯,张 颖,王 爽,刘凡凡,何 勐
(郑州大学附属郑州中心医院药学部,河南 郑州 450000)
雷帕霉素(rapamycin,RAPA)是从吸水性链霉菌发酵液中提取出来的内酯类抗生素[1]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)在癌细胞中的表达通常被上调,RAPA作为一种mTOR抑制剂,可有效抑制mTOR活性,激活自噬,同时降低缺氧诱导因子-1α的表达,进而抑制新生血管形成[2-3]。有研究表明,RAPA具有抑制乳腺癌细胞增殖、诱导乳腺癌细胞凋亡的特性[4-5]。但由于RAPA自身具有毒性作用、亲水性差、治疗指数偏低等药理学缺点[6],严重限制了RAPA在临床中的应用。目前,RAPA有片剂和口服液2种制剂,这2种制剂在体内生物利用度低,分布缺乏选择性[7-8]。因此,如何克服RAPA自身的药理学缺点并降低口服药物非特异性分布所带来的毒副作用,是RAPA得以在临床广泛应用的关键。肿瘤药物递送系统的研发已成为目前医药领域研究的热点方向,脂质体纳米粒递药系统因其独特的优势而引起了研究者的广泛关注[9],其是将一定浓度的脂质囊泡和纳米粒通过自组装形成的具有脂质外壳和纳米粒核心的新型药物传输系统[10-11]。本研究选择脂质体纳米粒作为药物载体,以介孔二氧化硅(mesoporous silica nanoparticles,MSN)作为纳米粒核心,将RAPA载入MSN制备RAPA-MSN,然后采用pH敏感脂质体包裹RAPA-MSN 纳米粒,制备载雷帕霉素介孔二氧化硅核-脂质壳纳米粒(rapamycinloaded mesoporous silica nanoparticles core-lipid shell nanoplatform,RAPA-MSN-LN),并对其体外释药行为及对乳腺癌细胞的体外作用进行研究,现将结果报道如下。
1 材料与方法
1.1 细胞、试剂与仪器
人乳腺癌细胞MCF-7、小鼠乳腺癌细胞4T1购自中国科学院上海细胞库,细胞接种于含有体积分数10%血清的RPMI-1640培养基(含100 U·mL-1青霉素、100 mg·L-1链霉素)并置于含体积分数5% CO2、37 ℃恒温培养箱中培养。RAPA购自大连美仑生物技术有限公司,十六烷基三甲基氯化铵(cetyltrimethylammonium chloride,CTAC)购自成都贝斯特试剂有限公司,三乙醇胺(triethanolamine,TEA)、硅酸四乙酯(tetraethyl orthosilicate,TEOS)购自阿拉丁试剂(上海)有限公司,3-氨丙基三甲基氧基硅烷[(3-aminopropyl)trimethoxysilane,APTMS]购自国药集团化学试剂有限公司,二油酰磷脂酰乙醇胺(dioleoyl phosphoethanola-mine,DOPE)购自上海艾韦特医药科技有限公司,胆固醇购自北京索莱宝生物科技有限公司,二硬脂酰基磷脂酰乙醇胺聚乙二醇2000(distearoyl phosphoethanolamine-PEG2000,DSPE-PEG2000)购自美国Corden Pharma公司,体积分数75%乙醇购自上海励致化工有限公司,4′,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染色液购自北京雷根生物技术有限公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)购自上海麦克林生化科技有限公司,IR780碘化物购自美国Sigma-Aidrich公司,胎牛血清(fetal bovine serum,FBS)购自兰州民海生物工程有限公司,噻唑蓝(methylthiazol tetrazolium,MTT)购自美国Sigma-Aldrich公司,细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司,其他试剂均为分析纯; AB135-S型分析天平购自瑞士Mettler Toledo公司,WSJB-03恒温磁力搅拌器购自河南中良科学仪器有限公司,DZF-6021型真空干燥箱购自上海精宏实验设备有限公司,RE-52AA 型旋转蒸发仪购自上海亚荣生化仪器厂,傅里叶红外光谱仪购自美国Thermo Scientific公司,JEM-1400透射电子显微镜购自日本电子株式会社,Malvern Zetasizer Nano-2000 动态光散射粒径仪购自英国马尔文仪器有限公司,Waters e2695 高效液相色谱仪购自美国Waters公司,Synergy H1多功能酶标仪购自美国博腾(BioTek)有限公司,Accuri C6型流式细胞仪购自美国BD公司。实验所用缓冲溶液和样品溶液配制用水均为超纯水。
1.2 RAPA-MSN-LN的制备
1.2.1 MSN的制备
称取2 g CATC、20 mg TEA,置于50 mL的圆底烧瓶中,加入20 mL超纯水充分溶解,将圆底烧瓶置于80 ℃ 油浴条件下搅拌20 min,缓慢滴加1.5 mL TEOS,回流反应4 h。反应结束后,将反应液转移至离心管中,12 000 r·min-1离心30 min,收集沉淀并用适量的无水乙醇和去离子水洗涤2次。使用含NaCl的甲醇溶液(8 g·L-1)将洗涤后的沉淀萃取3次,每次12 h,最后用超纯水洗涤沉淀,真空干燥后即得MSN。
1.2.2 氨基化MSN的制备
参照文献[12]中的方法制备MSN-NH2。将7 mg 的MSN超声分散于10 mL无水乙醇中,在磁力搅拌下加入冰乙酸(50 μL),反应0.5 h后,逐滴加入APTMS(25 μL),反应1 h。然后,将所有溶液转移至离心管中,12 000 r·min-1离心5 min,将所得沉淀用无水乙醇和去离子水洗涤,真空干燥得白色粉末,即为MSN-NH2。取一定量干燥的溴化钾放入玛瑙研钵中,加入适量MSN和MSN-NH2干燥粉末混匀,研磨后压片,将压好的薄片放置于傅立叶红外扫描仪中进行扫描,分析特征吸收峰。
1.2.3 RAPA-MSN的制备
分别称取40 mg MSN-NH2和80 mg RAPA,各加入4 mL甲醇分散后混匀。常温下磁力搅拌8 h后,12 000 r·min-1离心5 min,保留上清液用于包封率的测定,沉淀经洗涤后真空干燥,所得白色粉末即为RAPA-MSN纳米粒。平行制备3份样品,分别测定包封率后取均值。
1.2.4 RAPA-MSN-LN的制备
通过薄膜分散法制备RAPA-MSN-LN[13]。分别称取一定量的DOPE、胆固醇、DSPE-PEG2000(质量比为7:1:7)于茄型瓶,加入15 mL氯仿,超声溶解后将茄型瓶置于45 ℃、真空条件下旋转蒸发30 min 以除去氯仿。取制备好的RAPA-MSN纳米粒,超纯水分散后加入茄型瓶中,45 ℃水浴条件下旋转茄型瓶至脂质薄膜全部脱落。1 h后将所有产物取出,超声波细胞粉碎机中超声处理5 min,功率200 W,工作3 s,间隔5 s,所得混悬液即为RAPA-MSN-LN。将制备的纳米粒置于4 ℃条件下保存。
1.3 RAPA-MSN-LN的质量评价
1.3.1 形态观察
取适量RAPA-MSN-LN溶液滴加至铜网上,自然晾干后,在透射电镜下观察纳米粒形态并拍照记录。
1.3.2 粒径和电位表征
取适量的RAPA-MSN-LN纳米粒溶液,加入超纯水稀释3倍,然后采用激光粒度分析仪测定RAPA-MSN-LN的粒径和电位,每个样品平行制备3份,记录平均粒径和电位。
1.3.3 RAPA包封率的测定
1.3.3.1 色谱条件
色谱柱为Symmetry C18 (4.6 mm×250.0 mm,5 μm),流动相为甲醇:水:乙腈 = 67:18:15,流速为1.0 mL·min-1,柱温40 ℃,检测器为紫外检测器(L-2489),检测波长277 nm。
1.3.3.2 标准曲线的建立
称取一定量的RAPA,以甲醇为溶剂,使用10 mL 容量瓶配制RAPA储备液(500 mg·L-1),然后将储备液稀释成一系列标准浓度:64、32、16、8、4、2、1 mg·L-1,按照“1.3.3.1”项下色谱条件对所有样品进行测定,以峰面积为纵坐标,浓度为横坐标,建立RAPA的标准曲线回归方程。
1.3.3.3 RAPA包封率的测定
取“1.2.3”中保留的上清液,采用高效液相色谱法,按照“1.3.3.1”的色谱条件对上清液进行检测,采用“1.3.3.2”中的标准曲线回归方程计算上清液中RAPA含量[14],并计算包封率;包封率(%)=(RAPA投入量-上清液中RAPA含量)/RAPA投入量×100%。
1.3.4 RAPA-MSN-LN稳定性检测
(1)储存稳定性:取3份适量的RAPA-MSN-LN溶液,分别置于4、25、37 ℃条件下,并于0、1、3、7、15 d时测量RAPA-MSN-LN的粒径。重复3次,取均值。(2)血清稳定性:取RAPA-MSN-LN溶液,加入体积分数20%的FBS,然后将其置于37 ℃水浴锅中,分别于静置0、1、3、6、12、24 h时,取出纳米粒溶液并测定其粒径,平行测定3次取均值。
1.4 RAPA-MSN-LN体外释放实验
配制pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)和pH 5.0 PBS溶液,均含质量分数0.5%的十二烷基硫酸钠。取2份等量的RAPA-MSN-LN溶液,分别加入2种PBS溶液稀释后置于透析袋(截留相对分子质量= 8 000~14 000)中,于37 ℃下100 r·min-1恒温振荡。在振荡0、1、2、4、6、8、12、24、36、48 h取出500 μL释放介质,同时补加等体积的释放介质。每组平行制备3份样品进行释放实验,采用高效液相色谱法测定各时间点释放介质中RAPA的含量,计算释放量,取均值绘制累积释放曲线。

其中Cn为第n个时间点释放介质中的药物浓度,V为释放介质的总体积,Ci为第i个时间点时释放介质中的药物浓度,V0为取样体积。
1.5 RAPA-MSN-LN的体外抗肿瘤实验
1.5.1 细胞毒性实验
取对数生长期人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1,胰蛋白酶消化后,收集细胞并进行计数。将人乳腺癌细胞MCF-7、小鼠乳腺癌细胞4T1分别接种于96孔板中,每孔7.0 ×103个细胞,培养24 h后,将2种细胞均分为MSN-LN组、RAPA组和RAPA-MSN-LN组,MSN-LN组和RAPA组分别加入含0、5、10、20、30 mg·L-1MSN-LN、RAPA培养基,RAPA-MSN-LN组分别加入含0、5、10、20、30 mg·L-1RAPA的RAPA-MSN-LN培养基;每个浓度设3个复孔,孵育24 h后,向各孔加入20 μL MTT溶液(5 g·L-1),培养4 h,然后吸去孔内培养液,加入150 μL二甲基亚砜,37 ℃下100 r·min-1恒温振荡10 min。使用酶标仪于490 nm波长处测各孔的吸光度值,计算细胞存活率。
1.5.2 细胞凋亡检测
取对数生长期人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1,胰蛋白酶消化后,收集细胞并进行计数。将人乳腺癌细胞MCF-7、小鼠乳腺癌细胞4T1分别接种于6孔板,每孔3.0×105个细胞,培养 24 h 后,吸去旧培养基,将2种细胞均设置空白对照组、MSN-LN组、RAPA组和RAPA-MSN-LN组,各组分别加入空白培养基和含有MSN-LN、RAPA和RAPA-MSN-LN的培养基(RAPA质量浓度为20 mg·L-1),每组设3个复孔。继续培养24 h后,胰蛋白酶消化并收集细胞,分别用500 μL的Binding Buffer缓冲液重悬细胞,然后加入5 μL的膜联蛋白(annexin V)-FITC溶液,室温条件下静置15 min,再加入5 μL 的碘化丙啶(propidium iodide,PI)溶液,5 min后使用流式细胞仪检测细胞凋亡情况。
1.6 统计学处理

2 结果
2.1 红外光谱分析特征吸收峰结果
MSN在3 428 cm-1处存在1个特征峰,此峰对应于MSN中O-H的伸缩振动峰,1 632 cm-1处特征峰为O-H的弯曲振动峰,1 102 cm-1和798 cm-1分别对应于Si-O-Si反对称伸缩振动峰和对称伸缩振动峰。氨基改性后的MSN-NH2在668 cm-1附近处出现了新峰,该新峰为N-H的面外弯曲振动峰,表明-NH2 成功地接枝到了MSN上。结果见图1。

图1 MSN和MSN-NH2的红外光谱图Fig.1 Infrared spectra of MSN and MSN-NH2
2.2 RAPA-MSN-LN的质量评价
2.2.1 RAPA-MSN-LN形态、粒径、电位及包封率
RAPA-MSN-LN纳米粒呈球形,分散性好,粒径均一,具有介孔结构。经脂质体包裹后,MSN表面增加了一层薄膜,核-壳结构明显可见,表明脂质体成功地包裹在MSN的表面。RAPA-MSN-LN的粒径为(98.12±1.8) nm,多分散性指数(polydispersity index,PDI)为 0.146±0.013,电位(-18.4±1.2)mV,包封率为(48.92±1.50)%。结果见图2。

图2 RAPA-MSN-LN的形态结构(透射电镜)Fig.2 Morphology of RAPA-MSN-LN(transmission electron microscopy)
2.2.2 RAPA-MSN-LN稳定性
在 4、25 ℃条件下,RAPA-MSN-LN的粒径变化范围在95~115 nm,无显著性增大。在37 ℃条件下,RAPA-MSN-LN的粒径从(95.2±1.0)nm增加到(133.1±2.5)nm,差异有统计学意义(P<0.05),但无沉淀现象。与血清共孵育0、1、3、6、12、24 h,RAPA-MSN-LN粒径分别为(97.9±1.5)、(96.3±1.2)、(96.6±0.8)、(98.2±0.3)、(98.6±1.1)、(99.4±0.7)nm,粒径大小无显著变化(P>0.05)。结果见表1。
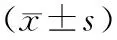
表1 RAPA-MSN-LN在不同环境温度下的粒径变化Tab.1 Particle size changes of RAPA-MSN-LN at different ambient temperatures
2.3 RAPA-MSN-LN在体外不同pH环境中的释放量
RAPA-MSN-LN在pH 5.0环境中释放较快,6 h时累积释放量为(68.24±2.40)%,48 h时累积释放量为(92.24±3.20)%。在pH 7.4环境中,48 h时的累积释放量为(49.93±2.80) %。结果见图3。
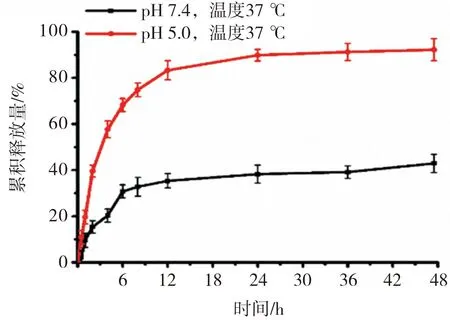
图3 RAPA-MSN-LN的体外释放曲线Fig.3 Release curve of RAPA-MSN-LNinvitro
2.4 RAPA-MSN-LN的体外抗肿瘤作用
2.4.1 RAPA-MSN-LN对人乳腺癌细胞MCF-7和4T1小鼠乳腺癌细胞的毒性作用
RAPA和RAPA-MSN-LN对人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1的杀伤作用均呈现浓度依赖性(P<0.05)。 当RAPA的质量浓度为10、20 mg·L-1时,RAPA-MSN-LN组人乳腺癌细胞MCF-7的存活率显著低于RAPA组,差异有统计学意义(P<0.05)。当RAPA的质量浓度为10、20、30 mg·L-1时,RAPA-MSN-LN组小鼠乳腺癌4T1的细胞存活率显著低于RAPA组,差异有统计学意义(P<0.05)。结果见表2和表3。

表2 3组人乳腺癌细胞MCF-7细胞存活率比较Tab.2 Comparison of survival rate of human breast cancer cells MCF-7 among the three groups

表3 3组4T1小鼠乳腺癌细胞存活率比较Tab.3 Comparison of survival rate of 4T1 mouse breast cancer cells among the three groups
2.4.2 人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1凋亡情况
空白对照组、MSN-LN组、RAPA组和RAPA-MSN-LN组MCF-7细胞的凋亡率分别为(1.1±1.0)%、(8.8±1.5)%、(25.8±1.3)%、(55.9±1.7)%。空白对照组、MSN-LN组、RAPA组和RAPA-MSN-LN组4T1细胞的凋亡率分别为(1.6±1.4)%、(8.2±2.1)%、(35.4±2.1)%和(61.9±1.7)%。RAPA-MSN-LN组MCF-7细胞和4T1细胞的凋亡率均显著高于空白对照组、MSN-LN组、 RAPA组,差异有统计学意义(P<0.05)。结果见图4和图5。

A:空白对照组;B:MSN-LN组;C:RAPA组;D:RAPA-MSN-LN组。图4 各组人乳腺癌细胞MCF-7凋亡情况(Annexin V-FITC/PI双染法)Fig.4 Apoptosis of human breast cancer cells MCF-7 in each group (Annexin V-FITC/PI double staining)
3 讨论
本研究通过溶胶-凝胶法制备了MSN,使用APTMS对MSN进行氨基化修饰,将RAPA载入MSN-NH2后,采用薄膜分散法将pH敏感脂质薄膜包裹在RAPA-MSN-NH2纳米粒的表面。红外光谱分析结果证明,氨基改性后的MSN-NH2在 668 cm-1附近处出现了新峰,该新峰为N-H的面外弯曲振动峰,表明-NH2成功地接枝到了MSN上[15]。
本研究透射电镜结果显示,pH敏感脂质薄膜包裹在MSN表面,形成的纳米粒形态均一,分散性好;RAPA-MSN-LN的包封率为(48.92±1.50 )%,平均粒径为(98.12±1.8 )nm(PDI=0.146±0.013),电位为(-18.4±1.2)mV;这样的RAPA-MSN-LN有利于实现体内药物递送。RAPA-MSN-LN稳定性实验结果显示,RAPA-MSN-LN在4、25、37 ℃环境温度下具有良好的稳定性,受环境因素影响小,相对而言,更适合在低温条件下保存。将RAPA-MSN-LN与血清共孵育不同时间,RAPA-MSN-LN的粒径未发生明显的变化,表明RAPA-MSN-LN具有一定的抗血清成分降解能力,血清稳定性较好。
体外释放实验结果表明,在pH 5.0时,RAPA释放较快,48 h时累积释放量达(92.24±3.20)%。这是因为在酸性条件下,pH敏感脂质体的结构变为疏松的六方晶相,促使MSN孔道中的药物快速释放出来[16],该结果表明RAPA-MSN-LN纳米粒具有pH敏感性,在正常体液环境中较稳定,能够有效防止药物泄漏,从而减少药物对正常组织的毒副作用。
体外抗肿瘤实验结果表明,MSN-LN纳米载体生物相容性好,与RAPA相比,RAPA-MSN-LN对人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1均具有较强的抑制作用;细胞凋亡结果表明,在MCF-7和4T1细胞中,RAPA-MSN-LN均可以有效诱导细胞发生凋亡;且RAPA-MSN-LN组人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1存活率低于RAPA组,细胞凋亡率高于RAPA组,差异有统计学意义;说明RAPA-MSN-LN具有更显著的抑制肿瘤细胞生长的作用。这是由于将RAPA载入MSN-LN后,增加了药物在细胞内的蓄积量,从而使RAPA-MSN-LN对肿瘤细胞的杀伤作用增强。
4 结论
脂质体纳米粒作为一种新型药物传输系统,充分结合了纳米粒和脂质体各自的优点[17]。脂质体结构类似于细胞膜,具有良好的生物相容性,将脂质体包裹在纳米粒表面,可以赋予纳米载体缓释和被动靶向性等优良特性[18-19]。纳米粒作为脂质体的核心,为脂质体提供支撑骨架,给予脂质体机械稳定性[11]。本研究制备的MSN-LN纳米载体具有载药量高,分散性好,粒径均一,且在生物相容性好等优点,不仅提高了难溶性抗肿瘤药物的包封率,而且能够保护药物在正常生理条件下不被释放,从而减少对正常组织的损伤,降低毒副作用。将抗肿瘤药物RAPA载入MSN-LN纳米粒后,纳米粒通过内吞作用进入细胞,增强了RAPA的抗肿瘤作用,RAPA通过抑制肿瘤细胞生长、诱导细胞凋亡而杀死肿瘤细胞。
