体外不同条件诱导L02 肝细胞损伤模型的构建
2024-04-20姜晓杰潘金明琚立萍张晶孙晶晶庄思静席建军庄让笑
姜晓杰,潘金明,琚立萍,张晶,孙晶晶,庄思静,席建军,庄让笑
肝脏作为机体最重要的腺体,在机体新陈代谢、排毒以及胆汁的生成和排泄等方面起到至关重要的作用,肝脏容易受到如酒精、病毒、药物等多种外在因素的攻击而受到损伤,从而影响机体的健康[1-2]。临床常见肝损伤由于病因不同,常分为病毒性肝损伤、自身免疫性肝损伤、药物性、酒精性及化学性肝损伤等。而在多种肝脏疾病的肝细胞损伤中,氧化应激是他们的共同损伤机制,在肝损伤的发病过程中起到重要的作用[3]。
目前,药物性肝损伤模型常用的诱导剂主要有四氯化碳(CCl4)、对乙酰氨基酚(APAP)等,两种诱导剂在过量的情况下均能够对肝脏产生损伤,APAP更能模拟人类因服用过量药物而导致的肝损伤;而氧化性肝损伤常用的诱导剂为过氧化氢(H2O2),由于H2O2在体内释放大量的氧自由基破坏体内的氧化系统从而导致肝损伤,不同浓度的H2O2产生的肝损伤程度也较大。虽然建立各类肝损伤体内外模型较多,但缺乏统一的建模标准。合理的模型是研究肝损伤发生发展机制以及药物筛选的基石,因此,本研究通过体外培养L02 人肝细胞,分别以不同浓度的过氧化氢(H2O2)、对乙酰氨基酚(APAP)和酒精诱导不同时间L02 人肝细胞后,观察L02 肝细胞的细胞存活率,摸索最佳的肝细胞损伤条件,建立稳定、可靠的L02 体外肝细胞损伤模型,为后续相关机制研究、保肝药物的体外活性筛选等提供实验基础和依据,现报道如下。
1 材料与方法
1.1 材料与仪器 人正常L02 肝细胞(上海睿智化学研究有限公司),DMSO(Sigma,批号52396AK),RPMI-1640 培养基(Invitrogen,批号1234-12),胎牛血清(FBS,BIOSERA,批号030813),BCA蛋白浓度测定试剂盒(江苏碧云天生物技术研究所,批号LF146255),细胞计数试剂盒(CCK-8,江苏碧云天生物技术研究所,批号101416170109),丙二醛(MDA)检测试剂盒(江苏碧云天生物技术研究所,批号041916160630),超氧化物歧化酶(SOD)活性检测试剂盒(江苏碧云天生物技术研究所,批号051216160706),丙氨酸氨基转移酶(ALT)检测试剂盒(江苏碧云天生物技术研究所,批号071315160811),天冬氨酸氨基转移酶(AST)检测试剂盒(江苏碧云天生物技术研究所,批号091512160930),H2O2(Sigma,批号 52396AK),APAP(梯希爱化成工业发展有限公司,批号103-90-2),乙醇(北京百灵威科技有限公司,批号1610-5)。CO2细胞培养箱(美国Thermo 公司),酶标仪(美国Thermo 公司),低温离心机(德国Eppendorf 公司),超净工作台(苏州苏洁净化设备公司),分析天平(德国Sartorius 公司),96 孔板(美国Corning 公司)。
1.2 方法
1.2.1 细胞培养及分组 L02细胞复苏后,用含10%FBS 的RPMI-1640 培养液转移至培养皿中,37 ℃、5% CO2条件下培养,每2 ~3 天换液1 次,取对数生长期的细胞用于实验,将L02 细胞随机分为正常对照组和实验组(H2O2组、APAP 组和乙醇组)。
1.2.2 不同条件诱导L02细胞损伤细胞存活率的检测
1.2.2.1 H2O2诱导L02 肝细胞损伤细胞存活率的检测 取对数生长期的L02 细胞,按2.5×105/ml 接种于96 孔板,每孔100l,接种12 h细胞完全贴壁后,正常组加入无FBS 的培养基,H2O2组分别加入不同浓度梯度(300、400、500 和600mol/L)的H2O2且无FBS 的RPMI-1640 培养液,37 ℃、5%CO2条件下分别孵育6、12 和16 h,用CCK-8 检测L02 细胞的存活率,设定正常对照组的细胞存活率为100%,计算细胞存活率,每个浓度设6 个复孔,取平均值。
1.2.2.2 APAP 诱导L02 肝细胞损伤细胞存活率的检测 取对数生长期的L02 细胞,按2.5×105/ml 接种于96 孔板,每孔100l,接种12 h 细胞完全贴壁后,正常组加入无FBS 的培养液,APAP 组分别以不同浓度梯度(1、10、20 和40 mmol/L)的APAP 诱导L02 细胞,在37℃、5%CO2条件下分别培养3 和6 h后,用CCK-8 检测L02 细胞的存活率,设定正常对照组的细胞存活率为100%,每组设6 个复孔,取平均值。
1.2.2.3 乙醇诱导L02 肝细胞损伤细胞存活率的检测 取对数增长期的L02 细胞按2.5×105/ml 接种于96 孔板,每孔100l,接种12 h 后细胞完全贴壁后,正常组加入无FBS 的培养液,乙醇组分别加入不同浓度梯度(0.5%、1%、1.5%和2%)的乙醇,在37℃、5%CO2条件下孵育6 和24 h,用CCK-8 检测L02 细胞的存活率,设定正常对照组的细胞存活率为100%,CCK-8 细胞活性检测按照说明书使用,应用酶标仪在450 nm 处检测吸光度(A450),计算细胞存活率,每个浓度设6 个复孔,取平均值。
1.2.3 体外不同条件作用L02 肝细胞损伤模型的建立 取对数生长期的L02 细胞,按2.5×105/ml 接种于96 孔板,每孔100l,接种12 h细胞完全贴壁后,正常组加入无FBS 的培养基,H2O2损伤组用300mol/L 的H2O2诱导6 h,APAP 损伤组用40 mmol/L的APAP作用3h,乙醇损伤组用1.5%的乙醇作用6h,37 ℃、5%CO2条件下培养,用CCK-8 检测各组L02细胞的存活率;严格按照试剂盒说明书操作,检测各组细胞培养上清中ALT、AST、MDA 含量和SOD 活性,每个浓度设6 个复孔,取平均值。
1.3 统计方法 采用SPSS 22.0 统计软件进行统计处理,计量资料以均数±标准差表示,组间比较采用单因素方差分析,多重比较采用LSD检验。P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度的H2O2诱导不同时间L02 肝细胞存活率的比较 经过不同浓度的H2O2诱导L02 肝细胞不同时间后,L02 肝细胞存活率有不同程度的降低,见图1。与正常对照组比较,300mol/L 的H2O2诱导12 h后,L02肝细胞存活率无明显变化(P>0.05),其余各组细胞在不同浓度的H2O2诱导不同时间后差异均有统计学意义(均P <0.05);在相同诱导时间下,随着H2O2浓度增加,L02肝细胞存活率显著下降;而相同浓度的H2O2随着诱导时间的延长,L02 细胞存活率有增加的趋势。考虑到试验时间的可操作性及细胞的承受能力,采用300mol/L 的H2O2诱导6h为氧化性肝细胞损伤建模的最佳条件。

图1 不同浓度H2O2 诱导不同时间L02 肝细胞存活率比较
2.2 不同APAP 浓度诱导不同时间L02 肝细胞存活率的比较 不同浓度APAP分别诱导L02 肝细胞损伤3 和6 h 后,L02 细胞存活率逐渐降低,见图2。在相同浓度的APAP 诱导L02 细胞时,随着造模时间的延长,L02 肝细胞的存活率逐渐下降,与正常对照组比较,40 mmol/L 的APAP 作用3 和6 h 后,肝细胞存活率分别降至33%和72%左右,差异均统计学意义(均P <0.05);20 mmol/L 的APAP 作用6 h时,细胞存活率降至39%左右,差异有统计学意义(P<0.05),其余各组差异均无统计学意义(均P >0.05)。采用40 mmol/L 的APAP 诱导L02 肝细胞3h为药物性肝损伤模型的最佳诱导条件。
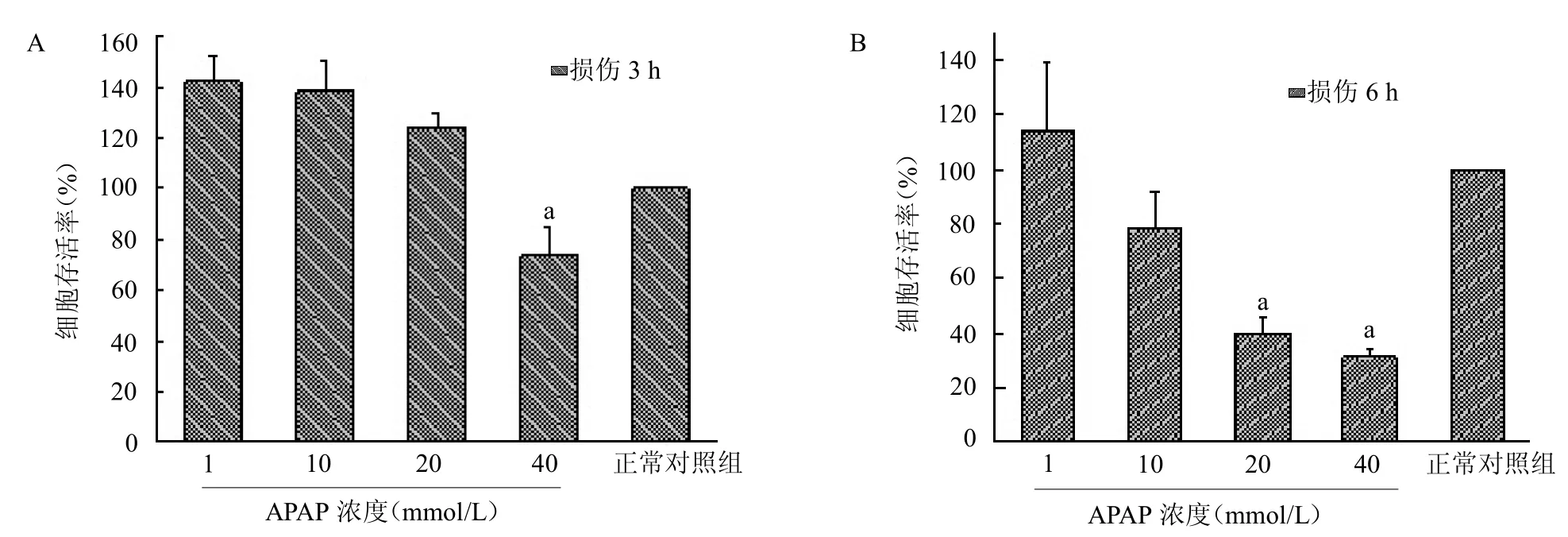
图2 不同浓度APAP 诱导不同时间L02 肝细胞存活率比较
2.3 不同乙醇浓度作用不同时间L02 肝细胞存活率的比较 当用不同浓度乙醇诱导24 h 时,可能由于实验操作以及诱导24 h时已超出细胞的承受能力等因素,导致L02 肝细胞大量坏死,导致参与统计的细胞组数不够,差异无统计学意义,因此不同浓度乙醇诱导24 h 组的数据不纳入统计计算。当乙醇浓度为1.5%和2%诱导6 h 时,细胞存活率显著下降,差异均有统计学意义(均P<0.05),见图3。采用1.5%的乙醇诱导L02 肝细胞6 h 为酒精性肝损伤模型的最佳建模条件。
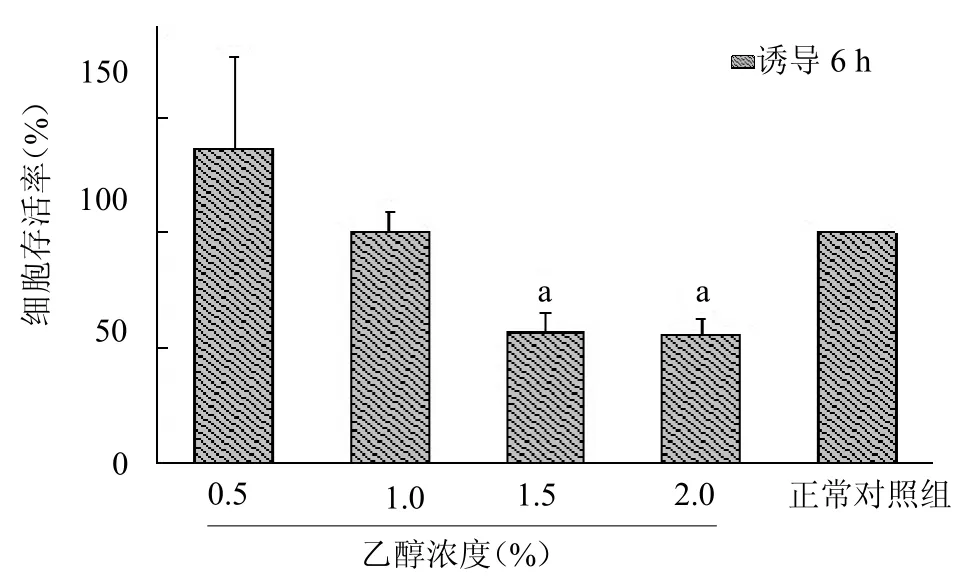
图3 不同乙醇浓度诱导6 h 后L02 肝细胞损伤的细胞存活率比较
2.4 体外L02 肝细胞损伤模型各组细胞存活率比较 H2O2模型组、APAP 模型组和乙醇模型组的细胞存活率均低于正常对照组(均P <0.05),见图4。

图4 不同条件诱导L02 肝细胞损伤的细胞存活率比较
2.5 体外L02 肝细胞损伤模型ALT、AST、MDA 和SOD 指标比较 H2O2模型组、APAP 模型组和乙醇模型组的ALT、AST、MDA 含量均高于正常对照组(均P <0.05),而SOD 活性均低于正常对照组(均P<0.05),见表1。
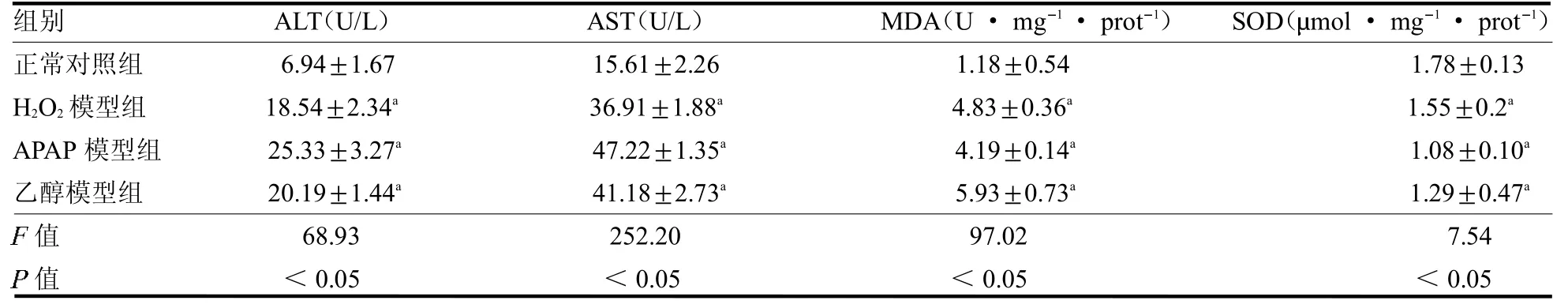
表1 各组细胞ALT、AST、MDA 含量和SOD 活性结果
3 讨论
肝细胞损伤是由各种因素引起的多种肝脏疾病的共同病变基础和表现,而内源性活性氧(ROS)引发的氧化应激是肝损伤最重要的发病机制[4]。正常情况下,机体内抗氧化系统能够维持细胞内氧自由基的代谢平衡,但当肝细胞受到大量氧自由基的攻击,机体氧化平衡系统被打破,造成细胞膜和细胞结构的破坏,导致肝细胞肿胀坏死,进一步使细胞内清除自由基酶的活性下降,使肝细胞损伤进一步加重[5-6]。
氧化性肝损伤主要是一些药物及活性氧在肝脏内生成大量的ROS 引起组织内氧化-还原失衡,从而影响到肝脏内的抗氧化酶系统,使肝细胞功能发生紊乱,肝组织破坏而导致的一类肝损伤;而药物性肝损伤是药物在使用过程中,因药物本身或/及其代谢产物或由于特殊体质对药物的超敏感性或耐受性降低所导致的肝脏损,药物性肝损伤常常是药物研发失败、上市后被撤市或限制使用的主要原因之一;酒精性肝损伤即酒精性肝病是一种进行性发展严重影响身体健康的疾病,而且在世界范围内酒精性肝病的发病率呈逐年上升趋势。因此,建立合适的体内外肝损伤模型,对于深入研究肝损伤的发病机制、药物筛选等具有重要的研究意义。
H2O2是一种重要的活性氧,能够穿透细胞膜使细胞内氧自由基增加,而且极易通过细胞膜与细胞内铁离子反应形成高活性羟基损伤肝细胞[7-8];长期或过量服用APAP后,其代谢产物N-乙酰-对苯醌亚氨将肝细胞中的谷胱甘肽耗竭,进一步与线粒体和脂质膜中蛋白质共价结合,破坏线粒体功能而产生超氧阴离子、H2O2等活性氧[9-10];乙醇能够激活细胞色素P450 活性,导致机体氧化应激的发生,产生ROS,在胞内酶作用下,生成大量超氧阴离子、羟基等自由基[11-13]。
本研究分别用不同浓度的H2O2、APAP 和乙醇作为诱导剂,分别作用L02 人肝细胞不同时间后,采用CCK-8 检测L02 肝细胞的存活率,结果发现,不同条件诱导的L02 肝细胞损伤细胞存活率降低,与正常对照组比较,用300mol/L H2O2诱导6 h、40 mmol/L APAP 作用3 h 和1.5%的乙醇作用6 h 处理的L02 肝细胞存活率差异均有统计学意义(均P <0.05),可作为H2O2、APAP和乙醇诱导L02 肝细胞损伤的最佳条件。通过体外L02 肝细胞损伤模型的建立,对所建立的L02 肝细胞损伤条件进行验证,结果发现,H2O2模型组、APAP 模型组和乙醇模型组细胞存活率均低于正常对照组(均P<0.05),ALT、AST、MDA 含量高于正常对照组,而SOD 活性低于正常对照组(均P <0.05),这提示采用300mol/L H2O2诱导6 h、40 mmol/L APAP 作用3 h 和1.5%的乙醇作用6 h 的L02 肝细胞,可作为不同肝细胞损伤模型的最佳诱导条件。
利益冲突 所有作者声明无利益冲突
作者贡献声明 姜晓杰:论文撰写;潘金明、琚立萍、张晶:细胞培养及模型建立;孙晶晶、庄思静:数据整理、统计学分析;席建军、庄让笑:论文修改及审核
