光照与浮游动物耦合作用对浮游植物群落的影响
——以小兴凯湖为例
2024-04-12董向前袁宇翔路永正武海涛蔡羽曼朱晓艳
董向前,袁宇翔,路永正,武海涛,侯 璐,蔡羽曼,朱晓艳*
(1.吉林建筑大学,松辽流域水环境教育部重点实验室,吉林长春 130118;2.中国科学院湿地生态与环境重点实验室,中国科学院东北地理与农业生态研究所,吉林长春 130102)
浮游植物和浮游动物是湖泊生态系统的重要组成部分。作为湖泊生态系统重要的初级生产者,浮游植物不仅在整个生态系统的能量流动、物质循环和信息传递过程中发挥着重要作用[1],还可以为消费者提供氧气和食物营养[2]。浮游动物在将能量从低营养级生物传递至高营养级生物、调节浮游植物生长、塑造湖泊生态系统功能方面发挥着重要作用[3]。气候变化与人类活动严重影响浮游植物-浮游动物的互作关系及其能量传递效率[4],这将进一步影响更高营养级的消费者和整个生态系统的功能。因此,研究变化环境下浮游植物-浮游动物的互作关系,对于湖泊生态系统的稳定性和可持续性尤为重要。
光照可以直接影响浮游植物和浮游动物的丰度、垂直分布和体尺[5-6],光照还可以通过影响浮游植物的光合作用来影响水生生态系统的食物资源和初级生产力,进而影响浮游动物的生长和群落结构[7]。浮游动物则通过直接摄食或资源竞争来驱动浮游植物群落结构的变化[4,8]。在不同环境条件下,浮游动物捕食与光照的耦合作用能够极大地影响浮游植物的生长和群落组成[9],并且浮游动物对浮游植物的摄食和消化率会随着光照强度的增加而增加[10]。因此,在全球湖泊富营养化和蓝藻暴发加剧的背景下,了解光照与浮游动物耦合对浮游植物群落结构的影响,对于蓝藻水华治理和湖泊生态系统功能提升具有重要意义。
湖泊富营养化和有害藻类水华是全球面临的生态环境问题[11]。兴凯湖是东北亚最大的淡水湖泊,也是典型的浅水富营养化湖泊。受人类活动和气候变化的影响,兴凯湖入湖营养物质和污染物不断增加,引发水质下降、蓝藻水华暴发、鱼类死亡等生态环境问题[12-13]。以往研究多关注兴凯湖浮游植物群落的时空变化规律[14]、蓝藻水华对浮游动物的影响[15]、浮游植物与环境因子的关系[12]等,但关于光照与浮游动物耦合作用对浮游植物群落结构影响的研究仍然欠缺。本研究在兴凯湖夏季水华的背景下,结合野外调查和室内培养实验,开展变化光照条件下浮游动物对浮游植物群落结构的影响,以期为蓝藻水华治理和兴凯湖的可持续管理提供科学依据。
1 材料与方法
1.1 研究区
兴凯湖位于黑龙江省密山市,分为小兴凯湖和大兴凯湖两部分。小兴凯湖(45°16′N~45°24′N,132°20′E~132°50′E)南临大兴凯湖,其间由一条天然沙岗相隔。大兴凯湖和小兴凯湖通过两个泄洪闸相连通,小兴凯湖水环境变化直接影响国际界湖的水生态安全。小兴凯湖东西长约35 km,南北宽约4.5 km,总面积约150 km2,平均水深1.8 m,最大水深4 m,蓄水量最高达3×108m3。研究区域属温带大陆性季风气候,冬季长夏季短;年平均气温3.1 ℃,无霜期149 d,封冻日数为131 d[16]。小兴凯湖周围多农田,且离居民区较近,农田退水、水产养殖等人类活动导致小兴凯湖水色混浊,水质明显恶化,富营养化加剧,夏季蓝藻水华时有发生[13],通常发生在每年的7月至9月[15]。
1.2 样品采集与处理
小兴凯湖湖心区受人类活动干扰较少,2022年8月中旬,在湖心区域设置3个采样点(图1),利用采水器采集表层(0.5 m)水样5 L 直接装入已灭菌的聚乙烯水桶中,低温保存,用于后续室内培养实验。研究发现,小兴凯湖中、大型(>700 μm)桡足类和枝角类浮游动物占主导地位(相对生物量>85%)[17]。为了对比浮游动物存在与否对浮游植物群落的影响,利用13#浮游生物网(200 μm网孔)过滤5 L 水样后低温保存,以除去浮游动物,为了确保消除浮游动物的影响,对过滤后的水样进行至少300个视野镜检,未发现浮游动物。利用采水器采集20 L混合浮游动物样品,经13#浮游生物网(200 μm网孔)浓缩后转入50 mL聚乙烯塑料瓶中,立即加入5%福尔马林溶液进行固定,用于浮游动物鉴定;利用采水器采集1 L浮游植物样品放入聚乙烯塑料瓶中,立即加入1%鲁哥试剂固定,用于浮游植物鉴定。
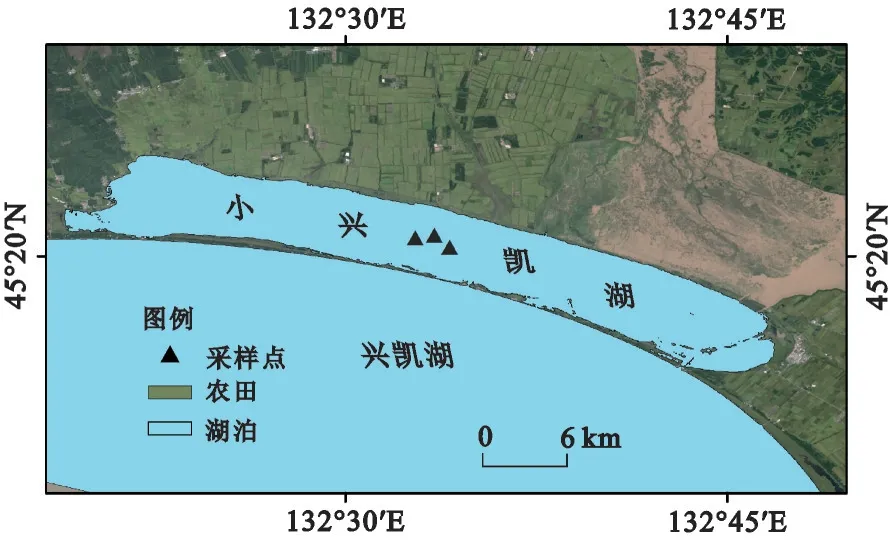
图1 小兴凯湖浮游生物采样点示意图Fig.1 Schematic diagram of plankton sampling sites in the Xiaoxingkai Lake
1.3 室内培养实验
设置滤除与未滤除浮游动物两个实验组,分别取滤除与未滤除浮游动物的水样各500 mL 分装于经消毒灭菌过的1 L容量的三角烧瓶中,同时置于人工培养箱内进行培养,每个实验组各4个重复。野外原位测得的表层水下0.3 m 处的光照强度(上午11∶30)为1 229.4 μmol/(m2·s)(对应培养箱中60%的光照强度),结合其2/3 值和1/3 值模拟一天中太阳光照的强弱变化,以此设置不同培养时段的光照强度,共设置5个培养时段,分别为培养时段1~5,每个培养时段持续12 h,实验共进行60 h(表1)。在培养实验开始时(培养时段0)及上述每个培养时段结束时,取50 mL样品,离心浓缩后进行镜检,用于计算浮游植物的丰度和生物量。实验开始前和结束后,按照《水和废水监测分析方法》(第四版)对水样总氮、总磷等指标进行测定,以分析环境条件对浮游植物群落结构的影响。
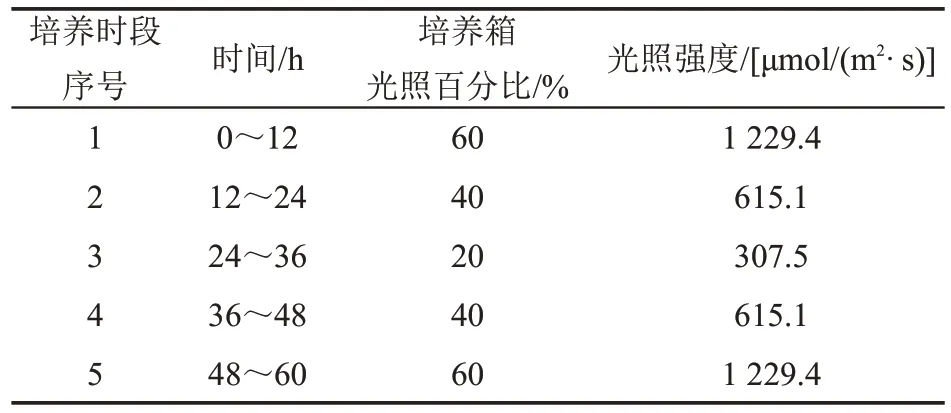
表1 培养实验不同培养时段的光照强度Table 1 Light intensities in different periods of the culture experiment
1.4 浮游生物群落结构分析
1.4.1 浮游动物样品的鉴定
利用显微镜(CKX41,Olympus,Tokyo,Japan),对浮游动物进行种类鉴定和计数。在计数之前将样品混匀,吸取1 mL,滴入计数框,在100~200倍显微镜下鉴定并分种计数。依据《中国淡水轮虫志》[18]、《中国动物志·节肢动物门·甲壳纲·淡水枝角类》[19]、《淡水浮游生物研究方法》[20]和《淡水微型生物与底栖动物图谱》[21],对浮游动物种类进行鉴定。
1.4.2 浮游植物样品的鉴定
利用显微镜(CKX41,Olympus,Tokyo,Japan),进行浮游植物鉴定和计数。在计数之前将样品混匀,吸取0.1 mL,滴入浮游植物计数框中,在400倍显微镜下鉴定并分种计数。根据《中国淡水藻类:系统、生态及分类》[22]、《淡水浮游生物研究方法》[20]鉴定浮游植物种类。
1.4.3 浮游生物群落结构分析
浮游生物优势度(Y)计算公式为:
公式(1)中,ni为第i种浮游生物的个体数,N为所有种类的总个体数,fi为第i种浮游生物出现的频率。若Y>0.02,则该物种为优势种;若Y>0.1,则该物种为主要优势种。
使用Shannon-Weiner 多样性指数(H′)计算浮游植物的生物多样性,计算公式如下:
公式(2)中,Pi代表第i种浮游植物的个体数占总个体数的比例,S为浮游动植物的总种类数。
1.5 数据分析
利用Excel 2019 软件,进行数据整理。利用SPSS 23软件,对理化因子、浮游植物丰度和生物多样性指数进行单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)。利用R 4.2.1软件中corrplot包,进行理化因子和浮游植物丰度的相关性分析。利用ArcGIS 10.2软件,绘制采样点分布图。利用Origin 2021 软件和R 中的ggplot包,绘制其他图形。
2 结果与分析
2.1 浮游动物群落结构
小兴凯湖湖心浮游动物丰度为228.00 ind/L,生物量为0.96 mg/L。后生浮游动物共检出44种,包括3 大类,其中轮虫(Rotifera)的相对丰度占比为32.62%,枝角类(Cladocera)为19.53%,桡足类(Copepoda)为47.85%。浮游动物群落主要优势种为枝角类和轮虫,桡足类未发现优势种。最主要的优势种为月形单趾轮虫、月形腔轮虫和长额象鼻溞,其优势度分别为0.17、0.10和0.10(表2)。

表2 小兴凯湖浮游动物优势种及其优势度指数值Table 2 Dominant zooplankton species and their dominance index values in the Xiaoxingkai Lake
2.2 浮游植物群落丰度的变化
滤除与未滤除浮游动物实验组的浮游植物自然群落初始丰度分别为13.77×104cells/L和13.25×104cells/L(图2)。在整个变化光照强度培养实验周期,滤除与未滤除浮游动物实验组浮游植物丰度呈现相同变化趋势,即浮游植物丰度先降低后增加。在实验初期,浮游植物丰度随光照强度降低而降低(p<0.01),并且在培养时段2[光照强度为615.1 μmol/(m2·s)]出现谷值,滤除与未滤除浮游动物实验组浮游植物丰度的谷值分别为7.14×104cells/L和9.43×104cells/L。在最低光照强度[培养时段3,307.5 μmol/(m2·s)]时,浮游植物丰度开始显著增加(p<0.01),之后浮游植物丰度随着光照强度提高而增加(培养时段4~培养时段5)。在培养前期(培养时段0~培养时段2),未滤除浮游动物实验组的浮游植物丰度显著低于滤除浮游动物的实验组(p<0.05),但在培养后期(培养时段3~培养时段5)却显著高于滤除浮游动物的实验组(p<0.01,n=4)。培养结束时,未滤除浮游动物实验组浮游植物丰度显著高于初始丰度(p<0.05),而滤除浮游动物实验组的浮游植物丰度略低于初始丰度(p>0.05)。
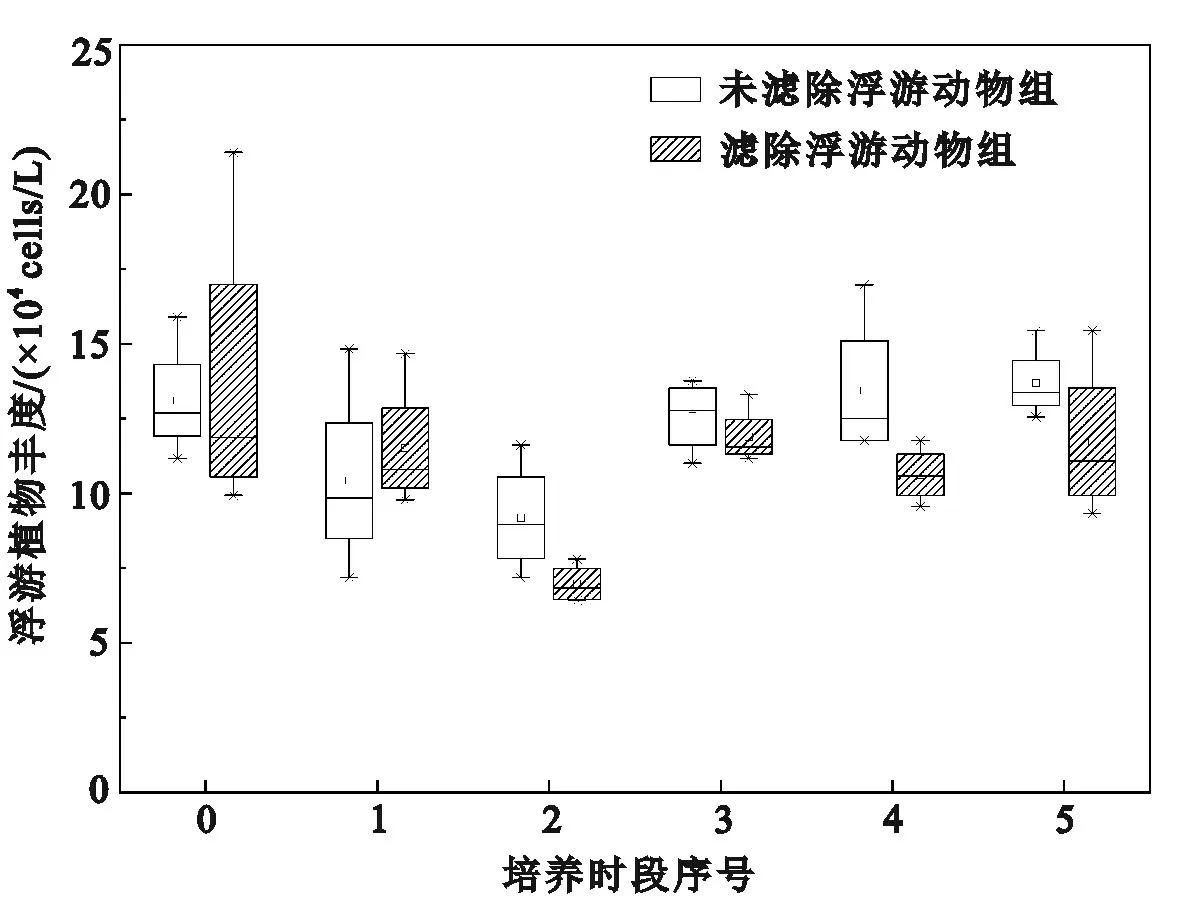
图2 不同培养时段浮游动物对浮游植物群落丰度的影响Fig.2 Effects of zooplankton on phytoplankton community abundance in different culture periods
2.3 浮游植物多样性及优势种变化
滤除与未滤除浮游动物实验组浮游植物多样性指数都呈现先减小后增大再减小的波动趋势,并且从培养时段1 开始浮游植物丰度与多样性指数呈现相反趋势(图2 和图3)。在整个培养周期,滤除浮游动物实验组的浮游植物优势种数量显著高于未滤除浮游动物实验组(p<0.05),表明浮游动物的存在影响了浮游植物群落结构。未滤除浮游动物实验组的3 个主要优势种分别为蓝藻门的铜绿微囊藻、束缚色球藻和裸藻门的细粒囊裸藻;而滤除浮游动物实验组的7 个优势种分别为蓝藻门的铜绿微囊藻、极小集胞藻,硅藻门的梅尼小环藻,裸藻门的细粒囊裸藻以及绿藻门的小球藻、椭圆卵囊藻和狭形纤维藻(表3)。铜绿微囊藻的丰度变化与整个浮游植物群落丰度的变化趋势一致(图4),均先降低后增加,铜绿微囊藻的丰度是其他各优势种丰度的10 倍左右。在整个培养周期,在滤除与未滤除浮游动物实验组中铜绿微囊藻均为主要优势种(Y>0.1),其优势度和丰度在不同实验组之间差异不明显(p>0.05)。
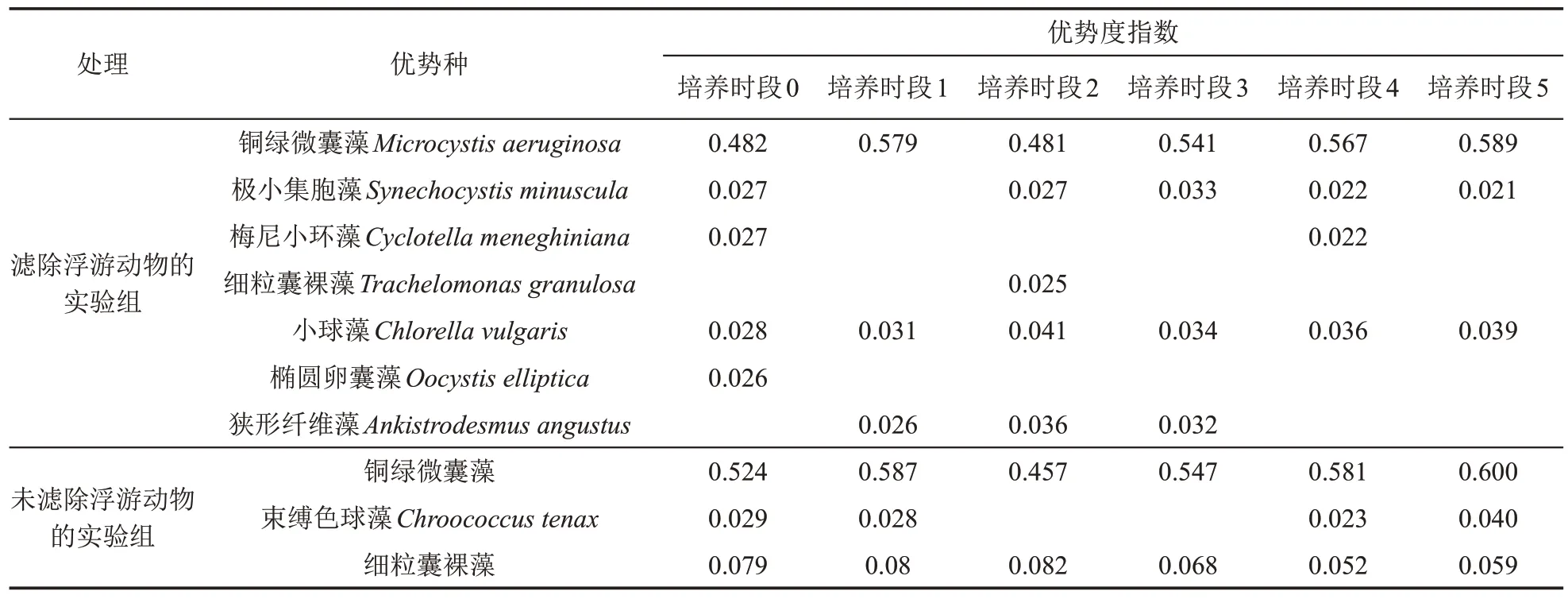
表3 不同培养时段浮游动物对浮游植物优势种及优势度指数值的影响Table 3 Impacts of zooplankton on dominant phytoplankton species and dominance index values in different culture periods
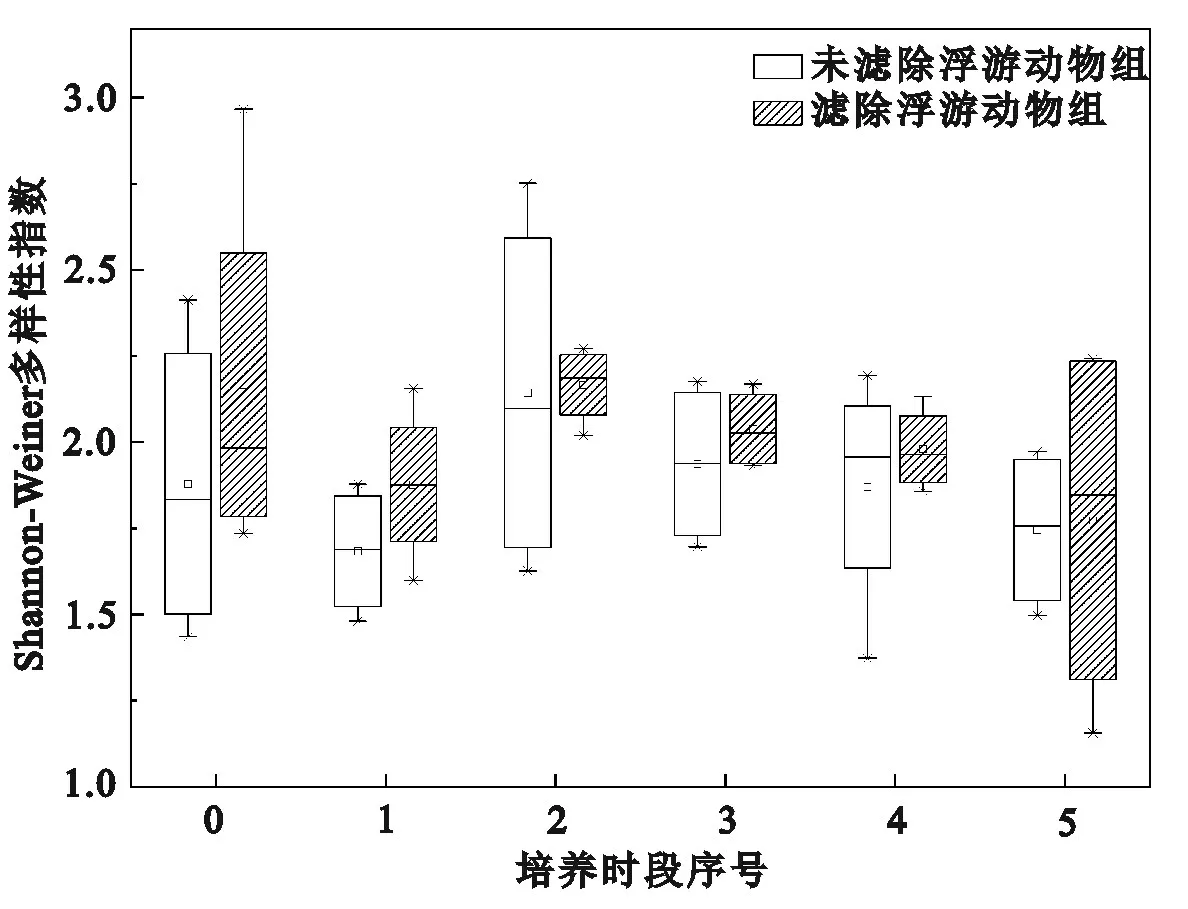
图3 不同培养时段浮游动物对浮游植物群落Shannon-Weiner多样性指数的影响Fig.3 Effects of zooplankton on Shannon-Weiner diversity index of phytoplankton community in different culture periods
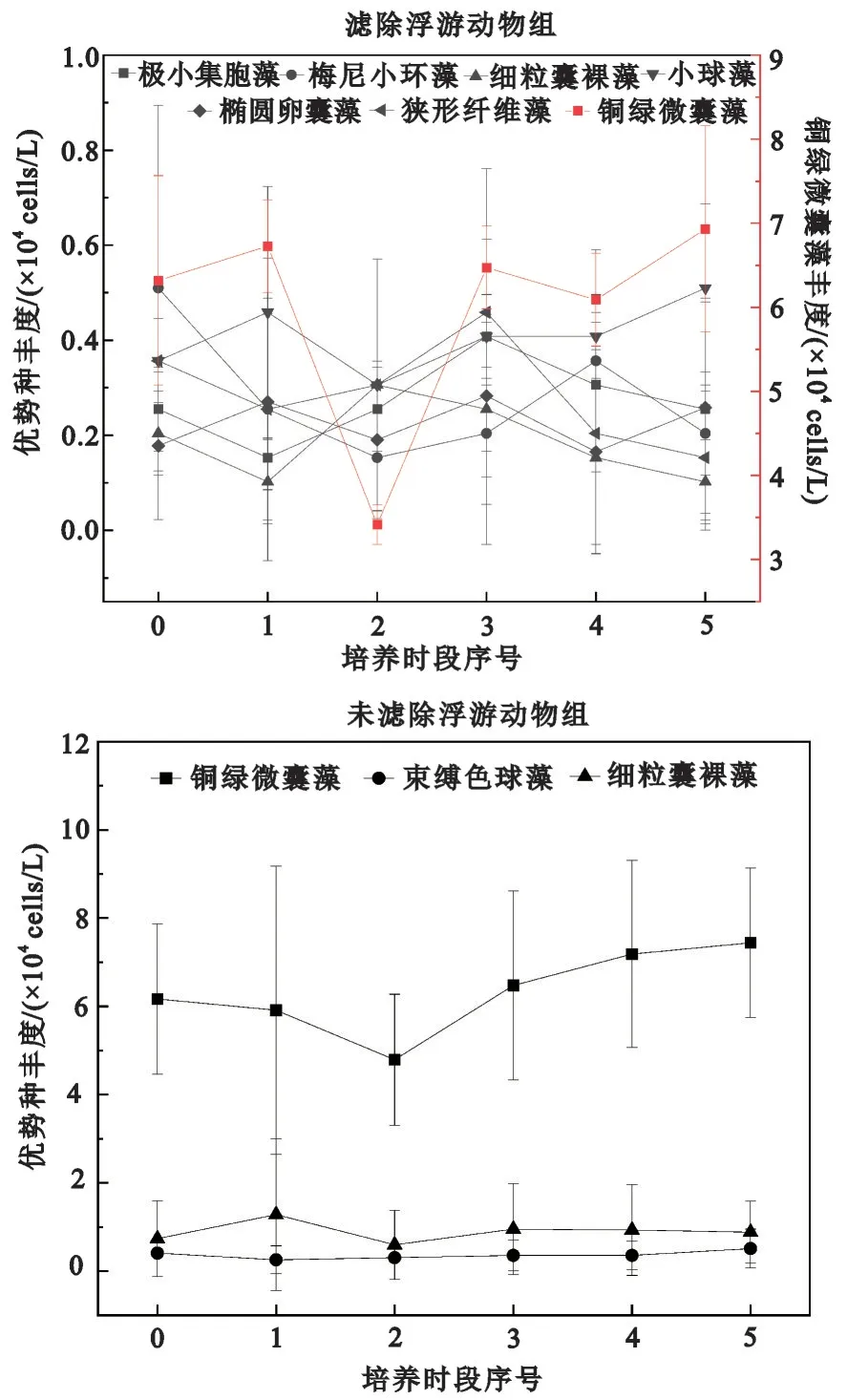
图4 滤除与未滤除浮游动物实验组浮游植物优势种丰度的变化Fig.4 Changes of dominant phytoplankton species in experimental groups of filtered and unfiltered zooplankton
双因素方差分析表明(表4),光照强度、浮游动物及二者交互作用对铜绿微囊藻丰度的影响均不显著(p>0.05),浮游动物对束缚色球藻和细粒囊裸藻无显著影响(p>0.05),但是光照强度、浮游动物及二者交互作用对其他浮游植物优势种丰度均有显著影响(p<0.05),并且光照强度变化的影响比浮游动物及二者交互作用的影响更显著,表明光照是影响浮游植物优势种丰度的更主要因素。
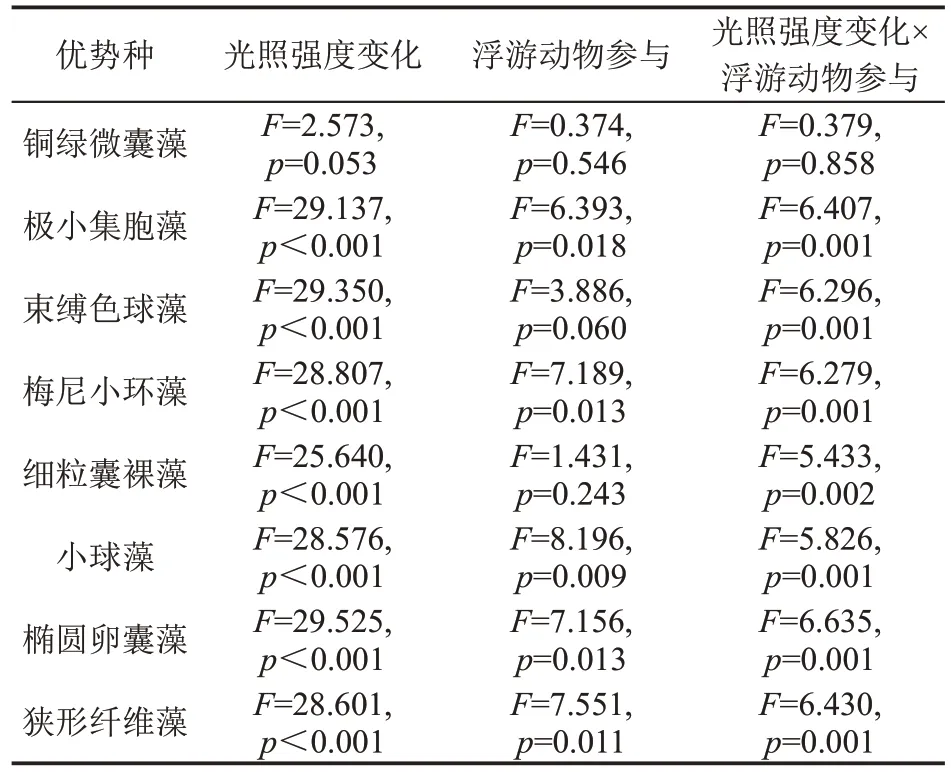
表4 光照强度与浮游动物对浮游植物优势种丰度影响的双因素方差分析结果Table 4 Two-way variance analysis results for effects of light intensity and zooplankton on abundance of dominant phytoplankton species
实验期间,各藻门相对丰度呈波动变化,其中蓝藻门在滤除与未滤除浮游动物组中均占绝对优势,占比约60%;绿藻门、硅藻门相对丰度占比次之(图5)。滤除浮游动物组的裸藻门相对丰度在培养时段1与培养时段2之间差异显著(p<0.05);未滤除浮游动物组的隐藻门和裸藻门相对丰度在培养时段0至培养时段4之间变化显著(p<0.05)。对相同光照强度条件下不同种类浮游植物相对丰度的变化进行分析发现,浮游动物对硅藻门、隐藻门和甲藻门丰度有显著影响(p<0.05),对裸藻门有极显著影响(p<0.01),对蓝藻门、绿藻门和金藻门影响不显著(p>0.05)。
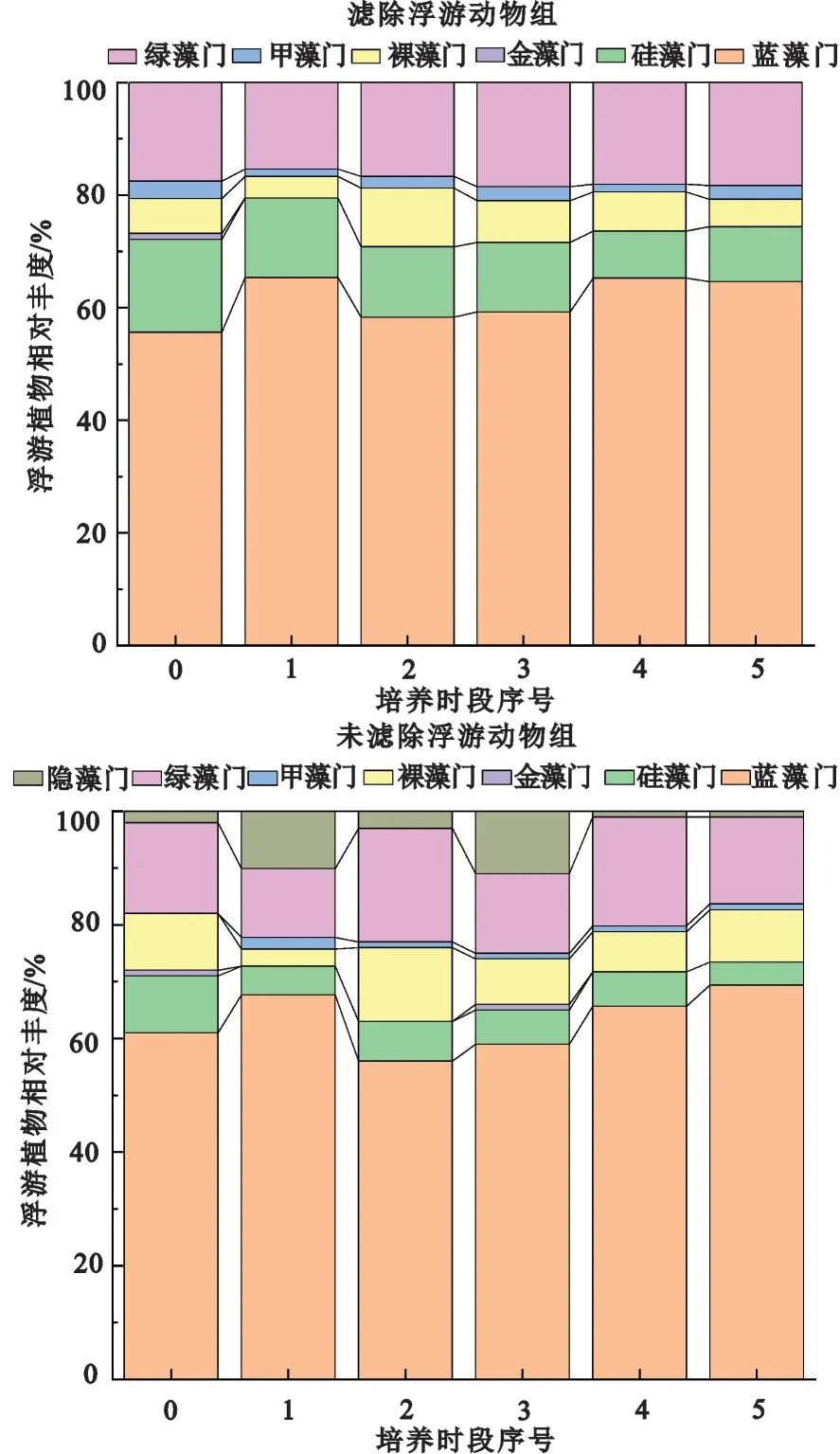
图5 滤除与未滤除浮游动物实验组不同门类浮游植物相对丰度的变化Fig.5 Relative abundance changes of different phytoplankton phyla in experimental groups of filtered and unfiltered zooplankton
2.4 环境因子的变化
水样总氮、总磷浓度和pH在实验开始和结束时差异不显著(p>0.05,表5)。环境因子与浮游植物丰度的相关分析表明,总氮、总磷浓度和pH 与浮游植物群落丰度的相关性不显著(p>0.05)。
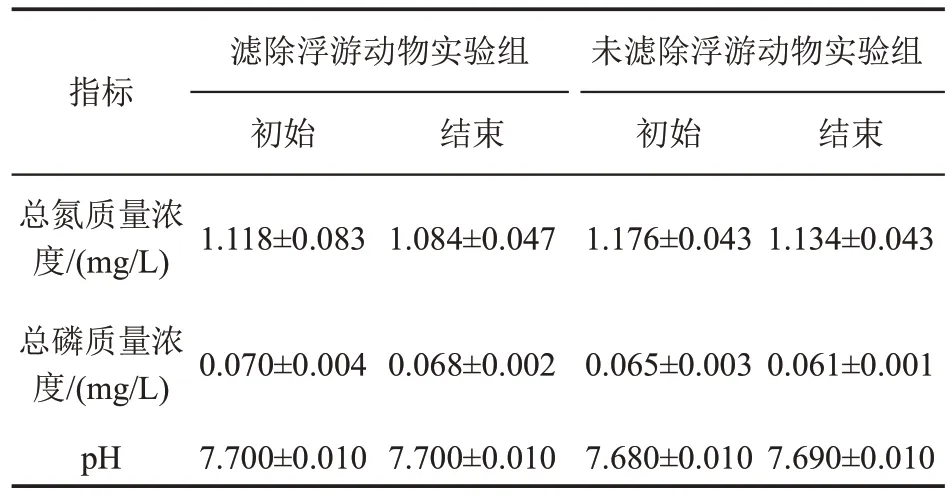
表5 培养实验开始和结束时总氮、总磷质量浓度和pH的变化Table 5 Variations of total nitrogen,total phosphorus mass concentrations and pH at the beginning and the end of the culture experiment
3 讨 论
浮游植物群落结构受水体环境因子的上行效应和浮游动物、鱼类等消费者摄食的下行效应以及种间竞争的影响[23]。本研究中实验开始和结束时水样总氮和总磷浓度均处于富营养水平,在培养实验开始和结束时差异不显著,且与浮游植物丰度无明显相关性,因此总氮和总磷浓度不是浮游植物生长的限制因子。光照是浮游植物生长的必要条件,光照强度影响着浮游植物的生长速率、光适应能力、种间竞争等[24];浮游动物是初级生产者与较高营养级之间的纽带,其中的后生浮游动物是浮游植物的主要捕食者,每日可消耗一半以上的初级生产力[25]。在本研究中,光照强度是影响极小集胞藻、束缚色球藻、梅尼小环藻等浮游植物优势种生长的关键因素,且光照强度变化与浮游动物摄食具有交互作用(见表4),具体表现在浮游植物丰度受光照强度变化的同时被浮游动物摄食,而浮游动物的摄食活动又受光照强度变化的调节[9,26],因而浮游植物受光照变化与浮游动物耦合作用的影响。
3.1 光照与浮游动物耦合作用对浮游植物生长的影响
本实验设计的培养时段1~培养时段3 为光照强度降低阶段,培养时段3~培养时段5为光照强度增加阶段,培养时段3为光照强度谷值。在整个培养周期,浮游植物群落丰度在光照强度波动下近似呈线性增长或降低,但不同种类之间有所差异。从优势种来看,光照强度变化对铜绿微囊藻、束缚色球藻和细粒囊裸藻等优势种的优势度和丰度影响都较大,但无论低光照还是高光照条件下铜绿微囊藻都占据绝对优势(Y>0.1),在对光照的种间竞争中胜出。不同浮游植物种类对光照强度变化响应的种间差异可能是由色素含量、呼吸成本、细胞大小以及光保护和光损伤修复途径的差异所致[27],而富含多种藻蛋白的铜绿微囊藻能够通过调节自身的光合特性来适应不同光质,从而获得较好的生长活性[28]。此外,浮游植物可以通过调节叶绿素含量、叶绿素a 和叶绿素b 的比值、光保护机制等方式来适应不同的光照条件,如蓝藻对弱光环境有较强适应能力,绿藻对高光环境有较强适应性,而有混合营养能力的群体具有弱光竞争能力和高光需求的性状[29-30]。由此导致不同种类浮游植物的生长情况在光照强度变化条件下呈现较大差异。
低光照会降低浮游植物生长的温度敏感性[27],进而减缓浮游植物的生长速度。之前在兴凯湖浮游植物群落的研究中也发现,光照和铁耦合作用影响了浮游植物群落结构,高光照条件下蓝藻生长较快,而低光照限制了浮游植物的生长速率[13]。在本研究中,恒温条件下,在光照强度开始降低的时段浮游植物丰度随之下降,在最低光照强度下[615.1 μmol/(m2·s),培养时段2]浮游植物丰度反而呈现增加趋势,而在光照强度开始增加的时段浮游植物丰度却略有降低,这说明浮游植物群落中的某些种类可能对光照强度变化的响应不敏感或存在滞后性[31-32]。这是因为浮游植物信号转导运作具有内在的滞后性,导致在强光下色素合成下降或在弱光下色素合成增强,这与光收集复合蛋白的分子信号合成水平的变化有关[33]。虽然铜绿微囊藻在低光照条件下仍然保持较高的丰度和优势度,但整体生长速率下降,导致培养初始阶段和结束阶段铜绿微囊藻丰度差异不大(p>0.05)。这可以为解释小兴凯湖铜绿微囊藻水华发生但持续时间较短和难以大面积暴发提供参考依据。小兴凯湖水体透明度较低,仅为(0.32±0.02)m[12],且风浪较大,这极大地降低了水面下的光照强度,从而可以有效限制水华藻类的光合作用,抑制水华强度。
浮游动物是水生生态系统中的重要组成部分,其可以通过捕食活动直接影响浮游植物的密度[34]。研究期间小兴凯湖浮游动物主要优势种为月形单趾轮虫、月形腔轮虫和长额象鼻溞,均为滤食者,主要以藻类、细菌和有机质为食。在培养时段1 未滤除浮游动物组浮游植物丰度显著低于滤除浮游动物组(见图2),且浮游植物优势种种类、数量均有明显差异(见图4),这表明浮游动物的存在影响了浮游植物群落结构,对特定藻类进行了摄食。而在光照强度增加的培养时段4 和培养时段5,未滤除浮游动物组的浮游植物平均丰度高于滤除浮游动物组,这可能是因为浮游动物的捕食减少了浮游植物的数量,同时还减少了浮游植物之间的营养竞争,增加了未被捕食的浮游植物细胞的营养供给[35],使得光照充足条件下,未滤除浮游动物组浮游植物生长速率高于滤除浮游动物组。从优势种来看,浮游动物的存在对铜绿微囊藻优势度和丰度基本无影响,而对束缚色球藻、细粒囊裸藻等其他优势种影响较大。在整个培养周期,铜绿微囊藻在滤除浮游动物组与未滤除浮游动物组均为主要优势种,且优势度差异不明显,表明浮游动物的存在对铜绿微囊藻的生长无影响。然而,有无浮游动物对裸藻门、硅藻门、隐藻门和甲藻门丰度均有显著影响,但对蓝藻门、绿藻门和金藻门丰度影响不大,说明小兴凯湖浮游动物可能主要摄食裸藻、硅藻、隐藻和甲藻。之前的研究也表明,大型后生浮游动物对个体较大的浮游植物(如硅藻、裸藻)具有摄食偏好,而非微囊藻,从而促进了微囊藻在浮游植物群落中的竞争优势[8]。
3.2 光照与浮游动物耦合作用对浮游植物群落生物多样性的影响
滤除浮游动物组与未滤除浮游动物组浮游植物群落的Shannon-Weiner多样性指数变化趋势一致,总体表现为高光照强度下物种丰富度降低和低光照强度下物种丰富度增加,这与丰度变化刚好呈现相反趋势。浮游植物群落结构受光照、温度、pH、营养盐等环境因子影响[36-37],同时藻类之间存在竞争关系,优势种的过度生长可能抑制其他浮游植物的生长,尤其是当环境条件更加有利于优势藻种生长时。在本研究中,实验前后水体总氮和总磷浓度均处于富营养水平,有利于优势藻种铜绿微囊藻的生长,并且其代谢产生的微囊藻毒素,对其他浮游植物以及浮游动物有毒害作用,能够降低其存活率[31-32],从而可以从种间竞争中胜出并调控浮游动物对其他种类浮游植物的捕食。我们之前的研究也表明,铜绿微囊藻水华降低了浮游动物的物种多样性,但增加了它们的生物量、功能分散度和功能均匀性[15]。本研究中,在有无捕食者存在的情况下浮游植物物种多样性指数都呈现出与丰度波动相反的趋势,这也证明了在铜绿微囊藻竞争占优势的情况下,浮游动物加强了对其他种类浮游植物的捕食,从而影响了浮游植物物种多样性。
总体来看,无论有无捕食者存在,除甲藻和金藻外,其他浮游植物生长对光照强度的变化响应都很强烈,这可能是由于浮游植物和浮游动物的营养级联关系在低光照、高营养盐的环境下变弱[33],从而影响了捕食者对浮游植物的下行效应。小兴凯湖浮游植物群落主要受营养盐、浊度和滤食压力影响[34],优势浮游动物功能群对大型藻类的摄食偏好促进了蓝藻在浮游植物群落中的竞争优势,导致小兴凯湖夏季易发生蓝藻水华。此外,夏季小兴凯湖水温较高,水流速较缓且浊度较高,为喜高温、高营养盐、低流速,耐受低光照的微囊藻生长创造了适宜的生境,从而增加了微囊藻水华的风险。因此,在兴凯湖水华治理时,应关注主要水华藻类的生理生态特征对水环境的响应机制,并对浮游植物的种间关系及其对浮游动物和鱼类等消费者的影响开展深入研究。
4 结 论
采集小兴凯湖原位水样,研究了浮游动物与光照耦合作用对浮游植物群落结构的影响,发现有无浮游动物和不同光照强度共同调控了浮游植物群落结构。不同浮游植物种类对浮游动物和光照强度变化的响应存在种间差异,且对光照强度变化的响应可能存在滞后性。室内培养实验期间,无论有无捕食者存在,浮游植物主要优势种均为铜绿微囊藻,表明浮游动物摄食不是影响蓝藻水华的主要因素。浮游植物多样性指数的变化趋势与浮游植物丰度变化相反,可能与高营养盐条件下铜绿微囊藻的竞争优势有关。
