山荆子MbLRK10L1.1基因正调控腐烂病抗性
2024-04-11鲁远冒霞王超孙娥郑艳左存武
鲁远 冒霞 王超 孙娥 郑艳 左存武

摘 要 此前从东北山荆子(Malus baccata)中发现可能参与腐烂病信号响应的WAK基因 MbLRK10L1.1,在此基础上,拟结合生物信息学分析、表达分析和功能验证研究其在腐烂病抗性中的作用机制。结果表明, MbLRK10L1.1响应Valsa mali(Vm)信号,并且在瞬时表达 MbLRK10L1.1后,‘烟富6号果实表面病斑扩散速率明显减小, FRK1(Flg22-induced Receptor-like Kinase 1)、TaNOX(Triticum aestivum NADPH oxidase)、 EDS1(Enhanced disease susceptibility 1)等相关抗病基因均有不同程度的上调表达。表明 MbLRK10L1.1可通过JA、SA、SAR以及PTI等途径正调控果实对腐烂病菌的抗性。
关键词 腐烂病(Valsa canker);WAK基因;瞬时表达标记基因
由黑腐皮壳菌(Valsa mali,Vm)引起的腐烂病(Valsa canker)是中国乃至亚洲苹果产区最为严重的真菌型病害之一,主要危害枝干、果实等组织,导致产量和果实品质下降[1]。随着苹果种植面积不断扩大,腐烂病成为制约国内苹果产业可持续发展的重要因素之一 [2]。目前提倡将农业防治、生物防治和化学防治相结合的综合防控措施,但大面积推广受到抗病品种少、易复发、劳动力投入成本高等因素的限制[3]。长期以来,抗病育种是有效防控该病害最长久、高效、环保的措施之一,而鉴定抗病基因可以加快抗病育种进程。
细胞壁相关类受体激酶(Wall-associated kinases, WAK)是植物的类受体激酶( Receptor-like kinases, RLKs)中一类重要的亚家族,N末端存在類表皮生长因子型(epidermal growth factorlike, EGF)结构域[4]。WAK部分成员与细胞壁中的果胶共价结合,在激发植物免疫反应中起重要的调控作用[5]。拟南芥基因组包括5个WAK基因( WAK1~ WAK5), AtWAK1是第一个被鉴定的植物WAK,可识别寡聚半乳糖苷,进而激活防御反应[6]。茉莉酸甲酯(Methyl jasmonate,MeJA)可增加海岛棉 GbWAK3的转录,从而提高棉花对黄萎病菌的抗性[7]。此后,在水稻和烟草中都发现WAK家族基因的同源基因,其激活免疫反应并参与寄主对多种病原物抗性的调控[8]。
当植物激活免疫反应时,会产生活性氧(Reactive oxygen species, ROS)、激活有丝分裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)级联、细胞壁上的胼胝质(Callose)沉积以及免疫相关基因的转录[9]。茉莉酸(Jasmonic acid, JA)和水杨酸(Salicylic acid, SA)作为植物中与防御有关的重要信号分子,在病原体侵染时,植物细胞中JA和SA水平的增加,从而诱导相关抗病基因转录[10]。由辅因子 NPR1(Nonexpressor of pathogenesis related genes 1)调节的系统获得抗性(Systemic acquired resistance, SAR)由病菌局部侵染激活,在受侵部位产生系统信号,转运到未受侵部位,激活防卫反应,从而产生对多种病菌的抗病反应[11]。在植物触发免疫反应时,与免疫相关的标记基因(亦称为Marker基因)的表达量显著升高。因此,分析不同代谢通路Marker基因可快速、方便地检测是否激发抗性反应。
山荆子(Malus baccata)是北方苹果产区广泛应用的砧木之一,对多种生物和非生物胁迫具有较强适应能力,对腐烂病亦具较强抗性[12]。前期工作中,结合转录组学分析,鉴定出一个可能调控腐烂病抗性的基因 MbLRK10L1.1。基于此,本研究结合生物信息学分析、瞬时表达验证及标记基因(Marker基因)表达分析等多种技术手段,以期明确 MbLRK10L1.1对腐烂病抗性的作用及可能的作用机制,为抗病基因的鉴定提供参考。
1 材料与方法
1.1 试验材料
1.1.1 病菌、材料及细胞系 腐烂病菌(Valsa mali,Vm)菌株Vm-A-019分离自甘肃静宁发病‘富士苹果树韧皮组织,经单孢分离获得,对‘长富2号具有强致病力,经ITS序列测定确定为Vm。东北山荆子组织材料由国家果树种质兴城苹果圃提供,其悬浮细胞通过幼嫩叶片诱导后悬浮培养获得,经多次继代后,细胞松散、颜色淡黄、活力良好且状态稳定。生长培养基(MS)为M519(PhytoTech Labs,美国)。
1.1.2 菌株、载体和试剂 大肠杆菌感受态TreliefTM 5SymbolaA@购买自擎科生物科技有限公司(北京),农杆菌感受态GV3101,克隆载体pMDTM19-T均购买自TaKaRa(北京)。表达载体pFGC5941与pBI121均保存于甘肃农业大学园艺学院果树分子生物学实验室。柱式植物RNA out(含DNA酶)试剂盒购买自天恩泽基因科技有限公司(北京)。Evo M-MLV RT-PCR试剂盒、LA-Taq酶、Evo-M-MLV反转录试剂盒Ⅱ、SYBR Green Pro Taq HS预混型qPCR试剂盒、Steady Pure质粒DNA提取试剂盒、Steady Pure DNA凝胶回收试剂盒、DNA连接试剂盒均购自艾科瑞生物科技有限公司(湖南)。核酸内切酶AscⅠ和AvrⅡ购自Thermo scientific公司(美国)。
1.2 试验方法
1.2.1 生物信息学分析 山荆子和苹果WAKs的CDS和蛋白序列均下载自蔷薇科基因组在线数据库GDR(Genome Database of Rosaceae species, GDR; https://www.rosaceae.org/species/malus/all)。拟南芥WAKs蛋白序列下载自拟南芥在线数据资源库(Arabidopsis information resource, TAIR; http://www.arabidopsis.org)。利用Clustal X软件进行多序列比对,并用进化分析软件MEGA5.0 (http://www.megasoftware.net/),以邻接法(Neighb or-joining method)构建进化树,执行参数为p-distance模式(p-distance)、部分删除(Partical deletion)、有根树设置1 000次重复(Bootstrap replicated 1 000)。 MbLRK10L1.1的结构域组成、理化性质和亚细胞定位预测分析分别利用在线软件SMART(http://smart.emblheidelberg.de/)、ExPASy ProtParam(https://web.expasy.org/)和WoLF PSORT(https://www.genscript.com/wolf-psort.html)进行。启动子区域(起始密码子上游3 000 bp)的顺式作用元件(cis-element)在PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中分析。
1.2.2 苹果腐烂病代谢物收集及细胞处理 将Vm-A-019菌株接种至PDA(Potato dextrose agar)培养基,活化培养72 h后,取10个菌饼接种至100 mL PDB(Potato dextrose broth)培养基,黑暗、静置培养72 h(每隔12 h震荡1次),经离心和过滤除菌,获得菌株代谢物原液。利用40目细胞过滤筛收集小的东北山荆子细胞团,并将500 μL细胞(密实体积)转入至16 mL MS液体培养基,25 ℃、130 r/min摇床黑暗培养。培养 48 h后,加入4 mL 菌株代谢物(VmM),分别于0、1、3 和6 h后收集悬浮细胞,速冻后-80 ℃保存,备用。
1.2.3 基因克隆和载体构建 利用软件Primer Premier 5设计 MbLRK10L1.1全长序列扩增的引物(1.1F:5′-CTGGCGCGCCATGCCTACCCATTTTCTCCTAAAAC-3′;1.1 R:5′- TCCCTAGGTTACGGCGGAGAACGAATAAGT- TTAC- 3′),送至通用生物股份有限公司(安徽)合成。利用柱式植物RNA out(含DNA酶)试剂盒提取山荆子悬浮细胞的总RNA,经Evo M-MLV RT-PCR试剂盒反转录合成cDNA。以该cDNA为模板,利用LA-Taq酶进行PCR扩增。反应体系如下:cDNA模板1 μL;LA-Taq酶 10 μL;上下游引物(均為10 μmol/L)各1 μL;加水至总体积20 μL。PCR反应产物用1%的琼脂糖凝胶电泳检测。PCR产物回收步骤参考Steady Pure DNA凝胶回收试剂盒。将上述胶回收的片段连接到pMDTM19-T载体上,连接产物转化大肠杆菌感受态TreliefTM 5α。挑取阳性克隆于 1 mL LB培养基中[含氨苄青霉素(Amp),100 mg/L], 37 ℃,180 r/min摇床培养12 h。活化后的菌液送至上海生工生物工程有限公司测序。将碱基无错配的菌液扩繁后用Steady Pure质粒DNA提取试剂盒提取质粒,经AscⅠ与Avr Ⅱ酶切获得 MbLRK10L1.1基因片段。参考DNA连接试剂盒将酶切后的 MbLRK10L1.1基因片段与表达载体pFGC5941进行连接,获得重组质粒(pFGC5941- MbLRK10L1.1)后进一步转化农杆菌GV3101,涂布于LB固体培养基上[含卡纳青霉素(Kana)100 mg/L,利福平(Rif)37.5 mg/L],28 ℃培养箱倒置培养48 h后挑取阳性克隆,经PCR验证获得阳性单克隆农杆菌,扩繁后-20 ℃保存,备用。
1.2.4 果实瞬时表达分析 将分别携带pFGC5941- MbLRK10L1.1、pFGC5941和pBI121的农杆菌菌株活化后,利用农杆菌渗入法在‘烟富6号果实(花后180 d)瞬时表达,方法参考Mao等[13]的报道。将活化后的农杆菌菌株用MES-KOH重悬,于4 ℃静置4 h,用1次性无菌针头吸取0.2 mL菌液注射进苹果果实,25 ℃培养3 d后用GUS染色液(索莱宝,北京)对注射pBI121菌液的果肉进行染色。当果肉呈现蓝色,表明基因成功瞬时表达。之后在注射菌液的部位接种已活化的Vm,于25 ℃的培养箱中继续暗培养,每隔12 h测量1次果实病斑。同时,于Vm处理0、3、6和12 h时收集接种部位的果肉样品,速冻后-80 ℃保存,用于Marker基因的表达模式分析。以上试验设3次生物学重复。
1.2.5 基因表达分析 利用柱式植物RNA out(含DNA酶)试剂盒(北京)提取各样品总RNA,经凝胶电泳质量检测合格后利用的Evo M-MLV反转录试剂盒Ⅱ(湖南)合成用于RT-qPCR的cDNA。利用在线软件Primer 3.0(http:∥primer3.ut.ee/)设计引物,Actin引物采用Zuo等[14]的报道,抗性反应相关Marker基因引物参考孙娥等[15]的报道(表1)。
1.2.6 统计分析 原始数据处理采用Microsoft Excel 2010软件,利用2-△△CT计算基因的相对表达量,利用t-test(P<0.05)分析差异显著性,将处理好的数据利用OriginPro 8.0进行图形可 视化。
2 结果与分析
2.1 MbLRK10L1.1生物信息学分析
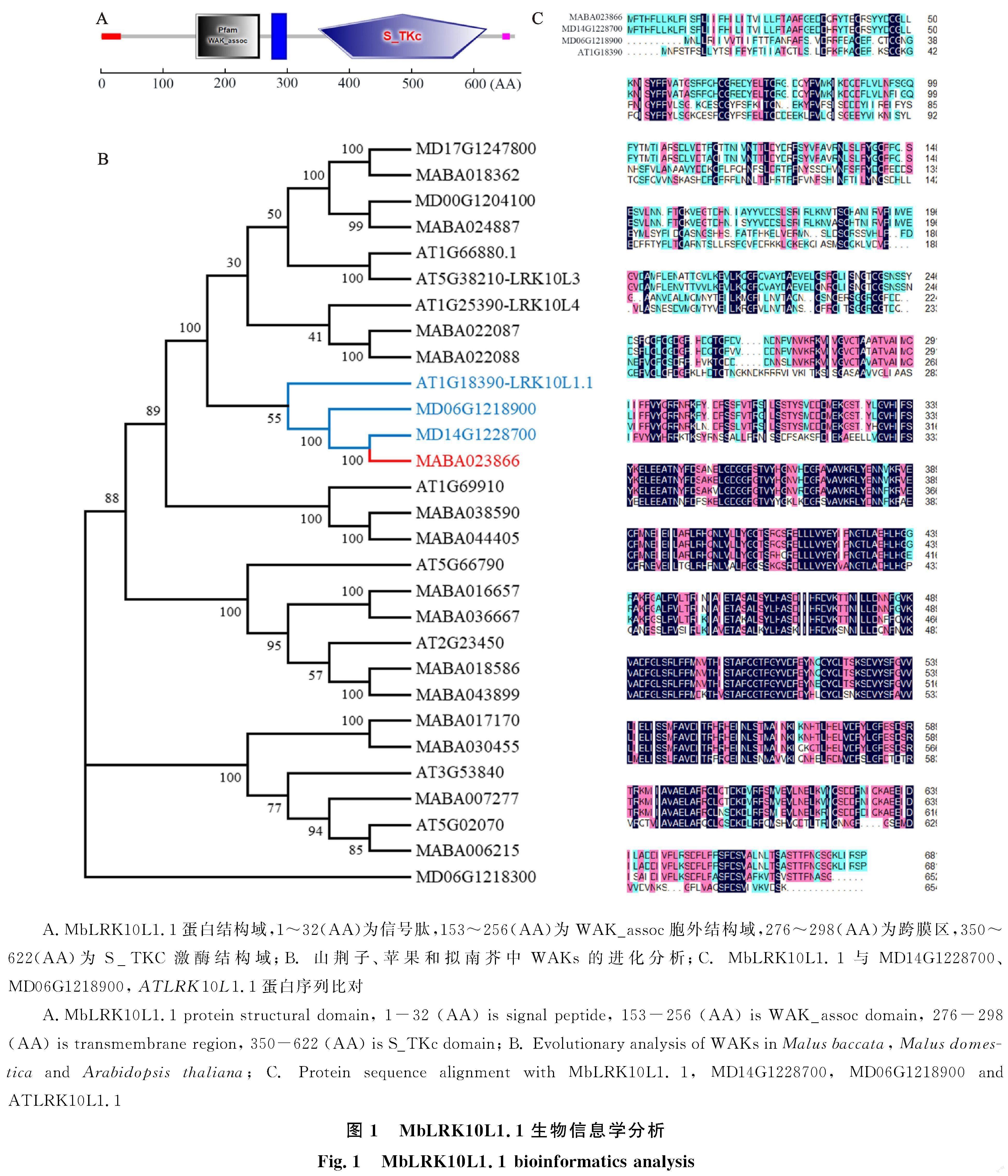
对 MbLRK10L1.1的基本参数分析表明,其氨基酸序列大小为660、分子质量为74.92 ku、理论等电点为5.42、位于质膜。结构域预测分析显示, MbLRK10L1.1具有WAK_assoc胞外结构域,完整的跨膜区和S_TKC激酶结构域,为WAK亚家族成员(图1-A)。利用山荆子、苹果和拟南芥中WAKs的蛋白序列构建进化树,发现 MbLRK10L1.1(基因ID:MABA023866)与苹果 MD14G1228700、 MD06G1218900,拟南芥 ATLRK10L1.1(基因ID:AT1G18390)亲缘关系最近,命名为 MbLRK10L1.1(图1-B)。对MbLRK10L1.1、MD14G1228700、MD06G1218900和ATLRK10L1.1的蛋白序列进行比对发现,MbLRK10L1.1与MD14G1228700、MD06G1218900、ATLRK10L1.1的序列相似度分别为94.82%、64.17%、43.72%(图1-C)。说明 MD14G1228700是 MbLRK10L1.1在苹果中的同源基因, ATLRK10L1.1是 MbLRK10L1.1在拟南芥中同源基因。 ATLRK10L1.1是编码拟南芥叶锈病10号抗病位点受体样蛋白激酶基因[16],但 MbLRK10L1.1与 ATLRK10L1.1序列相似度较低,推测 MbLRK10L1.1可能存在不同功能。
2.2 MbLRK10L1.1上游启动子区域存在响应逆境信号的顺式作用元件
为进一步研究 MbLRK10L1.1的功能,分析了其启动子区域(基因上游3 000 bp)存在的顺式作用元件(cis-element)。如表2所示,在该基因启动子区域含有较多的cis-element,包括9个响应脱落酸(ABA)元件、4个响应茉莉酸甲酯(MeJA)元件、2个厌氧诱导元件、2个参与玉米醇溶蛋白(Zein)代谢调节元件和17个参与光照响应元件。
2.3 MbLRK10L1.1组织特异性分析
为研究 MbLRK10L1.1在山荆子不同组织中的表达模式,通过RT-qPCR分析该基因在不同组织中的表达模式(图2)。结果表明, MbLRK10L1.1在根组织中的表达量最高,为各组织表达量平均值的6.6倍,其次为1 a生枝,略高于平均值,在2 a生枝、老根和功能叶中的表达量最低。
2.4 MbLRK10L1.1响应腐烂病信号的表达分析
从前期转录组数据中提取 MbLRK10L1.1在山荆子悬浮细胞响应腐烂病代谢物(VmM)前后的表达数据[17]。对照细胞中,该基因的FPKM(Fragments per kilobase of exon model per million mapped fragments)值为211,处理1、3和6 h后,分别上调至398、416和433(图3-A)。利用RT-qPCR分析相同条件下该基因的表达模式,发现该基因在响应VmM过程中显著上调表达。在处理1、3和6 h后分别上调表达至对照的3.2、 2.7和3.1倍(图3-B)。表明 MbLRK10L1.1可能参与VmM信号的响应。
2.5 载体构建及农杆菌转化
以山荆子总RNA反转录合成的cDNA为模板,加入 MbLRK10L1.1基因特异性引物和LA-Taq酶,经 PCR扩增后得到产物,用1%琼脂糖凝胶电泳检测,片段大小约为2 049 bp(图4-A),与目的基因片段大小一致。将上述PCR产物回收后与pMDTM19-T连接,经酶切(图4-B)和测序双重验证后,回收双酶切目的片段并构建重组质粒pFGC5941-MbLRK10L1.1,转化农杆菌GV3101,得阳性克隆(图4-C),大小为 2 049 bp与预期相符,表明成功将 MbLRK10L1.1转入农杆菌。
2.6 果实瞬时表达
2.6.1 果实瞬时表达MbLRK10L1.1基因的表达量 果实中分别注射携带重组质粒(pFGC5941- MbLRK10L1.1)、空载体pFGC5941和pBI121的农杆菌。于注射72 h后,注射携带pBI121载体的农杆菌的果实可成功被GUS染色液标记至蓝色,表明在该条件下GUS基因成功表达(图5-A)。此后,用RT-qPCR测定各处理果实中目标基因的表达量,发现注射携带重组质粒农杆菌的果实中 MbLRK10L1.1的表达量上升至对照(pFGC5941)的17倍(图5-B),表明 MbLRK10L1.1在果实中成功瞬时表达。
2.6.2 MbLRK10L1.1正调控苹果腐烂病 为验证 MbLRK10L1.1对苹果腐烂病的调控作用,在注射部位分别接种Vm,于不同时间点统计病斑直径。接种24 h时, MbLRK10L1.1對Vm的调控作用不显著,此后 MbLRK10L1.1瞬时表达果实的病斑直径小于对照果实。接种36、48、60、72和84 h时,瞬时表达果实的病斑直径分别为8.2、9.8、11.3、13.4、18.5 mm,而对照的则分别为8.9、11.6、14.3、17.5、21.6 mm(图6-C)。于接种72 h拍照记录, MbLRK10L1.1瞬时表达部位的病斑(图6-B)显著小于对照部位(pFGC5941)(图6-A)。以上结果表明, MbLRK10L1.1瞬时表达增强了苹果果实对腐烂病的抗性。
2.7 果实瞬时表达后相关通路Marker基因表达量的测定
为进一步了解 MbLRK10L1.1调控腐烂病的机制,使用RT-qPCR检测抗性相关通路Marker基因的表达模式。如图7所示,与对照果实相比,接种Vm后,瞬时表达 MbLRK10L1.1果实中参与PTI、ROS、R蛋白、SA、SAR和JA信号通路的Marker基因 FRK1(Flg22-induced receptor-like kinase 1)、TaNOX (Triticum aestivum NADPH oxidase)、 EDS1(Enhanced disease susceptibility 1)、 PR4(Pathogenesis-Related 4)、 CHN50(LOC107826794)和 LOX1(Lipoxygenase 1)的表达量都呈现不同程度的上调。其中, LOX1(图7-F)的上调表达最为明显,在Vm处理6和12 h时,分别上调至对照的1.7和4.6倍。其次 PR4(图7-D)和 CHN50(图7-E)在Vm处理6和12 h时,分别上调至对照的1.5、3.5倍以及1.4、3.4倍。此外, FRK1(图7-A)、TaNOX(图7-B)和 EDS1(图7-C)均在Vm处理12 h明显上调,分别上调至对照的1.7、2.1和2.2倍。以上结果表明, MbLRK10L1.1瞬时表达后可激活PTI、ROS、R蛋白、SA、SAR和JA等多种抗性相关的信号通路。
3 讨论与结论
WAKs在植物中的表達会受到生物和非生物胁迫的影响,并参与细胞伸长及对盐碱、重金属和病原菌等多种逆境信号响应[18]。在拟南芥、水稻和番茄等模式植物中研究较为广泛。例如: OsWAK1与胞壁相关联,受稻瘟病诱导表达,并且受水杨酸、茉莉酸的诱导[19]。番茄中 SlWAK1能加强植株对番茄假单胞杆菌抗性[20]。但WAKs在苹果等非模式植物中研究较少。本试验通过对前期转录组学分析,发现山荆子WAK家族成员 MbLRK10L1.1能响应腐烂病信号,并结合生物信息学分析,果实瞬时表达以及RT-qPCR等技术,初步研究 MbLRK10L1.1在Vm处理后的抗病机制。
病原微生物侵害初期,位于细胞膜上的模式识别受体(Pattern recognition receptors,PRRs)通过识别外源病原物/损伤相关分子模式(Pathogen/damage-associated molecular pattern, PAMP/DAMP)而触发基础免疫反应,也称PAMP触发的免疫反应(PAMP-triggered immunity,PTI)[21]。 EDS1作为一种重要的防卫基因,在植物触发PTI反应中发挥重要作用,可调控细胞内活性氧爆发、SA和JA通路的信号传导[22]。 FRK1作用于MPK3(Mitogen-activated protein kinases 3 )的下游,在PAMP/DAMP处理后的早期时间点被诱导[23]。在植物PTI反应初期,植物体内的ROS含量升高,NADPH氧化酶(NADPH oxidase, NOX)作为植物ROS产生的关键酶之一,其家族成员的转录增加,在植物抗逆响应中发挥重要作用[24]。在本试验中,瞬时表达 MbLRK10L1.1可以一定程度上激活 EDS1、 FRK1以及TaNOX的表达,表明 MbLRK10L1.1可以通过激活植物的PTI反应抵御腐烂病菌的 侵染。
SA和JA在植物防御中起着极其重要的作用,是植物防御反应中重要的信号分子,但二者存在不同的机制。目前已经在许多植物中发现JA和SA之间存在相互拮抗作用。研究表明,SA信号途径主要调控植物抵御寄生菌的侵染,JA信号途径则主要介导腐生菌的侵染[25]。苯内氨酸转氨酶(Phenylalaninammo-nialyase,PAL)是SA合成过程中的关键酶之一,在烟草中过量表达PAL后植株体内SA含量升高的同时JA含量却下降[26]。JA信号通路也能够抑制SA信号通路。在臭氧诱导的细胞死亡过程中,JA能通过抑制SA的生物合成从而减弱由SA引起的细胞死亡[27]。但当SA和JA的浓度不同,这种拮抗作用也会转变为协同作用,例如:对烟草幼苗施加SA和JA的混合液后,诱导的SA相关基因的表达量会比单独施加SA的高[28]。本试验表明,在Vm处理后, MbLRK10L1.1既能激活JA信号通路基因的表达,也能激活SA信号通路基因的表达。表明 MbLRK10L1.1可通过参与JA和SA通路的信号转导抵御腐烂病的侵染。
综上,在Vm处理下能激活 MbLRK10L1.1的表达,并且瞬时表达 MbLRK10L1.1能增强苹果果实对腐烂病的抵抗,同时也激活PTI、JA和SA等相关抗性通路。
参考文献 Reference:
[1] 张 冕.苹果黑腐皮壳菌Valsa mali的两类效应蛋白VmHEPs及VmPODs的功能及机制研究[D].陕西杨凌:西北农林科技大学,2019.
ZHANG M.Study on function and mechanism of two kinds of Valsa mali effectors Vm HEPs and Vm PODs [D].Yangling Shaanxi:Northwest A&F University,2019.
[2] 曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查[J].植物保护,2009,35(2):114-116.
CAO K Q,GUO L Y,LI B H,et al.Investigations on the occurrence and control of apple canker in China[J].Plant Protection,2009,35(2):114-116.
[3] 李 阳,宋素琴,王 静,等.苹果树腐烂病的防治研究进展[J].北方园艺,2015(13):194-197.
LI Y,SONG S Q,WANG J,et al.Research progress on control of the Valsa cancer of apple trees[J].Northern Horticulture,2015(13):194-197.
[4] KOHORN B D,KOHORN S L.The cell wall-associated kinases,WAKs,as pectin receptors[J].Frontiers in Plant Science,2012,3:88.
[5] VERICA J A,HE Z H.The cell wall-associated kinase (WAK) and WAK-like kinase gene family[J].Plant Physiology,2002,129(2):455-459.
[6] LALLY D,INGMIRE P,TONG H Y,et al.Antisense expression of a cell wall-associated protein kinase,WAK4,inhibits cell elongation and alters morphology[J].Plant Cell,2001,13(6):1317-1331.
[7] 王宏蕾. GbWAK3在棉花抗黃萎病中的功能研究[D].武汉:华中农业大学,2017.
WANG H L.Functional analysis of GbWAK3 in cotton responsive to Verticillium dahliae[D].Wuhan:Huazhong Agricultural University,2017.
[8] AMSBURY S.Sensing attack:the role of wall-associated kinases in plant pathogen responses[J].Plant Physiology,2020,183(4):1420-1421.
[9] GREENBERG J T,YAO N.The role and regulation of programmed cell death in plant-pathogen interactions[J].Cellular Microbiology,2004,6(3):201-211.
[10] 李国婧,周 燮.植物防御反应中水杨酸与茉莉酸的“对话”机制[J].细胞生物学杂志,2002,24(2):101-105.
LI G J,ZHOU X.Mechansims on “dialogue” between salicylic acid and jasmonic acid in plant defensive responses[J].Chinese Journal of Cell Biology,2002,24(2):101-105.
[11] STEVEN H S,ZHONGLIN M,YASUOMI T,et al.Proteasome-mediated turnover of the transcription coactivator NPR1 plays dual roles in regulating plant immunity[J].Cell,2009,137(5):860-872.
[12] 杜学梅,杨廷桢,高敬东,等.中国野生山定子的自然分布及利用研究现状[J].中国农学通报,2017,33(5):24-28.
DU X M,YANG T ZH,GAO J D,et al.Wild Malus baccata (L.) Borkh.in China:Natural distribution,utilization and study status[J].Chinese Agricultural Science Bulletin,2017,33(5):24-28.
[13] MAO X,WANG C,L Q,et al.Cyclic nucleotide gated channel genes (CNGCs) in Rosaceae:genome-wide annotation,evolution and the roles on Valsa canker resistance[J].Plant Cell Reports,2021,40(12):2369-2382.
[14] ZUO C,LIU H,L Q,et al.Genome-wide analysis of the apple (Malus domestica) cysteine-rich receptor-like kinase (CRK) family:Annotation,genomic organization,and expression profiles in response to fungal infection[J]. Plant Molecular Biology Reporter,2020,38(1):14-24.
[15] 孙 娥,闫文萍,余宏强,等.苹果和梨抗病相关基因的诱导与表达分析[J].西北植物学报,2022,42(9):1468-1476.
SUN E,YAN W P,YU H Q,et al.Induction and expression analysis of the disease resistance related genes in apple and pear[J].Acta Botanica Boreali-Occidentalia Sinica,2022,42(9):1468-1476.
[16] LIM C W,YANG S H,SHIN K H,et al.The AtLRK10L1.2,Arabidopsis ortholog of wheat LRK10,is involved in ABA-mediated signaling and drought resistance[J].Plant Cell Reports,2015,34(3):447-455.
[17] WANG C,MAO X,ZHAO D,et al.Transcriptomic analysis reveals that cell wall-and hypersensitive response (HR)-related genes are involved in the responses of apple to Valsa mali[J].Plant Biotechnology Reports,2022: 1-13.
[18] YANG K,QI L,ZHANG Z.Isolation and characterization of a novel wall-associated kinase gene TaWAK5 in wheat (Triticum aestivum)[J].The Crop Journal,2014,2(5):255-266.
[19] LI H,ZHOU S Y,ZHAO W S,et al.A novel wall-associated receptor-like protein kinase gene, OsWAK1,plays important roles in rice blast disease resistance[J].Plant Molecular Biology,2009,69(3):337-346.
[20] ZHANG N,POMBO M A,ROSLI H G,et al.Tomato wall-associated kinase SlWak1 depends on Fls2/Fls3 to promote apoplastic immune responses to Pseudomonas syringae[J].Plant Physiology,2020,183(4):1869-1882.
[21] BOLLER T,FELIX G.A renaissance of elicitors:perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors[J].Annual Review of Plant Biology,2009,60(1):379.
[22] WAGNER S,RIETZ S,PARKER J E,et al.Crystallization and preliminary crystallographic analysis of Arabidopsis thaliana EDS1,a key component of plant immunity,in complex with its signalling partner SAG101[J].Acta Crystallographica,2011,67(Pt 2):245-248.
[23] TSUNEAKI A,GUILLAUME T,JOULIA P,et al.MAP kinase signalling cascade in Arabidopsis innate immunity[J].Nature,2002,415(6875):977-983.
[24] 梅鵬颖,周常勇.与NADPH氧化酶相关的植物抗病性研究进展[J].江西农业学报,2013,25(9):90-94.
MEI P Y,ZHOU CH Y.Research progress in plant disease resistance associated with NADPH oxidase[J].Acta Agriculturae Jiangxi,2013,25(9):90-94.
[25] PIETERSE C M J,VAN DER DOES D,ZAMIOUDIS C,et al.Hormonal modulation of plant immunity[J].Annual review of Cell and Developmental Biology,2012,28:489-521.
[26] GARY W F,KENNETH L K.Trade-offs between pathogen and herbivore resistance[J].Current Opinion in Plant Biology,2000,3(4):309-314.
[27] MUR L A J,KENTON P,ATZORN R,et al.The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy,antagonism,and oxidative stress leading to cell death[J].Plant Physiology,2006,140(1):249-262.
[28] 徐 刚,姚银安.水杨酸、茉莉酸和乙烯介导的防卫信号途径相互作用的研究进展[J].生物学杂志,2009,26(1):48-51.
XU G,YAO Y A.The cross-talk between salicylic acid,jasmonic acid and ethylene defense pathway[J].Journal of Biology,2009,26(1):48-51.
Gene MbLRK10L1.1 Positively Regulates Valsa Canker in Malus baccata
Abstract Valsa canker caused by Valsa mali (Vm) is a prevalent fungal disease affecting the apple industry.Wall-associated kinases (WAKs) play an important role in cell proliferation,growth and development,pathogen resistance and other physiological responses in plants.In the previous work,we identified the WAK genes, MbLRK10L1.1,from Malus baccata,which is potentially associated with the response to Vm infection.On this basis,this study integrated bioinformatics analysis,expression analysis and functional validation to elucidate the molecular mechanism underlying the involvement of MbLRK10L1.1 in the response to Vm.The results showed that MbLRK10L1.1 responded to the Vm signaling,and overexpression of MbLRK10L1.1 significantly reduced the rate of lesion spread on the fruit surface.The upregulation of disease resistance-related genes such as FRK1(Flg22-induced Receptor-like Kinase 1),TaNOX (Triticum aestivum NADPH Oxidase), EDS1(Enhanced Disease Susceptibility 1) and others were observed.The above results indicated that the gene ( MbLRK10L1.1) could positively regulate the resistance of apple to the Valsa canker through JA,SA,SAR,and PTI pathways.
Key words Valsa canker; WAK gene; Transient expression; Marker gene
