基于小鼠粪菌移植临床前研究影响因素的讨论
2024-04-02孙诗琪刘路胡双元王雨岩孙铭声赵凌
孙诗琪刘路胡双元王雨岩孙铭声赵凌
(1. 成都中医药大学针灸推拿学院,成都 610075;2. 针灸治疗老年病教育部重点实验室(成都中医药大学),成都 610075)
近年来,肠道微生物在健康和疾病中的作用成为热点,其中粪便微生物移植,即粪菌移植(fecal microbiota transplant,FMT),是一种以肠道微生物为靶向,通过将供体粪菌移植到受体胃肠道,以重构受体肠道菌群的治疗方式[1]。 大量研究表明FMT不仅在治疗溃疡性结肠炎[2]、肠易激综合症[3]等肠道疾病中作用显著,且对包括神经系统疾病(包括脊髓损伤[4]、阿尔茨海默症[5])、代谢性疾病(肥胖症[6]、糖尿病[7])等因肠道菌群紊乱引起的肠道外疾病同样具有治疗价值。 FMT 将肠道微生物变化与病理联系起来,为疾病的治疗及深入研究提供了新的思路和手段。 但FMT 应对不同疾病的作用机制及不良反应尚未明确,因而无法广泛应用于临床试验中,仍需依赖临床前研究的深入。 当前报道的FMT 临床前研究中实验细节高度不一致或不完整,严重影响了其研究的可重复性和结果解释,阻碍了成果的临床转化。 本综述从FMT 常用的小鼠受体着手,对其中包括受体选择、饲养环境、抗生素使用、样本采集及储存条件、移植材料制备、移植途径等在内的关键影响因素进行了讨论,并对不同选择的优势及局限性进行分析。 上述影响因素的繁杂性提示亟需提供FMT 临床前研究标准化实验指导以减少异质性及非必要损耗、提升严谨性及可复制性的必要性。 本文回顾并分析近年的相关报道,从FMT 动物实验的关键步骤及重要影响因素着手,提出针对实现其研究可复制及标准化的建议,并对未来的研究提出展望。
1 受体动物选择
1.1 不同品种及特征受体差异
啮齿动物由于生理解剖结构与人类相似,被广泛应用于临床前研究。 得益于肠道微生物在属水平与人类的相似性,小鼠被广泛应用于FMT 的相关研究,尽管其丰度存在差异[8-9],但研究人员在小鼠中发现了与人类相似的肠型,且不同菌株丰度差异导致的疾病表现与人类研究中结果一致,为小鼠在FMT 临床前研究中的应用提供了更多的可能[10]。LLEAL 等[11]在评估小鼠和大鼠作为人类微生物移植临床前模型的性能时发现,较小鼠而言,大鼠的肠道环境表现出与人类更高的相似性,且大鼠捕获人类肠道微生物的效率更高,未来或能成为日后建立人源化肠道微生物模型的重要工具。 但当前,FMT 的基础研究仍以小鼠为主,大鼠的使用仍有待更多研究的认可。 除品系外,设计FMT 实验时还需考虑性别、年龄等影响因素,以确保实验结果在不同性别、年龄中都能得到解释。 研究表明,肠道微生物状态因性别及年龄而异,其丰度在不同性别受体中不尽相同[12],FMT 疗效也受受体年龄的影响[13-15]。 综上所述,受体的选择需要依据研究目的选择最相适的品种及特征。
1.2 受体肠道微生物控制途径
1.2.1 选择无菌动物或无特定病原体动物限制常驻微生物
无菌(germ-free,GF)物由于缺乏常驻肠道微生物,在接收外源性肠道微生物时无须竞争,表现出对供体微生物的高效“吸收”,因而GF 动物被认为是该领域的最佳受体模型[16-17]。 但GF 状态会导致小鼠的异常发育或生理性改变,如:免疫及代谢系统异常、神经系统异常等[18-20];如选择GF 模型则需要考虑规避其特异性改变对目标疾病的影响(表1)。 同时,GF 动物在运输、饲养及处理中对成本投入、环境设施的高要求限制了其广泛应用,加之人类不存在等效的无菌状态,因此使用GF 动物的研究从临床前向临床的转化存在尚待解释的环节。常规无特定病原体(specific pathogen free,SPF)动物,即指不携带潜在感染或条件致病的病原体的实验动物。 与GF 动物的无菌饲养不同,SPF 动物肠道菌群易受出生及成长环境的影响,通过对GF 与SPF 模型疾病表征异同的比较,能够分析常驻肠道微生物对疾病的影响,更能进一步聚焦其中单菌或多菌的具体作用。 简化肠道微生物动物亦属于悉生动物,如被报道的最小微生物群落(OligoMM12)小鼠或谢德勒菌群ASF(Altered Schaedler Flora)模型,作为含有明确微生物的受体模型,能实现对肠道微生物的更准确把控[21-22]。 综上,可选择单独通风笼(Individual ventilated caging,IVC)系统在降低无菌饲养对环境设施及成本的双重高要求的同时实现对菌群一定程度的控制[23]。 针对GF 动物存在的特异性改变,或能通过ex-GF 鼠,即出生后立即饲养于微生物充足但无病原体环境的鼠作为对照,以提供由于先天因素对研究结果产生影响的证据。

表1 不同受体动物模型间比较Table 1 Comparison between different receptor animal models
1.2.2 抗生素预处理消耗肠道微生物
通过抗生素预处理破坏菌群,有操作简单、成本低、环境及设施要求低、可控性强的优势,是当前普遍采用的诱导肠道微生物消耗的有效方法。 抗生素预处理不仅能实现FMT 前的肠道清理[24],还能有效增强异体微生物的定殖能力[25]。 但研究者对携带不同微生物的实验动物进行抗生素预处理后,表现出抗生素扰动后菌群的个体间变异[26];并在不同抗生素单独使用后观察到对特定类别微生物的特异性改变[27-28],提示不同抗生素及不同受体在肠道微生物消耗过程中存在个性化差异,建议选择由多种抗生素混合的抗生素鸡尾酒以实现肠道微生物的有效消除。 另有研究表明,使用抗生素将促生耐抗生素菌株,并增强病原体的肠道定植力,提升炎症及感染风险[29];部分抗生素使用存在毒性反应,包括诱发心血管疾病[30]、破坏血脑屏障[31],甚至诱发认知障碍[32]等。 因此建议使用被报道的不可吸收的抗生素,以规避由抗生素使用造成的额外影响[33],如若目标疾病存在使用抗生素无法规避的影响,则考虑采用其他替代方法[34]。 此外,据报道,给药7 d 足以在保证受体肠道微生物耗尽的同时避免耐抗生素菌的过度生长或耐药性的产生[35-36],但不排除部分研究为保证微生物的彻底清除而选择了更长的给药时间。 在给药方式中,口服灌胃能更好的控制给药剂量及时间,但单次给药能维持的抗生素作用时间有限;饮用水给药虽能长时间维持药效,但难以确保摄入药品的剂量,需刻意记录其饮水量以估算每日摄入抗生素剂量,不适于群居动物,还需要考虑抗生素在饮用水中的放置时间与稳定性[37-39]。
基于上述的影响因素,研究人员提出建议:(1)在抗生素选择方面建议选用被报道的不可吸收的抗生素类型,以规避抗生素对模型动物造成的额外影响,并以抗生素鸡尾酒的形式配置,以涵盖更广泛的目标微生物;从整理的结果来看,氨苄西林、新霉素、甲硝唑及万古霉素的组合是最广泛使用的;(2)建议采取间断重复灌胃为主,饮用水添加抗生素维持为辅的给药方式,在保证抗生素摄入量的同时延长抗生素作用时间,以更彻底的清除肠道微生物;(3)给药时间建议保持在7 ~10 d,在有效清除肠道微生物的同时尽可能避免产生抗生素毒性。由于当前不同报道中抗生素给药类型、给药方式、持续时间及剂量等存在差异,基于上述建议研究人员整理了当前高质量报道中抗生素使用的配方及细则,以期为后续研究者提供参考(见表2)。

表2 抗生素肠道预处理方案细则Table 2 Details of the antibiotic enteral pretreatment program
1.2.3 其他替代方式
肠道清洁溶液(bowel cleansing,BC)是临床肠道检查常用的肠道清洁方法,但研究发现BC 溶液使用后,小鼠肠道微生物群同未处理小鼠一样维持原始状态,且异体微生物的定殖效率不及抗生素制备的肠道环境[92];又或微生物群的结构和组成在短期内发生变化,但迅速恢复了初始状态[93]。 尽管并不建议使用这样的处理方式,但在抗生素不适用情况下BC 溶液可作为替代方法,或与抗生素联合使用以增强对肠道微生物的清除效果[94]。 人源化菌群模型是通过移植人类患者的菌群到受体动物,使受体动物携带大部分的人类肠道微生物,以表现出一种或多种疾病特征,模拟疾病发病状态。 该模型是药物筛选或疾病发病机制等需要模拟还原疾病状态人类肠道环境研究的重要工具[95]。 研究表明,当前仅约47%的人类肠道菌群可以在小鼠中重建,其中超过1/3 发生显著改变[16];FMT 的疗效因跨物种移植中外源性微生物定植受阻而减弱[34],人类肠道环境在啮齿动物中的完整重建仍有待后续研究的深入,如需选择该模型则应当明确是否需要建立对照以对跨物种移植产生的紊乱作出合理解释。
1.3 饮食及环境对肠道微生物的影响
肠道微生物的组成和比例是动态的,同时受内部(年龄和遗传背景)和外部(饮食和环境)因素的影响[96-97]。 通过控制饮食摄入及环境温度可以诱导能量消耗、肠道菌群及代谢物的改变[98-101]。 基于饮食-环境-微生物群间相互作用的复杂性,研究者在使用相同饮食方案但光暗周期及环境温度不同的啮齿动物中观察到肠道微生物组成的显著差异,并在每日明暗循环及季节变化中观察到肠道微生物的规律性改变[102-103]。 因此可考虑使用时间限制喂养(TRF)将饮食摄入控制在24 h 周期的特定时间内,避免生物钟改变对肠道菌群的影响[104]。此外,由于啮齿类动物具有食粪习性,研究发现同笼饲养几周后,微生物相关表型能够在共同安置的小鼠间转移,因而要避免将准备接受来自不同组别供体的受体置于同一饲养区域[105]。 未来的FMT 临床前研究当谨慎选择并在报告中交代实验动物所接受的饮食、环境(如温度、湿度以及明/暗循环),以完整解释饮食或环境因素对结果的影响。
2 移植前操作
2.1 样本收集及储存的建议
采集粪便样本时建议先用75%乙醇消毒啮齿动物肛门,然后用无菌棉球轻压肛门同时按揉腹部,引起自发排便后立即将粪便颗粒转移到冰上的无菌离心管或冻存管中;如果无法诱导即时排便可以将供体动物转移到高压灭菌笼或已消毒的独立环境中,待其自然排便后再立即收集[106-109]。 啮齿动物供体样本除粪便外还可能涉及肠腔内容物,可待动物麻醉后直接在厌氧无菌条件下采集[110]。 相较于局部内容物而言全肠菌群移植(Wholeintestinal microbiota transplantation,WIMT)能够相对完整的重建整个胃肠道环境[111],且来自特定位置的微生物能够选择性地定殖到同源区域,因此当需要重建整个胃肠道微生物状态或对肠道不同区域微生物进行靶向分析、干预时WIMT 可作为最佳选择。 上述空间异质性提示胃肠道中不同部分间微生物不可相互替代,且其组成及丰度存在差异,据报道,与空肠和回肠相比,盲肠、结肠和粪便中的微生物含量更高,因而多被选择[112]。 在采集时间上,基于报道的啮齿动物24 h 内肠道微生物丰度变化规律,建议在7:00 ~11:00 或15:00 ~17:00 进行,以避免昼夜节律影响样本成分的稳定性[112-113]。
研究表明哺乳动物肠道内多数微生物属于厌氧菌,在氧气中暴露将使这些菌群失去活性[114],为最大限度保留微生物活性,粪便样本的采集及匀质化、过滤等操作需要在厌氧条件下进行。 粪便的采集难以在绝对厌氧的环境中进行,因此建议使用厌氧袋或在装有二氧化碳的开放式容器中进行的半厌氧处理法。 若采集肠腔内容物则可当动物处死后在厌氧室内进行,并使用脱氧溶液进行稀释和均质。
低温冻存是保持粪便样本中微生物组成及丰度的有效方式,样本在采集后及运输过程中需保持4 ℃或临时冰上保存,短期保存时-20 ℃可以实现对其中微生物定殖能力的保护,如需冻存超过6 个月则需要-80 ℃储存,以保证定植能力不受影响[115-117],但理想模式是采集后1 h 内制备并立即移植[118]。 需要强调的是,冻融循环比持续长时间冻存更伤害微生物活性,如不能持续低温冻存,可以暂存于较低温环境,避免反复的冻融循环。 样本长期零度以下储存时需添加冷冻保护剂(cryoprotectants,CPA),如15%或20%(v/v)甘油及5%(v/v)二甲基亚砜亦或麦芽糊精与海藻糖混合物(1 ∶3)等[119],以减少冻融环节对细胞的损伤,并保持冻存样本的菌株活性[120]。 此外,冻干样品能更大限度保持微生物稳定性[121],粪便等分吸管技术(Fecal Aliquot Straw Technique,FAST)能实现不解冻情况下的二次取样[122-123],研究者可持续关注新报道的方法以选择成本及设施范围内的最佳储存方案。
2.2 移植材料制备的建议
制备移植材料时样本需先稀释并过滤后,再按照比例悬浮在磷酸缓冲盐溶液(phosphate buffered saline,PBS)中静置沉淀,然后以预设参数反复离心[124-127],制备完成后应立即进行移植(图1)。 为避免微生物成分在移植前发生改变,建议在移植前10 min 临时制备移植材料,以保证最短的氧气暴露时间。 如果不具备新鲜制备条件,可以将新鲜样本立即制成移植材料然后低温冻存,至使用时再解冻[126]。 本文回顾了近年的相关研究,在移植材料的制备过程中尽管具体配置比例及离心参数有所不同,但大致步骤相似,研究人员总结了其中相对完整的操作方案以供参考(表3)。
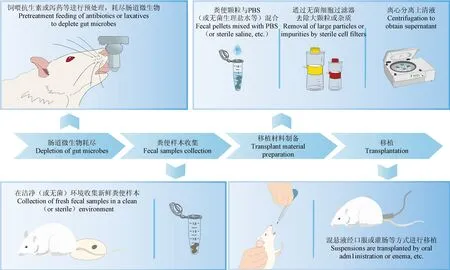
图1 粪菌移植的关键步骤Figure 1 Critical steps in fecal bacteria transplantation

表3 粪菌移植前关键操作细则Table 3 Details of key operations before fecal bacteria transplantation
3 移植途径的选择
口服灌胃或灌肠给药是啮齿动物FMT 最为常见的移植途径(图1),口服灌胃给药因具有给药量可控且无需麻醉的优势而更广泛采用,移植时通过弯头灌胃针将移植材料注入受体胃内,以尽可能避免与氧气的接触,保持厌氧菌活性。 通常可以选择每天给予受体动物100 ~200 μL 的移植材料,持续7 ~ 14 d 以确保异体肠道微生物的成功定植[150-151];亦可选择集中连续给药3 d,而后每隔1 d 给药1 次,能达到同等的移植效果[152-153]。 不同报道中移植材料的使用量存在差异,相对标准化的建议是根据每10 g 体重给予0.1 mL 液体(微生物移植或生理盐水)的比例个性化给药[108],或明确将每只受体动物每日接受的移植量控制在200 μL(108CFU/mL)内[112,154]。 肛门给药时将涂抹石蜡油的置入管轻插入肛门,再把加热到体温的悬浮液缓慢注入,拔下置入管后用棉签按压肛门处,并倒置动物1 min,防止液体流出[155-156]。 研究表明,灌肠给药在坏死性结肠炎等相关肠道疾病中可以更好的发挥减轻炎症等作用[157],研究者可根据实验目的选择适宜的移植途径。 报道中亦有通过将移植材料涂抹于受体动物皮毛等基于接触共生环境中微生物接受定植的方式,但这类方式无法明确摄入量且无法实现微生物群的完整传递[75,158-159],在结果解释上或存在疑虑。 人类FMT 往往需要多轮移植来保证定值效果,但相对无菌条件下的受体动物是否同样需要多轮移植尚无定论,通常认为当目标微生物较为复杂时,建议进行一轮以上的定植以保证定殖效率。 亦或者通过荧光染色、16S rRNA 全长测序等方式对其定植情况进行监测[160],以保证成功移植。
4 展望
一篇关于洗涤菌群移植(washed microbiota transplantation,WMT)的报道[161]基于智能化粪菌分离系统及严格质控相关漂洗过程的概念,通过以具体菌群数量作为精确剂量的衡量依据,并且通过自动净化系统去除了大部分病毒及促炎物质,在量化和质控移植材料、提高治疗安全性等方面将未来FMT 研究引入机械化精度把控时代。 研究发现,肠道微生物群产生的脂质能够进入循环并控制与微生物组成相关的表型变化,同时能显著影响包括炎症信号在内的多种信号通路[162],未来肠道微生物源脂质的应用或能通过靶向特定受体调控信号通路,实现针对性个性化治疗,同时有效避免病原体的伴随转移。 基于当前对FMT 后微生物定植规律的不明晰,IANIRO 等[163]发表的一项分析供体菌株植入率与疗效关系的研究提出,建立可预测FMT 后菌株定植情况的机器学习模型,能够帮助选择最匹配受体的菌群供体,提示在未来研究中通过智能算法的广泛应用,可以实现对FMT 后受体肠道菌群的精准预测,以确定最佳供体。 此外,未来若能基于机器学习等手段预测药物成分-肠道微生物-宿主间的复杂作用,或能有效助力化学结构及调控机制网络复杂的药物作用机制的阐释、应用思路的拓展[164-165]
5 总结
基于当前FMT 临床前研究的报道中实验细节的高度不一致,亟需标准的方法学指导。 本文回顾并讨论了FMT 动物实验的关键步骤细节,其目的在于提高实验动物、耗材及劳动力等因素的利用率,其中部分是基于当前动物实验的报道,其他则是综合参考了评议性文章[166-167]。 受限于回顾的文献以小鼠为目标对象,以上提及的方法学建议或存在偏倚,期待更多关于FMT 临床前研究方法学建议的文章,并最终提出“黄金标准”的方法学指导。
