紫铆花素对人黑色素瘤细胞A375 与人永生化角质形成细胞HaCaT 共培养细胞生物学活性的影响*
2024-03-28罗静莺
高 莉,谭 雪,罗静莺,闫 明
(新疆维吾尔自治区维吾尔医药研究所新疆维吾尔医方剂学重点实验室,新疆乌鲁木齐 830011)
小眼畸形相关转录因子(MITF)是黑色素细胞生长的主要调节器,调控黑色素生成的3 个关键酶[酪氨酸酶(TYR),以及其相关蛋白1,2(TRP-1,2)][1-2]。角质形成细胞来源的干细胞因子(SCF)及其受体c - Kit 可激活MITF双重磷酸化,调节双重激活和降解,进而影响黑色素细胞的生长和分化[3-4]。中药驱虫斑鸠菊具有激活TYR活性、提高黑色素合成能力、调节免疫等功能[4],临床主要用于治疗白癜风[5]。前期研究发现,驱虫斑鸠菊的活性成分紫铆花素能激活黑色素细胞TYR活性和增强黑色素合成能力[6],促进角质形成细胞分泌促黑色素细胞激素(MSH)、SCF等因子[7],表明紫铆花素可能通过调控黑色素细胞和角质形成细胞的相互作用促进黑色素合成。基于此,本研究中拟进一步考察紫铆花素对人黑色素瘤细胞A375与人永生化角质形成细胞HaCaT共培养细胞生物学活性的影响,并探讨其相关机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:SQP 型电子分析天平(德国Sartorius 公司,精度为0.1 mg);YJ-875型超净工作台(苏州安泰空气技术有限公司);MCO - 18AIC 型CO2培养箱(日本Sanyo公司);SPX-150B-Z 型生化培养箱(上海博远实业有限公司);Multiskan Go 1510 型酶标仪(美国Thermo Fisher Scientific 公司);FC500型流式细胞仪(美国Beckman Coulter公司);CFX96型荧光定量PCR仪(美国Bio-Rad 公司);OMKS001 型电泳仪、20150168 型凝胶成像系统(上海伯乐生命医学产品有限公司)。
试药:紫铆花素(新疆维吾尔自治区维吾尔医药研究所自制,批号为20151208,含量≥95%);DMEM 干粉培养基(美国Gibco 公司,批号为1645780);胎牛血清(美国HyClone公司,批号为NZJ1221);四甲基偶氮噻唑蓝(MTT,美国Amresco 公司,批号为YY11351);二甲基亚砜(DMSO,天津市光复化工研究所,批号为D5879);左旋多巴(美国Sigma 公司,批号为LC0922B5011J);JC- 1 线粒体膜电位检测试剂盒(批号为3242985),碘化丙啶(PI)细胞周期检测试剂盒(批号为6051571),均购自美国BD 公司;TRP-1,TRP-2,MITF,SCF,c-Kit抗体(美国Abcam 公司,批号分别为ab235447,ab221144,ab303530,ab64677,ab283653);水为纯化水。
细胞:人黑色素瘤细胞A375(中国科学院上海生科院细胞资源中心);人永生化角质形成细胞HaCaT(武汉大学中国典型培养物保藏中心)。
1.2 方法
共培养细胞的建立:取对数生长期的HaCaT 细胞适量,加0.25%胰酶消化,以5×105个/mL 接种于6 孔板中,5%CO2、37 ℃条件下培养6 h使细胞充分贴壁;取对数生长期的A375 细胞适量,同上处理并接种于同一6孔板中(2种细胞的接种比例为2∶1),置5%CO2、37 ℃条件下过夜培养,得共培养细胞。
分组及给药:取共培养细胞适量,用3.0 mL 0.25%胰酶消化,以5×104个/mL接种于96孔板中,每孔100 μL,置37 ℃、5%CO2条件下培养过夜,弃去培养基,设对照组(等体积培养液),紫铆花素(以DMSO溶解制成质量浓度为100 g/L的贮备液)低、中、高剂量组(以下简称低、中、高剂量组,0.5,1.0,5.0 μg/L),各组细胞进行相应处理(每孔200 μL),继续培养48 h。
细胞活性:采用MTT 法。在“分组及给药”项下分组的基础上,加设空白对照组(无细胞,等体积培养液),每组设8个复孔,培养44 h时加入5 g/L MTT 20 μL,继续培养4 h,弃去上清液,加入DMSO 200 μL,振荡10 min,采用酶标仪于490 nm 波长处测定吸光度(A),并计算细胞增殖率。细胞增殖率(%)=(A给药组-A空白对照组)/(A对照组-A空白对照组)×100%。
细胞周期:取共培养细胞适量,置25 cm2细胞培养瓶中培养,同“分组及给药”项下操作,每组设3个复孔。培养48 h,吸出原培养基,以1 mL 胰酶消化,用原培养液缓慢吹下所有细胞,移入4 mL 离心管,1 000 r/ min离心10 min(下同)后弃去培养液,加入1 mL 磷酸盐缓冲液(PBS)重悬细胞后离心,重复清洗3 次。以1 mL 75%乙醇重悬细胞,4 ℃固定过夜后,离心,弃去固定液,加入1 mL预冷PBS重悬细胞后离心,重复清洗3次,加入500 μL PI/核糖核酸酶(Rnase)染液,37 ℃避光染色15 min,200 目尼龙滤网滤过,采用PI 细胞周期检测试剂盒,以流式细胞仪检测。
细胞线粒体膜电位:取共培养细胞适量,按“细胞周期”项下分组、给药及处理,得到细胞(至“重复清洗3 次”时止)。各管加入500 μL JC-1 工作液,37 ℃孵育15 min,加入1 mL Assay Buffer 混匀,1 000 r/ min 离心10 min;弃去上清液(重复1 次),再加入500 μL Assay Buffer 重悬细胞,200 目尼龙滤网滤过,采用JC-1 线粒体膜电位检测试剂盒,以流式细胞仪检测。
mRNA表达:采用实时荧光定量聚合酶链反应(qPCR)法。取共培养细胞适量,同“细胞周期”项下分组、给药、处理(至用原培养液缓慢吹下所有细胞止)。用Trizol 法提取细胞的总RNA;取5 μL 进行1%琼脂糖凝胶电泳,检测RNA 的完整性,使用反转录酶进行反转录PCR 合成cDNA 并纯化,进行RNA 电泳并检测浓度,最后以qPCR法检测SCF,c-Kit,MITF的mRNA表达水平。
蛋白表达:采用Western blot 法。取共培养细胞适量,同“细胞周期”项下分组、给药、处理(至用原培养液缓慢吹下所有细胞止),以裂解法提取总蛋白,检测蛋白含量;取变性后蛋白50 μg,进行SDS-PAGE 凝胶电泳,转膜、封闭、洗膜,分别加入β - actin,TRP - 1,TRP -2,SCF,c-Kit,MITF的抗体(1∶1 000,V/V),4 ℃孵育过夜;洗膜5 min,加入二抗(1∶2 000,V/V),室温孵育2 h,进行化学发光反应后成像,采用Image J 1.5.1软件分析,检测目标蛋白的相对表达水平。
1.3 统计学处理
2 结果
2.1 细胞活性
与对照组[(100±2.89)%]比较,中、高剂量组细胞增殖率[(110.47±5.71)%、(117.74±4.32)%]均显著升高(P<0.01);低剂量组细胞的增殖率为[(90.70 ±5.71)%]。
2.2 细胞周期
与对照组比较,各剂量组细胞G0/G1期细胞比例显著降低(P<0.01),S 期和G2/ M 期细胞比例均显著升高(P<0.01)。详见表1和图1。

A. 对照组 B. 低剂量组 C. 中剂量组 D. 高剂量组图1 细胞周期图(±s,n=3)A.Control group B.Low - dose group C.Medium - dose group D.High - dose groupFig.1 Cell cycle(X ± s,n = 3)
表1 各组细胞的周期分布及高线粒体膜电位比例比较(±s,%,n=3)Tab.1 Comparison of cell cycle and proportion of cells with high mitochondrial membrane potential in each group(X ± s,%,n = 3)
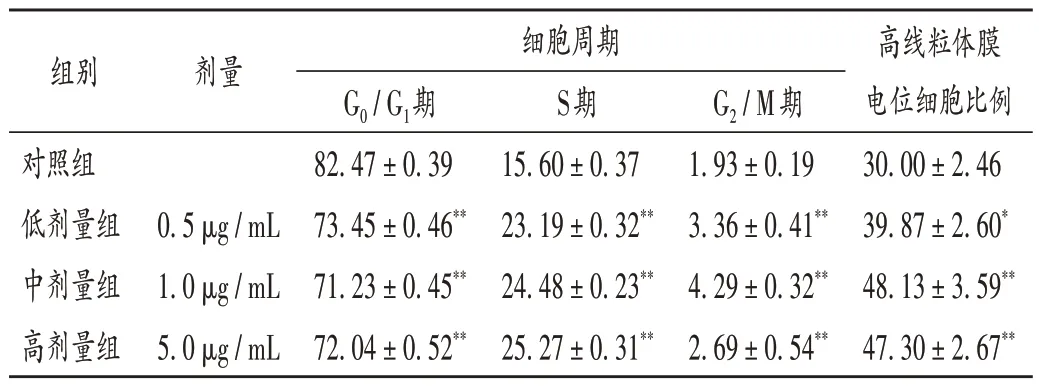
表1 各组细胞的周期分布及高线粒体膜电位比例比较(±s,%,n=3)Tab.1 Comparison of cell cycle and proportion of cells with high mitochondrial membrane potential in each group(X ± s,%,n = 3)
注:与对照组比较,*P <0.05,**P <0.01。图3、图4同。Note:Compared with those in the control group,*P <0.05,**P <0.01(for Tab.1 and Fig.3 - 4).
?
2.3 细胞线粒体膜电位
与对照组比较,各剂量组细胞高线粒体膜电位细胞比例均显著升高(P<0.05 或P<0.01)。详见表1和图2。
2.4 SCF,c-Kit,MITF mRNA 及蛋白表达水平
与对照组比较,各剂量组细胞SCF,c-Kit,MITF的mRNA和蛋白表达水平均显著升高(P<0.05或P<0.01)。详见图3。
2.5 TRP-1 和TRP-2 蛋白表达水平
与对照组比较,各剂量组细胞的TRP-1和TRP-2蛋白表达水平均显著升高(P<0.05 或P<0.01)。详见图4。
3 讨论
在机体毛囊中,黑色素细胞能生成黑色素,然后通过树突递送至表皮角质形成细胞进行表皮色素沉着,其分化和色素沉着依赖于SCF/ c - Kit 信号通路[8]。SCF/c - Kit 信号激活可增强MITF 的磷酸化和转录活性[9]。MITF 参与黑色素合成和色素沉着信号传导,是黑色素细胞色素沉积的主要调节因子,参与黑色素细胞的生长、分化和存活,其通过调节TYR 蛋白家族(包括TYR,TRP-1,TRP-2)参与优黑素生成[10-11]。
本研究中构建了能更好地模拟黑色素细胞体内生存环境[12]的A375 细胞和HaCaT 细胞共培养细胞体系,结果发现,中、高剂量组细胞的增殖率显著升高,各剂量组G0/G1期细胞比例均显著降低,S期和G2/M期细胞比例均显著升高,0.5 μg/mL的紫铆花素不能显著升高细胞的增殖率,但能显著缩短细胞周期,提示0.5 μg/mL的紫铆花素可能通过调节细胞周期提高细胞增殖率,但由于质量浓度较低可能效果较弱,在48 h 的作用周期内,其促细胞增殖成效还未显现。各剂量组细胞的高线粒体膜电位细胞比例均显著升高,TRP - 1,TRP - 2蛋白表达水平及SCF,c - Kit,MITF 的mRNA 和蛋白表达水平均显著升高,表明紫铆花素可促进细胞增殖,调节细胞周期,调节细胞线粒体膜电位,保护线粒体功能,抑制细胞早期凋亡的发生,与前期研究[6-7,13-14]的结果一致,也表明紫铆花素能调节SCF/c- Kit/MITF信号通路,进而影响共培养细胞的生物学活性。
综上所述,紫铆花素可能通过调节SCF和c-Kit的表达而影响A375 细胞与HaCaT 细胞共培养细胞的增殖、细胞周期和线粒体膜电位等细胞生物学活性。
