黄芪甲苷对地塞米松诱导的骨质疏松模型C57BL/6小鼠RAAS系统的影响
2024-03-14柴艺汇牛建均田兴中刘春艳陈云志吴大梅
柴艺汇 牛建均 田兴中 刘春艳 陈云志 吴大梅△
(1.贵州中医药大学,贵州 贵阳 550025;2.德江县民族中医院,贵州 铜仁 565200;3.张家口市第五医院,河北 张家口 075000)
近年来,骨质疏松症(osteoporosis,OP)已经成为全球性的严重健康问题,尤其是在老年人中更加普遍。据统计,全球每年骨折约有930万例,其中约80%以上是由于骨质疏松所致。OP是一种以骨量减少、骨密度下降和骨组织微结构受损为特征的骨骼系统疾病[1]。RAAS系统被认为是影响骨代谢和骨质疏松的潜在因素之一。RAAS系统的过度激活会导致骨质疏松病变,而VD/VDR被证明是RAAS系统调节中的关键因素。RAAS系统激活后,其产生的血管紧张素Ⅱ(AngⅡ)可抑制骨再生过程,增加骨吸收活性细胞的形成和功能,导致骨质量下降[2]。RAAS系统的另一个关键成分是醛固酮(ALD)。ALD通过Na+/K+转运蛋白增加肠道和肾脏对钙的吸收和排泄,还通过增加Na+/H+在骨细胞膜上的转运和钠钾泵的活性,从而抑制骨形成[3]。VD/VDR则是RAAS系统中一个重要的调节因子,VD/VDR能够降低RAAS系统的活性,从而减轻骨质疏松病变过程[2]。黄芪甲苷(astragaloside IV,AS-IV)为黄芪最主要活性成分之一,具有调节免疫功能、提高机体免疫力和抗氧化等药理活性。研究表明,黄芪制剂可通过抑制血浆中肾素(Renin)的活性和AngⅡ中介的骨吸收作用,从而增加骨形成率和骨矿密度。黄芪甲苷还可上调VD/VDR表达水平,提高VD/VDR介导的钙离子信号转导和骨形成活性[4,5]。VD/VDR调控RAAS系统在骨质疏松症中的作用和AS-IV在改善骨质疏松症中的作用机制是当前研究的热点和难点。通过对VD/VDR和RAAS系统在骨质疏松中的作用机制的分析,以及AS-IV在这个过程中的作用机制的研究,可以增加我们对骨代谢和骨质疏松症治疗的认识,为临床骨质疏松症的防治提供新的思路和实践依据。
1 材料与方法
1.1 实验材料(1)实验动物:选取30只健康8周龄C57BL/6雄性小鼠,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010,所有小鼠实验前均适应性喂养1个月,室温(25±1)℃、相对湿度(55±5)%,每日12 h光照黑暗交替,自由进食进水,持续干预12周,每周称量1次体重,根据体重每周调整用药量。(2)试剂:苏木素染液(珠海贝索生物技术有限公司,C202101);伊红染液(珠海贝索生物技术有限公司,C202103);25(OH)D3(武汉基因美生物科技有限公司,GR20221206);AKP测试盒(南京建成生物科技有限公司,20221206);RIPA Lysis Buffer (康为世纪有限公司,CW2333S);蛋白酶抑制剂(康为世纪有限公司,CW2200S);BCA蛋白定量试剂盒(康为世纪有限公司,CW0014);SDS-PAGE loading buffer(康为世纪公司,CW0027A);SDS-PAGE凝胶制备试剂盒(康为世纪公司,CW0022);ECL高灵敏度化学发光检测试剂(康为世纪有限公司,CW0049);ECL低背景学发光检测试剂盒(康为世纪有限公司,CW0048);山羊抗兔(H+L)HRP(康为世纪有限公司,CW0103S);FGF23 抗体(Bioswamp,PAB34378);VDR 抗体(Bioswamp,PAB37474);ACE 抗体(成都正能,R381341);AngⅡ 抗体(博奥森有限公司,bs-20101R);GAPDH 抗体(abcam,ab181602)(3)仪器:转轮式切片机(徕卡-2016,德国);自动组织脱水机(武汉俊杰电子有限公司,JT-12S);型包埋机(常州郊区中威电子仪器厂,BMJ-A);正置荧光显微镜(德国徕卡,DM500);板式酶标仪(北京新风机电公司,ZS-2);紫外可见分光光度计(北京普析通用仪器有限责任公司,T6新世纪);台式高速冷冻离心机(湘仪贝克公司,TGL-20M);超声波细胞粉碎机(宁波荣顺公司,RS-25S);成像系统(德国徕卡);凝胶成像仪(天能,4600SF);电泳仪(BIO-RAD,164-5050);蛋白电泳槽(BIO-RAD,Mini-PROTEAN Tetra);蛋白转印系统(BIO-RAD,Mini Trans-Blot);Analog 3D Shaker(SCILOGEX,SK-D1807-E)。
1.2 方法
1.2.1 分组、造模与给药将30只C57BL/6雄性小鼠随机分为六组:空白组(生理盐水),模型组[地塞米松,3 mg/(kg·d),每周2次]、模型组+黄芪甲苷低剂量组[6 mg/(kg·d)]、模型组+黄芪甲苷中剂量组[12 mg/(kg·d)]、模型组+黄芪甲苷高剂量[25 mg/(kg·d)]、模型组+VD 组[0.7 μg/(kg·d),1,25(OH)2D3]。各组均采用灌胃给药,每周称量1次体重,根据体重每周调整用药量。
1.2.2 取材末次给药后,对小鼠进行断头取血,收集小鼠股骨。所取血液静置30 min后,4 000 rpm 离心10 min,取上层血清。血清样品保存-80 ℃冰箱,股骨浸泡于4 %多聚甲醛中进行固定。
1.2.3 HE染色取小鼠股骨使用EDTA脱钙液脱钙、脱水、透明、浸蜡,包埋后切片,使用苏木素染液染色5 min,自来水冲洗1~3 min,1%盐酸酒精脱去细胞质中多余的的苏木素染色液,伊红染液染色1 min,自来水冲洗1~3 min,梯度酒精脱水,使用透明二甲苯与中性树胶封片,并用显微镜进行图像采集。
1.2.4 ELISA法检测按照ELISA试剂盒说明书,检测大鼠血清中25(OH)D3、BGP水平,使用酶标仪内的450 nm波长测定板内各孔的OD值,最终计算求得各孔的AKP、25(OH)D3浓度。
1.2.5 Western-blot法检测取各组小鼠股骨,加入组织蛋白抽提试剂,冰浴匀浆及超声破碎,冰上孵育20 min后,10 000 rpm离心20 min,收集上清,以BCA蛋白定量试剂盒测定蛋白浓度。将制备好的股骨组织蛋白样品进行SDS-PAGE凝胶电泳,低温转膜0.5 h,加入VDR一抗(稀释比例1∶1 000)、FGF23一抗(稀释比例1∶1 000)、ACE一抗(稀释比例1∶500)、AngⅡ一抗(稀释比例1∶1 000)、GAPDH(稀释比例1∶10 000)4℃孵育过夜,TBST洗膜,加入山羊抗兔二抗(稀释比例1∶200),室温孵育1 h,ECL发光显影。将胶片进行扫描,分析目的蛋白分子量和净光密度值。以GAPDH为内参照。用凝胶显微成像系统进行化学发光显影成像,利ImageJ 软件测定目的蛋白条带灰度值。
2 结 果
2.1 C57BL/6小鼠股骨病理学改变HE染色显示,正常组小鼠股骨骨皮质光滑,由排列规则的骨板及骨细胞组成,骨小梁粗大饱满连续,厚度均匀,间隙正常;模型组骨质疏松模型小鼠股骨可见骨皮质变粗糙,破骨细胞增多,伴随凹坑吸收区域的增大,骨小梁变细,数量减少,间隙增大,见骨髓水肿;与模型组比较,黄芪甲苷高剂量组和阳性对照组小鼠股骨破骨细胞数量明显减少,骨小梁变细程度轻微,骨小梁数量明显增多,未见骨髓水肿;黄芪甲苷中、低剂量组小鼠股骨组织病理学改变亦有不同程度改善。见图1。
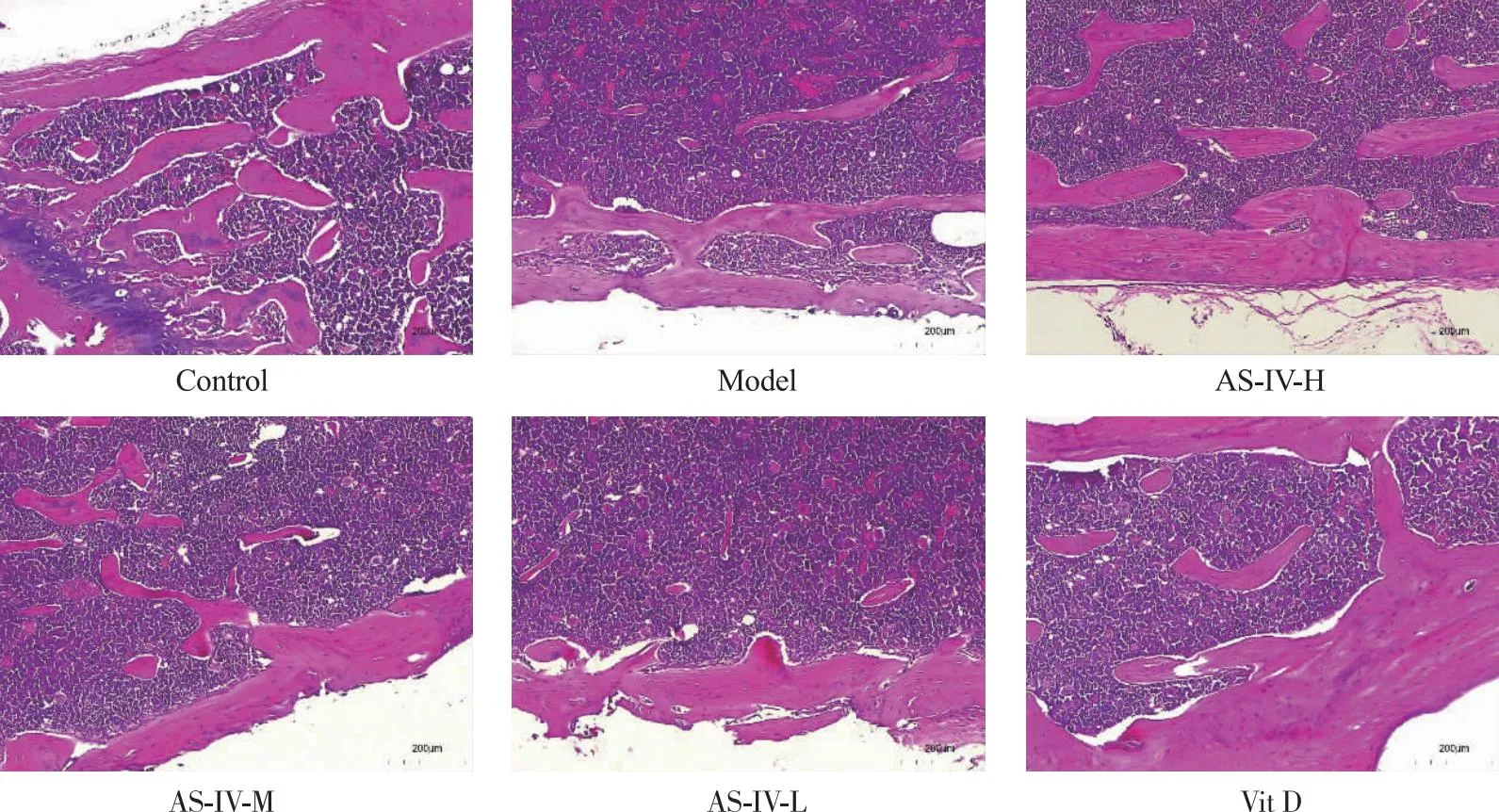
注:正常组:Control;模型组:Model;黄芪甲苷高剂量组:AS-IV-H;黄芪甲苷中剂量组:AS-IV-M;黄芪甲苷低剂量组:AS-IV-L;阳性对照组(维生素D)8Vit D。
2.2 小鼠血清中AKP、25(OH)D3水平含量ELISA结果显示,与正常组比较,模型组C57BL/6小鼠血清AKP、25(OH)D3含量显著降低(P<0.01);与模型组比较,黄芪甲苷高、中剂量组和维生素D组C57BL/6小鼠血清AKP、25(OH)D3含量显著升高(P<0.01);黄芪甲苷低剂量组AKP、C57BL/6小鼠血清AKP、25(OH)D3含量亦显著升高(P<0.05)。见表1。

表1 黄芪甲苷对地塞米松诱导骨质疏松C57BL/6小鼠模型血清25(OH)D3含量的影响
2.3 小鼠股骨中VDR、FGF23、ACE、AngⅡ蛋白表达水平Western-Blot检测结果显示,与正常组比较,模型组C57BL/6小鼠股骨细胞中VDR 蛋白相对表达量显著降低(P<0.01),FGF23、ACE、AngⅡ 蛋白相对表达量显著升高(P<0.01);与模型组比较,黄芪甲苷高、中剂量组和维生素D组小鼠C57BL/6股骨细胞中VDR 蛋白相对表达量显著升高(P<0.01),FGF23、ACE、AngⅡ蛋白相对表达量显著降低(P<0.01)。见表2,图2。

表2 黄芪甲苷对地塞米松诱导的骨质疏松模型C57BL/6小鼠股骨VDR、FGF23蛋白相对表达量的影响

注:正常组:Control;模型组:Model;黄芪甲苷高剂量组:AS-IV-H;黄芪甲苷中剂量组:AS-IV-M;黄芪甲苷低剂量组:AS-IV-L;阳性对照组(维生素D):Vit D。
3 讨 论
OP的发生主要与遗传、营养、激素代谢、生活方式等有关,临床表现为全身疼痛、呼吸功能下降,严重可导致骨折、脊柱变形等症状[6-7]。随着人口老龄化局势的加剧,骨质疏松患者逐渐增多,给家庭和社会带来巨大的医疗负担[8]。维生素D是一种具有多种生理功能的类固醇激素,也是体内骨代谢的重要调节因子,可通过对成骨细胞的作用影响骨形成[9]。维生素D系统包括维生素D、参与维生素D代谢的酶以及维生素D作用的受体(VDR)[10]。其中,1,25(OH)2D通过提高血钙浓度,为骨矿化提供必需的原料,从而间接作用于骨形成[11]。维生素D能促进骨钙盐的沉积及新骨钙化,促进骨的吸收[12]。同时与成纤维细胞生长因子23 (FGF-23)形成钙磷代谢内分泌轴与许多骨代谢疾病密切相关[13]。另外,OP的发生发展与肾素-血管紧张素-醛固酮 (RAAS)系统密切相关,RAAS系统可直接参与骨代谢,介导成骨细胞和破骨细胞增殖、分化、凋亡[14]。实验[15]显示,骨组织局部RAAS系统过度激活是OP的重要发生机制之一,可调节成骨细胞和破骨细胞分化和成熟和功能,导致骨量减少及骨吸收增加。同时,RAAS系统的激活后产生的AngⅡ可引起FGF23水平代偿性的升高抑制维生素D活化,最终导致体内活性维生素D水平降低[16]。而1,25(OH)2D3可减少AngⅡ的产生,抑制骨组织中局部RAAS活性,并下调破骨细胞的表达,降低骨吸收活性,从而改善骨质疏松的发展[17]。
中医学并无骨质疏松症的病名记载,根据临床特征将其归为“骨痹”“骨痿”“腰痛”等。《素问·长刺节论篇》记载:“病在骨,骨重不可举,骨髓酸痛,寒气至,名骨痹。”《素问·痿论篇》曰:“肾主身之骨髓,肾气热,则腰脊不举,骨枯而髓减,发为骨痿”,认为肾主骨,生髓。《医经精义》中进一步指出:“肾藏精,精生髓,髓养骨,故骨者,肾之合也”。中医认为肾虚是骨质疏松的主要发病机制,肾藏精且主骨生髓,髓藏于骨腔滋养骨骼,骨的生长发育依赖于肾中精气的滋养与温煦,肾为先天之本,肾精充足,骨有滋养而强健有力,肾精亏虚,骨失充养则骨骼脆弱无力[18]。骨质疏松的发生与肾虚、脾虚、血瘀等原因密切相关,因此,治疗应以补肾、健脾和活血化瘀为基本法则。研究[19]表明,黄芪及其成分可通过VD/VDR对FGF23-Klotho 轴的调控作用,改善衰老骨髓间充质干细胞活力和骨形成,从而防治骨质疏松症。本研究结果显示,AS-IV可显著改善骨质疏松模型C57BL/6小鼠股骨病理学改变及损伤;升高小鼠血清AKP、25(OH)D3含量;升高小鼠股骨VDR蛋白表达,降低FGF23、ACE、AngⅡ蛋白表达量,表明AS-IV防治地塞米松诱导的C57BL/6J小鼠骨质疏松,可通过对维生素D的调节,从而调控FGF23、ACE、AngⅡ蛋白的表达。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过贵州中医药大学实验动物伦理审查委员会审查(科学伦理委员会)批准。
