MED8表达与肝癌临床病理特征及其预后的相关性分析
2024-03-12张涛元曹三成王增国祝撷英
吴 爽 张涛元 李 俏 曹三成 王增国 祝撷英
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第六大最常见的癌症,也是癌症相关死亡的第四大原因[1]。肝癌的分子机制还不完全清楚。由于缺乏有效的早期诊断和靶向治疗,5年生存率仅为11%[2]。主流的检测方法包括计算机断层扫描(CT)、磁共振成像(MRI)和糖蛋白生物标志物(如甲胎蛋白)[3]。然而,这些方法有各种限制:CT和MRI昂贵且难以广泛应用,而糖蛋白生物标记物因缺乏对肿瘤区域特异性而受到限制。鉴于早期肿瘤检测可显著提高HCC患者生存率,探索新的标志物非常重要。
Mediator是一种进化上保守的多蛋白复合物,在人类中由33个亚基组成,是转录过程中不可或缺的调节因子[4]。研究表明,某些Mediator亚家族成员的表达在肿瘤中发生了较显著的变化,例如中介体复合物亚基8(mediator complex subunit 8,MED8)在结直肠癌细胞系中发生突变[5];此外,MED8在肾透明细胞癌中的表达与存活时间短、TNM分期相关,且MED8在转移性肿瘤中的表达高于原发肿瘤[6]。然而,MED8与HCC之间的相关性尚未得到评估。
本研究基于TCGA数据分析了MED8在HCC中的表达及预后价值。我们证实,在HCC样本中,MED8表达升高,并与较差的总生存率相关,我们的研究为HCC提供了一种新的诊断和预后指标。
1 材料与方法
1.1 MED8在泛癌及HCC中的表达差异验证
利用UCSC XENA(https://xenabrowser.net/datapages/)下载经Toil流程统一处理的TCGA和GTEx的TPM(transcripts per million reads)格式的RNAseq数据,Wilcoxon rank sum test法比较MED8在GTEx联合TCGA的癌旁组织样本和TCGA对应的肿瘤样本中的表达情况。同时,从TCGA数据库(https://portal.gdc.cancer.gov/) 下载HCC项目中level 3 HTSeq-FPKM(Fregments Per Kilobase per Million)格式的RNAseq数据以及临床数据。将FPKM格式的RNAseq数据转换成TPM格式后进行HCC癌旁组织及其配对的癌组织样本间的表达比较。
1.2 Western blot验证MED8在正常肝细胞QSG-7701及肝癌细胞HepG2中的表达差异
将QSG-7701及HepG2分别接种于10 cm含牛血清的培养基中培养48 h,RIPA裂解后提取总蛋白并检测蛋白浓度,经过电泳、转膜,兔抗人MED8抗体(购买于Invitrogen Ebioscienc公司)孵育及二抗孵育后,以GAPDH为内参比较MED8在两种细胞中的表达情况。
1.3 MED8在HCC中的共表达分析、可视化显示及共表达基因的富集分析
按照MED8表达量的中位值将HCC患者分为高表达组和低表达组,通过DESeq2包对HTSeq-Counts数据分析表达差异基因,火山图用于展示差异分析的结果(参数设置如下:|logFC|>2,padj<0.05)。clusterProfiler包用于分析基因的本体论(gene ontology,GO)富集分析,包括生物过程(biological process,BP),细胞组分(cellular components,CC)和分子功能(molecular function,MF)),以及京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析。
1.4 HCC患者样本MED8和C1qc蛋白表达水平
通过Human Protein Atlas(www.proteinatlas.org)分析HCC组织和正常肝组织中MED8和C1qc蛋白表达水平,以免疫组化结果进行呈现。
1.5 MED8与HCC临床病理的相关性及预后分析
通过Kruskal-Wallis rank sum test统计方法分别比较MED8表达与HCCT分期、病理分期、组织学分级的关系。按照MED8表达值的中位数,将LIHC数据分为MED8高表达组及低表达组,利用survminer包绘制Kaplan-Meier 图,用于评估MED8对HCC总生存期(overall survival,OS)及疾病相关生存率(Disease-Specific Survival)的预测价值;同时对MED8进行亚组分析,比较在HCCT分期的T1&T2&T3&T4亚群、病理分期的Stage I&Stage II&Stage III&Stage IV亚群、组织学分级G1&G2&G3&G4亚群中MED8对其OS的预测价值。最后通过ROC曲线,分析MED8对HCC的诊断效能。ROC曲线横坐标为假阳性率(false positive rate,FPR),纵坐标为真阳性率(true positive rate,TPR)。
1.6 统计学方法
应用R语言对数据进行分析处理,各数据的比较采用Wilcoxon signed rank test或Kruskal-Wallis rank sum test,以P<0.05为差异有统计学意义。
2 结果
2.1 MED8在16种肿瘤组织中差异表达
Wilcoxon rank sum test法,比较MED8在GTEx联合TCGA的正常样本和TCGA对应的肿瘤样本中的表达情况。结果显示,与正常样本相比,MED8在膀胱尿路上皮癌(BLCA)、乳腺浸润癌(BRCA)、宫颈鳞癌和腺癌(CESC)、胆管癌(CHOL)、结肠癌(COAD)、食管癌(ESCA)、多形成性胶质细胞瘤(GBM)、头颈鳞状细胞癌(HNSC)、肾透明细胞癌(KIRC)、肝细胞肝癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、胃癌(STAD)、子宫内膜癌(UCEC)组织中呈高表达,在肾嫌色细胞癌(KICH)和甲状腺癌(THCA)组织中呈低表达,差异具有统计学意义(P<0.05)。
2.2 MED8在HCC组织中的表达情况
Wilcoxon signed rank test法比较50例HCC样本以及配对的HCC癌旁样本中的MED8的表达情况。结果发现,MED8在HCC样本中呈高表达,差异具有统计学意义(P<0.001,图1A)。进一步实验验证结果表明,与正常肝细胞QSG-7701相比,MED8在肝癌细胞HepG2中呈高表达(图1B)。免疫组化实验也表明,与正常人肝组织相比,MED8在肝癌组织中呈高表达(图1C)。
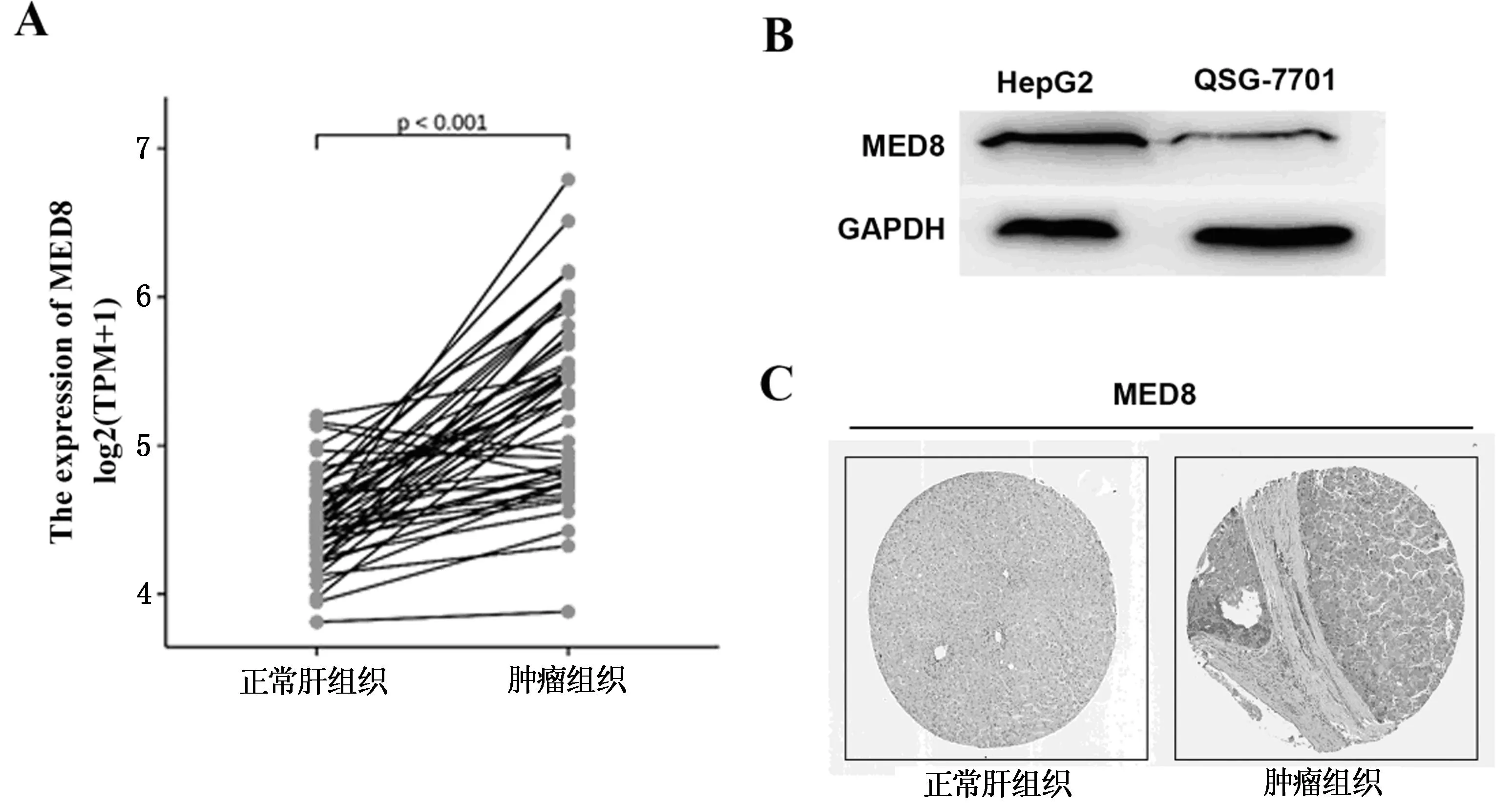
注:A为MED8在HCC及配对癌旁样本中表达情况;B为Western blot检测MED8蛋白表达水平;C为MED8在正常肝组织和HCC组织中的表达。
2.3 MED8在HCC中的共表达及富集分析
根据MED8在HCC中表达情况,以中位数为截点将患者分成高表达组和低表达组。差异分析结果显示,两组共有582个差异表达基因,其中536个基因显著上调,46个基因显著下调(图2A)。GO富集分析及KEGG通路富集分析结果显示,差异表达基因主要参与补体的激活,离子反应等生物过程,如图2B所示。免疫组化实验表明,补体激活明星分子C1qc蛋白表达水平在HCC 标本中升高(图2C)。GEPIA数据库分析显示,在肝癌中,MED8与C1qc的表达呈正相关(R=0.47,P<0.001,见图2D)。
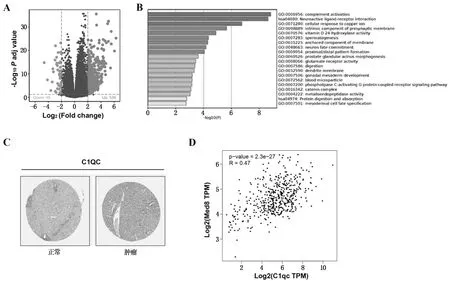
注:A为火山图分析差异表达基因;B为富集分析;C为C1qc在正常肝组织和HCC组织中的表达;D为MED8与C1qc相关性检测。
2.4 MED8表达与HCC肿瘤分期、病理分期及组织学分级的关系
MED8表达与TCGA肝细胞肝癌的T分期(图3A)、病理分期(图3B)、组织学分型(图3C)呈显著正相关。
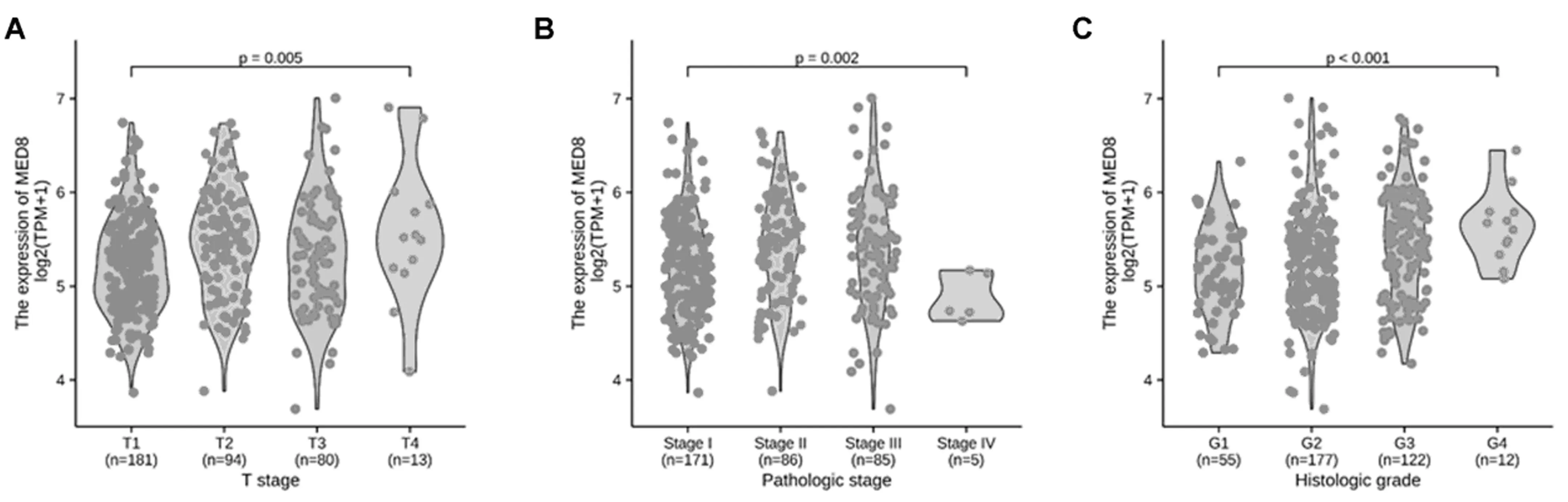
注:A为MED8与HCCT分期的相关性;B为MED8与HCC病理分期的相关性;C为MED8与HCC组织学分型的相关性。
2.5 MED8表达对HCC患者OS及疾病相关存活率的预测价值
以MED8表达值的中位数为截点,将HCC患者分为高表达组和低表达组。KM曲线结果显示:MED8高表达患者OS短[HR=2.49(1.74~3.58),P<0.001,图4A]及疾病相关存活率低[HR=2.57(1.62~4.07),P<0.001,图4B]。
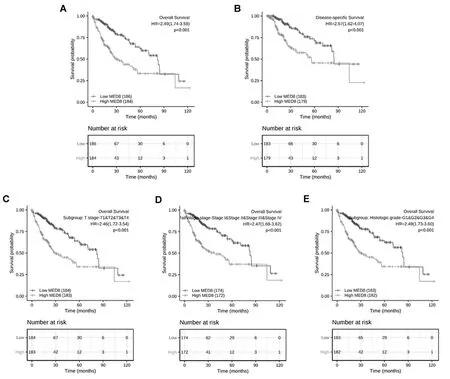
注:A为KM曲线预测两组HCC患者总生存期;B为KM曲线预测两组HCC患者疾病相关生存率;C为MED8在HCC的T分期中的亚组分析;D为MED8在HCC的病理分期中的亚组分析;E为MED8在HCC的组织学分级中的亚组分析。
2.6 MED8的亚组预后分析
对HCC的T分期、病理分期、组织学分级进行亚组分析,结果显示:高表达MED8与T分期的T1&T2&T3&T4亚群[HR=2.46(1.72~3.54),P<0.001,图4C]、病理分期的Stage Ⅰ&Stage Ⅱ&Stage Ⅲ&Stage Ⅳ亚群[HR=2.47(1.69~3.62),P<0.001,图4D]、组织学分级的G1&G2&G3&G4亚群[HR=2.49(1.73~3.60),P<0.001,图5E]呈显著相关性。
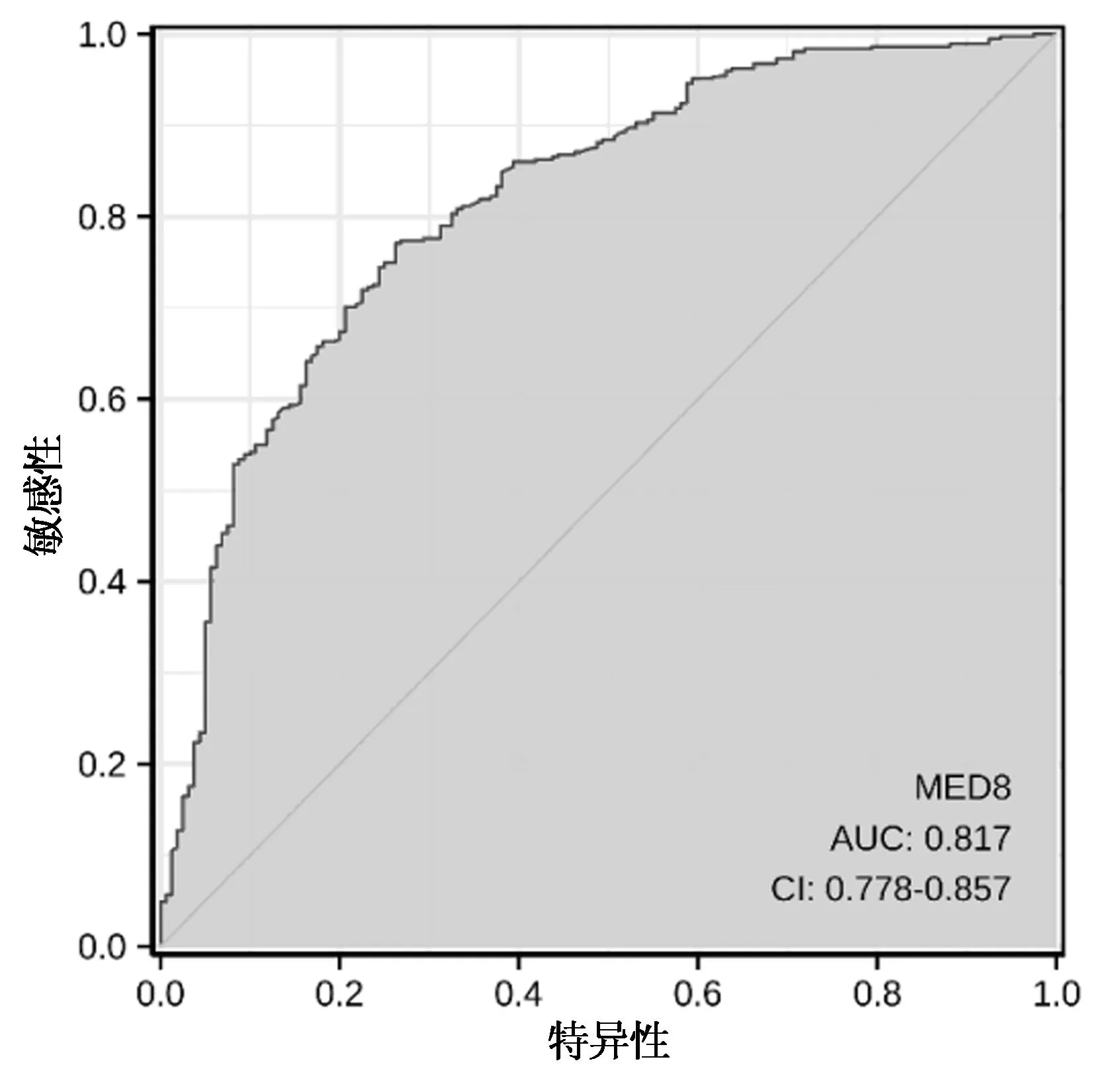
图5 ROC曲线
2.7 ROC曲线评价MED8在HCC中的诊断价值
ROC分析结果显示:曲线下面积为0.817(95%CI 0.778~0.857),提示MED8对肝癌有一定的诊断准确性(图5)。
3 讨论
介体复合物是基因转录的关键调节因子。Mediator分为四个不同的子模块:头、中、尾和激酶[7]。MED的头部和中间模块可以直接与RNA聚合酶Ⅱ(RNA polymerase Ⅱ,POLⅡ)相互作用,作为转录因子和上游调控元件结合机制之间的桥梁。MED8、MED18和MED20表示中介头域的子模块。MED头模块主要由SRB编码的蛋白质组成[8]。研究表明,MED19[9],MED15[10],MED23[11]在HCC中升高,且与HCC预后相关。但很少有研究评估MED8和癌症之间的关系。MED8被认为是一种多结构域蛋白,由一个n端螺旋结构域、一个灵活的配体和一个与Med18(25)16相互作用的c端螺旋结构域组成。MED8在所有真核生物的转录中起着重要的作用,其功能和/或组成的改变可能会产生重要的功能后果,导致包括癌症在内的各种疾病。免疫组化检测到MED8在肾透明细胞癌中表达高水平,沉默MED8会降低肾透明细胞癌细胞的增殖和运动能力。其他研究表明,MED8在结肠癌中会发生突变[5,12-13]。然而,MED8表达与HCC发生和预后的关系尚未见报道。
为了明确MED8在HCC中的作用,我们分析了来自TCGA的完整临床信息的371例HCC患者的数据。结果表明,HCC组织中MED8表达水平高于正常组织。此外,MED8高表达与T分期、病理分期、组织学分级等病理参数密切相关,提示MED8高表达参与了HCC的侵袭转移。结合MED8高表达组HCC患者总生存率低于MED8低表达组,提示MED8可能作为HCC新的诊断和预后标志物。本文根据MED8在HCC中表达的中位数将其分为高表达组和低表达组,并进行差异分析及GO分析。结果显示,与MED8共表达的基因主要参与补体激活,细胞对铜离子反应等生物过程。补体激活是先天免疫的组成部分,能够抵御入侵病原体。肝脏是合成补体成分的主要来源(>80%),并表达多种补体受体。HCC与先天性及适应性免疫失调密切相关,而免疫网络的核心是补体级联,这是肝脏固有的基本防御系统[14]。研究表明,肿瘤微环境中的补体激活增强了肿瘤生长并增加了转移,可以帮助肿瘤逃避免疫消除[15-16]。HCC是一种以慢性炎症、纤维化和肝硬化为特征的免疫原性癌症。由于HCC几乎仅在慢性炎症环境中出现[17],因此过早的补体激活可能是肿瘤炎症过程的潜在驱动因素。因而,我们猜测MED8通过调控补体激活通路从而影响HCC患者预后。免疫组化分析结果表明,补体激活经典通路分子C1qc在肝癌患者癌组织升高,这与Lee等[18]的报道一致。同时,MED8与C1qc表达水平正相关性。这些结果表明,MED8可能通过上调C1qc水平调控HCC进展。在后续实验中,我们将通过细胞实验和动物学实验验证MED8通过C1qc调控HCC进展的分子机制。
综上所述,MED8高表达与HCC的T分期、病理分期、组织学分级等病理参数密切相关,MED8可能是HCC诊断和预后的有效生物标志物。同时,我们对MED8调控HCC的分子机制进行了初步研究,从而为开发HCC抗癌药物提供了新的思路。
