基于肠道菌群调控胆汁酸代谢途径探讨二氢杨梅素对肥胖小鼠的改善作用
2024-03-12李昀珊夏世金刘梦冉冷清阳李文毅张宏利李晓华
李昀珊,李 景,夏世金,刘梦冉,冷清阳,李文毅,张宏利,李晓华∗
(1.上海中医药大学附属第七人民医院内分泌科,上海 200137; 2.复旦大学附属华东医院上海市老年医学研究所,上海 200040; 3.上海交通大学医学院附属同仁医院内分泌科,上海 200336)
由于久坐的生活方式和高热量饮食的摄入,肥胖已成为人类的主要健康问题[1]。预计2030 年全球超重和肥胖人数将达到10 亿[2],因此预防和治疗肥胖成为了全球亟待解决的公共卫生问题之一。民族特色药材藤茶的原植物是显齿蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.) W.T.Wang,二氢杨梅素是从藤茶中提取的活性最高的黄酮类化合物,课题组前期研究发现其能够通过促进饮食诱导肥胖(diet-induced obesity,DIO) 小鼠的白色脂肪棕色化改善肥胖[3],但具体机制尚不清楚。
肠道微生物群和肥胖之间存在密切关联[4-5]。有研究表明肠道菌群对宿主新陈代谢的调节是通过影响下游的活性代谢物实现的,其中胆汁酸为肠道菌群下游重要活性代谢物,其稳态由肠道菌群通过复杂的相互作用维持[6]。胆汁酸与肠道菌群通过肠肝循环相联系,不仅参与脂质的消化和吸收,同时作为信号分子能够激活下游信号通路参与宿主靶器官的调控。胆汁酸对能量稳态的调控主要是由法尼醇X 受体(farnesoid x receptor,FXR) 和G 蛋白偶联受体5 (G protein-coupled receptor 5,TGR5) 介导[7]。
本研究通过16S rDNA 测序和胆汁酸靶向分析对DIO 小鼠肠道菌群组成和胆汁酸谱分别进行分析,并观察二氢杨梅素干预后表型的变化,以期为二氢杨梅素改善肥胖提供实验依据。
1 材料
1.1 动物 5 周龄无特定病原体(SPF) 的C57BL/6J 雄性小鼠购自上海斯莱克实验动物有限责任公司[实验动物生产许可证号SCXK (沪) 2022-0004],饲养于上海斯莱克实验动物有限责任公司动物房 [实验动物使用许可证号SCXK (沪) 2022-0001],饲养条件维持在室温 (20±2)℃,相对湿度(50±10)%,标准12 h 黑暗和12 h 光照循环,自由进食、饮水。该动物研究由中国科学院上海实验动物中心机构动物护理和使用委员会(IACUC) 审查和批准(伦理号20220215018)。
1.2 试剂与药物 二氢杨梅素(纯度98%,南京广润生物制品有限公司,批号GR-138-352418),使用0.5% 羧甲基纤维素钠配制二氢杨梅素溶液。羧甲基纤维素钠(上海生工生物工程技术服务有限公司,批号9004-32-4); UCP-1抗体(英国Abcam 公司,批号ab234430); TRIzol (美国Ambion 公司,批号15596026); 逆转录试剂盒、SYBR Green Realtime PCR Master Mix (日本ToYoBo 公司,批号031500、067600); 60%高脂饲料(美国Research Diets 公司,批号D12492); Omega Mag-bind soil DNA kit (美国Omega 公司,批号M5636-02); Quant-iT PicoGreen dsDNA Assay Kit (美国Invitrogen 公司,批号P7589); NovaSeq 6000 SP Reagent Kit (美国Illumina 公司,批号20040326)。甲醇、乙腈、甲酸(美国Thermo Fisher Scientific 公司,批号67-56-1、75-05-8、A456-4)。
1.3 仪器 BMJ-IB 型包埋机(天津天利航空机电有限公司); MRZ16F050 型高速冷冻离心机 (美国Beckman 公司); NC2000 型Nanodrop (美国Thermo Fisher Scientific 公司); A33186 型QuantStudioTM5 荧光定量PCR 仪、PCR 仪(美国ABI 公司); Eclipse Ci-L 型正置光学显微镜、DS-Fi2型成像系统(日本Nikon 公司); KF-PRO-120 型全景扫描仪(宁波江丰生物信息技术有限公司); 基因测序仪(美国Illumina 公司); FLX800T 型酶标仪 (美国BioTek 公司); EXion LC 型液相色谱仪(上海爱博才思分析仪器贸易有限公司); AB6500+型质谱仪(上海爱博才思分析仪器贸易有限公司)。
2 方法
2.1 肥胖小鼠模型构建 18 只小鼠在适应性喂养7 d 后,其中12 只小鼠按照课题组前期研究方法[3],采用60%高脂饲料(60.0%脂肪、19.4%蛋白质、20.6%碳水化合物,热量5.0 kcal/g) 喂养小鼠11 周构建饮食诱导肥胖小鼠模型,即为造模组。
2.2 模型验证 使用6 只普通饲料喂养的小鼠作为对照组。喂养11 周后,称定小鼠体质量,高脂饲料喂养小鼠较普通饲料喂养小鼠体质量平均值增加20% 以上[8-9],判断为模型构建成功。
2.3 药物处理 将造模组小鼠随机分为模型组和二氢杨梅素组,每组6 只,模型组灌胃给予0.5%羧甲基纤维素钠溶液,二氢杨梅素组灌胃给予100 mg/kg 二氢杨梅素溶液,对照组灌胃给予纯水,每天1 次,连续28 d,期间持续给予高脂饮食。
2.4 取材 给药结束后,留取小鼠血清和粪便; 取腹股沟皮下脂肪(inguinal white adipose tissue,iWAT)、附睾脂肪(epididymal white adipose tissue,eWAT)、棕色脂肪(Brown adipose tissue,BAT) 并记录质量,将少量iWAT 和BAT 置于4%多聚甲醛溶液中固定; 取少量肝脏和回肠组织,置于冻存管中冻存。
2.5 小鼠体质量、进食量、脂肪质量检测 每周称量小鼠体质量,计算体质量增加量,记录进食量。给药结束后,称量iWAT、eWAT、BAT 质量。
2.6 免疫组化染色检测脂肪组织UCP1 表达 脂肪组织石蜡切片60 ℃烤片1 h,后进行脱蜡水化,加入100 μL 过氧化氢处理,并在室温下孵育10 min; 将切片放入热抗原修复液中煮沸,室温冷却后加入100 μL 5%BSA 封闭液,在湿盒中孵育20 min; 去除血清,在组化笔划定区域中加入50 μL 稀释过的一抗,在湿盒中4 ℃孵育过夜; 次日清洗后加入50 μL 标记的二抗,37 ℃孵育30 min; 经DAB 显色、复染、脱水、透化、固定后用中性树脂封片,于显微镜下观察。
2.7 16S rDNA 测序 微生物组总DNA 提取后,进行目标片段PCR 扩增,将PCR 扩增回收产物进行荧光定量,采用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库,并对文库进行质检,最后采用Illumina MiSeq/NovaSeq 平台进行双端(Paired-end) 测序。测序的下机原始数据按照QIIME2 dada2 分析流程进行序列去噪然后对其进行聚类和后续的分析。
2.8 胆汁酸靶向分析 取出于-80 ℃超低温冰箱保存的粪便和血清,随后配制胆汁酸标准品,提取代谢物,上机进行色谱质谱检测,对所有样品进行定量分析。
2.9 RT-qPCR 法检测肝脏和回肠组织胆汁酸代谢相关基因mRNA 表达 取出于-80 ℃超低温冰箱保存的肝脏和回肠组织,分别称取50 mg 组织加入1 mL TRIzol 进行组织匀浆,然后加入200 μL 氯仿,提取总RNA,使用逆转录试剂盒逆转录为cDNA,以cDNA 为模板进行荧光定量PCR 扩增。以β-actin为内参,采用2-ΔΔCT法计算相关基因mRNA表达。引物由上海尚亚生物科技有限公司合成,引物序列见表1。

表1 引物序列
2.10 统计学分析 通过GraphPad Prism 9.0 软件进行处理,数据以(x±SE) 表示,两组之间比较采用独立样本t检验,不符合正态分布使用U检验,方差不齐时使用校正t检验。P<0.05 表示差异有统计学意义。微生物相关分析使用QIIME2 (2019.4) 软件进行。
3 结果
3.1 肥胖小鼠模型评价 如图1 所示,60%高脂饲料喂养第二周开始,造模组小鼠体质量较对照组增加(P<0.01);喂养11 周后,造模组小鼠体质量高于对照组平均值20%以上,表明肥胖造模成功,造模结束时肥胖小鼠体质量为(40.2±0.86) g。

图1 饮食诱导肥胖小鼠体质量情况(x±SE,n=6~12)
3.2 二氢杨梅素对肥胖小鼠体质量、进食量、脂肪质量和脂肪组织产热的影响 药物干预期间,二氢杨梅素组比模型组小鼠体质量增加缓慢,在干预结束的第28 天时,与模型组比较,二氢杨梅素组小鼠体质量增加量减少 (P<0.01),而小鼠食物摄入量无明显变化(P>0.05),提示二氢杨梅素组小鼠体质量降低与摄食量无关,见图2A ~2B。与模型组比较,二氢杨梅素组小鼠iWAT 和eWAT 质量减轻(P<0.05,P<0.01),BAT 质量无明显变化(P>0.05),见图2C。与模型组比较,二氢杨梅素组iWAT 和BAT 中的UCP1 表达增加,提示可能通过促进产热脂肪活化减轻小鼠体质量,见图2D。
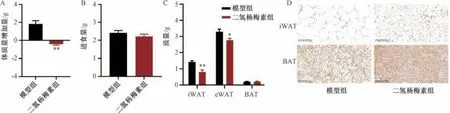
图2 二氢杨梅素对肥胖小鼠体质量、进食量、脂肪质量和脂肪组织产热的影响(x ±SE,n=6)
3.3 二氢杨梅素对肥胖小鼠肠道菌群的影响 通过Alpha多样性分析,发现二氢杨梅素并没有改变肠道菌群Alpha多样性(P>0.05),见图3A。群落的Beta 多样性分析常用方法主坐标分析(PCoA) 结果可见,二氢杨梅素组和模型组分为2 个不同的簇,通过调用置换多元方差分析( permutational multivariate analysis of variance,PERM ANOVA) 法检验两组之间的差异,发现差异有统计学意义(P<0.05),提示2 组小鼠肠道菌群结构有差异,见图3B、表2。门水平物种分布前20 种见图3C,属水平物种分布前20 种见图3D,在门分类水平上,厚壁菌门(Firmicutes) 与拟杆菌门(Bacteroidetes) (F/B) 比值降低被认为是肠道微生物区系的正常状态,与模型组比较,二氢杨梅素处理后F/B 比值有下降趋势,但无统计学差异(P>0.05); 在属分类水平上,与模型组比较,二氢杨梅素组Adlercreutzia、Rikenella、Roseburia、Coprococcus相对丰度升高(P<0.01),Akkermansia相对丰度无明显变化(P>0.05),见图3E ~3F。为了进一步筛选差异物种,进行LefSe 分析,发现在二氢杨梅素组中能够影响胆汁酸代谢的肠道菌群Streptococcus和Bacteroides显著富集; 在模型组中,能够影响胆汁酸代谢的肠道菌群Blautia显著富集,见图3G。

图3 2 组小鼠肠道菌群分析(x ±SE,n=6)

表2 PERMANOVA 结果
3.4 二氢杨梅素对肥胖小鼠粪便胆汁酸谱的影响 与模型组比较,二氢杨梅素处理后粪便总胆汁酸水平呈升高趋势,见图4A。对不同类型胆汁酸进行统计后可见,与模型组比较,二氢杨梅素处理后结合型胆汁酸水平升高(P<0.01),见图4B。对单一成分胆汁酸进行分析可见,与模型组比较,二氢杨梅素处理后牛磺-alpha-鼠胆酸 (Tauro-alphamuricholic acid sodium salt,T-alpha-MCA) 和牛磺-beta-鼠胆酸 (Tauro-beta-muricholic acid sodium salt,T-beta-MCA)(P<0.05,P<0.01) 水平升高,见图4C。

图4 2 组小鼠粪便胆汁酸水平分析(x±SE,n=5)
3.5 二氢杨梅素对肥胖小鼠血清胆汁酸谱的影响 与模型组比较,二氢杨梅素处理后血清总胆汁酸水平升高,见图5A。对不同类型胆汁酸进行统计后发现,与模型组比较,二氢杨梅素组血清次级胆汁酸水平降低(P<0.05),初级胆汁酸和结合型胆汁酸有升高趋势,但差异无统计学意义(P>0.05),见图5B。对单一成分胆汁酸进行分析发现,与模型组比较,二氢杨梅素处理后TGR5 的内源性激动剂胆酸(cholic acid,CA)、鹅去氧胆酸(chenodeoxycholic acid,CDCA)、牛磺鹅去氧胆酸 (taurochenodeoxycholic acid,TCDCA)、牛磺胆酸(taurocholic acid Sodium Salt,TCA) 水平有升高趋势,但差异无统计学意义(P>0.05),见图5C。
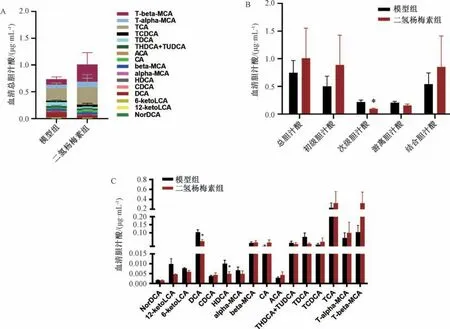
图5 2 组小鼠血清胆汁酸水平分析(x ±SE,n=5)
3.6 二氢杨梅素对肥胖小鼠胆汁酸合成通路的影响 与模型组比较,二氢杨梅素处理后肝脏Cyp7a1 mRNA 表达上调(P<0.05),Fgfr4 mRNA 表达无明显变化(P>0.05),回肠组织Fxr和Fgf15 mRNA 表达均下调(P<0.05),结果表明二氢杨梅素处理后FXR-FGF15 通路被抑制,见图6。上文可见粪便胆汁酸中FXR 的抑制剂T-alpha-MCA 和T-beta-MCA 水平升高,提示二氢杨梅素干预后粪便胆汁酸中Talpha-MCA 和T-beta-MCA 水平的升高,进而抑制肠FXRFGF15 通路导致胆汁酸合成过程中重要的限速酶Cyp7a1 表达升高,促进血清胆汁酸水平的提高。

图6 2 组小鼠Fxr、Fgf15、Fgfr4、Cyp7a1 mRNA 表达分析(x ±SE,n=5)
4 讨论
本实验发现二氢杨梅素能够减少DIO 小鼠体质量增加,减轻脂肪质量,在治疗肥胖中具有潜在价值。二氢杨梅素作为中药活性成分具有口服生物利用度低且难以吸收入血的特点,进入肠道进行代谢后以粪便形式排出,导致其对体内靶标的直接激活不足,而是与肠道菌群接触发生相互作用[10-11],所以肠道可能是其首先作用的器官。童庆[12]通过使用肠道菌群剔除和肠道菌群移植方式验证二氢杨梅素对大鼠肠道菌群的调节作用是其防治肥胖的有效途径。
肠道微生物区系是一个复杂的生态系统,肥胖和肠道微生物群之间具有密切而动态的联系[13]。肠腔中的微生物种类繁多,其中Firmicute 和Bacteroidetes 占总数80% ~90%。Turnbaugh 等[5]发现,肥胖个体的肠道中Firmicutes与Bacteriodete 的比例增加。F/B 低比例被认为是肠道微生物区系的正常状态,本研究发现二氢杨梅素干预后F/B 比值有下降趋势。通过分析16S rDNA 测序结果,二氢杨梅素干预改变了部分与宿主代谢能力相关的微生物群丰度,增加了Adlercreutzia、Bacteroides相对丰度。Adlercreutzia被发现在糖脂代谢中发挥作用[14]; 有研究表明糖脂代谢紊乱小鼠中Adlercreutzia含量较低[15]。Bacteroides、Akkermansia相对丰度被报道与体脂量呈负相关[16-17]。近年来,Akkermansia被认为是治疗代谢性疾病的益生菌,能够发挥改善肥胖的作用[18]。然而本研究发现二氢杨梅素对Akkermansia相对丰度没有明显影响,这提示二氢杨梅素的减肥作用可能与Akkermansia无关,这也与文献报道结果一致[19]。
肠道菌群被认为是人体不可或缺的“内分泌” 器官,能够通过产生活性代谢物调节宿主新陈代谢,肠道菌群通过肠肝循环与胆汁酸联系密切[20-21]。胆汁酸为胆汁的最主要成分,其在肝脏中由胆固醇为原料合成,与牛磺酸或甘氨酸结合后储存在胆囊中,当受到食物刺激,初级结合型胆汁酸流进肠腔,肠道内菌群能发挥胆盐水解酶(bile salt hydrolase,BSH) 的作用,使结合型胆汁酸变成游离型胆汁酸,随后,肠道菌群对其进行脱羟基和脱氢等过程,促进向次级胆汁酸转变,次级胆汁酸在回肠末端通过主被动运输的方式经门静脉系统重回肝脏完成肠肝循环[20]。由肠肝循环可见,肠道菌群的变化可导致胆汁酸谱的改变,其中肠道菌群对胆汁酸的修饰作用的第一步就是发挥BSH 的功能[22]。Bifidobacterium、Clostridium、Lactobacillus、Streptococcus、Bacteroide、Blautia具有BSH 功能[23]。本研究发现,二氢杨梅素组中Streptococcus(LDA score>2)、Bacteroides(LDA score>2) 显著富集,模型组中Blautia(LDA score>4) 显著富集,由于肠道菌群BSH 酶的活性并不取决于单一菌种而是与菌群总体BSH 活性有关[24]。根据Lefse 分析可见,模型组中Blautia的LDA score 大于4,二氢杨梅素组中Streptococcus、Bacteroide的LDA score 仅大于2,LDA score 反映不同组间差异物种的影响程度,其数值越大对应的菌群影响力越大。据此推断,二氢杨梅素组中的BSH 活性可能低于模型组。并且由粪便胆汁酸靶向分析可见,二氢杨梅素干预后结合型胆汁酸水平升高,这可能与BSH 减少有关。
升高的结合型胆汁酸中T-alpha-MCA、T-beta-MCA 增加幅度较大,且二者为FXR 拮抗剂[21]。肠FXR-FGF15 通路是存在于肠肝循环中的一条负反馈途径,能够影响胆汁酸的合成,其发挥作用的途径是在远端回肠中,FXR 能够诱导FGF15 表达,通过肠肝循环,使FGF15 进入肝脏; 在肝脏中,激活成纤维细胞生长因子受体4 (fibroblast growth factor receptor 4,FGFR4) 及其辅助受体B-klotho,形成FGFR4/B-klotho 复合物,随后触发JNK1/2、ERK1/2 信号联级反应,抑制CYP7A1 的表达[7,20]。CYP7A1 为胆汁酸合成过程中重要限速酶,其表达下调能够减少胆汁酸的合成。本研究发现二氢杨梅素干预后肠道Fxr、Fgf15 表达下调,CYP7a1 表达上调,促进胆汁酸的合成。
胆汁酸通过2 个主要的受体参与糖脂代谢调节,其中激活TGR5 受体能够促进UCP1 的表达促进产热改善肥胖,TGR5 在维持机体能量稳态中起到至关重要的作用[7],其促进UCP1 产生的机制主要是激活BAT 和促进iWAT 的棕色化。本研究发现二氢杨梅素能够促进iWAT 和BAT 中UCP1的表达改善DIO 小鼠肥胖。文献报道,某些游离型胆汁酸及其牛磺酸结合形式的胆汁酸(tauro Bile acids,TBAs) 能够激活TGR5,且TBAs 对TGR5 激活效力更强[25-26]。CA、CDCA、TCA、TCDCA 被认为是TGR5 的内源性激动剂[7]。本研究发现,二氢杨梅素干预后 CA、CDCA、TCA、TCDCA 水平有升高趋势。因此推测升高的胆汁酸可能通过门静脉系统作为信号分子激活TGR5 进而促进棕色脂肪组织和腹股沟皮下脂肪组织UCP1 的产生。
综上所述,本研究初步证明藤茶的活性单体二氢杨梅素能够通过重塑肠道微生物区系使产生BSH 相关菌群的相对丰度降低,导致对胆汁酸的水解作用减弱,使粪便中牛磺酸结合型胆汁酸T-alpha-MCA 和T-beta-MCA 水平增加,抑制了回肠FXR-FGF15 信号通路,并上调肝脏CYP7A1 的表达促进胆汁酸合成进而改善肥胖。
