口蹄疫病毒O型全自动磁微粒CLIA抗体定量检测方法的建立
2024-03-08包艳芳蒋韬何莉吕律李涛善李昕孙燕燕杨光魏婷潘晓乐林密
包艳芳,蒋韬,,何莉,吕律,李涛善,李昕,孙燕燕,杨光,魏婷,潘晓乐,林密,
口蹄疫病毒O型全自动磁微粒CLIA抗体定量检测方法的建立

1兰州兽研生物科技有限公司,兰州 730046;2中国农业科学院兰州兽医研究所/动物疫病防控全国重点实验室/国家口蹄疫参考实验室,兰州 730046
【背景】口蹄疫(foot and mouth disease, FMD)是由口蹄疫病毒引起的一种急性、热性、烈性传染病,疫苗接种是预防临床口蹄疫的有效措施。免疫抗体水平监测则是评估疫苗免疫效果、制定免疫程序的重要依据,是免疫工作和疫情防控必不可少的关键环节,因此建立高效、快速、全自动的抗体检测方法具有重要意义。【目的】基于磁微粒(micromagnetic particles,MMPs)化学发光免疫分析技术(CLIA),建立一种新型 、全自动、可定量的口蹄疫病毒O型抗体检测方法,为口蹄疫免疫监测和疫情防控提供技术支撑。【方法】使用纳米材料磁微粒为固相载体和分离载体包被捕获抗体,用碱性磷酸酶(alkaline phosphatase,ALP)标记检测抗体,经过条件优化建立了一种新型磁微粒CLIA检测方法(magnetic particle chemiluminescence immunoassay, MP-CLIA)。本方法首先加入磁微粒-兔抗偶联物 (magnetic particle-polyclonal antibodies, MPs-pAbs)、待测样本、口蹄疫病毒O型抗原,37℃孵育;再加入适量酶标抗体(ALP-pAbs),37℃孵育;最后加入化学发光底物AMPPD,检测相对发光强度(relative light unit,RLU)。研究通过检测标准品拟合标准曲线,并应用受试者工作特征曲线(receiver operating characteristic,ROC)确定检测方法的判定标准;利用质控样本进行方法学评价,同时检测田间样本,并和液相阻断ELISA(LPB-ELISA)比对,验证临床检测效果。【结果】优化后最佳反应条件为磁微粒浓度0.25 mg·mL-1、口蹄疫病毒O型抗原1﹕1 000稀释、酶标抗体1﹕2 000稀释、加样量20 µL。整个检测过程均在全自动化学发光免疫分析仪中完成,反应时间20 min,在抗体含量0—1 280 U(效价0—1﹕2 048)范围内标准曲线2>0.99,可进行定量检测。该方法敏感性为94.66%;特异性为97.10%,检测口蹄疫A型、Asia I型血清型特异性为97.14%,与塞内卡病毒(SVV)、猪繁殖与呼吸综合征病毒(PPRSV)、牛流行热病毒(BEFV)、猪圆环病毒2型(PCV2)、羊痘病毒(QRFV)、小反刍兽疫病毒(PPRV)抗体阳性血清无交叉反应;重复检测变异系数 CV值<10%;田间样本检测结果与LPB-ELISA符合率为94.69%,定量结果相关系数2为0.8473,<0.0001,相关性显著。【结论】建立的MP-CLIA方法耗时短、操作简便,配套国产全自动化学发光仪,可进行全自动化检测,是一种新型、高效的口蹄疫病毒O型抗体定量检测方法,本方法对应的试剂盒已经完成中试生产和临床检测试验,在全国不同区域试用效果较好,具有较高的临床应用价值。
磁微粒化学发光免疫分析法;口蹄疫;磁微粒;全自动化
0 引言
【研究意义】口蹄疫(foot and mouth disease, FMD)是由口蹄疫病毒引起偶蹄动物的一种急性、热性、烈性传染病,在牛、猪、绵羊、山羊等家畜中感染最为普遍,造成重大经济损失和社会政治负面影响[1-2]。疫苗接种是预防口蹄疫疫情传播的有效策略[3-4]。免疫抗体水平监测则是评估疫苗免疫效果、制定免疫程序的重要依据,是口蹄疫防控必不可少的关键环节,因而建立一种高效、快速、全自动的抗体检测方法可以为口蹄疫疫病防控提供强有力地技术支撑。【前人研究进展】1977年HALMANN等[5]通过化学发光技术和免疫分析技术联用对少量微生物进行鉴定和定量,从而建立了化学发光免疫分析(chemiluminescence immunoassay,CLIA)技术,同年,ARAKAWA等[6]用鲁米诺-过氧化物酶化学发光反应进行皮质醇酶免疫测定。经过几十年的发展,CLIA技术现在已经广泛应用于环境监测、临床诊断,药物分析、生命科学等领域[7-11]。在动物疫病检测方面也有许多研究和报道,如1995年VIDZIUNAITÉ等[12]建立的检测布病和兔土拉菌病的CLIA方法,2014年ZHOU等[13]使用金纳米材料为载体,建立了检测猪细小病毒抗体的CLIA方法,YANG等[14]结合磁微粒化学发光和PCR,建立了检测伪狂犬病毒的方法;口蹄疫方面, LIU等[15-16]分别在2017年、2018年建立了检测非结构蛋白2C和3ABC抗体的CLIA方法和基于3A-3B重组表位的CLIA检测方法,能有效区分FMDV感染和免疫抗体, LIU等[17]于2021年利用多表位重组蛋白建立了间接CLIA方法,用于检测猪血清的FMDV-O型抗体,孙雨等[18-19]建立了口蹄疫病毒O型/A型抗体CLIA检测方法,可以检测血清样本中的VP1蛋白抗体。由于在敏感性、特异性、检测效率上明显优于ELISA[8],CLIA已经用于动物疫病临床检测中,欧盟已经将CLIA方法作为牛海绵状脑病(BSE)的快速检测手段之一[20]。【本研究切入点】近年来,纳米粒子在化学发光免疫技术方面表现出较好的应用效果[21-25],其中磁性纳米材料制备简单、成本低、易清洗分离,通过共价键连接抗原/抗体不易脱落[26]。以磁性纳米颗粒为固相包被和分离载体建立的磁微粒CLIA技术,使得免疫反应在几乎全液相的状态下进行,具有快速、高通量、全自动化、操作简单方便等特点[27-29],此方法克服了传统ELISA和板式CLIA方法使用聚乙烯化学发光板作为反应载体,包被抗原/抗体浓度有限和免疫反应表面积小导致的检测的灵敏度低、检测范围窄的缺点[30]。2023年SHI等人使用此方法建立了非洲猪瘟抗体检测的方法,并证明此方法检测P30蛋白具有高敏感性和特异性,其稳定性好,保存期长,检测效果好[31]。到目前为止,此方法在FMDV抗体检测中还未见报道。【拟解决的关键问题】本研究使用磁微粒作为固相载体偶联抗口蹄疫O型兔抗,以碱性磷酸酶(Alkaline phosphatase,ALP)标记抗口蹄疫O型豚鼠抗,灭活O/Mya-98全病毒为检测抗原,3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷(AMPPD)为发光底物,旨在建立一种新型口蹄疫病毒O型全自动磁微粒CLIA抗体定量检测方法,同时配套全自动化学发光免疫分析仪,克服ELISA、板式CLIA等检测方法重复性差、操作繁琐等缺点,实现对FMDV-O型抗体的定量、快速、自动化检测。
1 材料与方法
试验于2019年11月至2021年5月在中国农业科学院兰州兽医研究所、兰州兽研生物科技有限公司完成。
1.1 毒种、抗体、血清样本
口蹄疫O/Mya-98全病毒灭活抗原由中农威特生物科技有限公司提供;兔抗口蹄疫病毒O型纯化抗体、豚鼠抗口蹄疫病毒O型纯化抗体、口蹄疫病毒O型抗体标准血清,均为兰州兽研生物科技有限公司实验室制备、保存。
口蹄疫病毒O型免疫血清样本131份,口蹄疫病毒A型免疫血清样本18份, 口蹄疫病毒亚洲Ι型免疫血清样本17份,健康未免疫血清样本34份,共200份样本如表1所示。塞内卡病毒(SVV)抗体阳性血清3份,猪繁殖与呼吸综合征病毒(PPRSV)、牛流行热病毒(BEFV)、猪圆环病毒2型(PCV2)、羊痘病毒(QRFV)、小反刍兽疫病毒(PPRV)抗体阳性血清各3份,均兰州兽医研究所动物疫病防控全国重点实验室收集保存。
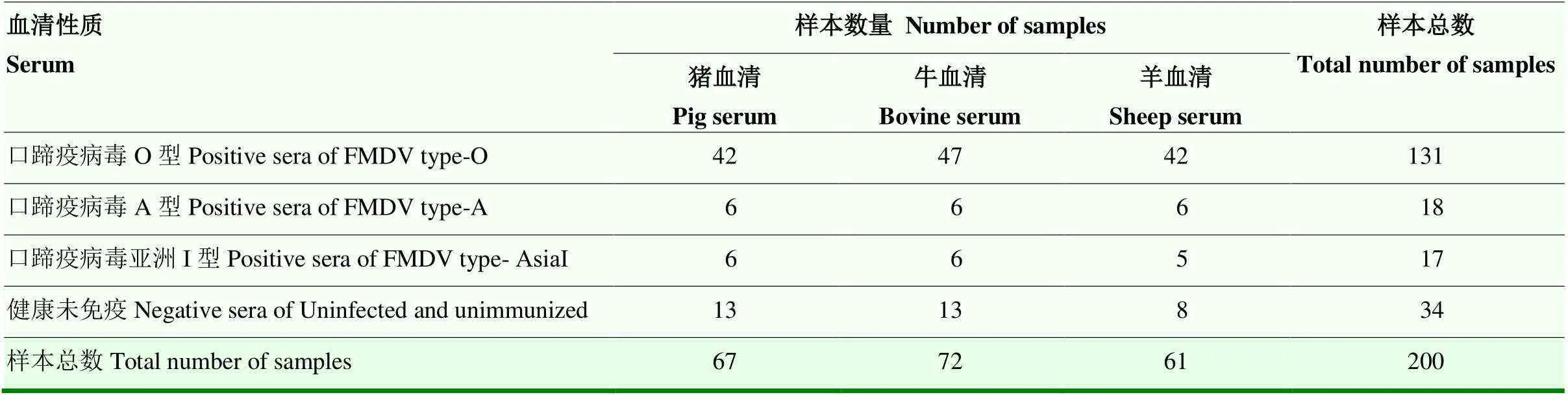
表1 200份血清及背景
1.2 主要试剂和仪器
磁性微粒购自JSR集团MBL公司,碱性磷酸酶(alkaline phosphatase,ALP)、AMPPD均购自sigma公司。口蹄疫病毒O型液相阻断ELISA抗体检测试剂盒,兰州兽研生物科技有限公司提供。
LYC100T全自动化学发免疫分析仪由兰州兽研生物科技有限公司提供;SEPMAG® A200 mL生物磁性分离器购自sepmag公司,X718-1 XK01血液混匀仪购自江苏新康医疗器械有限公司,GHP-9270恒温培养箱购自上海-恒科学仪器有限公司,超速离心机购自Thermo Fisher公司。
1.3 口蹄疫病毒O型检测抗原的制备
使用PEG6000和NaCl沉淀灭活抗原,进行差速、超速离心,弃上清。用0.1 mol·L-1Tris-HCl缓冲液悬浮沉淀至原体积的1/10,加入2倍三氯乙烯去酯,用原体积1/100的0.01 mol·L-1PBS缓冲液重悬沉淀,分装后置-20℃以下保存备用。
1.4 磁性微粒(MMPs)偶联抗口蹄疫O型兔抗
取20 mg MMPs,用生物磁性分离器吸附1 min,弃去溶液后使用2 ml 0.1 mol·L-1MES(pH5.0)重新悬浮,如此反复清洗4次后,加入NHS(10 mg·mL-1)和EDC(10 mg·mL-1)各200 µL进行MPs活化,常温混匀反应30 min。之后用2 mL0.1 mol·L-1MES(pH5.0)清洗MPs 4次,加入抗口蹄疫病毒O型纯化兔抗200 µg,室温震荡偶联3 h后,加入200 µL10% BSA室温震荡3 h,制备成磁微粒-多抗偶联物(magnetic particle-polyclonal antibodies, MPs-pAbs)。最后,用PBST清洗3次,用80 mL保存液分散,4℃储存备用。
1.5 碱性磷酸酶(ALP)标记口蹄疫O型豚鼠抗体
使用高碘酸钠(NaIO4)法进行活化标记,整个反应均在4—8℃下进行。首先,NaIO4和ALP反应1 h后,加入等体积乙二醇(1%),还原过量NaIO4,完成ALP的活化。然后,将抗FMDV-O豚鼠抗体与和活化的ALP混合,置于pH9.6,浓度 0.5 mol·L-1的CBS中透析过夜,制备成碱性磷酸酶标记抗体(alkaline phosphatase -polyclonal antibodies ALP- pAbs)。最后,在上述混合液中加入50%甘油的PBS,-20℃及以下保存备用。
1.6 口蹄疫抗体含量的定义和标准品制备
取经病毒中和试验(VNT)检测结果为1﹕16的O型口蹄疫抗体血清样品,定义该抗体含量为10个活性单位,即10 U,则标准品(效价1﹕2 048的血清)抗体含量为1 280 U。用新生牛血清分别倍比稀释标准品,制备抗体含量分别为1 280 U(1﹕2 048)、640U(1﹕1 024)、320U(1﹕512)、160U(1﹕256)、80U(1﹕128)、40U(1﹕64)、20(1﹕32)、10(1﹕16)、5U(1﹕8)的标准品,-20℃及以下保存备用。
1.7 口蹄疫病毒O型磁微粒CLIA抗体检测方法的初步建立
方法原理及建立过程如图1所示,将抗口蹄疫兔抗和磁微粒偶联制备成磁微粒-兔抗偶联物(MPs-pAbs),碱性磷酸酶标记豚鼠抗体制备成酶标抗体。检测时,首先将待测样本、口蹄疫病毒O型抗原和适量磁微粒-兔抗偶联物(MPs-pAbs)混合,37℃孵育10 min;用磁力板吸附磁珠1 min,弃去反应液,加清洗液重悬磁珠后再进行吸附清洗,如此重复4次后弃去清洗液,加入适量酶标抗体(ALP-pAbs),混匀磁珠,37 ℃孵育10 min;重复清洗4次后加入100 µL化学发光底物AMPPD,混匀磁珠,37℃孵育3 min,检测相对发光强度(relative light unit,RLU),计算抗体含量,初步建立口蹄疫病毒O型磁微粒CLIA(magnetic particle chemiluminescence immunoassay,MP-CLIA)抗体检测方法。
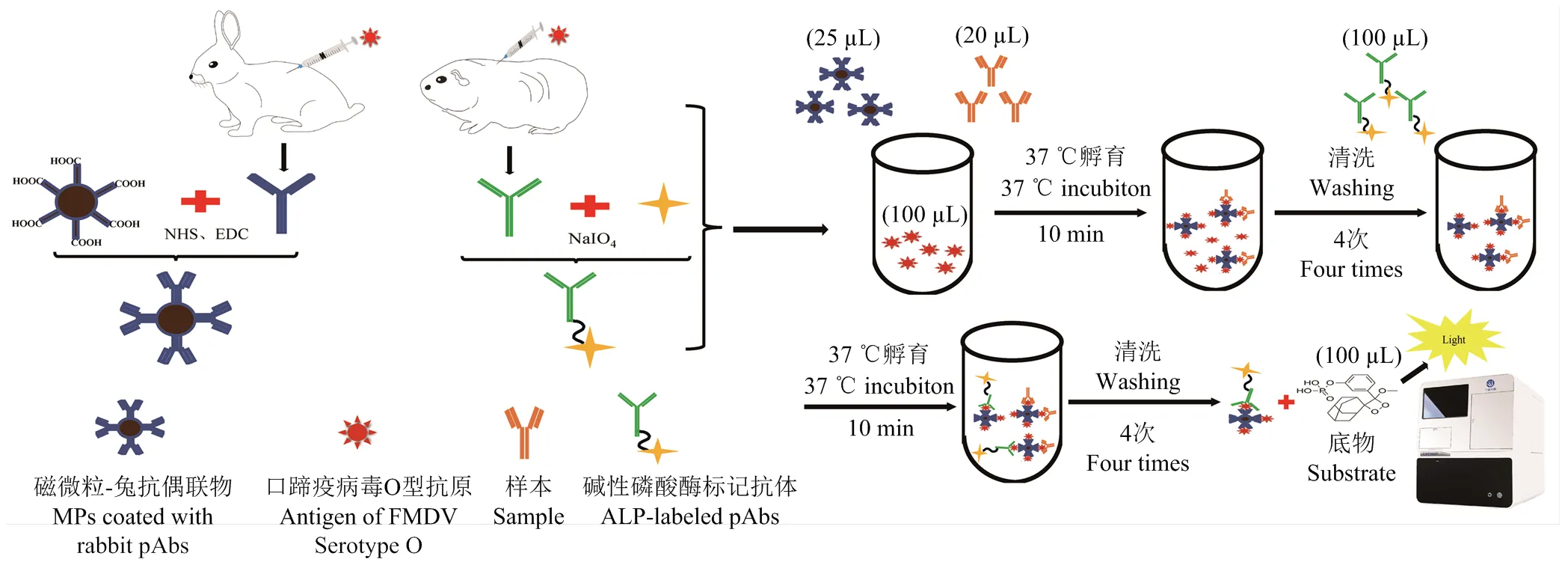
图1 口蹄疫病毒O型磁微粒CLIA抗体定量检测方法原理及检测过程示意图
1.8 口蹄疫病毒O型抗原、MPs-pAbs、ALP-pAbs反应浓度的优化
按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000比例依次稀释口蹄疫病毒O型抗原,以MPs浓度0.1、0.25、0.5、1 mg·mL-1分别稀释MPs-pAbs,按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000比例依次稀释ALP-pAbs,保存备用;以标准品为待检血清,检测在使用不同浓度抗原、不同浓度的MPs-pAbs和ALP-pAbs条件下的发光值,以抗体含量为X值,RLU为Y值拟合标准曲线;以阴阳性对照为待检血清,检测后计算阴阳性血清发光强度比值(luminescence intensity ratio,LIR)N/P值,检测步骤同1.7。通过比较标准曲线2值,和N/P值,确定口蹄疫病毒O型抗原、MPs-pAbs、ALP-pAbs最佳反应浓度。
1.9 反应时间、加样量优化
选择加样量分别为5、10、15、20、30 µL;待测样本、口蹄疫病毒O型抗原和适量磁微粒-兔抗偶联物(MPs-pAbs)混合,37℃分别孵育5、10、15、20 min;加入酶标抗体后37℃分别孵育5、10、15、20 min,同1.8检测标准品和阴阳性对照血清,拟合标准曲线,计算N/P值,通过比较标准曲线R2值,和N/P值,确定最佳反应时间和加样量。
1.10 CLIA方法的Cut-off值和判定标准
使用优化后的MP-CLIA方法检测标准品,拟合标准曲线,并检测200份背景清楚的田间样本,通过ROC曲线和交互式点状图进行分析,以Youden index值为指标确定CLIA方法的最佳Cut-off值,并作为该方法检测口蹄疫O型病毒抗体阴阳性的判定标准。
1.11 CLIA方法的敏感性、特异性
分析200份样本中131份FMDV-O抗体阳性样本检出率,计算该方法的敏感性;分析69份阴性血清检测结果,计算该方法的特异性,并通过其中34份型特异性血清的检测结果,考察该方法的型特异性。另外,通过检测SVV、PPRSV、BEFV、PCV2、QRFV、PPRV的抗体阳性血清21份,检验该方法对不同病原抗体是否有交叉反应。
1.12 CLIA方法的重复性
根据农业农村部第638号公告《兽用诊断制品试验研究技术指导原则》,选择2份阴性、1份弱阳性、1份强阳性共4份血清,抗体含量从低到高,每个样本进行20次重复性检测,计算结果平均值(Mean)、标准差(SD)和变异系数CV%,通过比较变异系数大小,考察CLIA方法的检测重复性和稳定性,其中CV%=(SD/Mean)×100。
1.13 CLIA方法对临床样本的检测
用建立的CLIA方法和OIE推荐的口蹄疫病毒O型液相阻断ELISA抗体检测方法(LPB-ELISA)分别检测320份田间样本的抗体含量和效价,并对结果进行比对和分析,比较两种方法阴阳性判定的符合率,并通过相关性分析,比较定量检测结果的相关性,从而比较两种方法的检测差异,评估磁微粒CLIA方法对临床样本的检测准确性。
1.14 统计学处理
采用GraphPad Prism做方法优化数据分析,Medcalc软件做ROC曲线分析,Origin85做相关性分析,计量比较采用t检验,以<0.05为差异有统计学意义。
2 结果
2.1 磁微粒CLIA方法的优化
2.1.1 偶联抗体的磁微粒浓度优化 偶联抗体过程中磁微粒(MPs)并没有丢失,以MPs浓度0.1、0.25、0.5、1 mg·mL-1计算,分别稀释偶联抗体的磁微粒用于检测标准血清,结果如图2-a所示,磁微粒浓度为0.25mg·mL-1时,标准曲线2为0.9987,阴阳性样本发光强度比(luminescence intensity ratio,LIR)N/P值为6.27,检测结果最优。
2.1.2 口蹄疫病毒O型抗原、碱性磷酸酶(ALP)标记抗体稀释度优化 口蹄疫病毒O型抗原和碱性磷酸酶(ALP)标记抗体分别按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000稀释,均使用100 µL检测标准血清,结果如图2-b所示,口蹄疫病毒O型抗原1﹕1 000稀释、酶标抗体1﹕2 000稀释时,N/P为20.36,检测结果最佳。
2.1.3 反应时间、加样量优化 待测样本、口蹄疫病毒O型抗原和适量磁微粒-兔抗偶联物(MPs-pAbs)混合,37℃分别孵育5、10、15、20 min;加入酶标抗体后37℃分别孵育5、10、15、20 min,进行组合优化,如图2-c所示,随着反应时间增长,N/P先增大后降低,两步反应最佳反应时间均为10 min,此时N/P为20.03。选择加样量分别为5、10、15、20、30 µL,图2-d为加样量优化结果,样本加入20 µL时检测结果最好,此时N/P为23.98,标准曲线2为0.9981。
a:磁微粒-捕获抗体偶联物使用浓度优化;b:口蹄疫病毒O型抗原、ALP标记抗体稀释度优化;c:反应时间优化;d:加样量优化
a: Optimization of the concentration of magnetic particles coated with capture antibodies; b: Dilution optimization of FMDV-O antigen and ALP-labeled pAbs; c: Optimization of the reaction time; d: Optimization of volume of sample
图2 口蹄疫病毒O型磁微粒CLIA抗体定量检测方优化
Fig. 2 Optimization of the MPs-based CLIA method for quantitative detection of of Foot and Mouth Disease Virus Serotype O
2.2 CLIA方法的Cut-off值和判定标准
2.2.1 标准血清及抗体含量 病毒中和试验结果1﹕16定义为10个活性单位,即10U,以效价(1﹕)为横坐标,活性含量(U)为,其对应关系为=0.0625(图3),则标准血清抗体含量分别为5U(1﹕8),10(1﹕16),20(1﹕32),40U(1﹕64),80U(1﹕128),160U(1﹕256),320U(1﹕512),640U(1﹕1 024),1 280U (1﹕2 048)。
2.2.2 CLIA方法的Cut-off值和判定标准 按照优化后的CLIA方法检测标准血清,制作四参数标准曲线如图4所示,2为0.9994,相关性较好。检测背景清楚的200田间份血清,使用ROC曲线进行统计分析,结果如图5所示,本方法的最佳Cut-off值为70.74U(效价为1﹕113.18),此时AUC值为0.975,<0.0001,Youden指数为0.9176,证明CLIA方法具有很好的检测效果。判定标准定为:当检测结果≥70.74U判定为口蹄疫病毒O型抗体阳性,<70.74U时判为口蹄疫病毒O型抗体阴性。
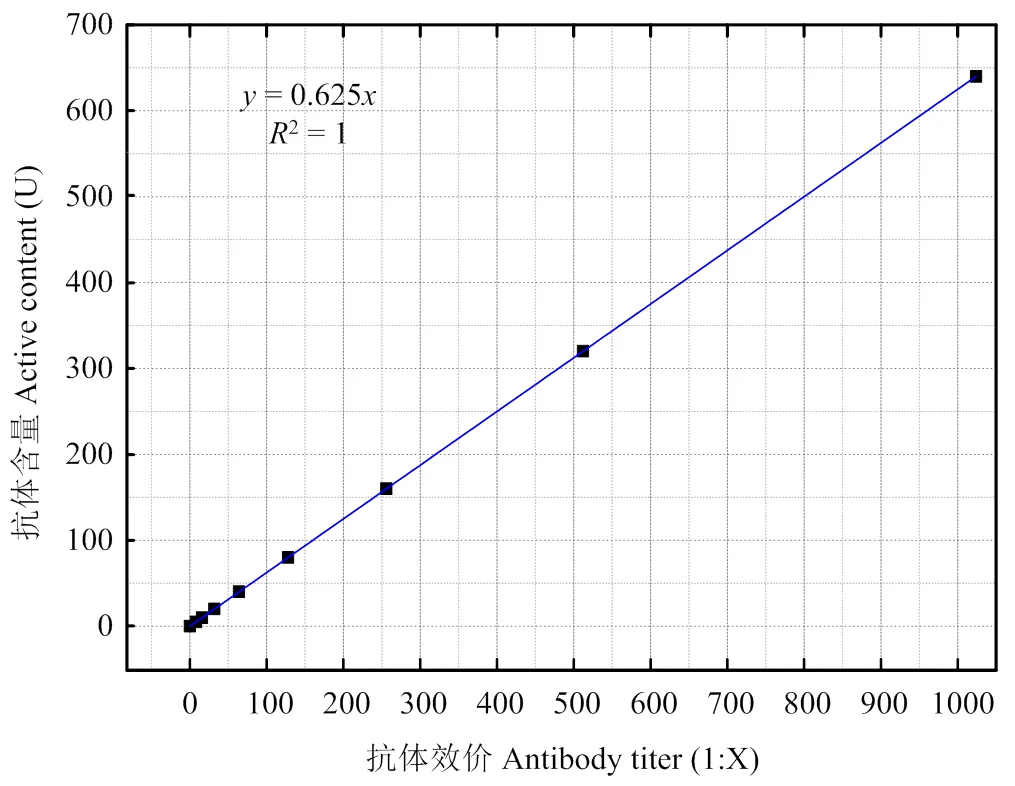
图3 抗体效价和活性含量对应关系
2.3 CLIA方法的特异性和敏感性
200份样本检测结果如图6所示,其中131份阳性样本,CLIA方法检出124份,敏感性为94.66%;69份阴性样本,检出阴性67份,特异性为97.10%。特异性样本具体检测结果如图7所示,共计检测阴性血清69份,其中35份型特异性样本(A型18份,亚洲Ι型17份)中,34份检测结果为阴性,型特异性为97.14%;检测SVV、PPRSV、BEFV、PCV2、QRFV、PPRV的抗体阳性血清21份,结果均为阴性,特异性为100%;其他阴性样本13份,检测特异性为97.06%。

图4 CLIA方法的标准曲线
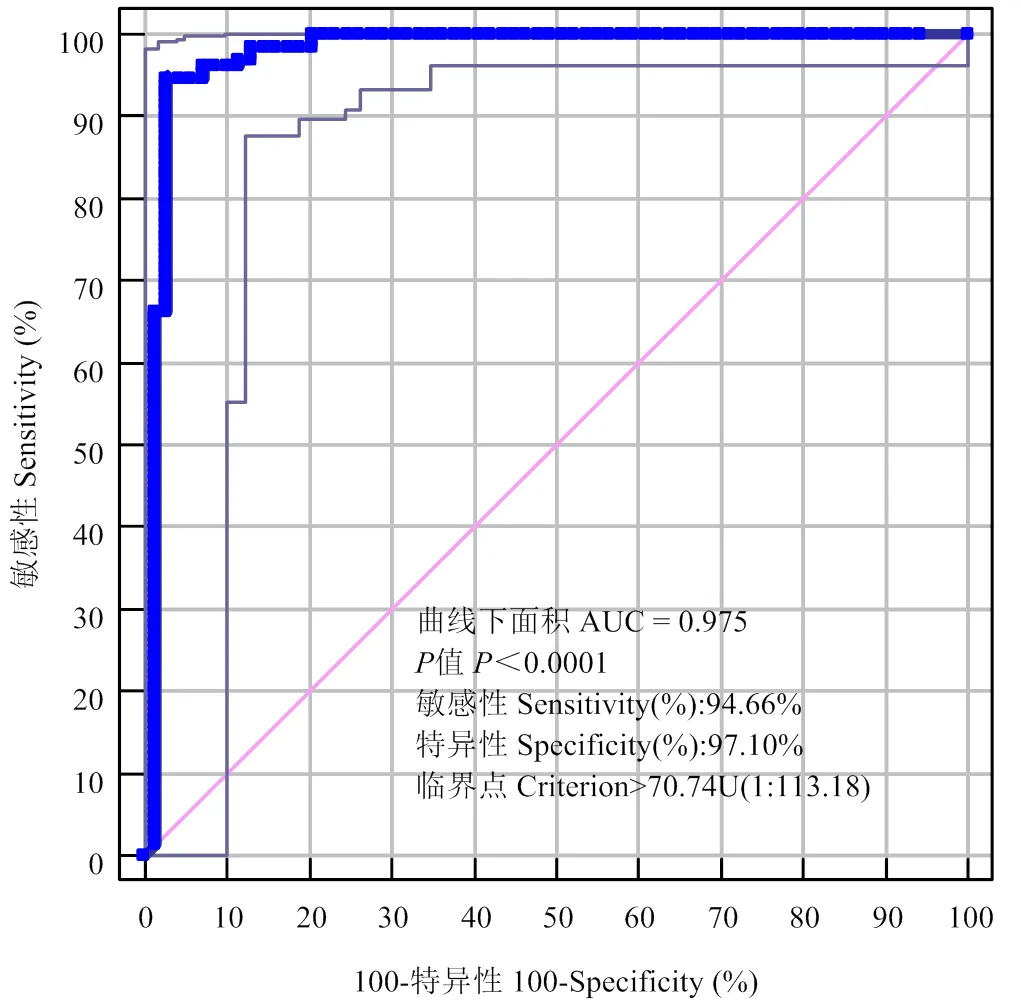
曲线上每一点代表不同的敏感性和特异性
Each point on the graph represents the sensitivity and specificity at a particular threshold
图5 ROC曲线
Fig. 5 Determination of the Cut-off value for MPs-based CLIA(a) Receiver operating characteristic curve

0为阴性,1为背景阳性图
0 represents negative sera and 1 represents the positive sera
图6 200份血清检测结果
Fig. 6 The result of 200 sample

图7 特异性检测
2.4 CLIA检测方法重复性
检测4份抗体含量从低到高的血清样本,每个样本检测20次,重复性检测结果如表2所示,4个样本变异系数CV%值分别是8.20%、4.14%、3.56%、1.59%,均小于10%,说明CLIA抗体检测方法重复性较好。
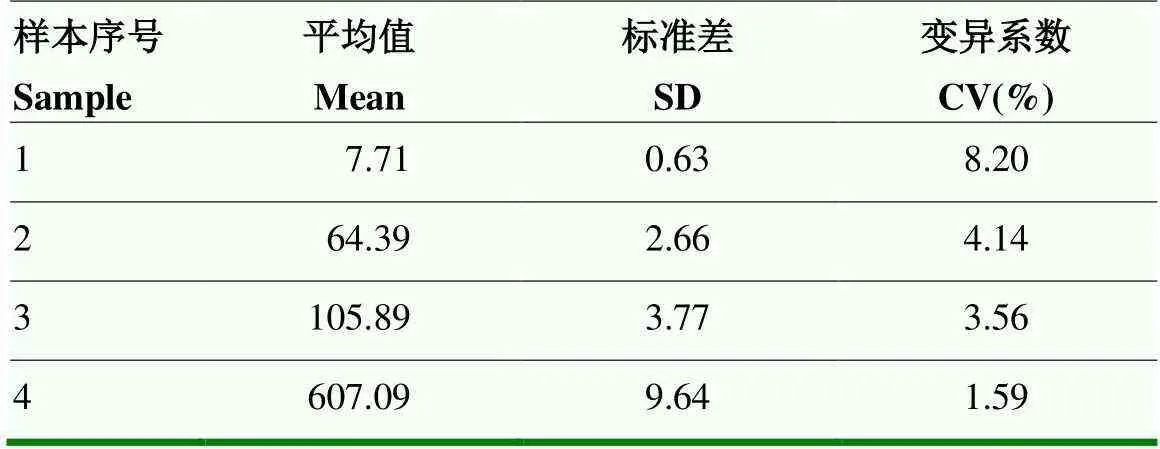
表2 重复性试验
2.5 CLIA方法对临床样本的检测
用建立的CLIA方法和LPB-ELISA方法分别检测320份田间样本,并对结果进行比对和相关性分析,检测结果如表3所示,在该批临床比对试验中,建立的CLIA方法检出阳性182份,阴性138份,和LPB-ELISA方法阴性符合率为96.90%,阳性符合率为93.19%,总符合率为94.69%;定量结果相关性如图8所示,2为0.8473,<0.0001,说明两种方法检测结果相关性较好。该批临床试验样本根据田间免疫背景进行收集,CLIA方法和LPB-ELISA方法阳性检出率分别为56.88%、59.69%,阴性检出率分别为43.13%、40.31%,阴阳性比例满足比对试验要求,比对结果显示,建立的CLIA方法检测结果可靠,可用于口蹄疫病毒O型抗体的定量检测。

表3 320份田间样本检测
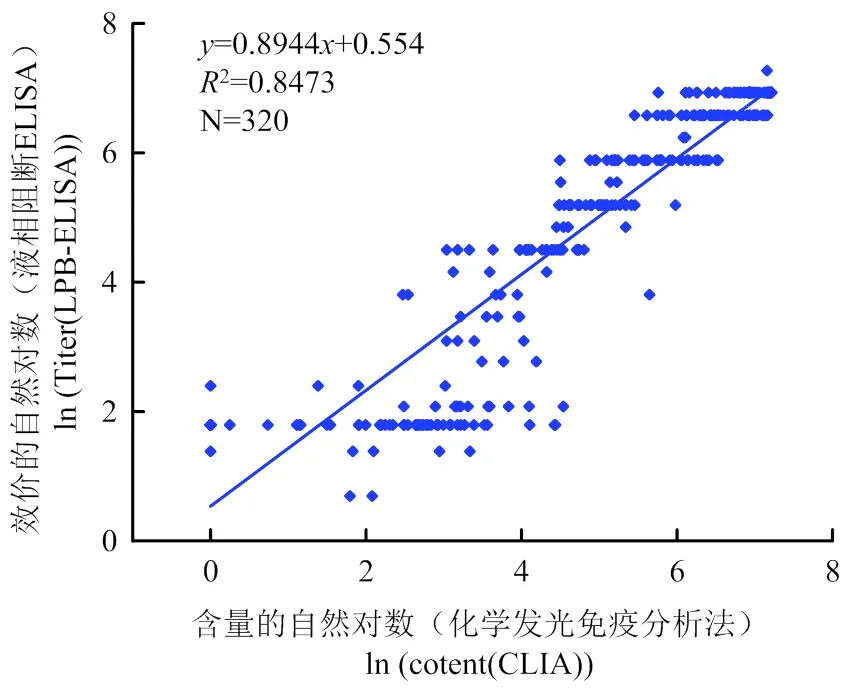
图8 T-CLIA和ELISA方法检测相关性分析
3 讨论
3.1 磁微粒CLIA方法检测速度快、检测重复性好
本研究使用磁微粒为反应载体,通过系统性优化,建立了一种口蹄疫病毒O型抗体检测方法,并使用针对动物疫病诊断定制的专用化学发光免疫分析仪进行全自动化检测。本方法使用样本20 µL,总反应时间为20 min,配套全自动化学发光免疫分析仪,检测通量达到300测试/h,使用CLIA方法对4份不同抗体含量的样本进行重复性检测,检测结果变异系数均小于10%,实现了FMDV-O抗体高重复性、自动化、快速检测。
3.2 磁微粒CLIA方法可实现口蹄疫抗体定量检测
按照农业农村部《国家动物疫病强制免疫指导意见(2022—2025年)》,我国目前采取对所有牛、羊、骆驼、鹿进行O型和A型口蹄疫免疫,对全国所有猪进行O型口蹄疫免疫。推进口蹄疫防控效果进入更高阶段,关键在诊断检测技术和疫苗[4],随着Asia Ι型和A型趋于控制,对O型进行免疫和免疫监测将是主要的措施之一。同时,随着集约化养殖和降本增效的推行,按照免疫抗体含量制定免疫计划势在必行。传统的ELISA和板式CLIA需要4—1 024倍比稀释样本,若要检测1﹕1 024以内的滴度,每个酶标板只能检测10份血清,因此定量检测工作量大、操作繁琐。本研究参考VNT试验及判定对抗体的活性单位(U)进行了定义,通过检测标准品血清建立标准曲线,其检测范围在5—1 280U(效价1﹕8—1﹕2 048)内,标准曲线2≥0.99,实现了口蹄疫O型抗体单管定量检测,为定量检测口蹄疫病毒抗体提供了一种新思路。
3.3 磁微粒CLIA方法使用国产设备进行全自动化检测
磁微粒CLIA方法具有灵敏度高、检测范围宽、自动化高等优势,在人医体外诊断领域发展迅速,但是因为技术门槛较高,化学发光免疫分析仪器被少数进口厂家垄断,试剂和仪器使用成本昂贵,使得此方法在检测量较少的动物疫病诊断行业发展缓慢,技术更新换代落后。本研究根据动物疫病诊断的特点定制国产全自动化学发光免疫分析仪(LYC100T、LYC200T),检测时无需对每个样本进行梯度稀释和人工加样、洗涤、计算结果,从加样、检测到打印报告全程在全自动化学发光免疫分析仪上进行,实现了口蹄疫病毒O型抗体的全自动化检测。
3.4 磁微粒CLIA方法的应用
本研究配套国产全自动化学发光免疫分析,通过系统优化试验,使得检测效果达到了应有要求,已经在全国不同区域进行试用,试用反馈效果较好,具有较高的临床应用价值。在后续的临床检测和使用中,研究人员将探索定量结果和免疫保护的关系,以期为临床免疫方案的制定提供技术支撑。
4 结论
建立了一种磁微粒口蹄疫病毒O型CLIA抗体检测方法,可通过国产化动物疫病诊断专用化学发光免疫分析仪进行全自动检测,其特异性好、敏感度高,避免多次稀释样本和繁琐的手动操作,可在20 min内实现口蹄疫病毒O型抗体的定量、高通量检测,为口蹄疫病毒抗体定量检测提供了一种新思路和新方法,具有良好的临床应用潜力。
[1] CLEMMONS E A, ALFSON K J, DUTTON J W 3rd. Transboundary animal diseases, an overview of 17 diseases with potential for global spread and serious consequences. Animals, 2021, 11(7): 2039.
[2] 何继军, 靳野, 马维民, 杨亚民, 吕律, 郑海学, 杨帆, 曹伟军, 郭建宏, 李彦敏, 刘在新, 刘湘涛. 外来口蹄疫流行毒株跟踪分析与防控. 中国动物检疫, 2018, 35(11): 52-55, 61.
HE J J, JIN Y, MA W M, YANG Y M, LÜ L, ZHENG H X, YANG F, CAO W J, GUO J H, LI Y M, LIU Z X, LIU X T. Tracking analysis and control strategies for exotic FMD epidemic strains. China Animal Health Inspection, 2018, 35(11): 52-55, 61. (in Chinese)
[3] DIAZ-SAN SEGUNDO F, MEDINA G N, STENFELDT C, ARZT J, DE LOS SANTOS T. Foot-and-mouth disease vaccines. Veterinary Microbiology, 2017, 206: 102-112.
[4] 刘在新. 全球口蹄疫防控技术及病原特性研究概观. 中国农业科学, 2015, 48(17): 3547-3564.
LIU Z X. Progress and prospect of the technologies to control foot-and-mouth disease and its pathogen characteristics worldwide. Scientia Agricultura Sinica, 2015, 48(17): 3547-3564. (in Chinese)
[5] HALMANN M, VELAN B, SERY T. Rapid identification and quantitation of small numbers of microorganisms by a chemiluminescent immunoreaction. Applied and Environmental Microbiology, 1977, 34(5): 473-477.
[6] ARAKAWA H, MAEDA M, TSUJI A. Enzyme immunoassay of cortisol by chemiluminescence reaction of luminol-peroxidase. Bunseki Kagaku, 1977, 26(5): 322-327.
[7] PIRES N M M, DONG T. Measurement of salivary cortisol by a chemiluminescent organic-based immunosensor. Bio-Medical Materials and Engineering, 2014, 24(1): 15-20.
[8] AZIM M A U, HASAN M, ANSARI I H, NASREEN F. Chemiluminescence immunoassay: basic mechanism and applications. Bangladesh Journal of Nuclear Medicine, 2018, 18(2): 171-178.
[9] ZHANG C S, SU Y, LIANG Y, LAI W, JIANG J, WU H Y, MAO X Y, ZHENG L, ZHANG R Y. Chemiluminescence and its biomedical applications. Nanophotonics in Biomedical Engineering. Singapore: Springer Singapore, 2020: 143-195.
[10] ZHANG B, LI H Z, LI Y, FU X L, DU D L. A sensitive chemiluminescence immunoassay based on immunomagnetic beads for quantitative detection of Zearalenone. European Food Research and Technology, 2021, 247(9): 2171-2181.
[11] LIU R P, WANG C, JIANG Q, ZHANG W, YUE Z, LIU G H. Magnetic-particle-based, ultrasensitive chemiluminescence enzyme immunoassay for free prostate-specific antigen. Analytica Chimica Acta, 2013, 801: 91-96.
[12] VIDZIUNAITÉ R, MIKULSKIS P, KULYS J. Chemiluminescent immunoassay (CLIA) for the detection of brucellosis and tularaemia antigens. Journal of Bioluminescence and Chemiluminescence, 1995, 10(4): 199-203.
[13] ZHOU Y, ZHOU T, ZHOU R, HU Y G. Chemiluminescence immunoassay for the rapid and sensitive detection of antibody against porcine parvovirus by using horseradish peroxidase/detection antibody- coated gold nanoparticles as nanoprobes. Luminescence, 2014, 29(4): 338-343.
[14] YANG H W, GUO Y F, LI S, LAN G Q, JIANG Q Y, YANG X R, FAN J, ALI Z, TANG Y J, MOU X B, LIU H N, ALI A SHAH M, JIN S, JIANG H S, LI Z Y. Magnetic beads-based chemiluminescent assay for ultrasensitive detection of pseudorabies virus. Journal of Nanoscience and Nanotechnology, 2014, 14(5): 3337-3342.
[15] LIU Z Z, SHAO J J, ZHAO F R, ZHOU G Q, GAO S D, LIU W, LV J L, LI X M, LI Y F, CHANG H Y, ZHANG Y G. Chemiluminescence immunoassay for the detection of antibodies against the 2C and 3ABC nonstructural proteins induced by infecting pigs with foot-and-mouth disease virus. Clinical and Vaccine Immunology, 2017, 24(8): e00153-e00117.
[16] LIU Z Z, ZHAO F R, GAO S D, SHAO J J, ZHANG Y G, CHANG H Y. Development of a chemiluminescence immunoassay using recombinant non-structural epitope-based proteins to accurately differentiate foot- and-mouth disease virus-infected and vaccinated bovines. Transboundary and Emerging Diseases, 2018, 65(2): 338-344.
[17] LIU W, SHAO J J, ZHANG G L, CHANG Y Y, GE S D, SUN Y, GAO Z, CHANG H Y. Development of an indirect chemiluminescence immunoassay using a multiepitope recombinant protein to specifically detect antibodies against foot-and-mouth disease virus serotype O in swine. Journal of Clinical Microbiology, 2021, 59(3): e02464-e02420.
[18] 孙雨, 宋晓晖, 肖颖, 王睿男, 李秀梅, 任雪建, 李雪刚, 魏巍, 杨林, 王传彬. O型口蹄疫病毒抗体化学发光免疫分析检测方法的建立. 中国草食动物科学, 2020, 40(3): 47-52.
SUN Y, SONG X H, XIAO Y, WANG R N, LI X M, REN X J, LI X G, WEI W, YANG L, WANG C B. Establishment of chemiluminescent immunoassay for detection of type O FMDV virus antibody. China Herbivore Science, 2020, 40(3): 47-52. (in Chinese)
[19] 孙雨, 宋晓晖, 王睿男, 李秀梅, 肖颖, 任雪建, 李晓霞, 魏巍, 杨林, 王传彬. A型口蹄疫病毒抗体化学发光免疫分析检测方法的建立. 动物医学进展, 2020, 41(8): 29-36.
SUN Y, SONG X H, WANG R N, LI X M, XIAO Y, REN X J, LI X X, WEI W, YANG L, WANG C B. Establishment of chemiluminescent immunoassay for detection of type A FMDV antibody. Progress in Veterinary Medicine, 2020, 41(8): 29-36. (in Chinese)
[20] 赵协, 安利民, 高沙沙, 张玉, 乔飞. 化学发光免疫分析技术在动物疫病检测中的应用. 中国动物检疫, 2020, 37(8): 82-87.
ZHAO X, AN L M, GAO S S, ZHANG Y, QIAO F. Application of chemiluminescence immunoassay in detection of animal diseases. China Animal Health Inspection, 2020, 37(8): 82-87. (in Chinese)
[21] WANG C, WU J, ZONG C, XU J, JU H X. Chemiluminescent immunoassay and its applications. Chinese Journal of Analytical Chemistry, 2012, 40(1): 3-10.
[22] LIU Z Z, ZHAO F R, GAO S D, SHAO J J, CHANG H Y. The applications of gold nanoparticle-initialed chemiluminescence in biomedical detection. Nanoscale Research Letters, 2016, 11(1): 460.
[23] WANG Y, DZAKAH E E, KANG Y, CAI Y X, WU P D, TANG B, LI R, HE X W. A sensitive and rapid chemiluminescence immunoassay for point-of-care testing (POCT) of copeptin in serum based on high-affinity monoclonal antibodies via cytokine-assisted immunization. International Journal of Nanomedicine, 2019, 14: 4293-4307.
[24] HUANG E Q, HUANG D Z, WANG Y, CAI D Y, LUO Y Z, ZHONG Z M, LIU D Y. Active droplet-array microfluidics-based chemiluminescence immunoassay for point-of-care detection of procalcitonin. Biosensors and Bioelectronics, 2022, 195: 113684.
[25] ROSI N L, MIRKIN C A. Nanostructures in biodiagnostics. Chemical Reviews, 2005, 105(4): 1547-1562.
[26] XIE G, ZHU M, LIU Z J, ZHANG B, SHI M J, WANG S. Development and evaluation of the magnetic particle-based chemiluminescence immunoassay for rapid and quantitative detection of Aflatoxin B1 in foodstuff. Food and Agricultural Immunology, 2018, 29(1): 564-576.
[27] LIU X Y, WAN X H, LU S, ZHANG L J, YU S H, LU X X. Evaluation of a magnetic particles-based chemiluminescence enzyme immunoassay for Golgi protein 73 in human serum. Clinica Chimica Acta; International Journal of Clinical Chemistry, 2015, 445: 54-59.
[28] BASILICATA P, PIERI M, SIMONELLI A, FAILLACE D, NIOLA M, GRAZIANO V. Application of a chemiluminescence immunoassay system and GC/MS for toxicological investigations on skeletonized human remains. Forensic Science International, 2019, 300: 120-124.
[29] NAKANO Y, KURANO M, MORITA Y, SHIMURA T, YOKOYAMA R, QIAN C G, XIA F Z, HE F, KISHI Y, OKADA J, YOSHIKAWA N, NAGURA Y, OKAZAKI H, MORIYA K, SETO Y, KODAMA T, YATOMI Y. Time course of the sensitivity and specificity of anti- SARS-CoV-2 IgM and IgG antibodies for symptomatic COVID-19 in Japan. Scientific Reports, 2021, 11(1): 2776.
[30] FU H J, YUAN L P, SHEN Y D, LIU Y X, LIU B, ZHANG S W, XIE Z X, LEI H T, SUN Y M, XU Z L. A full-automated magnetic particle-based chemiluminescence immunoassay for rapid detection of cortisol in milk. Analytica Chimica Acta, 2018, 1035: 129-135.
[31] SHI Z W, CAO L Y, LUO J C, ZHOU G J, ZUO Q S, LIU X T, HU Y H, TIAN H, ZHENG H X. A chemiluminescent magnetic microparticle immunoassay for the detection of antibody against African swine fever virus. Applied Microbiology and Biotechnology, 2023, 107(11): 3779-3788.
Development of a Full-Automated Magnetic Particle ChemiluminescenceImmunoassay Assay for Quantitative Detection of Antibodies Against Foot and Mouth Disease Virus Serotype O

1Lanzhou Shouyan Biotechnology Co.,Ltd, Lanzhou 730046;2Key Laboratory of Veterinary Etiological Biology/National Foot-and Mouth Disease Reference Laboratory/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046
【Background】Foot-and-mouth disease (FMD) is an acute, febrile and virulent infectious disease caused by foot-and-mouth disease virus (FMDV), and vaccination is an effective measure to prevent the spread of FMD. The level of immune antibody monitoring is an important basis of evaluating the effectiveness of vaccine immunization, and developing immunization procedures. It is an indispensable step in the prevention and control of FMD. Therefore, to establish an efficient, rapid and fully automated antibody detection method is of great significance. 【Objective】The aim of this study was to establish a novel, fully-automatic and quantitative antibody detection method for FMD virus type O based on the chemiluminescence immunoassay (CLIA) technology of magnetic particles (MMPs), in order to provide the technical support for the immunization monitoring of FMD and epidemic prevention and control.【Method】In this study, the magnetic nanoparticles were used for solid-phase carriers and separation carriers to encapsulate the captured antibody, the detection antibodies was labelled by using alkaline phosphatase (ALP), and AMPPD was used for the luminescent substrate. Finally, a new magnetic particle Chemiluminescence CLIA method (MP-CLIA) was established after optimization of conditions. In this method, firstly, the magnetic particle-polyclonal antibodies (MPs-pAbs), the samples to be tested, and the antigen of FMDV type O were added to a reaction system and incubated at 37℃, then the appropriate amount of enzyme-labeled antibodies (ALP-pAbs) was added and incubated at 37 ℃, finally, the chemiluminescence substrate AMPPD was added to detect the relative light unit (RLU). In this study, a standard curve was fitted by testing the standards, and thereceiver operating characteristic (ROC) curve was applied to determine the determination criteria of the assay. the quality control samples were utilized for methodological evaluation, and the field samples were also tested and compared with the liquid phase blocking ELISA (LPB-ELISA) to validate the assay results. 【Result】The optimized reaction conditions were 0.25 mg·mL-1of magnetic particles, 1:1 000 dilution of FMD O antigen, 1:2 000 dilution of enzyme-labeled antibody, and 20 µL of spiked sample volume. The entire detection process was completed in a fully automated chemiluminescence immunoassay analysis apparatus, with a reaction time of 20 min, The quantitative detection could be conducted within the range of antibody content of 0-1 280 U (potency of 0-1:2 048), and the standard curve2>0.99. The sensitivity of assay was 94.66%, the specificity was 97.10%, and there was no cross reactivity with the antibodies of six different pathogens which include SVV, PPRSV, BEFV, PCV2, QRFV, and PPRV. The repeatability of the assay showed the coefficient of variation less than 10%. The detection of field samples demonstrated the accordance rate was 94.69% between CLIA and LPB-ELISA, and the result of quantitative detection showed a correlation (2=0.8473,<0.0001) during two method. 【Conclusion】 The established MP-CLIA method was time-consuming, easy to operate, and could be fully automated by matching with the domestic automatic chemiluminescence instrument, which was a new and highly efficient method for the quantitative detection of antibody to FMD virus type O, and had a high value for clinical application.
magnetic particle chemiluminescence immunoassay (MP-CLIA); foot and mouth disease (FMD); micromagnetic particles; fully-automated

2023-07-10;
2023-11-03
中央引导地方科技发展资金项目(23ZYQA295)
包艳芳,E-mail:13919159893@163.com。通信作者林密,E-mail:linmi@caas.cn
(责任编辑 林鉴非)
