乳腺癌新辅助治疗后乳房与腋窝病理学完全缓解影响因素分析
2024-02-29王立书刘雨欣
王立书,刘 聪,刘雨欣,邢 华
(吉林大学中日联谊医院乳腺外科,长春 130033)
2022 年我国新发乳腺癌病例近43 万,病死例数超12万[1]。乳腺癌的复发、转移是主要的致死因素。其中腋窝淋巴结转移是乳腺癌的主要转移途径,评估腋窝淋巴结的转移状态对乳腺癌的临床分期与治疗方案的选择至关重要。在患者有保乳需求但原发肿瘤较大或临床评估腋窝淋巴结发生转移的情况下,临床医生通常会建议先行新辅助治疗(neoadjuvant therapy,NAT)后再手术[2]。对于初诊病理学明确腋窝淋巴结转移,新辅助治疗后临床评估为阴性的患者,腋窝的处理方式仍有争议。中国抗癌协会乳腺癌诊治指南与规范(2021 年版)中建议,即使穿刺证实为cN1 期,在新辅助治疗后腋窝淋巴结临床评估阴性的患者,也必须满足新辅助治疗前穿刺阳性淋巴结放置标记、采用双示踪方式、切除包括标记淋巴结在内的前哨淋巴结,才可行前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)[2]。由于放置标记、核素示踪等技术普及程度差异,部分患者依然无法避免腋窝淋巴结清扫术(axillary lymph node dissection,ALND)。然而ALND 后可能会出现淋巴水肿、腋窝塌陷、肩关节活动障碍等相关并发症[3-4],严重影响患者的生活质量[5]。如何筛选NAT 后,腋窝降级手术的患者群体,使患者获得生存获益的同时,兼顾生活质量,成为临床中亟待解决的问题。随着NAT 的治疗效果不断提升,创伤更小、相关并发症更少的手术方式也越来越被青睐。本研究通过对影响NAT 后乳房及腋窝的病理学完全缓解(pathological complete response,pCR)的因素进行分析,为NAT 后手术降级的可行性提供一定参考,报道如下。
1 资料与方法
1.1 纳入及排除标准
回顾性收集吉林大学中日联谊医院2015 年至今收治的乳腺癌行NAT 患者。纳入标准:1)女性乳腺癌患者;2)NAT 前行乳房病灶空心针穿刺活检证实为非特殊型浸润性癌;3)NAT 前有细胞或组织学病理证实为腋窝淋巴结转移;4)临床分期为II ~III 期;5)影像学检查无远处转移;6)按照标准完成NAT 后均行乳腺癌改良根治术。排除标准:1)男性乳腺癌、双侧乳腺癌、炎性乳腺癌及妊娠期与哺乳期乳腺癌;2)既往有其他恶性肿瘤病史,接受过放化疗;3)未完成NAT 或NAT 后未手术;4)病历资料缺失不全者。
1.2 收集指标及分组标准
包括患者的年龄、月经状态、吸烟史、T 分期、N 分期、TNM 分期、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(HER2)、增殖指数(Ki67)表达状况、分子分型、NAT 方案、乳房和腋窝的pCR 情况。TNM 分期参照AJCC 第8 版指南。ER、PR 均以≥1%作为临界值。HER2 表达水平通过免疫组化 (immunohistochemistry,IHC)和原位杂交 (in situ hybridization,ISH)进行评估。HER2阳性包括IHC3+、IHC2+/ISH+,阴性包括IHC0、IHC1+、IHC2+/ISH-。Ki67 分组以30%作为临界值。分子分型按照《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2023)》分为Luminal A 型、Luminal B 型、HER2 过表达型和三阴型,为了便于统计,将Luminal A 型和Luminal B 型合并为Luminal 型共同分析。NAT 方案分为化疗联合双靶方案和以及多药化疗方案,参照指南,HER2 过表达型患者接受TCbHP(紫衫类+卡铂+曲妥珠单抗+帕妥珠单抗)方案、THP(紫衫类+曲妥珠单抗+帕妥珠单抗)方案或AC-THP(蒽环类+环磷酰胺+序贯紫衫类+曲妥珠单抗+帕妥珠单抗)方案,少部分双靶普及时期前的患者应用了TAC(紫衫类+蒽环类+环磷酰胺)方案,Luminal 型及三阴型接受TAC 方案、AC-T(蒽环类+环磷酰胺+序贯紫衫类)方案或AT(蒽环类+紫衫类)方案。乳房pCR 定义为乳房原发灶无浸润性癌,可存在导管原位癌,腋窝pCR定义为腋窝淋巴结清扫组织没有阳性残留淋巴结,微转移及孤立的肿瘤细胞皆被认为是阳性残留淋巴结。
1.3 统计学方法
采用SPSS 26.0 统计学软件分析数据,计数资料采用例(%)表示,单因素分析采用χ2检验,单因素分析筛选出有统计学意义的变量纳入二元多因素Logistic回归分析,以P<0.05 表示差异具有统计学意义。
2 结果
共纳入符合条件的患者110 例,其中达到乳房pCR 42 例(38.2%),达到腋窝pCR 59 例(53.6%),总体pCR 37 例(33.6%)。
2.1 乳房pCR 的影响因素分析
对影响乳房pCR 的因素进行χ2检验,见表1。由表1 可以看出,N 分期、ER、HER2、Ki67、分子分型和新辅助方案与乳房pCR 有关(P<0.05),而年龄、月经状态、孕育史、吸烟史、T 分期、TNM 分期及PR 表达状态与乳房pCR 无明显相关性(P>0.05)。将单因素分析中P<0.05 的因素纳入二元多因素Logistic回归分析,见表2,可以发现,新辅助方案对乳房pCR 的影响具有统计学意义(OR= 6.957,95%CI=1.124,43.043,P<0.05),即接受化疗联合双靶方案的患者相较接受多药化疗方案的患者更容易得到乳房pCR。

表1 乳房pCR 影响的单因素分析结果
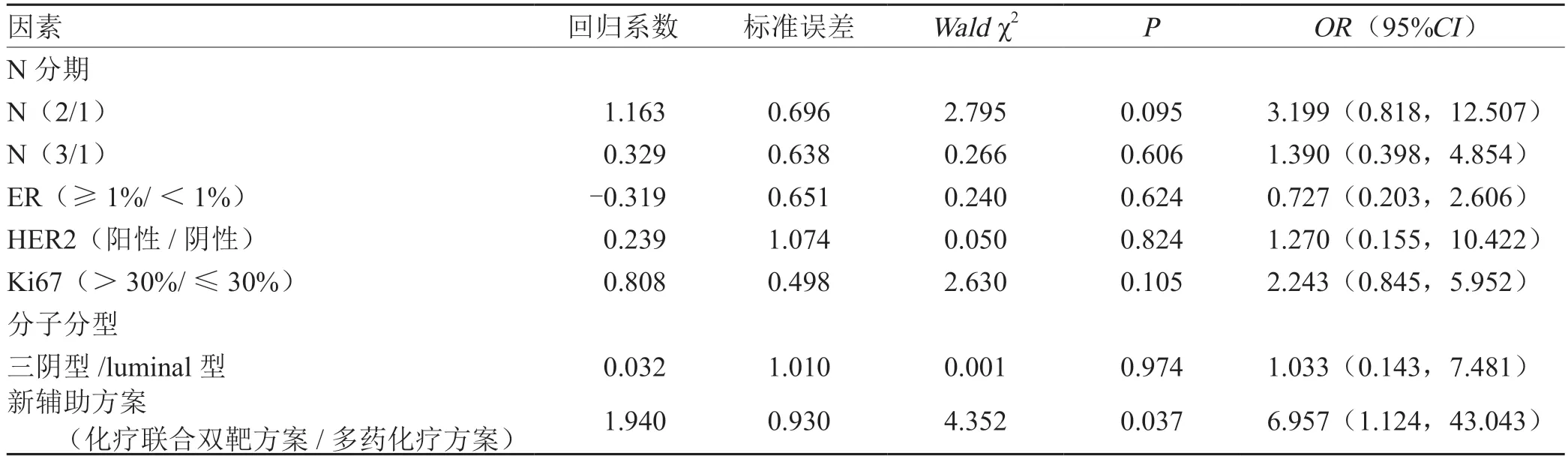
表2 乳房pCR 的影响因素的Logistic 回归结果
2.2 腋窝pCR 的影响因素分析
对影响腋窝pCR 的因素进行χ2检验,见表3。由表3 可以看出,ER、PR、HER2、分子分型、新辅助方案和乳房pCR 与腋窝pCR 有关(P<0.05),而年龄、月经状态、孕育史、吸烟史、T 分期、N 分期、TNM 分期和Ki67 表达状态对腋窝pCR 的影响无明显相关性(P>0.05)。将单因素分析中P<0.05的因素纳入二元多因素Logistic回归分析,见表4,可以发现,乳房pCR 对腋窝pCR 的影响具有统计学意义(OR=11.954,95%CI= 3.475,41.114,P<0.001),即达到乳房pCR 患者相较未达到乳房pCR患者更容易达到腋窝pCR。

表3 腋窝pCR 影响的单因素分析结果

表4 腋窝pCR 的影响因素的Logistics 回归结果
3 讨论
腋窝淋巴结转移状态是乳腺癌的一个重要预后因素,用于指导局部和全身治疗决策。对于原发肿瘤较大或淋巴结受累的患者,近年来各大指南均推荐新辅助治疗,从而达到乳腺癌降级,增加保乳的可能性,同时在新辅助治疗阶段,可以评估肿瘤对治疗药物的敏感性,为下阶段系统治疗提供参考。新辅助治疗后是否达到病理学完全缓解是评估治疗效果及评价患者生存的重要指标,也是考虑下一步全身治疗方案升级或降级的重要依据[6-8]。新辅助治疗后pCR 与良好的预后有关[9]。约20%患者会在NAT 后达到pCR,研究证实,pCR 率主要与乳腺癌亚型及分期有关,其中三阴型和HER2+/HR-亚型的pCR 率最高,肿瘤负荷较低(低cT 分级)的患者更容易获得pCR[10-12]。这与本研究的结果基本一致,本研究中总体pCR 率为33.6%(n= 37),HER2 过表达型乳腺癌的乳房pCR 率(59.6%)和腋窝pCR 率(80.8%)均显著高于其他亚型(P<0.001),但未见T 分期与pCR 相关,这可能与本研究中纳入的患者样本量较小、分布不均有关。本研究中cT3 患者多于cT1 和cT2 期,可能是早期乳腺癌患者接受NAT 的意愿较低导致。近年来,新辅助治疗后pCR 率的不断提高,引发了对乳房和腋窝手术降级的讨论和思考。据报道,有20%的保乳术后患者因长期美观程度显著下降,导致生活质量下降[13-15]。研究[16]探讨NAT 后是否能用真空活检以豁免可能达到乳房pCR 患者的乳房手术。尽管该研究样本量较少,且尚未达到研究终点,但其中期随访结果很值得期待。本研究中有42 例患者(38.2%)达到了乳房pCR,对于这部分患者,可能成为乳房手术降级的潜在获益人群。
腋窝淋巴结清扫术是腋窝分期的标准术式,但其并发症较多,被前哨淋巴结活检术逐步替代[17]。对于SLNB 后阳性的患者,腋窝放疗提供了与ALND 可比的良好控制率,且腋窝放疗后,不良反应发生率更低[18]。但这些研究并没有纳入接受NAT 的患者。对于cN+的患者NAT 后的腋窝管理方式尚无共识,手术仍是判断分期的主要手段。目前的临床实践中,推荐的腋窝手术方式包括ALND、SLNB、靶向淋巴结活检术(targeted lymph node biopsy,TLNB)和靶向腋窝清扫术(targeted axillary dissection,TAD),其中TLNB 为切除一个或几个标记过的NAT 前活检阳性淋巴结,TAD 为TLNB 联合SLNB[19]。本研究中有53.6%(n= 59)的患者达到腋窝pCR,与既往研究结果相似。基于以上数据,寻求比ALND 创伤更小的准确腋窝分期方式具备深远的临床意义。据问卷调查[20]统计,对于NAT 后cN1 转化为cN0 的乳腺癌患者,临床医生常选择的腋窝手术是TAD(54.2%),其次是单独前哨淋巴结活检(SLNB)(20.9%),对于cN2转化为cN0 和cN+的患者,ALND 仍然是首选的手术方式。研究[21-22]中,TAD 的假阴性率(false-negative rate,FNR)较低,在可以接受的可靠范围内,然而其技术细节仍不够同质化,如放置标记的数量、标记的时机、NAT 后额外的术前定位时机以及最佳定位技术等。SLNB 在NAT 后的可行性和可靠性尚存在争议,NAT 后腋窝组织可能会出现纤维化,乳房的淋巴引流可能会受损,从而会妨碍前哨淋巴结的检测;腋窝的肿瘤退缩反应可能并不均匀,会导致较高的假阴性率。SLND 在4 项大型研究(SENTINA,ACOSOG Z1071,GANEA 2,SN FNAC)[23-26]中FNR 都较高,从11.9%到14.6%不等,这也提示临床,NAT 后SLNB 作为单一腋窝干预手段可能仍待商榷。进一步研究[23-24,27-28]表明,切除至少3 枚SLN、包括在NAT 前标记的活检阳性的淋巴结,使用双重示踪剂,以及在病理检查中应用免疫组织化学分析可以有效降低SLNB 的假阴性率,利用腋窝超声检查筛选NAT 后cN0 的患者联合SLNB 也能够得到可以接受的FNR[29]。
在评估NAT 后腋窝治疗反应时,无创的影像学检查如腋窝超声、MRI 和PET-CT 的诊断性能有限[30]。尽管MRI 和PET-CT 比超声检查受操作者个体影响更少,但乳腺MRI 线圈仅可扫描部分腋窝区域,需要进行专门的腋窝MRI,提升不必要的评估成本,而PET-CT 对较小残留病灶的敏感性和检出率较低。新技术混合成像,如PET-MRI,将PET 的代谢信息与MRI 的影像学细节相结合,可能成为更佳优效的诊断工具,将指导未来的腋窝手术方案制定,甚至使豁免腋窝外科治疗成为可能[31]。
在探讨腋窝手术降级的可行性与可靠性的同时,患者长期生活质量和肿瘤学安全性也需要验证。目前仍缺乏高质量、大样本、前瞻性的临床研究给出腋窝手术降级之后的远期生存数据。本研究的Logistic多因素分析结果显示,新辅助方案是乳房pCR 的独立危险因素,而乳房pCR 是腋窝pCR的独立危险因素。目前利用乳房pCR 来预测是否达到腋窝pCR 在临床实践中具有一定的困难性,由于术中病理的准确性有限,部分患者可能面临二次手术可能,但随着诊断技术的发展,乳房pCR 有可能成为指导腋窝手术降级的重要参考。相信随着更多前瞻性、大样本的临床实验加入,NAT 后腋窝手术降级的实施标准及肿瘤安全性将得到验证,得以实现。
