拟南芥磷脂酸荧光探针的构建及应用
2024-02-25马疏言郑月萍郑志富
马疏言,郑月萍,2,郑志富,2
(1.浙江农林大学 现代农学院,浙江 杭州 311300;2.浙江农林大学 油料作物种质创新与利用研究所,浙江 杭州 311300)
磷脂酸(phosphatidic acid,PA)是一种常见的细胞甘油磷脂,也是最简单的膜脂之一[1]。几乎所有生物体内都会产生PA,包括酵母[2]、动物[3]和植物[4]等。在植物中PA 的合成主要包括2 种方式:第1 种是从头合成途径,3-磷酸甘油先后在3-磷酸甘油酰基转移酶和溶血磷脂酸脂酰基转移酶的作用下发生连续2 步酰化反应生成PA,这也是PA 合成的主要途径[5];第2 种是磷脂的降解途径,磷脂降解又可分为2 种,一种是磷脂酶D 通过水解某些结构磷脂直接生成PA[6-9],另一种是磷脂酶C 通过水解磷脂酰肌醇生成二脂酰甘油[10],继而经二脂酰甘油激酶磷酸化生成PA[11]。PA 作为一种结构膜脂,磷酸基团头部能够以“静电/氢键开关模型”的方式与蛋白质结合[12]。在该模型中,PA 结合蛋白中带正电荷的碱性氨基酸残基[13-17],可以吸引磷脂双分子层上的负电荷,并通过静电作用影响膜环境,继而与PA 头部的磷酸基团形成氢键,产生一个稳定的蛋白质结合位点。PA 这种携带负电荷并且在生理条件下呈圆锥体的独特分子构型[18],使得PA 结合蛋白的结构域能够特异性的与其结合,保证了生物膜结构的稳定和功能的发挥。除了作为膜脂的一个结构成分以及甘油脂合成的前体物质,PA 还是一个关键信号分子,在多种生物学过程中发挥重要作用。正常条件下,行使信号功能的PA 含量甚微;在植物应答各种生物与非生物胁迫过程中PA 水平则会迅速升高,但这种积累往往是短暂的。这说明生物体拥有一套严格控制信号分子PA 含量的机制,这对调节PA 信号传递强度、维持细胞物质与能量代谢的动态平衡至关重要[19-22]。
尽管PA 拥有多种功能,但目前对于细胞内PA 含量的动态变化仍知之甚少,这主要受PA 检测手段的限制。过去主要采用诸如薄层层析、高效液相色谱和放射性同位素标记等理化手段对其含量进行测定[23]。近年来,质谱分析技术的应用使得对包括PA 在内的各种脂质的测定更准确和高效[24-25]。然而,这些理化手段都只能对组织器官中PA 总量与种类进行定量或定性分析,无法捕捉细胞内PA 的动态与瞬时变化信息。通常认为,内质网上的PA 含量相对较高,这有助于促进磷脂和三酰甘油的合成[26-27];而质膜和细胞器中行使信号功能的PA 含量甚微。显然,采用理化测定会掩盖胞内PA 的真实变化。因此,亟需开发一种能可视化分析细胞内PA 的工具。
大量研究表明:生物体中PA 结合蛋白种类繁多,这些蛋白中的PA 结合域(phosphatidic acid binding domains,PABD)结构亦存在差异。其中一些PABD 因与PA 结合专一性强,被用来开发多种PA 探针[28-33]。酵母蛋白Spo20p 中的PA 结合域已被证实具有极强的专一性[33],只结合PA 而不结合其他磷脂。目前基于这一PABD 所开发的PA 探针在医学研究中应用广泛,但在植物中的应用却有限[34]。因此,本研究旨在构建基于Spo20p 中的PABD 的植物PA 荧光探针,为剖析植物早期应答逆境胁迫的细胞分子机制提供新工具。
1 材料与方法
1.1 植株培养
1.1.1 土壤基质的培养 将拟南芥Arabidopsisthaliana种子置于含有湿润滤纸的培养皿中,4 ℃冰箱内避光放置3 d 后将其点播在湿润的土壤基质上(V营养土∶V蛭石∶V珍珠岩=3∶1∶1)。将播种后的盆栽用透明塑料盖覆盖,置于24~25 ℃室温、50%~60%湿度、14 h 光照/10 h 黑暗的植物培养箱中培养,7 d 后揭去塑料盖间苗。
1.1.2 培养基的培养 将拟南芥种子进行消毒,加入适量灭菌过的蒸馏水,在4 ℃冰箱内避光放置3 d,点播在1/2 MS 培养基上,置于植物培养间中培养。
1.2 PA 荧光探针的构建
1.2.1 pSY06-GFP-PABD载体的构建 酵母蛋白Spo20p 中存在一个高度专一的PA 结构域(PABD),该PABD 由40 个氨基酸残基构成,只结合PA 而不结合其他磷脂[33-34],因此,本研究选择该PABD 与荧光蛋白融合,构建PA 荧光探针。根据PAPD 核苷酸序列[33]设计引物(表1)进行PCR 扩增,获得与该PABD 相对应的DNA 片段;同时PCR 扩增获得GFP基因编码区序列。随后,利用无缝克隆试剂盒(生工),将GFP和PABD片段克隆至植物表达载体pSY06 的限制性内切酶位点KpnI 和PstI 之间,获得重组质粒pSY06-GFP-PABD。PABD连接至GFP基因编码区的3′端,构成GFP-PABD融合基因,该融合基因的表达由组成型启动子UBQ10 驱动。重组质粒中的插入片段经菌落PCR、KpnI 和PstI 双酶切以及测序验证正确后,采用热激法将质粒转化至农杆菌AgrobacteriumtumefaciensGV3101,用于后续拟南芥遗传转化。

表1 相关引物序列Table 1 Sequence of related primers
1.2.2 拟南芥的遗传转化、筛选及鉴定 以哥伦比亚野生型拟南芥(WT)为植物材料,利用农杆菌花序侵染法转化拟南芥。将获得的T1代拟南芥种子进行表面消毒,均匀铺在含有草铵膦(10 mg·L-1)和特美汀(50 mg·L-1)的1/2 MS 筛选培养基上进行筛选。将具有除草剂抗性的阳性苗移栽到土壤中继续培养,3 周后提取叶片DNA 并设计引物(表1)进行PCR 鉴定,对T2和T3代转基因株系进行除草剂抗性的遗传分析,最终筛选得到纯合单插入位点转基因株系。
1.3 转基因拟南芥中目的基因表达量分析
以在1/2 MS 培养基中生长7 d 的转基因拟南芥根系作为测定材料,使用高纯度RNA 提取试剂盒(全式金)提取RNA 并对其进行纯度检测和浓度测定。取等量RNA,使用反转录试剂盒(翌圣)进行单链cDNA 的合成。选择拟南芥肌动蛋白基因Actin为内参基因,设计引物(表1)进行实时荧光定量PCR(RT-qPCR),并对数据采用2-ΔΔCt法进行分析。
1.4 PA 荧光探针转基因拟南芥的表型观察
将野生型和转基因株系种子点播在1/2 MS 方形培养基上,竖直培养6 d 后,挑选长势均匀一致的幼苗(每个基因型,20 株),分别转移至含有0 和50 mmol·L-1NaCl 的1/2 MS 固体培养基中继续竖直培养,7 d 后观察表型。
1.5 PA 荧光探针灵敏度分析
将在1/2 MS 方形培养基上竖直培养6 d 的幼苗分别浸泡在含有0、2 和10 μmol·L-1PA 的1/2 MS 液体培养基中,依次处理5、10、15 和20 min 后,利用荧光显微镜(ZEISS,Axio Imager 2)对拟南芥根尖分生区PA 的分布进行观察并拍照。
1.6 盐碱胁迫下根尖PA 的检测
将含PA 荧光探针的拟南芥转基因株系种子点播在1/2 MS 方形培养基上,竖直培养6 d,选择均匀一致的幼苗分别浸泡在含有100 mmol·L-1NaCl、10 mmol·L-1NaHCO3和兼含两者的1/2 MS 液体培养基中,处理5、10 和15 min 后用荧光显微镜观察根尖分生区PA 的分布。
2 结果与分析
2.1 PA 荧光探针的设计及其转基因拟南芥的获得
如图1 所示:该载体以pSY06 为骨架,由35S 启动子驱动植物选择标记基因——草铵膦抗性基因(bar)的表达,而GFP-PABD融合基因的表达则由UBQ10 启动子驱动。

图1 pSY06-GFP-PABD 载体图Figure 1 Vector diagram of pSY06-GFP-PABD
采用农杆菌花序侵染法将GFP-PABD融合基因转入拟南芥,获得T1代转基因种子。对T1代幼苗进行草铵膦(10 mg·L-1)抗性筛选与PCR 鉴定,获得56 个含融合基因的独立转基因株系。随后,对相应株系的T2代幼苗(每个株系约300 株)继续进行草铵膦除草剂抗性筛选。卡方测验显示:符合3(阳性苗数)∶1(阴性苗数)分离规律的株系共8 个,这些株系为含单插入位点的转基因株系。再对T2代各个株系不同植株的自交后代(T3代)进行除草剂抗性筛选,最终获得7 个纯合、单插入位点转基因拟南芥株系,分别为8-1、11-1、13-12、25-5、42-4、48-1 和53-1。
2.2 不同转基因株系PA 荧光探针表达量的分析
为了明确不同转基因株系PA 荧光探针表达量的差异,对上述7 个转基因株系进行了目的基因的表达量测定。RT-qPCR 结果(图2)显示:当将转基因株系8-1 中融合基因的相对表达量设为参考值“1”,其余6 个株系(11-1、13-12、25-5、42-4、48-1 和53-1)的相对表达量分别为1.74、15.91、0.72、1.06、1.69 和1.52。株系13-12 的PA 探针的表达量最高,是其他株系的9~22 倍,为PA 探针高表达转基因株系;相应地,将株系48-1 作为PA 探针低表达材料。

图2 不同转基因拟南芥株系中GFP-PABD 融合基因的相对表达量Figure 2 Relative expression level of the GFP-PABD fusion gene in transgenic A.thaliana lines
2.3 PA 荧光探针对拟南芥生长发育的影响
为了明确PA 荧光探针的表达是否会对植物生长发育产生影响,比较分析了野生型拟南芥和不同转基因株系在整个生长发育周期的表型差异。土培生长实验显示:野生型与转基因拟南芥株系的叶片生长无明显差异,高表达转基因株系(13-12)与低表达转基因株系(48-1)之间亦无可见表型差异(图3A)。另外,在含有0 和50 mmol·L-1NaCl 的1/2 MS 培养基中生长时,野生型与不同转基因株系之间也未表现出生长速率的差异(图3B)。这些结果说明:在一定范围内PA 荧光探针的表达不会影响拟南芥的正常生长发育,这一特性有助于合理解释特定条件下胞内PA 变化对植物生长发育产生的影响。

图3 野生型拟南芥与3 个PA 荧光探针转基因株系的表型比较Figure 3 Phenotypic comparison between wild type and three transgenic lines of A.thaliana bearing PA fluorescent probe
2.4 荧光探针监测PA 的灵敏度
随着荧光探针表达量的增加,细胞内的荧光强度也会增强,这会导致PA 检测的信噪比下降;相反,荧光探针表达量过低则会影响PA 检测的灵敏度。为了获得检测灵敏度和信噪比都较高的PA 荧光探针,用不同浓度的外源PA 处理荧光探针表达量存在差异的转基因株系,进而在荧光显微镜下观察根尖PA 的积累情况。结果(图4~6)显示:野生型拟南芥在有、无外源PA 处理下,根尖细胞自发荧光的强度无明显差别。另外,在不同浓度外源PA 处理下,荧光探针低表达的转基因株系(48-1)的根尖分生区的PA 含量变化未能被捕捉到。相反,对于荧光探针高表达的转基因株系(13-12),2 和10 μmol·L-1PA 分别处理10 和5 min 后,其根尖分生区细胞的胞内或质膜上的PA 积累清晰可见(图5)。当外源PA 浓度低时,随着处理时间延长,细胞中PA 积累减少(图5),这很可能是因为作为甘油脂合成前体物质的PA 已被转化为其他物质。而当外源PA 浓度升至10 μmol·L-1时,处理10、20 min 后依然可见细胞中的PA 呈点状分布(图6)。这些结果说明:荧光探针表达量较高的转基因株系(13-12)可被用于监测细胞中PA 含量的变化。
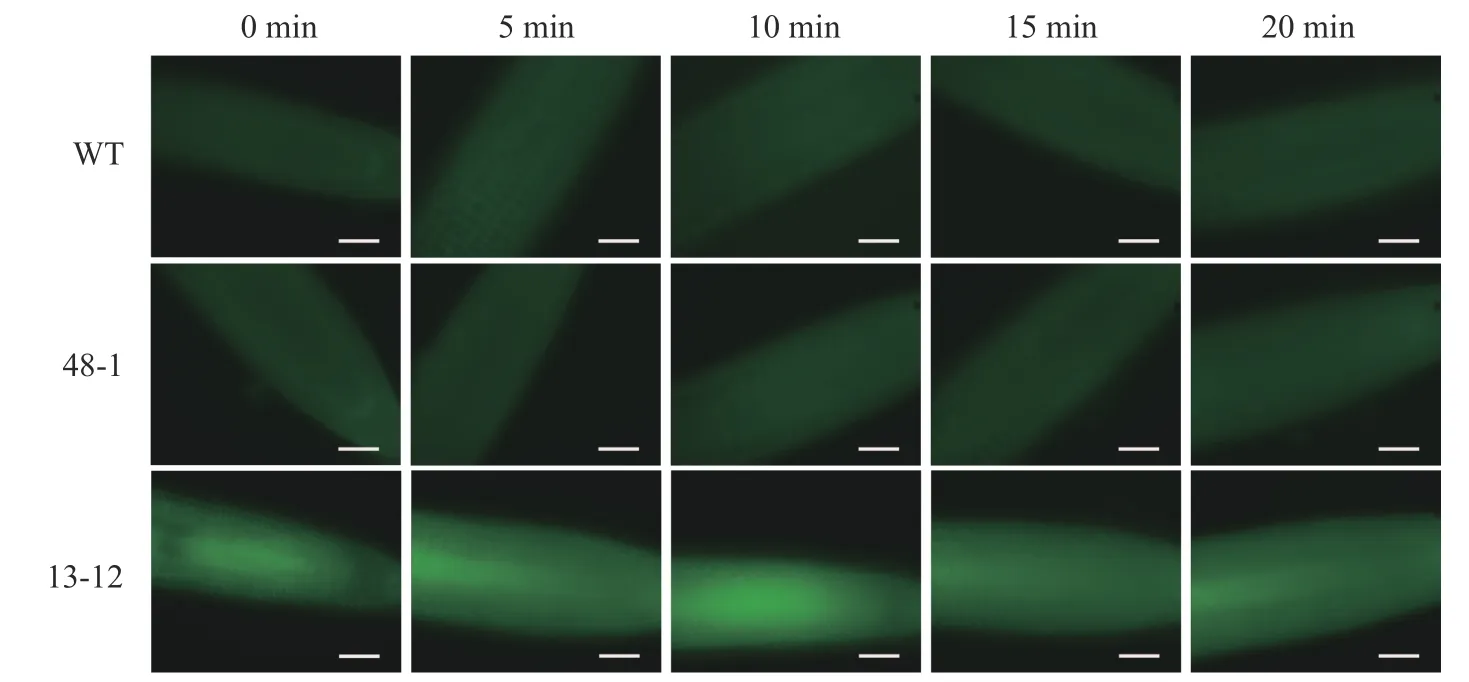
图4 无外源PA 处理下PA 探针在野生型和2 个转基因拟南芥株系根尖中荧光强度的差异分析Figure 4 Analysis of discrepancy in fluorescent intensity of PA probe between wild type and two transgenic lines of A.thaliana

图5 外源PA(2 μmol·L-1)处理下PA 荧光探针对PA 监测灵敏度的分析Figure 5 Sensitivity analysis of PA fluorescent probe monitoring PA under treatment with 2 μmol·L-1 exogenous PA

图6 外源PA (10 μmol·L-1)处理下PA 荧光探针对PA 监测灵敏度的分析Figure 6 Sensitivity analysis of PA fluorescent probe monitoring PA under treatment with 10 μmol·L-1 exogenous PA
2.5 荧光探针检测盐碱胁迫下拟南芥根尖PA 的含量变化
为了进一步验证 PA 荧光探针的实用性,利用荧光探针表达量较高的转基因株系(13-12)检测盐碱胁迫条件下根尖细胞中PA 含量的变化。结果显示:盐、碱单独或混合处理转基因株系,5 min 后即可在根尖分生区细胞中观察到PA 的点状分布(图7)。因此推断,本研究构建的PA 荧光探针可用于监测逆境条件下植物细胞中PA 含量的变化。另外,盐碱胁迫可快速诱导PA 积累这一现象表明在植物早期逆境响应中PA 发挥某种重要作用。

图7 单独或混合盐碱胁迫下PA 在转基因拟南芥根尖分生组织中的分布Figure 7 Distribution of PA in the root tip meristem of a transgenic A.thaliana line bearing PA sensor under saline and alkaline stresses, alone or in combination
3 讨论
已知PA 在植物生长发育与逆境响应过程中发挥重要作用,但由于缺乏PA 的可视化分析工具,对细胞中PA 含量动态变化的了解十分有限。这一方面限制了PA 作用机制的研究,另一方面给评估基因工程手段操控植物细胞PA 含量变化所产生的实际应用效果带来困难。因此,本研究将酵母蛋白Spo20p 中对PA 高度专一的结合域与荧光蛋白融合,成功构建了可对细胞内PA 进行可视化检测的荧光探针。
为了使荧光探针适用于监测整个生长周期不同组织细胞中的PA 水平,选择组成型表达启动子UBQ10 驱动GFP-PABD融合基因的表达。研究发现:植物细胞中PA 的检测灵敏度与PA 荧光探针的表达量密切相关,表达量较高的荧光探针可有效检测到外源PA 处理带来的胞内PA 水平的变化,而表达量较低的探针检测效果则相反。如13-12 株系中PA 荧光探针的表达量高于其他株系,该株系经2 μmol·L-1外源PA 处理10 min,其根尖细胞中PA 的点状分布即可被观察到,这也说明外源PA 能够被拟南芥根尖快速吸收,继而与PA 荧光探针结合。鉴于已有研究中常用浓度高于10 μmol·L-1的外源PA 检测PA 探针的灵敏度[35],本研究中构建的荧光探针可有效监测到2 μmol·L-1外源PA 处理所带来的细胞内PA 含量的变化,推测基于13-12 转基因株系的PA 荧光探针具有较高的PA 检测灵敏度。
需要指出的是,PA 荧光探针使用过程中,样品处理时间的延长和观察光源的增强均会使植物细胞造成某种损伤,导致细胞产生自发荧光,从而降低PA 检测的信噪比。因此在实验过程中,需尽量缩短植物样本的制片时间及荧光观察的时间,以提高观察结果的真实性。
盐碱地中盐和碱是2 种共存但不同的非生物胁迫,共同影响植物的正常生长发育。利用本研究构建的PA 荧光探针发现:盐胁迫处理5 min 就会造成PA 在细胞中的积累,这与已有的研究结果一致[22,36]。同时,碱胁迫和盐碱混合胁迫也会快速诱导PA 的积累。因此,为了全面了解植物早期逆境响应机制,有必要监测早期细胞中PA 含量的动态变化。本研究开发的PA 荧光探针为这些方面的研究提供了重要技术支撑。
4 结论
本研究成功构建了一种基于酵母蛋白Spo20p 中PA 结合域的荧光探针,可有效监测植物细胞中PA 含量变化。应用该探针发现盐碱胁迫可快速诱导拟南芥根尖细胞质膜上和胞内PA 的积累,这一结果表明PA 在植物对盐碱胁迫早期应答过程中发挥重要作用。
