许氏平(Sebastes schlegelii)TRAF 基因的鉴定及其响应杀鱼爱德华氏菌侵染的表达模式研究*
2024-02-24刘显通王宁宁吴瑞雪
刘显通 王宁宁 吴瑞雪 李 超 曹 敏
(青岛农业大学海洋科学与工程学院 山东青岛 266109)
肿瘤坏死因子超家族(tumor necrosis factor superfamily, TNFSF)和肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily, TNFRSF)成员参与了多种先天性和适应性免疫过程, 对细胞增殖、发育、死亡、存活、免疫和各种疾病起到调节作用(Locksleyetal, 2001; Colletteetal, 2003)。通常,TNFSF 配体通过结合TNFSF 同源结构域(THD)和TNFRSF 的富半胱氨酸结构域(CRDs)与TNFRSF 通信, 从而介导免疫相关信号通路和其他发育过程(Bodmeretal, 2002)。活化的TNFRSF 可以通过肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factors, TRAF)在胞内进行信号传导(Haet al, 2009)。TRAF 是一种兼具重要性和特殊性的胞内转导通路分子, 可以通过与下游信号分子结合, 激活NF-κB 信号通路, 介导免疫和炎症反应。TRAF 作为一种有凝聚性的衔接蛋白, 其作用可分为两个方面:一方面, 通过TRAF 同源域与受体接受外界刺激; 另一方面, 通过N-端指环/锌指结构与其他蛋白质分子或DNA 结合, 依靠这两种途径, 产生一个较为复杂的下端传递信号(李影等, 2015)。
大多数TRAFs 成员都含有这样两种结构, N-末端指环状结构域和数目不等的锌指, C-末端TRAF 结构域是由卷曲螺旋TRAF-N 和TRAF-C 结构域构成,后者是保守的, 这两个结构域的主要功能是维持蛋白质的构象, 对维持其稳定性起到了重要作用。它们都具有特殊的蛋白质结构, 可以帮助识别和结合受体, 并参与细胞因子的分泌、信号转导、细胞增殖、凋亡等生理过程(Chenetal, 2013)。在哺乳动物中,TRAF 分子的N 端, 都含有1 个指环结构域, 并且都含有5~7 个锌指结构域(Häckeretal, 2011)。需要指出的是, 指环状结构可以介导DNA-蛋白质和蛋白质-蛋白质这两种形式的转换。研究表明, 除了具备介导功能外, 指环状结构还可以参与到TRAFs 的蛋白酶体依赖的降解过程(Chapardetal, 2012)。其中, TRAF1结构是7 种TRAFs 家族中最为独特的, 它不仅没有上述提到过的TRAF 结构N-末端的指环结构域, 也没有锌指结构(Zottietal, 2012)。TRAF2 的特点是其结构域中含有 2 个亚结构域, 分别是 TRAF-N 和TRAF-C (Songetal, 2011)。TRAF2 作为一种多功能分子, 可以激活 NF-κB 诱导激酶(NF-κB inducing kinase, NIK)和 c-Jun 氨基端激酶(c-Jun N-terminal kinases, JNK)信号途径(Cabal-Hierroetal, 2014)。其中,NIK 是一种可以通过磷酸化和去磷酸化激活NF-κB信号通路的蛋白质激酶; 而JNK 则是一种可以通过磷酸化和去磷酸化激活c-Jun 信号通路的蛋白质激酶。TRAF3 的功能是TRAF 家族中最丰富的。前期研究发现, TRAF3 不但可以对NF-κB 和MAPK 这两种信号通路进行负性调控, 还可以对Ⅰ型干扰素进行正性调控, 从而发挥抗病毒的作用(Muroetal,2014)。TRAF4 是家族中唯一可以通过核定位的蛋白,这是区别于其他TRAF 家族成员的最大特征(Yoonet al, 2014)。TRAF5 的特征是表达范围比较广, 在肺、脾、胸腺、肾等器官中表达。与其他成员不同的是,TRAF6 在与受体结合时表现出特异性, 可以与白介素-1 受体相关激酶、核因子κB 受体激动剂、CD40这种信号分子直接结合(Liuetal, 2012)。TRAF7 的形式比较特殊, 分为长型和短型。长型就是普通的TRAF7, 它可以编码的氨基酸蛋白数多达670 个。短型则被定名为TRAFs (Fuetal, 2011)。因此, 对TRAF结构和功能的了解, 有助于明确TRAF 与下游信号分子结合, 激活下游信号通路的分子机制。
在硬骨鱼中, 对于TRAF 的报道较少, 仅在少数物种的先天免疫中发挥作用。前期研究证明TRAF2,TRAF3和TRAF6可能还参与了先天免疫系统的抗细胞凋亡途径(Manion, 2012)。例如, 在青鱼(Mylopharyngodonpiceus)中,TRAF2可上调MAVS 介导的EPC 细胞中的IFN 信号传导和抗病毒活性(Chenetal, 2017)。研究表明,TRAF3可以通过多种信号通路的介导, 参与多种抗病毒信号通路。在花鲈(Lateolabraxjaponicas)中,TRAF3与抵抗RGNNV 感染的先天免疫反应有关, 并可能通过RLR 信号通路介导的IFN 反应发挥其抗病毒活性(Zhangetal, 2018)。TRAF3还可以调节黄酸诱导基因I (RIG-I)和干扰素基因刺激因子(STING)基因的表达, 从而增强机体对病毒的防御能力(Fengetal,2011; Wangetal, 2018)。凌露露等克隆获得了日本鳗鲡(Anguillajaponica)TRAF3, 发现poly(I:C)和迟缓爱德华氏菌刺激可显著增强AjTRAF3的表达水平且利用免疫荧光和免疫共沉淀等方法证实了AjTRAF3通过其MATH 结构域结合位于线粒体上的MAVS, 从而调控由RLR 介导的Ⅰ型IFN 抗病毒免疫应答(凌露露等, 2023)。同样,TRAF6还在鱼类天然免疫应答中起着重要的调控作用(Phelanetal, 2005)。此外, 虹鳟(Oncorhynchusmykiss)中的TRAF6可以负调控LPS 诱导的p38MAPK 和JNK 的磷酸化(Jangetal, 2019)。相比在哺乳动物中的研究, 目前对鱼类中TRAF的相关研究较少。因此解析鱼类中TRAF的类型、结构和响应病原菌刺激后的表达模式的研究, 有助于了解鱼类中TRAF基因与哺乳动物中的差异, 并且有助于后续鱼类中TRAF介导信号通路的研究, 对于进一步了解鱼类中TRAF的免疫应答机制具有重要意义。
1 材料与方法
1.1 实验用鱼及饲养条件
1.2 许氏平TRAF 基因的全基因组鉴定
本项目利用NCBI 全基因组信息(物种包含人类、鼠和多种硬骨鱼), 在NCBI 全基因组范围内搜索, 下载TRAF基因序列, 构建BLAST 全序列比对数据库,通过对许氏平全基因组序列的分析, 将其与数据库中的数据进行比较, 最终确定了TRAF基因的候选基因。随后用hmmer 搜索程序, 对许氏平的全基因进行了初步筛选, 并对其中包含TRAF重复区域和TRAF功能域的基因进行了确定, 并将部分不包含该功能域的基因进行了初步筛选。在使用hmmer 搜索程序后, 我们发现了一些具许氏平的TRAF基因。通过对hmmer 和blast 的搜索结果的整合, 得到了关于许氏平TRAF家族成员的基因信息。
1.3 许氏平TRAF 基因特征分析
1.4 许氏平TRAF 基因共线性分析
1.5 许氏平TRAF 基因的系统发育分析
为了建立TRAF基因在不同种类间的亲缘关系。首先, 利用MUSCLE 算法, 将获得的TRAF序列进行多个序列的比较, 进而构建出一个数据丰富的大样本(Edgar, 2004)。采用ProtTest (Abascaletal, 2005)方法, 通过对TRAF基因进行了进化分析, 筛选出最合适TRAF基因的模型。使用BEAST v.2.2 软件重建了系统发育树, 选用G+I+T 最优化模型, 不变位点比例选定为0.32, Gamma shape 参数选定为0.56, 四个线程在同一时间内运行10 000 000 代。最后选用进化树可视化软件iTOL (http://itol.embl.de/)对系统进化树进行调整。
1.6 TRAF 家族基因的蛋白质相互作用网络预测及表达模式分析
1.7 杀鱼爱德华氏菌攻毒及实时荧光定量实验
2 结果与讨论
2.1 许氏平TRAF 基因的鉴定与表征
整合Pfam 数据库中TRAF 保守结构域和BLAST结果, 在许氏平中共鉴定出9 个TRAF基因, 分别命名为TRAF5、TRAF4.1、TRAF4.2、TRAF2.1、TRAF2.2、TRAF3.1、TRAF2.3、TRAF6、TRAF3.2。这些TRAF基因的 mRNA 长度范围为 231 bp(TRAF4.1)到 1 794 bp (TRAF2.1)不等。与此同时,TRAF 蛋白的长度范围为76 bp (TRAF4.1)至597 bp(TRAF2.1)之间。其中, TRAF2.1 的分子量最大(67.04 kDa), 其次为TRAF3.1 (66.93 kDa)和TRAF3.2(66.23 kDa), 而TRAF4.1 (8.73 kDa)的相对分子质量最小。结果显示, 所有基因的pI 值范围均在5.96~8.39之间。在亚细胞定位的统计分析中, 有7 个基因定位于细胞核内。除此之外, 我们发现TRAF4.1定位于细胞质,TRAF3.2定位于线粒体(表1)。

表1 9 个TRAF 基因的特征Tab.1 Characterization of the 9 TRAF genes
2.2 许氏平TRAF 基因的蛋白质结构域分析
在此次预测结果中, 除了发现TRAF4.1和TRAF4.2外, 其他基因都含有RING 结构域。同时, RING 在不同基因中的相对位置也是有区别的。TRAF3.1、TRAF3.2、TRAF5、TRAF6、TRAF4.2、TRAF2.2、TRAF2.3、TRAF2.1各有一个MATH 结构域。与典型的TRAF蛋白结构域相比, 在TRAF4.1中没有发现RING 结构域和MATH 结构域。而在TRAF4.2中没有发现RING 结构域(图1)。

图1 TRAF 基因的蛋白质结构域Fig.1 Protein domain structure of the TRAF gene
2.3 许氏平TRAF 基因的基因结构
9 个TRAF基因中, 有4 个(TRAF2.1、TRAF3.1、TRAF3.2、TRAF2.3)含有5'UTR 区域和3'UTR 区域,推测它们是全长基因(图2)。在TRAF6、TRAF4.1、TRAF4.2中没有发现UTR 区域, 而TRAF2.2和TRAF5只发现3′UTR 区域, 未发现5′UTR 区域。通过对其外显子和内含子进行了分析和比较, 进一步对这些TRAF基因的结构多样性进行了研究。研究结果表明,TRAF3.1和TRAF3.2的内含子/外显子数量最多, 分别有14 个外显子和13 个内含子(图2, 其中黄色框表示CDs 区域, 蓝色框表示UTR 区域, 黑线表示内含子), 其余的TRAF基因都有2 个以上外显子。同时,基因功能结构域显示除TRAF4.1和TRAF4.2外, 其余基因大多均有Zf-TRAF superfamily 和TRAF_BIRC3_bd 结构域(图3)。
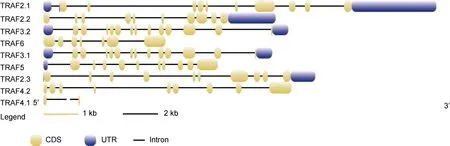
图2 许氏平中TRAF 基因的基因结构Fig.2 Gene structure of the TRAF gene in S. schlegelii

图3 许氏平中TRAF 基因结构域Fig.3 TRAF gene domain in S. schlegelii
2.4 许氏平TRAF 基因共线性分析
为了更好地认识TRAF基因的特点, 我们采用共线性分析方法对许氏平与其他硬骨鱼类的TRAF基因进行了标胶分析(图4)。提取了来自许氏平、斑马鱼、尼罗罗非鱼、斑点叉尾、大菱鲆和红鳍东方的TRAF基因及其上下游的邻位基因。特别的, 许氏平中的9 个TRAF基因在其他鱼类中只部分存在。TRAF2、TRAF3、TRAF4、TRAF6基因在上述几种硬骨鱼中均有发现(图4a)。我们发现在许氏平、斑马鱼、尼罗罗非鱼和斑点叉尾中,TRAF均存在多拷贝现象。对在许氏平中的TRAF2.1共线性模块分析结果中发现, 含上下游基因包括IL6、LIFR、MAST4、PIPNA3、TENN、GRM2B、ZN703、NP-C2、TIA1、EGF7, 与其他物种中TRAF的共线性存在差异。同样的差异也发现在TRAF2.3中, 但是TRAF2.2在许氏平、斑马鱼、斑点叉尾和大菱鲆中较为保守。与TRAF2相比, 许氏平中TRAF3的共线基因模块与斑马鱼和斑点叉尾较为相似(图 4b)。而TRAF4在许氏平、尼罗罗非鱼、斑马鱼、红鳍东方和大菱鲆中的共线性较为接近(图4c)。我们还发现TRAF5在许氏平、斑马鱼、大黄鱼(Larimichthys crocea)和斑点叉尾等物种中具有较高的保守性。MARK1和RCOR3作为TRAF5的两个邻位基因, 它们在多个物种中具有相同的序列, 而在许氏平中,TRAF5的相邻基因和尼罗罗非鱼类似(图4d)。此外,我们发现在许氏平、斑马鱼、尼罗罗非鱼中,TRAF6的共线性序列比较保守(图4e)。

图4 TRAF 共线性分析Fig.4 Collinearity analysis of TRAF
2.5 TRAF 基因的系统发育分析

图5 TRAF 进化树Fig.5 The TRAF evolutionary tree
2.6 TRAF 基因的PPI 网络分析
通过PPI 网络分析, 得到TRAF (TRAF2.2、TRAF2.1、TRAF6、TRAF5、TRAF3.1、TRAF3.2、TRAF4.1、TRAF2.3、TRAF4.2)与其互作蛋白的关联状况。如图6, fadd、tradd、birc2 均显示出与TRAF具有高度关联性, 并且在所有TRAF 亚家族的整个PPI 网络中都发现了map3k14 中枢节点。此外, 预测结果也证明了TRAF 与TNFRSF 存在互作关系(图6)。
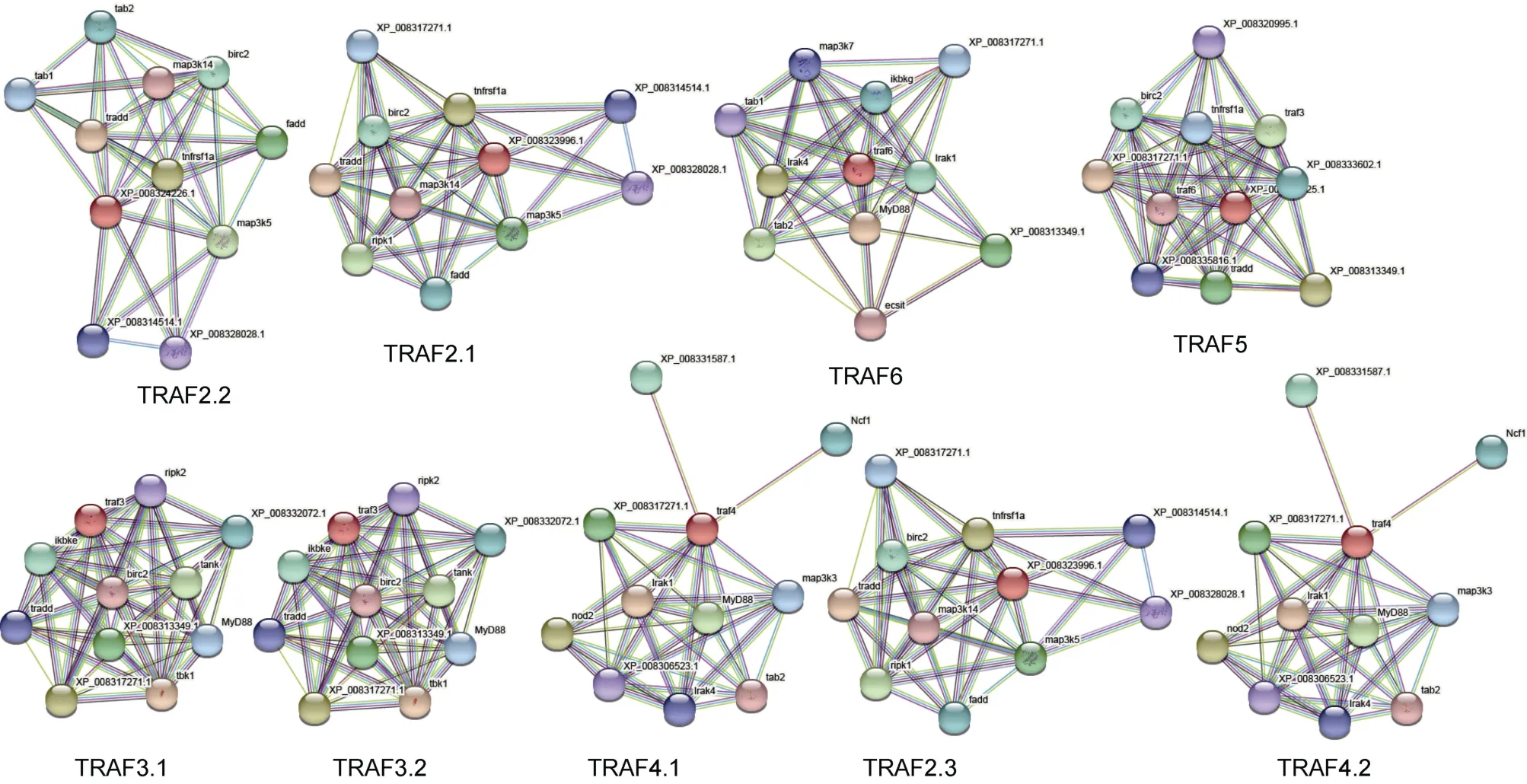
图6 许氏平中TRAF 互作蛋白的预测分析Fig.6 Predictive analysis of interacting proteins of TRAF in S. schlegelii
2.7 杀鱼爱德华氏菌感染许氏平后TRAF 基因在其肠道中的表达模式

图7 杀鱼爱德华氏菌感染后不同时间点许氏平肠道组织中TRAF 基因表达变化Fig.7 Expression changes of TRAF in the intestinal tissues of S. schlegelii at different time points following infection by E. piscicida
3 讨论
肿瘤坏死因子受体相关因子(TRAF)是TNF 受体超家族和白细胞介素-1 受体/Toll 样受体超家族的主要信号转导子, 调节各种细胞活性和先天免疫反应(Wangetal, 2015)。在本研究中, 我们通过整合Pfam数据库中TRAF保守区域和BLAST 结果, 在许氏平中鉴定出9 个TRAF基因, 发现部分TRAF家族成员存在多个拷贝, 然后获取了各家族基因的蛋白分子量、等电点以及在染色体上的位置等基本信息。并且通过系统的生物信息学分析了它们的基因结构、功能结构域、共线性排列, 蛋白互作网络以及系统进化关系, 发现它们在结构和功能上是比较保守的。在许氏平中共鉴定到9 个TRAF基因, 与黄颡鱼(Pelteobagrusfulvidraco) (8 个) (Nieetal,2022)、大菱鲆(8 个) (Zhouetal, 2023)、半滑舌鳎(7个) (Lietal, 2020)等其他硬骨鱼中的数目类似。以前的研究证实大多数硬骨鱼缺乏TRAF1或TRAF5基因,并且TRAF1基因的缺失比TRAF5基因的缺失更为普遍, 这表明TRAF5基因可能比TRAF1基因在进化上更为保守(Wajantetal, 1998)。在许氏平中, 就是缺失了TRAF1基因, 保留了TRAF5基因, 与前期的研究结果一致。在鉴定到的9 个TRAF基因中, 有5 个(TRAF2.1、TRAF3.1、TRAF3.2、TRAF5、TRAF2.3)含有5′UTR 区域和3′UTR 区域, 依据这一点可以推测它们是全长基因。在TRAF6、TRAF4.1、TRAF4.2中没有发现UTR 区域, 而TRAF2.2只发现3′UTR 区域,未发现5′UTR 区域。其中TRAF3.1和TRAF3.2的外显子数量最多。蛋白质结构域分析结果显示,TRAF4.1既没有 RING 结构域, 也没有 MATH 结构域, 而TRAF4.2有MATH 结构域却没有RING 结构域, 其余的TRAF家族基因均含有MATH 结构域和RING 结构域。
TRAF2、TRAF3、TRAF4的多拷贝现象在硬骨鱼中较为常见(Lietal, 2020; Nieetal, 2022; Zhouetal,2023)。另外, 我们发现TRAF5在许氏平、大黄鱼(Larimichthyscrocea)和斑点叉尾等物种中具有较高的保守性, 而在许氏平中, TRAF5 的相邻基因和尼罗罗非鱼类似。由于TRAF基因存在多拷贝显现,其共线性结构的保守性也存在很大的差异。进化分析结果显示,TRAF分为3 大支, 包括TRAF2、TRAF5、TRAF6。从家族分类上解释, 这些TRAF 可以分为5个主要亚家族: TRAF2 亚家族、TRAF3 亚家族、TRAF4 亚家族、TRAF5 亚家族和TRAF6 亚家族。结果显示许氏平中的TRAF基因能够分别和对应的类群聚为一支。其中, TRAF4 亚家族和TRAF6 家族成员关系较近, 这可能与它们具有相似的功能有关(Nieetal, 2022)。蛋白质互作网络分析结果显示, FADD、TRADD、BIRC2 均显示出与TRAF 具有高度关联性。
已有研究表明鱼类中的TRAF基因也发挥重要的免疫防疫作用。在青鱼中, 经过病原刺激后, 鱼体内的TRAF基因表达水平均显著升高(Wangetal, 2018)。在东北七鳃鳗(Lethenteronmorii)中,TRAF6在铜绿假单胞菌(Pseudomonasaeruginosa)感染后的成鱼的鳃、肠和肾组织中显著升高(丁少青等, 2019)。半滑舌鳎经哈维氏菌(Vibrioharveyi)刺激48 h 后, 其TRAF基因在各组织中表达量显著升高(Lietal, 2020)。为了探究TRAF 基因在许氏平肠道中响应病原菌侵染后的表达模式, 我们构建了杀鱼爱德华氏菌感染的肠道模式, 并通过荧光定量检测了9 个TRAF基因在肠道中的表达量。结果显示除TRAF4.1外, 其余TRAF基因均发生了显著上调表达。其中,TRAF4.2在感染后96 h 后, 表达量增高了14.24 倍。TRAF6在感染后2 h 上调倍数最大, 为对照组的2.27 倍。但是在嗜水气单胞菌感染的黄颡鱼的肝脏和脾脏中,TRAF4的基因是下调表达的, 而TRAF6也是呈现下调表达的, 与许氏平中的表达模式相反, 但是TRAF2和TRAF3均被诱导表达(Nieetal, 2022)。研究表明TRAF2作为一种多功能分子, 可以激活NF-κB 诱导激酶和c-Jun氨基端激酶信号途径(Cabal-Hierroetal, 2014)。因此,我们推测TRAF2在许氏平中也是通过这两种途径响应病原菌的侵染。但是前期研究发现,TRAF3可以对NF-κB 信号通路进行负性调控(Muroetal, 2014)。但是在大菱鲆中的TRAF2的基因的表达是被抑制的(Zhouetal, 2023)。因此, 我们推测,TRAF3的上调表达可以抑制过渡的炎症反应, 对机体进行保护。TRAF5在感染后6 h、24 h 和96 h 分别上调2.66 倍、4.57 倍和1.96 倍。研究证明尼罗罗非鱼中过表达的TRAF5激活NF-κB (Xiaetal, 2019)。因此, 我们推测许氏平中的TRAF5参与抗细菌免疫应答, 在信号转导中起着至关重要的作用。
