手持技术探究酸碱滴定过程中缓冲容量的变化
2024-02-21郑海鹏钟鸣陈鲜丽郑兰
郑海鹏,钟鸣,陈鲜丽,郑兰
手持技术探究酸碱滴定过程中缓冲容量的变化
郑海鹏1,钟鸣2,陈鲜丽1,郑兰1
(韶关学院 1. 化学与土木工程学院,2. 医学院,广东 韶关 512005)
针对韶关学院基础化学课程中酸碱滴定的学习内容,以酸碱滴定为基础,绘制滴定过程中溶液缓冲容量的变化图,并结合型体分布分数的知识联合讨论酸碱滴定过程中溶液缓冲容量变化,扩充了酸碱滴定和缓冲容量的知识,可以加深临床医学本科专业学生对酸碱滴定的理解.使用手持技术实验设备中的pH传感器和滴数传感器设计了酸碱滴定实验,使用NaOH溶液分别滴定HAc,H2C2O4,H3PO4溶液,绘制相应的pH-曲线和-pH曲线,基础借助-pH曲线解释缓冲容量变化,并联合分析其滴定过程中缓冲容量的变化,有利于加深学生对酸碱滴定和缓冲溶液的理解.
手持技术;pH传感器;滴数传感器;滴定曲线;分布型体;缓冲容量
基础化学是为临床医学本科专业大一学生开设的一门专业基础课程,内容包括无机化学基础知识和分析化学基础知识及其相关实验,难度和学习要求相对比较低.该课程的学习任务是使学生获得化学基础理论、基本知识和实验操作的基本技能,提高他们观察、分析、解决问题的能力,为学习医学基础课程和专业课程奠定基础.其中,缓冲溶液不仅包括了对强弱电解质、酸碱质子理论等前置知识的进一步理解,还包括了人体酸碱平衡对生命活动的意义;滴定分析中酸碱滴定法的内容包括了对强弱电解质、酸碱质子理论和缓冲溶液等前置知识的进一步理解,以及滴定分析对医药分析的意义,两部分内容均体现了化学与医学的紧密联系,且有密不可分的联系.
以韶关学院的《基础化学》教材为例,其中提及了酸碱滴定法是以质子转移反应为定量基础的滴定分析法[1].对于NaOH滴定HAc的pH-曲线的解释提及了“随着滴定的进行,NaAc和HAc形成缓冲溶液,对滴入的NaOH具有一定的缓冲作用,因而出现了较平坦的曲线部分”.因此,在滴定过程中形成了缓冲溶液,通过绘制pH-曲线可以反映出缓冲溶液的缓冲容量大小,进一步得到缓冲容量与pH的关系曲线.相关文献描述通过公式绘制缓冲容量曲线[2-3],以及通过滴定的方式测定缓冲容量[4].在文献[4]中,通过在不同的缓冲溶液中分别逐滴加入NaOH或HCl溶液,并使用电位滴定仪测定pH,并绘制成缓冲容量-pH图,结果比较直观,但数据点较少,难以完全展示完整的缓冲溶液曲线,所以该实验的思路和内容能进一步丰富和优化.因此,本文结合pH传感器和滴数传感器,设计了手持技术为基础的酸碱滴定实验,并以此绘制缓冲容量曲线,能够很好地观察到缓冲容量随pH的变化而变化,以及通过型体分布曲线讨论其变化原因.通过酸碱滴定的方式探究缓冲溶液缓冲容量的性质,有助于加深学生对酸碱滴定规律和缓冲溶液的理解.与大型仪器的实验和传统实验相比,手持技术数字化实验能够通过传感器、数据采集器和配套软件,大量、快捷、可视和精确地采集各种物理量数据,更好地认识物质在化学反应中变化的事实[5].
1 实验原理
在酸碱滴定中,以所得混合溶液的pH为纵坐标,以滴定过程中加入的酸或碱溶液的量为横坐标,所绘制的曲线为酸碱滴定曲线,一般为pH-或pH-(滴定分数)图.以0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc为例,在滴定过程中发生反应(1),以混合液的pH为纵坐标,加入NaOH的体积为横坐标,即得0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc的pH-图.在滴定过程中不足量的NaOH与HAc反应生成少量的NaAc,与溶液中大量存在的HAc形成缓冲溶液,缓冲对为HAc-NaAc,随着滴定的继续,缓冲比[Ac-]/[HAc]也在发生改变,直至HAc全部生成NaAc,失去缓冲能力.
NaOH+HAc=NaAc+H2O (1)
滴定过程中会形成HAc-NaAc缓冲溶液,可根据滴入NaOH的浓度和体积以及缓冲溶液的pH计算出缓冲溶液的缓冲能力,即缓冲容量(mol·L-1·pH-1),公式为

式中:为外加的NaOH溶液的物质的量;为缓冲溶液的体积;ΔpH为缓冲溶液pH的变化量.当总浓度一定时,缓冲比越接近1,缓冲容量就越大,缓冲比等于1时,缓冲容量最大[6].以缓冲容量为纵坐标,pH为横坐标可以绘制出缓冲容量-pH图.
在滴定过程中,HAc和NaAc的浓度也在发生变化,在某一刻平衡时,某酸(或碱)的型体占酸(或碱)总浓度的分数称为型体分布分数,一般使用δ表示[7].以δ为纵坐标,pH为横坐标,即可得到-pH图.在0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc中,根据型体分布分数(3)(4),可以绘制出-pH图.借助-pH图可以很好地解释-pH和pH-的变化.
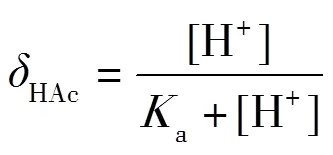

同理,0.1 mol·L-1NaOH滴定0.1 mol·L-1H2C2O4,由于H2C2O4为二元中强酸,会发生两步质子转移反应(5)(6),绘制pH-图.
NaOH+H2C2O4=NaHC2O4+H2O (5)
NaOH+NaHC2O4=Na2C2O4+H2O (6)
理论上,在滴定过程中,会依次形成H2C2O4-NaHC2O4和NaHC2O4-Na2C2O4两缓冲溶液,依据式(2)计算出缓冲容量,并绘制-pH图.根据草酸的型体分布分数公式(7)~(9)绘制其-pH图,并解释-pH和pH-的变化.
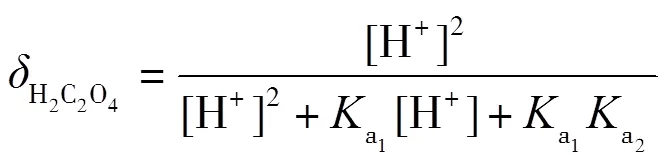
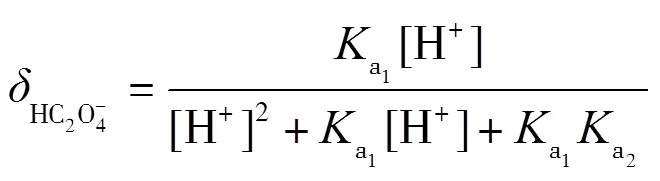
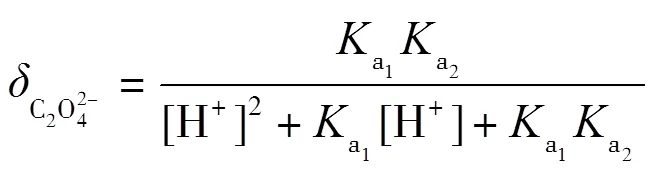
以三元酸的滴定为例,使用0.1 mol·L-1NaOH滴定0.1 mol·L-1H3PO4,滴定中发生三步质子转移反应(10)~(12),绘制pH-图.
NaOH+H3PO4=NaH2PO4+H2O (10)
NaOH+NaH2PO4=Na2HPO4+H2O (11)
NaOH+Na2HPO4=Na3PO4+H2O (12)
理论上,在滴定过程中,依次形成H3PO4-NaH2PO4,NaH2PO4-Na2HPO4,Na2HPO4-Na3PO4三种缓冲溶液,依据式(2)计算出缓冲容量,并绘制-pH图.根据磷酸的型体分布分数公式(13)~(16)绘制其-pH图,并解释-pH和pH-的变化.
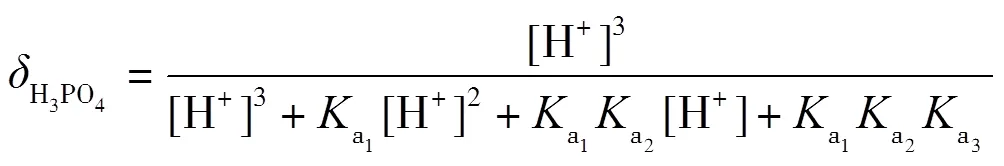
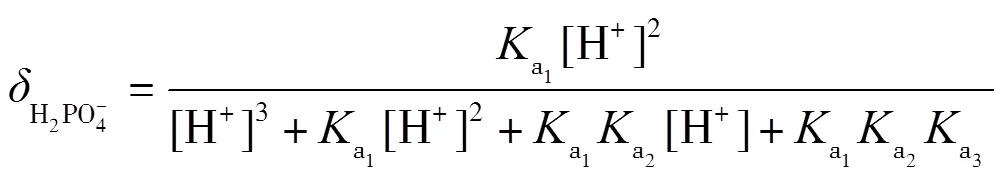
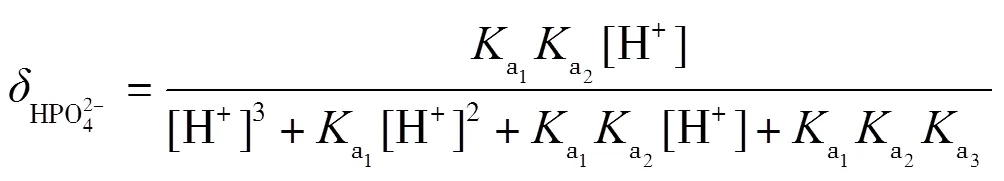

在滴定过程中,每一滴NaOH与被滴定的溶液反应后,形成缓冲溶液,对下一滴NaOH的滴入起到缓冲作用,滴入后,缓冲溶液的缓冲比发生了改变,缓冲容量也发生了改变.滴定中每一滴NaOH改变了缓冲比,下一滴NaOH的滴入引起的pH变化又能体现缓冲容量,循环往复,缓冲比从0到1,再到无限大,可以直观地看出缓冲容量的变化.通常,当缓冲比为1时,即组成缓冲对的共轭酸与共轭碱浓度最大,两者型体分布分数均为0.5,此时缓冲容量最大.即在滴定曲线pH-(或pH-)中,NaOH滴入分数约0.5时,所对应的pH变化最平缓.当滴入分数很小或很大时,共轭酸碱对型体分布分数偏离0.5,缓冲比偏离1,缓冲容量减小,滴定曲线pH变化较大.当反应完全到达质子转移反应终点时,弱酸已完全反应转化为共轭碱,到达滴定终点,共轭碱型体分布分数接近1,缓冲比偏离1的程度最大,缓冲作用最小,pH变化最大,滴定曲线出现突跃.
2 实验方法
2.1 仪器与试剂
Vernier数据采集器,Vernier磁力搅拌器,Vernier滴数传感器,VernierpH传感器(上海江凤光学仪器有限公司).
NaOH,HAc,H2C2O4,H3PO4(天津市大茂化学试剂厂),以上试剂浓度均为0.1 mol·L-1.
2.2 实验步骤
2.2.1 组装实验仪器 将数据采集器、磁力搅拌器、滴数传感器、pH传感器和计算机连接好(见图1),校正仪器,设置数据收集频率为2个/s,测试,待用.

图1 实验装置
2.2.2 滴定过程 0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc的实验操作过程为:在80 mL小烧杯中加入配制好的20 mL 0.1 mol·L-1HAc,加入搅拌子,然后在滴定管中加入0.1 mol·L-1NaOH,开启磁力搅拌器和数据记录,打开滴定管开关,使用pH传感器和滴数传感器同时记录连续滴定过程中混合溶液pH随NaOH加入的动态变化,绘制pH-曲线,在此基础上绘制-pH曲线,并借助-pH曲线讨论和解释-pH和pH-的变化.滴定操作平行三次,取最佳曲线作为后续最终实验结果.0.1 mol·L-1NaOH滴定0.1 mol·L-1H2C2O4和0.1 mol·L-1H3PO4的实验操作过程同理.
3 实验结果与讨论
3.1 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc
根据滴定数据,以pH为纵坐标,加入NaOH的体积为横坐标,绘制pH-图(见图2).由图2可见,pH起点为2.49,HAc为弱酸,少量解离.滴定开始时,pH起伏较大,滴定开始生成少量的NaAc对HAc产生同离子作用,抑制HAc的解离,NaOH的滴加使溶液中的[H3O+]迅速减少,pH升高.随着滴定的进行,NaAc和HAc形成缓冲溶液,曲线出现了较为平坦的部分.继续滴定,[HAc]逐渐减少,缓冲能力减弱,曲线起伏又开始变大,直至HAc与NaOH完全反应,引起pH的较大变化,在滴入约20 mL NaOH时出现滴定突跃,此时滴定产物为NaAc,计量点pH=8.60.需要说明的是,由于外界气温和仪器误差等不可控因素,导致实际实验结果的pH并非与理论计算pH一致.
为方便对照分析,将图2的纵坐标与横坐标对调,得到图3.使用式(2)计算出缓冲容量,并绘制-pH图(见图4),根据型体分布分数公式(3)(4)绘制出HAc型体分布-pH图(见图5).滴定前,溶液溶质为HAc,由图5可知,(Ac-)接近0,(HAc)接近1.滴定开始后,消耗HAc,生成NaAc,(Ac-)逐渐增大,(HAc)逐渐减小,开始时缓冲比[Ac-]/[HAc]小于1,并逐渐增加,因此缓冲容量较小,但处于爬升中.从图4可以发现,在滴定过程中所生成的HAc-NaAc缓冲溶液在pH=4.60附近时,缓冲容量最大,恰好对应图2与图3中pH变化较为平缓的阶段.对应图5的pH=4.60处,HAc与Ac-的型体分布分数接近0.5,即HAc与Ac-的浓度相当,缓冲比[Ac-]/[HAc]约等于1,缓冲容量最大,pH变化最平缓.同时,HAc的pa为4.76,接近4.60,当缓冲溶液pH尽可能接近pa时,缓冲溶液的缓冲能力最强[8].继续滴定,pH变化幅度又一次增大,两者型体分布分数均不等于0.5,(Ac-)继续增大,(HAc)继续减小,缓冲比[Ac-]/[HAc]逐渐大于1,因此缓冲容量减少.在到达计量点pH=8.60时,出现突跃,溶液溶质为NaAc,此时型体分布以Ac-为主,(Ac-)≈1,(HAc)≈0,缓冲比[Ac-]/[HAc]大于1,且偏离1的程度最大,失去缓冲能力.继续加入过量的NaOH,缓冲容量增大,此时溶液为NaOH和NaAc的混合溶液,pH由加入的NaOH浓度所决定,因此pH出现平台,使得“缓冲容量”增大.

图2 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的pH-V图

图3 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的V-pH图

图4 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的β-pH图

图5 HAc型体分布分数δ-pH图
3.2 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4

同理,为了方便对照分析,将图6的纵坐标与横坐标对调,得到-pH图(见图7),再通过式(2)得到-pH图(见图8),最后通过公式(7)~(9)得到型体分布分数-pH图(见图9).滴定开始时,由于H2C2O4为中强酸,pH约为1.46,能电离出H+,生成HC2O4-.由图9可知,此时溶质为H2C2O4和HC2O4-,(H2C2O4)≈0.4,(HC2O4-)≈0.6,缓冲比[HC2O4-]/[H2C2O4]接近1,pH=1.46,接近pa1=1.25,由图7可以看出,pH变化幅度小,对应图8缓冲容量较大,具有较强的缓冲能力.在H2C2O4溶液中,[H3O+]本来就很高,会抑制水的电离,外加的少量强碱不会使溶液中的[H3O+]发生明显变化,且溶液中由于增加了强电解质NaHC2O4而具有较大离子强度,亦可抑制H3O+的活动能力,所以在滴定开始时具有很高的缓冲容量.随着滴定进行,消耗H2C2O4,生成NaHC2O4,(H2C2O4)减小,(HC2O4-)增加,缓冲比(HC2O4-)/[H2C2O4]逐渐增大并偏离1,缓冲容量减小.滴定直至出现一个不明显的小突跃,此时对应的pH=2.65,H2C2O4尚未完全转化为NaHC2O4,生成的NaHC2O4又立即与NaOH作用生成Na2C2O4,溶质主要为NaHC2O4,还有少量H2C2O4和Na2C2O4.对应图9,(HC2O4-)≈0.93,(H2C2O4)≈0.02,(C2O42-)=0.02,“第一终点”时的缓冲比达到最大值,缓冲容量最小,但仍存在少量的H2C2O4和Na2C2O4,依旧能与大量的NaHC2O4共存,形成H2C2O4-NaHC2O4和NaHC2O4-Na2C2O4两组缓冲对,共同发挥缓冲作用.因此,虽然缓冲容量很小,但没有完全失去缓冲作用.

图6 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4V-pH图
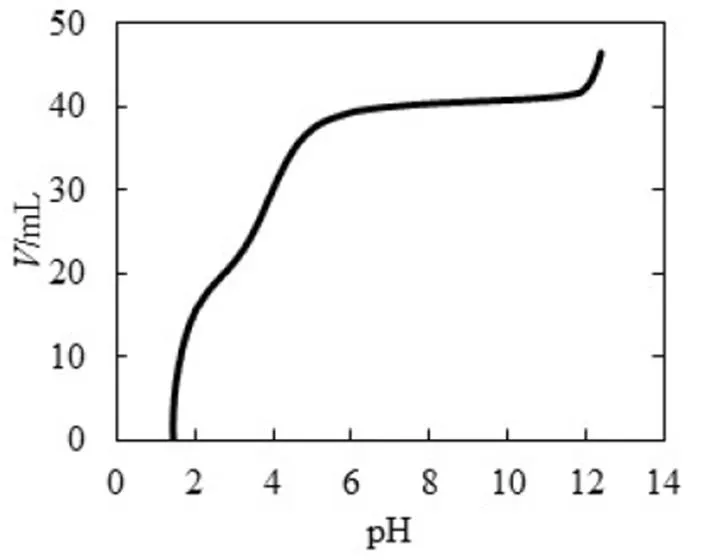
图7 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4 pH-V图

图8 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4β-pH图
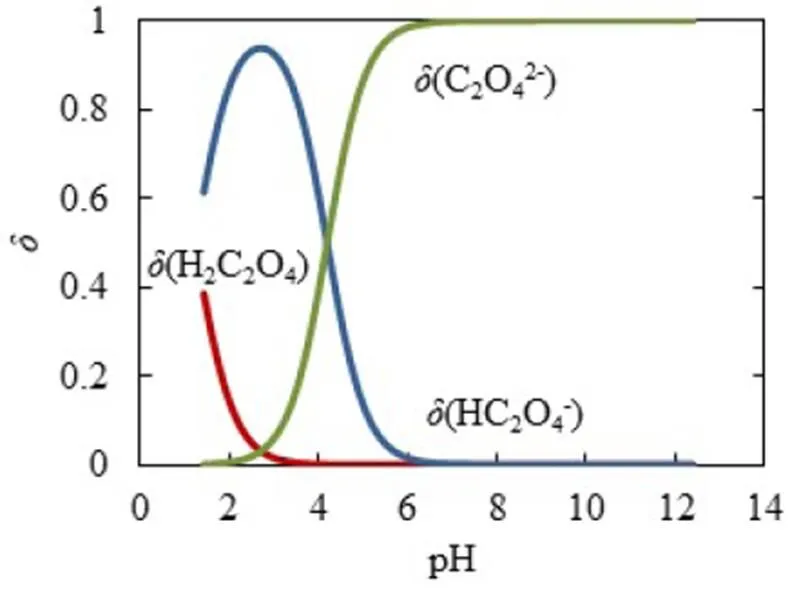
图9 H2C2O4型体分布分数δ-pH图
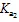
3.3 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4

同理,为了方便对照分析,将图10的纵坐标与横坐标对调,得到-pH图(见图11),再通过式(2)得到-pH图(见图12),最后通过公式(13)~(16)得到型体分布分数-pH图(见图13).滴定开始时,由于H3PO4是中强酸,会电离出H+,生成H2PO4-,pH约为1.37,由图13可以看出,(H3PO4)≈0.85,(H2PO4-)≈0.15,组成缓冲溶液,开始滴定,图11的pH变化比较平缓,图12的缓冲容量较大.在H3PO4溶液中,[H3O+]本来就很高,会抑制水的电离,外加的少量强碱不会使溶液中的[H3O+]发生明显变化,且溶液中增加了强电解质NaH2PO4而具有较大离子强度,亦可抑制H3O+的活动能力,所以在滴定开始时具有很高的缓冲容量.随着滴定的进行,(H3PO4)减小,(H2PO4-)增大,缓冲比[H2PO4-]/[H3PO4]先接近1,再偏离1,并增大,缓冲容量减小,直至H3PO4完全反应生成NaH2PO4,出现第一突跃,pH=4.35,滴定产物为NaH2PO4,(H3PO4)≈0,(H2PO4-)≈1,失去缓冲能力,缓冲容量最小.

图10 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4 pH-V图

图11 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4V-pH图

图12 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4β-pH图

图13 H3PO4型体分布分数δ-pH图


4 结语
手持技术数字化实验设备中的pH传感器和滴数传感器用于NaOH滴定HAc,H2C2O4,H3PO4,获得大量实验数据,整理并绘制出pH-图、-pH图和-pH图,实验操作简便,药品取用和配制方便.学生可以从-pH曲线了解缓冲容量随着pH变化的动态变化规律以及通过-pH曲线解释其变化原因.这样的呈现结果更为丰富、清晰、直观,能够很好地补充和丰富教材知识,将缓冲溶液和酸碱滴定这两部分知识结合在一起,保证知识的完整性,有助于学生理解缓冲溶液的组成,掌握缓冲比对缓冲能力的影响,形象地理解酸碱滴定过程中各阶段曲线变化的原因.
手持技术无论是在实践层面还是理论层面,都有不少的研究成果[9],在华南师范大学钱扬义教授的推动下,手持技术数字化实验在中学化学领域中已经取得相当显著的成效[10].大学化学的知识很大部分是基于中学化学的学习之上,同样手持技术也可以在大学化学实验中得到很好的应用,这能让学生了解这一类先进、便捷的实验技术,开拓学生的思维,激发学生对化学学习的兴趣,培养学生对化学学科研究的热情,并在化学、物理、生物、医学、技术等学科领域加深学生对概念的理解[11].
[1] 李雪华,陈朝军.基础化学[M].9版.北京:人民卫生出版社,2019:226-233.
[2] 方皓文,开小明.混合弱酸溶液缓冲容量计算[J].安庆师范大学学报(自然科学版),2017,23(1):75-77.
[3] 雷玉富,开小明.缓冲容量精确计算[J].广州化工,2016,44(1):131-132.
[4] 陈鲜丽,郑锋华.共轭酸碱对缓冲能力大小影响因素实验初探[J].大学化学,2012,27(3):80-83.
[5] 陈德成,钱扬义,黄倩莹,等.利用手持技术与T形玻璃管探究钠与空气中的氧气反应[J].化学教育(中英文),2022,43(9):76-85.
[6] 陈常兴,秦子平.医用化学[M].8版.北京:人民卫生出版社,2019:18.
[7] 任健敏,韦寿莲,刘梦琴,等.分析化学[M].北京:化学工业出版社,2014:56-59.
[8] 王同为.组成确定缓冲溶液中缓冲能力最强的分析[J].大学化学,2021,36(6):213-215.
[9] 俞真蓉,田涛,李峰伟.“手持技术”与化学教学整合的文献统计分析[J].化学教育(中英文),2017,38(9):74-81.
[10] 麦裕华,钱扬义.“中学化学手持技术数字化实验案例”的多维分析:以钱扬义工作室20年研究的期刊论文为例[J].化学教育(中英文),2020,41(19):83-89.
[11] 马善恒,王后雄,刘正宇.中学化学手持技术数字化实验研究的演进及展望[J].化学教育(中英文),2020,41(17):112.
Exploring the changes of buffering capacity during acid-base titration by using handheld technique
ZHENG Haipeng1,ZHONG Ming2,CHEN Xianli1,ZHENG Lan1
(1. School of Chemistry and Civil Engineering,2. Medical College,Shaoguan University,Shaoguan 512005,China)
Aiming at the learning content of acid-base titration in the basic chemistry course of Shaoguan University,based on the acid-base titration,the change diagram of the buffer capacity of the solution during the titration process was drawn,and the change of the buffer capacity of the solution during the acid-base titration process was discussed in combination with the knowledge of the distribution fraction.The knowledge of acid-base titration and buffer capacity can deepen the understanding of acid-base titration by undergraduates majoring in clinical medicine.The acid-base titration experiment was designed by using the pH sensor and the drop sensor in the handheld technology experimental equipment.The HAc,H2C2O4and H3PO4solutions were titrated by NaOH solution,and the corresponding pH-curve and-pH curve were drawn.The-pH curve was used to explain the change of buffer capacity,and the change of buffer capacity in the titration process was analyzed,which was helpful to deepen the students′ understanding of acid-base titration and buffer solution.
handheld technology;pH sensor;drop sensor;titration curve;distribution fraction;buffer capacity
O65∶G642.0
A
10.3969/j.issn.1007-9831.2024.01.018
1007-9831(2024)01-0097-08
2023-09-08
韶关学院第二十四批(2023年度)校级教育教学改革研究项目(SYJY20231030)
郑海鹏(1994-),男,广东韶关人,助教,硕士,从事化学教学研究.E-mail:pengge5820@qq.com
钟鸣(1985-),男,广东韶关人,讲师,硕士,从事抗流感病毒药物合成和生物学研究.E-mail:13580104368@163.com
