香水莲花开花过程中花色变化规律研究
2024-02-21周琦赵峰张慧会祝遵凌汤鹏
周琦 赵峰 张慧会 祝遵凌 汤鹏

关键词:香水莲花;花色变化;花青苷;黄酮;生理指标
睡莲属(NymphaeaL.)是睡莲科最大的属,种类繁多,包括热带睡莲和耐寒睡莲两大类型,共约50个种,广泛分布于欧亚大陆、美洲、非洲和大洋洲等地区。睡莲为多年生水生植物,是园林水体绿化、美化和净化的主要水生花卉之一[1]。睡莲属植物花色丰富,目前关于其花色研究主要集中于部分种和品种的花色素组成及生物合成途径[2-4]、花色遗传与育种[5-6]等方面。相比于耐寒睡莲,热带睡莲具有更为丰富的花色,其观赏性更高,因此,进一步开展热带睡莲类植物的花色研究,探索其花色变化规律,对创新睡莲花色育种具有十分重要的意义。
香水莲花(Nymphaeahybrid),为热带大型睡莲,是睡莲属中的新优植物。20世纪70年代,我国园艺工作者在引进美国香莲的基础上,进行多年的杂交选育,培育出红、黄、粉、紫等多个花色品系,经研究人员鉴定为Nymphaeahybrid[7]。其花朵硕大、色彩丰富、花香怡人,深受人们喜爱,是非常珍贵的观赏水生花卉。香水莲花除了拥有较高的观赏价值外,还在医药、工业、食品、化妆品等领域也具有十分重要的实用价值;同时,香水莲花还是美化净化水体的良好材料,是兼具观赏、经济和生态价值的多功能植物[8]。
花色和花香是香水莲花最为突出的两大重要园艺性状,其中,花色改良一直是园艺学家的研究重点。目前,关于香水莲花的研究主要集中在栽培技术[9]、繁殖特性[10-11]、生物活性物质提取及功效[12-13]、花香物质成分[14-15]等方面。在香水莲花花色方面,周琦等[16]对其色素成分及含量进行了初步研究,并探索了花色素的稳定性[17]。香水莲花虽然花色丰富,但关于其花色形成方面的深入研究报道还较为缺乏。本研究对不同颜色香水莲花花瓣在不同发育时期中的花色参数变化趋势及花色分布特征进行研究,重点分析了香水莲花开花过程中花瓣的色素含量、pH、可溶性糖(solublesugar,SS)和可溶性蛋白(solubleprotein,SP)含量、苯丙氨酸解胺酶(phenylalanineammonialyase,PAL)和查尔酮异构酶(chalconeisomerase,CHI)活性等生理指标的变化情况,以期揭示香水莲花花色变化规律,找出影响其不同花色表达的关键因素,为后期香水莲花的花色育种和杂交选育提供理论依据。
1材料与方法
1.1材料
供试材料:香水莲花材料采自厦门香水莲花种质资源圃,共4个不同颜色,包括香水莲花白色品系中的白花型香水莲花(白色)、黄色品系中的黄花型香水莲花(黄色)、紫色品系中的紫花型香水莲花(紫色)和粉色品系中的粉花型香水莲花(粉色),在本研究中,分别简称为白色香水莲花、黄色香水莲花、紫色香水莲花和粉色香水莲花,其中,以白色香水莲花为对照。将香水莲花的花期分为:S1(花蕾期,花瓣完全被萼片包裹,花蕾紧实)、S2(初花期,花朵初开,雄蕊不可见)、S3(盛花期,花朵完全开放,雄蕊可见)、S4(末花期,花朵即将凋谢,雄蕊发黑)4个时期(图1)。不同花色香水莲花种植条件均一致。
采样条件:于晴天上午8:00,温度为26℃左右,露水刚干时,采集对应开花时期的香水莲花花瓣,每个花色香水莲花3次重复,每个重复取花5朵,取花朵由外至内的第三轮花瓣,将花瓣立即用锡箔纸包好,液氮保存,然后置于–80℃冰箱保存备用。
1.2方法
1.2.1花色表型测定不同颜色香水莲花4个时期花瓣采集后立即进行花色测定。采用2种方法:(1)使用英国皇家园艺学会比色卡(RoyalHorticulturalSocietycolorcard,RHSCC)与香水莲花新鲜花瓣的中间部位颜色进行对比;(2)使用国际照明委员会(CIE)制定的CIEL*a*b*表色系统实现花色的数字化测定,即使用色差仪(3nh分光测色仪YS3010,深圳三恩时科技有限公司)测定花色的明度L*值、色相a*、b*值,并计算彩度c*和色相角h[18]。c*=(a*2+b*2)1/2,h=arctan(b*/a*),其中,c*值表示到L*轴的垂直距离,距离越大,表示彩度越大。每朵花的测定位置为花瓣上表皮的中间部分,每朵花测5个花瓣,总共测5朵花,取平均值。
1.2.2花瓣显微结构与色素分布观察(1)光学观察。在洗净的培养皿中倒入少量蒸馏水,将新鲜香水莲花的花瓣放置于操作台当中,手指均匀用力,压住花瓣,在花瓣切割处均匀地滴水,使材料保持湿润,用另一只手夹紧两片刀片,匀速划过花瓣,即可得到香水莲花花瓣切片,使用镊子小心夹取切片放置于干净的载玻片上,滴一滴清水,再盖上盖玻片,清理掉载玻片和盖玻片周围的水渍后,将切片移到显微镜下观察。用目镜和物镜均为10倍镜的电子显微镜进行观察和拍照。
(2)扫描电子显微镜。选取不同香水莲花花瓣,用蒸馏水冲洗干净之后,用刀片把花瓣切成5mm×5mm左右的小方块。然后进行以下处理:首先用FAA固定液进行固定;然后在梯度酒精中脱水;再用醋酸異戊醛渗透;渗透后的花瓣放置于干燥器中进行干燥;再将干燥好的花瓣材料用尖头镊子小心地粘贴在样品台上,进行离子溅射镀金;最后将镀金后的材料放置于20KW电压下,用Quanta200型扫描电镜观察、拍照。
1.2.3类黄酮色素测定(1)色素的提取。称取1.0g香水莲花花瓣,加入液氮快速研磨成粉末,再加入体积比为70%的甲醇溶液,在20℃条件下继续超声提取20min,继而用离心机于4℃、10000r/min的条件下离心10min,取上清液。对样品继续提取2次,得提取液10mL。将抽提液混合,使用0.22μm孔径的尼龙微孔滤器过滤,然后保存于–80℃的冰箱中,用于香水莲花花色素的HPLC-MS分析。
(2)HPLC分析。色素提取液样品使用戴安(DionexHPLC-DAD)系统分离分析,色谱柱为TSKgelODS-80TsQA反相硅胶柱(4.6mm×250mm)。分析条件:流速0.8mL/min,柱温35℃,进样量为10μL,在200~800nm范围内全波长扫描吸收光谱,525nm波长下检测花青素苷,350nm波长下检测黄酮类化合物。流动相A相为10%的甲酸水溶液(含有0.1%TFA,V/V);B相为0.1%甲酸乙腈溶液。洗脱程序:0min,8%B;15min,18%B;25min,23%B;45min,40%B;50min,8%B。
(3)花色素的定量分析。采用标准品半定量法计算总花青苷(totalanthocyanin,TA)和总黄酮(totalflavonoids,TF)的含量,单位均为μg/g[19]。测定TA的标准品为矢车菊素-3-O-葡糖苷(Cyanidin-3-Oglucoside,Cy3G),测定TF的标注品为芦丁(芸香叶苷:C27H30O16·3H2O)。每个处理3次重复。
1.2.4其他生理指标测定细胞pH测定,参照张超等[20]的方法,略有改动。SS含量采用蒽酮比色法测定[21],稍有修改;SP含量采用考马斯亮蓝染色法测定[22]。PAL和CHI酶的提取与测定参照王惠聪等[23]的方法,并略做修改。
1.3数据处理
用Excel2011软件对原始数据进行基础处理,用SPSS22.0統计软件对试验结果进行显著性检验和方差分析。
2结果与分析
2.1不同花色香水莲花不同花期花色变化分析
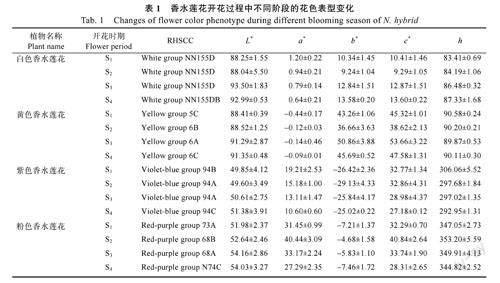
为了客观评价香水莲花的花色,使用RHSCC和CIEL*a*b*表色系统来评估不同颜色香水莲花各项花色指标,供试的4种香水莲花在4个不同开花期的形态及花色变化如图1,花色表型测定结果见表1。
由图1和表1可以看出,白色香水莲花花色RHSCC值在开花过程中几乎没有变化;黄色香水莲花在S3期色彩饱和度较高,到S4期色彩变淡;紫色香水莲花在开花过程中花色RHSCC值从S1期的Violet-bluegroup94B变到S4期的Violet-bluegroup94C;粉色香水莲花的RHSCC值在开花过程中的变化也不明显,但到S4期花色也逐渐变淡。
CIEL*a*b*表色系统的色值参数中,L*反映了花色的明度,L*值越低则越接近黑色,越高则越接近白色。由表1可看出,4个香水莲花L*值的变化范围为49.60~93.50,黄色和白色香水莲花的L*值较高,而紫色香水莲花的L*值最低;随着花瓣的逐渐开放,不同颜色香水莲花L*值逐渐增加,且S3期和S4期与S1期差异明显,说明花瓣的亮度逐渐增加。a*的正值和负值分别代表红度和绿度,b*的正值和负值分别代表黄度和蓝度。由表1可知,与黄色和白色香水莲花相比,紫色和粉色香水莲花的a*值较高,黄色的a*值最低;而通过b*值可以有效区分紫-红色系和黄-白色系香水莲花,紫色和粉色香水莲花的b*值在负值范围内浮动;随着花瓣的逐渐开放,紫色和白色的a*值逐渐减小,说明红度减小;粉色的a*值先增加后减小,黄色香水莲花的a*值呈上升趋势;紫色和白色香水莲花的b*值在S1期减小,之后逐渐增加,而粉色和黄色b*值则呈相反趋势。彩度c*用于描述色彩的饱和度,即色彩远离灰度的程度。香水莲花c*值变化范围为9.29~53.66,其中白色香水莲花c*值最小。色相角h用于描述色调(红、黄、蓝等),红色调h值在0°(360°)附近,黄色调h值在90°附近,蓝色调分别在270°(-90°)附近。香水莲花h值的变化范围为83.41~353.2,与CIEL*a*b*色彩空间中对应的各种颜色色相角分布范围大致相同,h值大小依次为:白色<黄色<紫色<粉色。
2.2香水莲花花瓣显微结构与色素分布
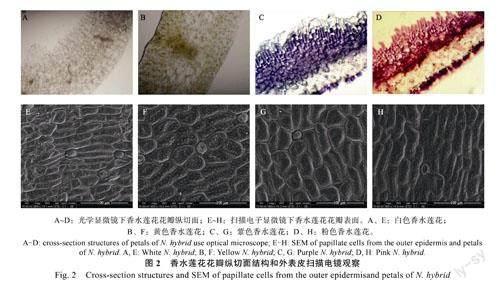
植物的花色素主要存在于花瓣的上下表皮细胞中,部分色彩较深的花瓣中,其叶肉组织或海绵组织也会含有一些色素。阳光照射到花瓣上时,含色素的细胞层数越多,花瓣能够吸收的光线也就越多,花瓣颜色更深。此外,花瓣的表皮细胞形状也会对花瓣的视觉效果产生一定的影响。不少被子植物的花瓣表皮细胞为凸起状,这种表型特征能够反射入射光,增加色素对光的吸收,使颜色加深;而有些植物的表皮细胞为扁平状,这种结构会产生更多的反射光,使植物的花色变淡。因此通过解剖学方法,分析花瓣的物理结构对香水莲花花色形成的影响。
观察香水莲花花瓣的徒手切片发现(图2A~图2D),香水莲花花瓣纵切面的结构特征较为典型:包括上、下表皮组织、栅栏组织及海绵组织。黄色、紫色和粉色香水莲花的呈色物质主要分布于上下表皮细胞及栅栏组织和海绵组织之中,且上表皮含色素的细胞层明显比下表皮厚;而在白色香水莲花花瓣中,几乎未看到色素物质(图2A),说明形成白色花的原因可能是由于花瓣细胞中的气泡对入射光线产生折射,这是一种光学现象。不同香水莲花花瓣中积累显色物质的细胞层数也存在差异,含色素细胞层越厚,显示的颜色越深,对应的L*明度值越低。
通过SEM进一步研究香水莲花花瓣表皮细胞形状和花色之间的潜在关系。由图2E~图2H发现。在所测的4种香水莲花花瓣中,表皮细胞的形状相似,均为不明显的褶皱形状,反映的光吸收特性较为相似;只有白色香水莲花的花瓣略微有别于其它材料,表面的颗粒状突起较少。说明表皮细胞形状可能与香水莲花花色变异有关,但不是关键性因素。
2.3不同花色香水莲花花瓣花色素变化
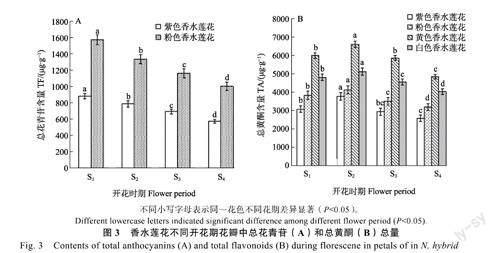
2.3.1不同花色香水莲花TA含量变化根据HPLC分析,在白色和黄色香水莲花中未检测出花青苷成分。对紫色和粉色2个香水莲花在不同发育期花瓣中的花青苷含量进行定量分析,结果如图3所示。由图3A可以看出,紫色和粉色香水莲花TA总量在4个开花时期逐渐减小,不同时期差异显著(P<0.05)。在S1期含量最高,紫色、粉色香水莲花TA含量分别达886.51、1583.38μg/g;而进入S4期,TA含量显著下降,紫色、粉色香水莲花TA含量分别比S1期下降了34.76%、36.34%。粉色香水莲花TA含量在不同时期均显著高于紫色香水莲花。
2.3.2不同花色香水莲花TF含量变化4个香水莲花品系不同发育时期花瓣中TF含量如图3所示。由图3B可以看出,不同颜色香水莲花的TF含量相差明显,变化范围为2622.29~6051.50μg/g,且随着香水莲花开花进程的推进,4种花色香水莲花花瓣中TF含量变化趋势一致,呈先上升后下降的趋势,S1~S2期不断上升,S2~S4期不断下降,S4期TF含量均显著低于S1期和S2期。不同花期,黄色香水莲花的TF含量均高于其他3个品系,白色香水莲花其次,紫色香水莲花的TF含量最少。
2.4香水莲花花瓣细胞液pH变化
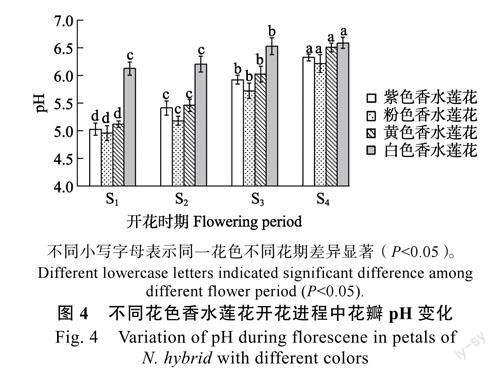
由图4可知,不同花色香水莲花在开花过程中花瓣细胞液的pH均低于7.0,在酸性范围内,且随着花期推进,pH呈不断上升的趋势。其中,白色香水莲花花瓣pH在S1期和S2期差异不显著,S3期和S4期差异显著,且在不同花期均高于其他花色香水莲花;紫色和粉色香水莲花的pH介于4.96~6.32之间,在开花各阶段均差异显著;不同花色香水莲花在S4期,pH均达到最大值,且与其他时期差异显著。
2.5香水莲花开花过程中SS和SP含量变化
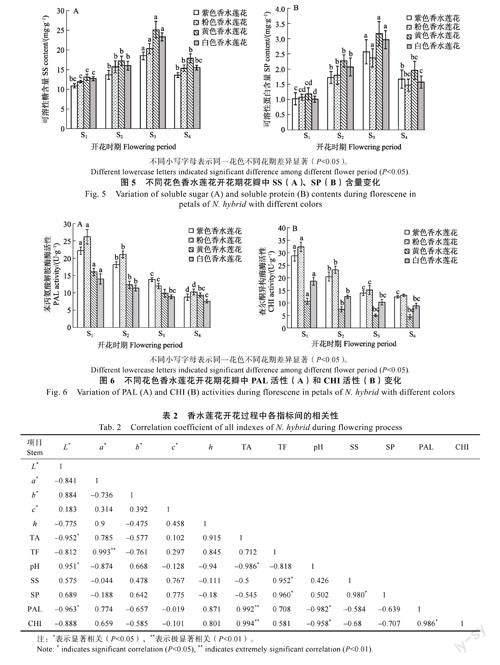
不同花色香水莲花SS和SP含量变化情况如图5所示。由图5可以看出,两指标随花期变化在不同花色香水莲花的变化趋势相似,总体均呈先上升后下降的趋势,从S1期到S3期逐渐增加,到S4期显著下降。S3期,紫色香水莲花SS含量顯著高于其他时期,达18.6mg/g;黄色香水莲花花瓣中SS含量最高,为25.2mg/g,比紫色高35.48%。在不同花期,SP含量在S1期含量均最低,在S3期达到峰值;其中,黄色香水莲花SP含量均高于其他花色香水莲花,比粉色香水莲花高33.3%。
2.6香水莲花开花过程中PAL和CHI活性变化
不同花色香水莲花开花过程中PAL酶和CHI酶活性变化如图6所示。由图6可知,PAL酶和CHI酶活性随花期不断降低,在S1期活性最高,S4期活性最低,变化趋势一致。其中,从S1~S3时期,PAL酶活性在紫色和粉色香水莲花中高于黄色和白色香水莲花;紫色、粉色、黄色和白色香水莲花PAL酶活性在S4期比S1期分别下降60.27%、60.53%、41.38%和45.50%,差异显著。在不同花期,黄色香水莲CHI酶活性花均低于其他花色香水莲花,从S1期到S2期,CHI酶活性显著下降,从S3期至S4期,CHI酶活性下降幅度趋于平缓,差异不显著。
2.7香水莲花开花过程中各指标间的相关性
对不同花色香水莲花开花过程中花瓣各指标之间相关性进行分析,结果见表2。由表2可知,明度L*与TA和PAL呈显著负相关关系,而与pH呈显著正相关,a*与TF呈极显著正相关(P<0.01),说明花青苷含量越低,花瓣的亮度越高,花青苷含量的高低直接影响花瓣颜色的深浅;TA与pH呈显著负相关,而与PAL、CHI呈极显著正相关关系,说明酸性环境有利于花青苷的合成与稳定,PAL和CHI酶对香水莲花花色的形成具有促进作用;SS、SP与TF关系显著,但与其他指标之间的关系不显著;PAL与CHI二者呈显著正相关。综合各指标间的相关性分析结果表明,香水莲花花色变化受多因素共同影响,且各指标间的关系存在差异。花青苷和黄酮的含量影响香水莲花花色的形成,同时pH、SS、SP、PAL和CHI酶活性通过参与开花过程中的生理代谢,进而影响香水莲花花色的表达。
3讨论
3.1RHSCC和CIEL*a*b*表色系统与花色测量
花色是植物重要的园艺特性,也是观赏花卉植物进行品种分类的一个关键指标,而花色素是影响植物花色变化的关键因素,色素在花瓣中不均匀分布或光线的影响会使人们对植物色彩产生不同感觉的原因。通常人们会通过目测法来直观地对花色进行分类,然而由于人们对不同颜色依据的分类标准不同,且每个人在视觉上会存在差异,主观性比较大,不能准确地判定不同的花色。目前,主要有2种比较客观的色彩测定方法,分别为比色卡比色、色差仪测色。RHSCC是进行植物色彩研究时使用最为广泛的一种比色色标,其优点是使用方便、购置费用低和移动性强等,缺点是对试验者和环境的要求非常苛刻。而仪器测色则可以克服这一缺点,其精度较高,受外界环境因素影响较小,同时对色彩可以进行数字化输出,这些优势对人们深入分析颜色的帮助很大。不少仪器均使用CIEL*a*b*系统来分析花色,色差仪就是应用比较广泛的色彩测量仪器。目前,花色表型测量在荷花[24]、芍药[25]、海棠[26]等观赏植物的研究中应用十分广泛。本研究发现:随着花朵的逐渐开放,紫色和粉色香水莲花a*值较高,花蕾期L*值较低,c*值较高;到末花期L*值较高,c*值较低;而黄色香水莲花L*较高,a*值最低;黄色花在盛花期颜色最鲜艳,紫色和粉色在初花期花色较为鲜艳。在观赏海棠[26]、鸳鸯茉莉[27]等植物的开花过程中,也发现相似的花色变化趋势。白色和黄色香水莲花花色变化趋势与其他植物略有不同,其中原因可能是该2种植物花瓣内未检测到花青苷物质。
由此可见,不同植物以及同种植物的不同品种之间花色变化规律也会存在差异。对香水莲花花色评价时,在目测的基础上,结合RHSCC比色卡比色之后,能够对香水莲花花色有一个较为全面的衡量,同时结合色差仪的CIEL*a*b*表色系统对其花瓣颜色进行定量分析,通过色彩三刺激值,便可以较全面地与花瓣中所含的色素建立关系。
3.2花色素在花瓣中的分布影响花瓣呈色
香水莲花花色与其花瓣形态及花色素分布的位置等有关。花瓣是体现植物花色的最终载体器官,植物花瓣的表皮细胞形状及分布会对其花色的形成产生较大的影响,香水莲花花瓣的表皮细胞基本呈不规则褶皱突起,这种褶皱的结构增加了光入射到细胞中的比例,从而使花瓣的颜色加深,白色香水莲花的表皮突起没有其他植物明显,呈扁平状,而这种扁平的细胞却能更多地反射入射光因而使花瓣颜色变浅。花瓣表皮的这种结构与花瓣的呈色有关,紫色、粉色和黄色香水莲花的色素主要存在于上、下表皮细胞,中间栅栏组织和海绵组织只有少量色素分布,而白色花中几乎未见色素分布,这可能与其色素成分有关。程怡等[28]在月季花瓣色素分布的研究中,也发现了类似的现象,说明花瓣表皮细胞与其呈色具有一定的相关性;邓娇[29]在对莲属植物的研究中,也证实了这一结论,她发现在黄色和白色莲品种的花瓣中几乎检测不到花青素,在红色莲花瓣中观察到红色色素积累,在白色莲花中未观察到色素积累。目前,不少相关研究也发现,不同植物花瓣或苞片的上下表皮往往都含有色素,如矮牵牛[30]、杜鹃花[31]、彩色马蹄莲的佛焰苞[32]等。
3.3香水莲花花色变化与生理生化指标的关系
植物的花色是由各种因子共同作用的结果,它与花瓣内花色素的种类与含量、液泡pH、花瓣表面或内部构造引起的变化、生理指标等各种因素相关。影响植物花色的色素主要包括类黄酮、类胡萝卜素和甜菜色素,而花青苷和黄酮均属于类黄酮物质[20]。有研究发现,植物花青苷含量越高,植物色彩越鲜艳[33]。本研究发现香水莲花开花进程中,明度L*与TA呈显著负相关,同时只在紫色和粉色香水莲花中检测出含有花青苷,且总花青苷含量随花期逐渐减小,但L*值逐渐变大。进一步说明植物花青苷含量越低,花瓣的亮度越高,花青苷含量的高低直接影响不同植物的花色及其色彩的深浅。
植物花色受花瓣细胞液pH的影响,在酸性条件下呈红色,在碱性条件下表现为蓝色[27]。本研究中,不同花色香水莲花在开花过程中其花瓣细胞液的pH均发生一定变化,但均在酸性范围内。紫色香水莲花各开花阶段的pH均高于粉色香水莲花,到末花期,4种花色香水莲花的细胞液pH均达到最大值,且pH与TA含量显著负相关,而与L*呈显著正相关,说明随着pH的上升,花青苷发生降解,导致在末花期香水莲花花色变浅。在二乔玉兰的花色研究中,也发现相似的研究结果[20],进一步说明酸性环境有利于花青苷的合成与稳定。
碳水化合物的糖类物质和可溶性蛋白等营养物质是植物开花的能量和物质基础[34]。有研究发现糖类物质积累有利于花色苷合成[35],也有研究结果相反,如苹果套袋后,果实糖分含量降低,但果色加深[36]。本研究中,香水莲花开花过程中,SS和SP含量变化趋势一致,均呈先上升后下降的趋势,在S3達到峰值。相关性分析发现,SS含量与TA、TF含量无明显相关性,而SP含量与TF含量显著正相关关系。可见,SS和SP对香水莲花花色的影响作用不一致。
PAL与CHI都是类黄酮合成的关键酶[37]。关于花色苷合成与PAL酶的关系,不同学者意见不一,有研究人员认为,花色苷的合成与PAL酶活性呈正相关[38];也有研究发现PAL活性的增加与花色苷的合成并无显著关系[39]。本研究中,PAL酶和CHI酶活性随花期不断降低,在S1期活性最高,S4期活性最低;且紫色和粉色香水莲花PAL和CHI酶活性显著高于白色和黄色香水莲花。同时,发现紫色和粉色香水莲花的花青苷含量也是在S1期最高,开花后下降,S4期最低,可见PAL和CHI酶活性变化与花青苷含量的变化一致。且相关性分析也发现花青苷含量与PAL、CHI活性呈极显著正相关关系,说明PAL和CHI酶活性的提高对香水莲花花色的形成具有促进作用,PAL和CHI酶活性的高低影响不同香水莲花花色的呈现,花蕾期是香水莲花类黄酮物质合成、积累的关键时期。
以上研究表明,不同花色香水莲花开花期间花色的呈现与花瓣形态及花色素分布的位置等有关,花青苷和黄酮的含量直接影响香水莲花的花色,PAL和CHI酶的活性在一定程度上对香水莲花的呈色起到促进作用;同时pH、SS和SP则通过参与开花过程中的生理代谢,影响香水莲花花色的形成及其稳定性,进而影响不同香水莲花花色的表达。由于香水莲花不同花色的形成受诸多因素共同影响,香水莲花种源复杂,调控其花色表达和形成的基因影响较多,因此今后可以从细胞和分子等方面进一步深入探究不同花色香水莲花的花色变化机理。
