用正交试验法分析四种表面活性剂的复配性能
2024-02-20杨碧云胡卫华邱美纯纪晓虹燕道贵林学镁
杨碧云 胡卫华 邱美纯 纪晓虹 燕道贵 林学镁
拉芳家化股份有限公司,广东汕头,515041
近年来,对表面活性剂复配协同增效的研究引起了越来越多的重视,不同结构的表面活性剂组成的复配体系不仅可以形成多种多样的体相缔合结构,而且在界面可以发生协同吸附,比单一表面活性剂体系降低界面张力的力更强[1]。目前在洗去型产品中最常用的表面活性剂是阴离子表面活性剂,应用最广的有烷基硫酸酯盐、烷基聚氧乙烯醚硫酸盐和N-酰氨基酸盐类表面活性剂等。辅助表面活性剂常为非离子表面活性剂和两性表面活性剂。非离子表面活性剂在洗发水中一般起到稳泡、增稠等作用;两性表面活性剂具有良好的去污、起泡、杀菌、抑菌和柔软等性能,耐硬水,对酸、碱和各种金属离子都比较稳定,毒性低,对皮肤的刺激性小,具有良好的生物降解性,广泛应用于成人洗发香波、沐浴露,婴幼儿用品等。
正交试验设计是用于多因素多水平的一种方法,它是从全面试验中挑选出部分有典型代表的点进行试验,它是部分因子设计的主要方法,具有很高的效率,应用广泛[2]。正交试验设计方法的主要优点是能在很多试验方案中挑选出代表性强的少数几个试验方案,并且通过分析这少数试验方案的试验结果,推断出最优方案,同时还可以做进一步的分析,得到与试验结果本身有关各因素的信息[3]。
目前关于表面活性剂的不同复配比例的综合性能的研究较少,本文旨在用正交试验设计法研究市面上常用表面活性剂(月桂醇聚醚硫酸酯钠、十二烷基硫酸钠、椰油酰胺丙基甜菜碱和月桂酰肌氨酸钠)复配的最佳使用比例,探讨表面活性剂对体系的泡沫、洗后皮肤水分含量及刺激性的影响。鸡胚绒毛尿囊膜试验是一种较早被采用的体外刺激性评估方法,利用孵化的鸡蛋胚胎中期血管化透明的绒毛尿囊膜,将一定量被评估物质滴加在上面,一段时间后观察绒毛尿囊膜上的血管及其网络的形态结构、颜色和通透性的变化,结合绒毛尿囊膜蛋白质性质改变,判断其受损程度,评估受试物的刺激性[4]。
1 试验部分
1.1 试剂与仪器
试剂:RSAW ESB70/ZA,w=70%(质量分数,以下皆是),RSAW LXNS/ZA,w=94%,湖南丽臣奥威实业有限公司;TC-CAB 35AB,w=29.5%,RSAW LS30/ZA,w=30%,广州天赐高新材料股份有限公司;Citric Acid Anhydrous,w=100%,山东柠檬生化有限公司;氢氧化钠,w=100%,西陇化工股份有限公司。
仪器:电子天平,购自梅特勒-托利多仪器(上海)有限公司;多功能皮肤测试仪(MPA580);pH计,购自梅特勒-托利多仪器(上海)有限公司;恒温培养箱,购自雅马拓科技贸易(上海)有限公司;悬臂式搅拌器(LABORATORY EQUIPMENT IKA);LED高亮度冷光源照蛋器;移液枪(DRAGONLAB)。
1.2 测试方法
1.2.1 泡沫测试方法
样品泡沫性能的测定参考GB/T 13173—2021《表面活性剂 洗涤剂试验方法》中的洗涤剂发泡力的测定(Ross-Miles法)。
1.2.2 pH值的测试方法
参考GB/T 13531.1—2008《化妆品通用检验方法 pH值的测定》对本文样品进行pH值的测定,采用直测法,测试方法如下:
电极、洗涤用水和标准缓冲溶液的温度均调整至25 ℃,按照仪器使用说明校正pH计。仪器校正后,用纯水冲洗电极,用滤纸吸干将电极小心插入试样中,使电极浸没,待pH计读数稳定,记录读数。重复一次,读取两次测量数据,取平均值。
1.2.3 皮肤水分含量测试方法
测试环境:温度23.0~25.0℃,相对湿度50%~55%。功效测试方法参考QB/T 4256—2011《化妆品保湿功效评价指南》。
本次试验遵循《赫尔辛基宣言》和中国有关临床试验研究规范、法规进行。本次试验方案已经由伦理委员会审核批准。每位志愿者入选本研究前,试验人员已通过书面文字形式向其完整、全面地介绍了本研究的目的、程序和可能的风险。试验前,每位入选的受试者均已签署志愿者知情同意书。
测试方法:(1)筛选30名20-45岁人群,无严重系统疾病,无免疫缺陷或自身免疫性疾病者,无活动性过敏性疾病者,既往对化妆品无严重过敏史者,近1个月未曾使用过激素类药物及免疫抑制剂者,在皮肤测试部位没有由于瘢痕、色素、萎缩、鲜红斑痣或其他瑕疵而影响试验结果的判定者,未参加其他临床测试者[5]。选择前臂内侧作为测试部位,测试部位测试前2-3 d不能使用任何产品(化妆品或外用药品),1-3 h不能接触水。根据随机表,将两侧手臂分为对照区和样品区(对照区和样品区均应随机且均匀地出现在样本总体左右侧的其中一侧手臂),各定位3个测试区域(同侧手臂测试区域间隔1 cm),依次进行角质层水分含量测试。
(2)筛选入组后,受试者需要统一用清水清洁测试部位,用干的面巾纸擦拭干水分,在符合环境要求的房间内静坐20 min,期间不能喝水和饮料。测试部位暴露,呈测试状态放置,保持放松。
(3)用Corneometer水分测试探头测试受试者对照区、样品区的角质层水分含量值,每个区域重复测试3次,取平均值作为初始值。
(4)使用样品:将0.2 g样品涂抹于样品区域,用清水沾湿,打圈清洗20圈,用清水冲净,对照区采用同样的手法用清水清洗。
(5)功效测试:使用样品后,用干的面巾纸擦拭干水分,即时测定样品区、对照区的角质层水分含量,每个区域重复测3次,取平均值作为即时测定值。一个受试者的测试必须使用同一仪器由同一个测试人员完成,两次测量之间应清洁测试探头。
(6)数据处理:对各测试区域的测量值进行描述性统计,包括最小值、最大值、均值、标准差等。计算各测试区域即时测定值与初始值之间的差值和变化率,然后利用此变化率,统计分析产品区与空白对照区的差别。变化率为负值表示使用后角质层水含量较使用前降低。
1.2.4 鸡胚绒毛尿囊膜测试方法
(1)鸡胚的孵化:购入7 d龄内的白莱杭鸡鸡蛋,然后气室朝上放置在孵化箱的托架上,在室温20~25 ℃、相对湿度45%~70%的条件下,孵化箱内温度控制在(37.5±0.5)℃,相对湿度控制在50%~60%,进行持续孵化。
(2)样品准备:样品溶液测试前应在(37.5±0.5)℃的环境下恒温30 min。本次试验所测试样品为透明的表面活性剂溶液,10倍稀释后进行测试。
(3)对照物及制备:0.9%的NaCl溶液为溶剂对照。
(4)绒毛尿囊膜试验:试验前洗净双手并消毒。将孵化第10-14天的鸡胚取出,用LED高亮度冷光源照蛋器找出鸡胚的气室,然后用酒精消毒过的镊子尾端敲破气室上方的蛋壳,使用镊子的弯尖头剥去部分蛋壳,暴露出白色蛋膜,用滴管滴加2 mL 0.9%NaCl溶液使蛋膜湿润变透,将0.9%NaCl溶液慢慢倾出。用镊子小心撕除内膜,血管膜需完整无损。将消毒过的特氟龙O型环放在鸡胚的绒毛尿囊膜上,用微量加样器滴加30 μL测试样品溶液于特氟龙O型环内。滴加完毕后,用保鲜膜密封蛋壳缺口,小心地将鸡胚放置在37.5 ℃ ±0.5 ℃的孵化箱中继续孵化30 min,尽量避免晃动、倾斜等机械性刺激。
(5)结果观察:鸡胚孵化30 min后,取出鸡胚去掉保鲜膜,借助手电筒观察并比较环内与环外CAM血管的变化,评估环内血管损伤,必要时拍照记录每只鸡胚血管的变化,每个样品做5次试验,评分取平均值(评分为0分时,表示样品无刺激性;评分<2分,表示为微刺激性;2≤评分<4.5分时,表示为轻度刺激性;评分≥4.5分时,表示为严重刺激性),血管效应评分表见表1。

表1 血管效应评分表
2 结果与讨论
2.1 溶液配制
主表面活性剂选择使用月桂醇聚醚硫酸酯钠(AES),辅助表面活性剂选用椰油酰胺丙基甜菜碱(CAB)、十二烷基硫酸钠(K12)和月桂酰肌氨酸钠(LS30),每种表面活性剂的试验比例设置如表2所示。这是一个四水平的试验,因此要选择一张Ln(4m)型正交表,本试验共有4个因素,且不考虑因素间的交互作用,所以采用五因素四水平(L1645)的正交试验来研究四种表面活性剂的搭配比例。(注:本文中,四种表面活性剂的用量均指原料商品名的用量,结论中提及的各种表面活性剂用量也均是指原料商品名的用量。)

表2 因素水平表格
根据L1645正交试验的设计表格整理出表3的试验方案,共16组。溶液配制按照下列表面活性剂的比例进行,每组试验的溶液的pH值用柠檬酸、氢氧化钠调至5.5~6.0,每组试验均是去离子水至100%。(注:空白列中没有因素作用,用于反映随机因素所引起的误差,故不列入试验比例配置,对试验方案没有影响。)
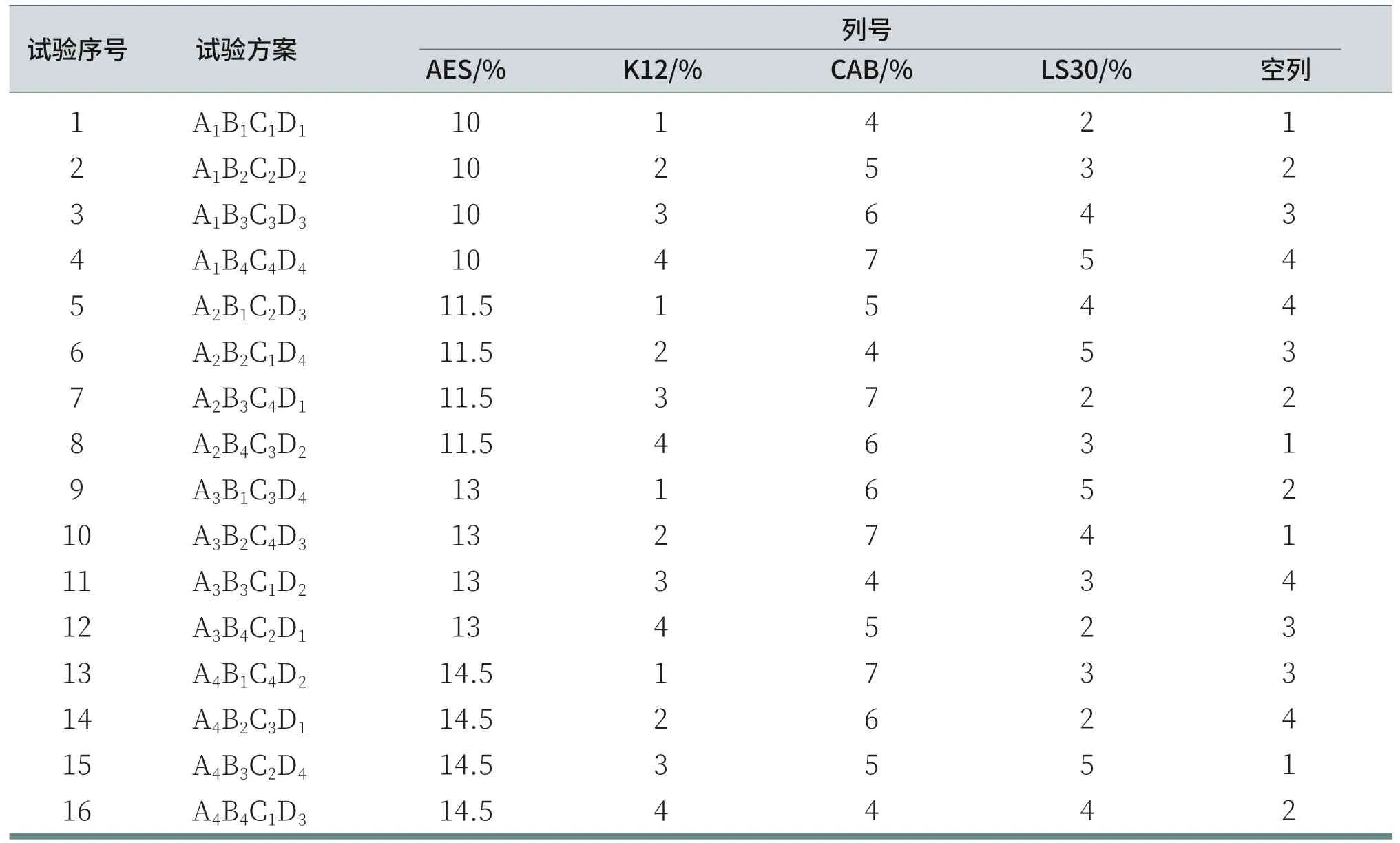
表3 四种表面活性剂的正交试验的方案
2.2 试验结果
配置好的16组溶液按上述1.2.1、1.2.3和1.2.4测试方法进行泡沫高度测试、洗后皮肤水分含量测试和鸡胚绒毛尿囊膜试验,其试验结果如表4所示。
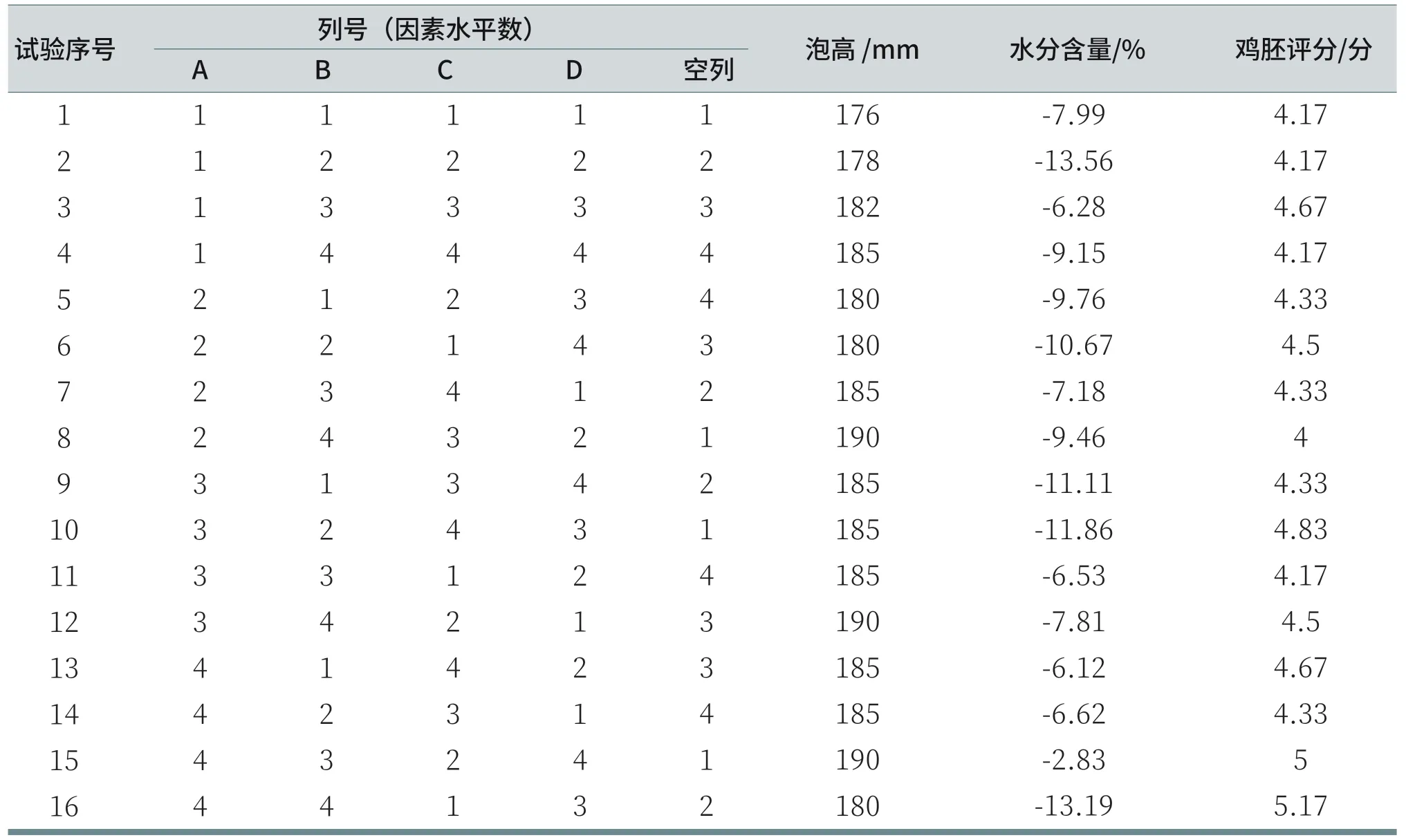
表4 试验结果汇总表
2.3 泡沫结果和分析
2.3.1 溶液活性物与泡沫高度的分析
每组溶液均进行3次泡沫高度测量,表5记录的泡高数据为每组溶液的3次起始泡沫高度的平均值。对每组溶液活性物进行估算后,由表5可知,泡沫高度数值的多少与表面活性物含量没有正相关关系。
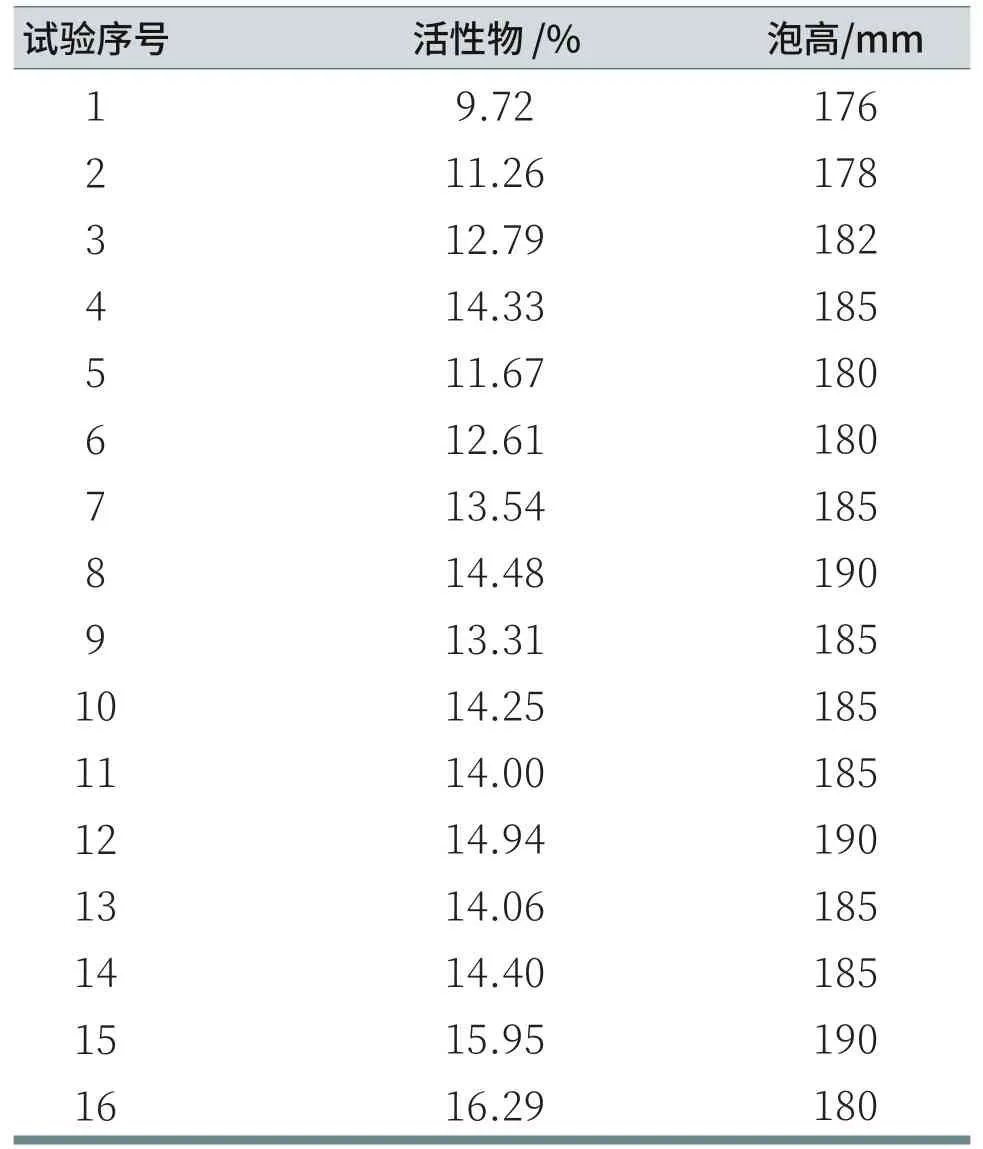
表5 溶液活性物和泡沫高度记录表
2.3.2 泡沫高度的数据分析
一般来说,各列的极差是不相等的,极差越大,表示该列因素的数值在试验范围内的变化,会导致试验指标在数值上有更大的变化,所以极差最大的那一列,就是因素的水平对试验结果影响最大的因素,也就是最主要的因素[6]。由表6可知,由于RA>RC>RB>RD,所以各因素从主到次的顺序为:AES、CAB、K12、LS30。分析各列的K值,A因素列:K3>K4>K2>K1;B因素列:K4>K3>K2>K1;C因素列:K3>K4>K2>K1;D因素列:K4>K2>K1>K3;所以,在给定的因素水平数中,泡沫高度的优方案为AES:13%,K12:4%,CAB:6%,LS30:5%。
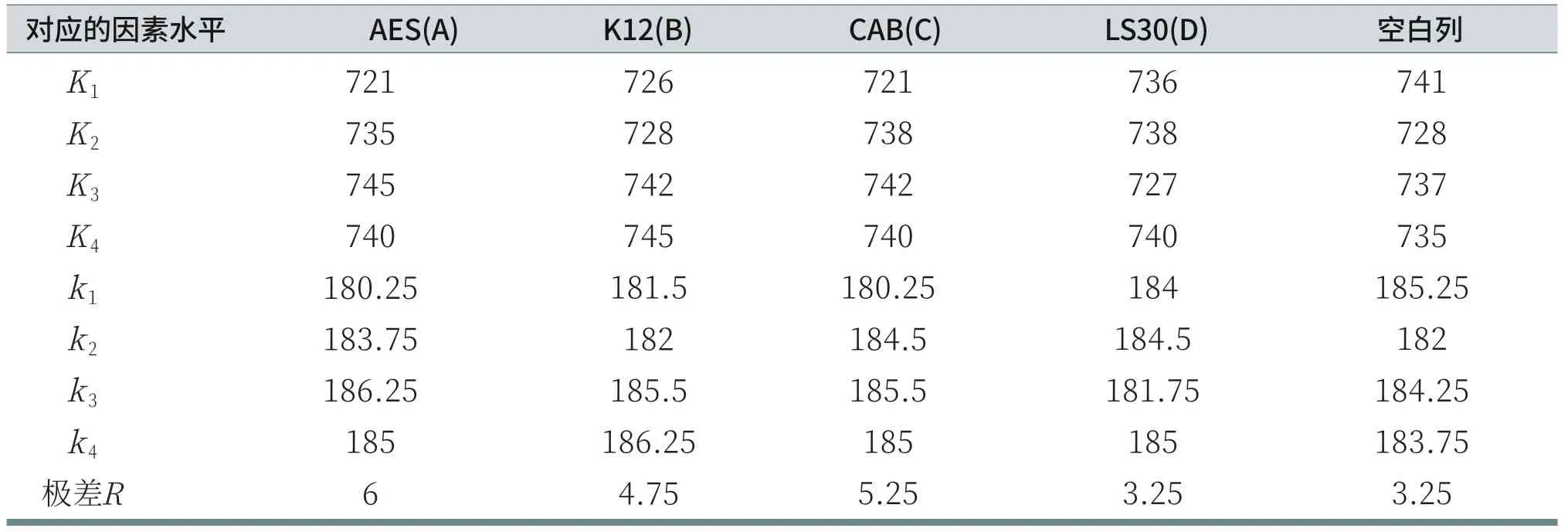
表6 泡沫高度数据分析表
对于给定的显著性水平α,检验因素A对试验结果有无显著性影响,可比较F值与临界值的大小,若FA>Fα(dfA,dfe),则因素A对试验结果有显著影响,若FA<Fα(dfA,dfe),则因素A对试验结果无显著性影响[6]。对以上数据进行方差和显著性分析,由表7可知,对于给定显著性水平α=0.16,AES对泡沫高度有显著影响;对于给定显著性水平α=0.19,K12和CAB对泡沫高度有显著影响;而LS30对泡沫高度无显著性影响。
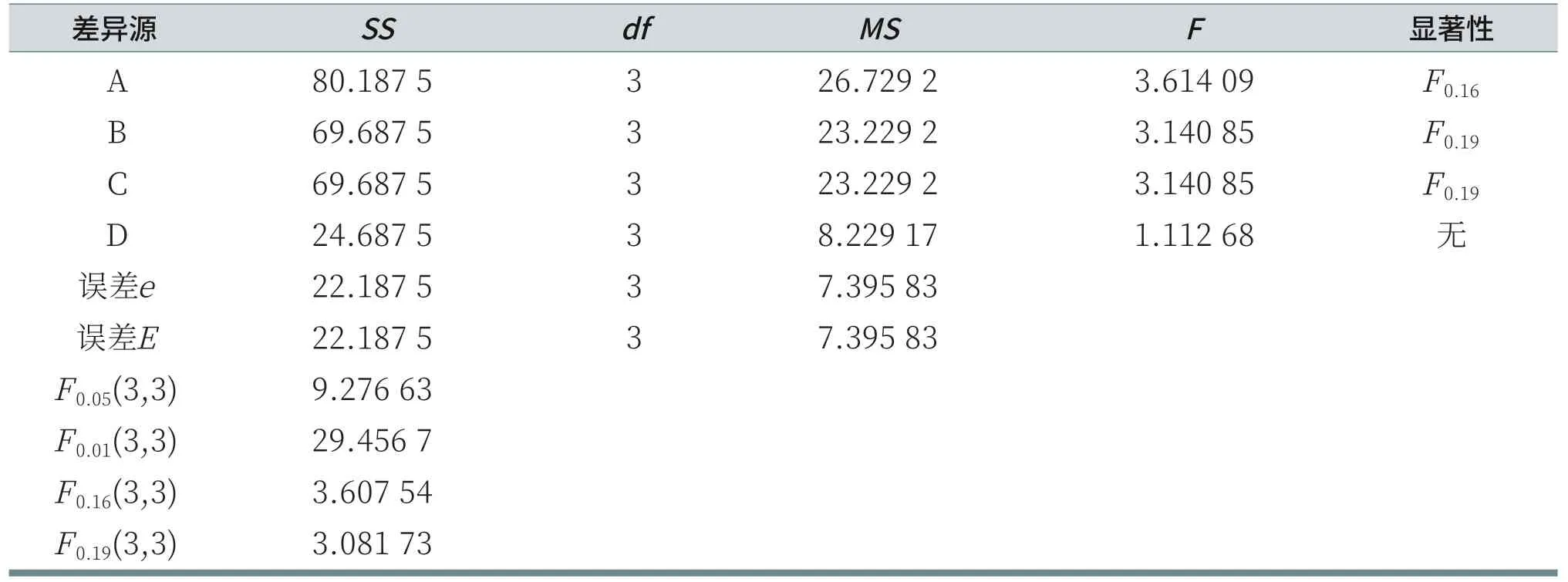
表7 泡沫高度的方差和显著性分析表
2.3.3 四种表面活性剂与泡沫高度的变化趋势
将因素水平作为横坐标,以它的试验指标的平均值ki为纵坐标,画出因素与指标的关系趋势图,从图1可知AES、K12、CAB、LS30单个因素在体系中的泡沫影响趋势。由此可以看出,随着AES的增加,泡沫高度先上升后下降,泡沫高度最高的水平是13%,随之下降,说明AES并非用量越高越好,在与K12和CAB配比时,最适宜的用量应该是13%;同样规律的还有CAB,最适宜的用量应该是6%;而K12在设置的水平内泡沫高度呈持续上升的趋势,可见并未得到最优值,LS30则无明显规律。
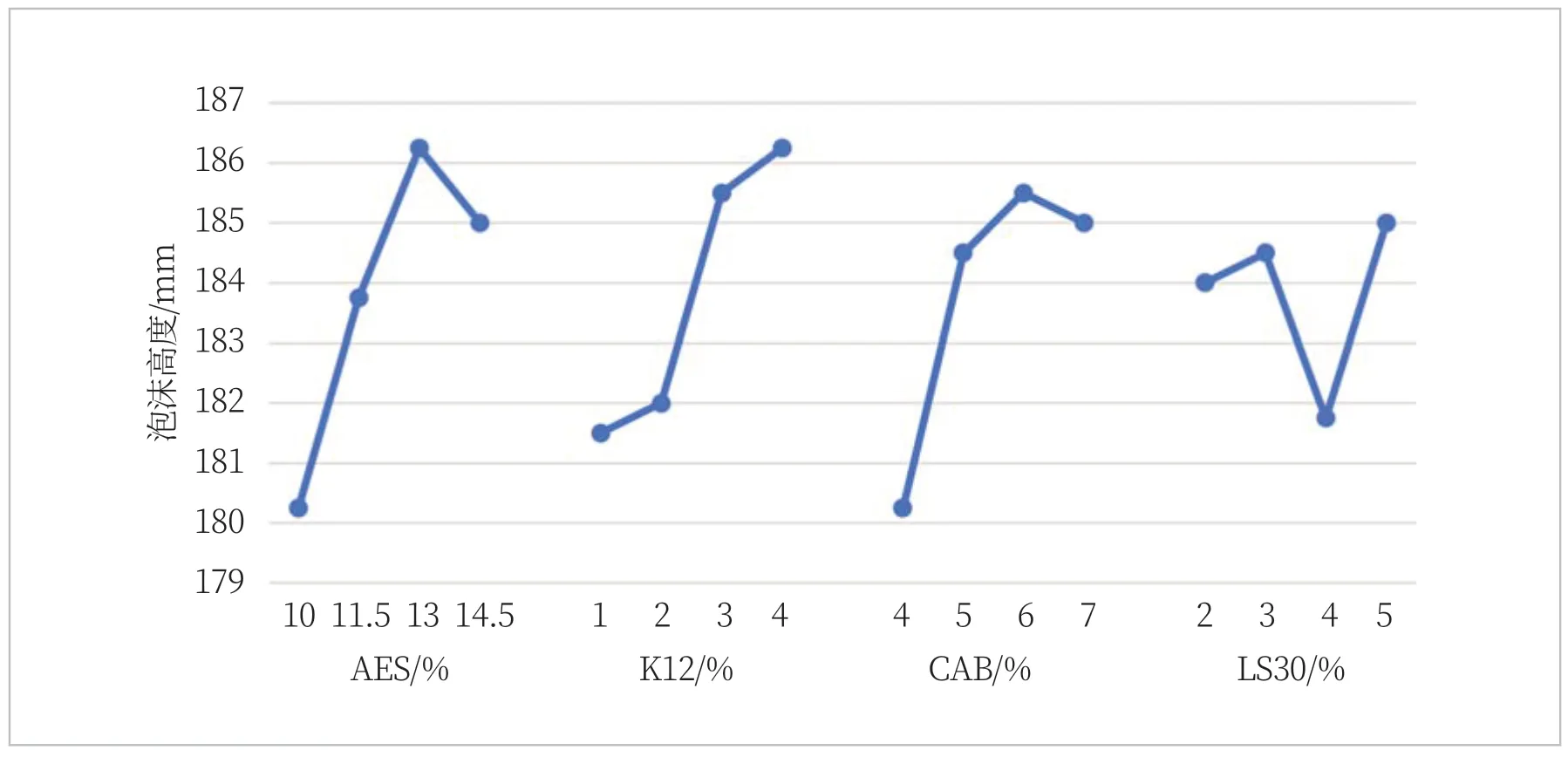
图1 四种表面活性剂的泡沫高度趋势变化
2.4 洗后皮肤水分含量结果和分析
2.4.1 洗后皮肤水分含量的数据分析
由表8可知,由于RB>RD>RA>RC,所以各因素从主到次的顺序为:K12、LS30、AES、CAB。分析各列的K值,A因素列:K4>K1>K2>K3;B因素列:K3>K1>K4>K2;C因素列:K3>K2>K4>K1;D因素列:K1>K4>K2>K3。所以,在给定的因素水平数里,洗后皮肤水分含量的优方案为AES:14.5%,K12:3%,CAB:6%,LS30:2%。但R空白列>RD>RA>RC,说明因素之间可能存在不可忽略的交互作用,或者漏掉了对试验结果有重要影响的其他因素[6],即对于洗后皮肤水分含量的测试,误差较大。由表9可知,对于给定显著性水平α=0.06时,K12对洗后皮肤水分含量有显著影响;而AES、CAB和LS30对洗后皮肤水分含量无显著性影响。
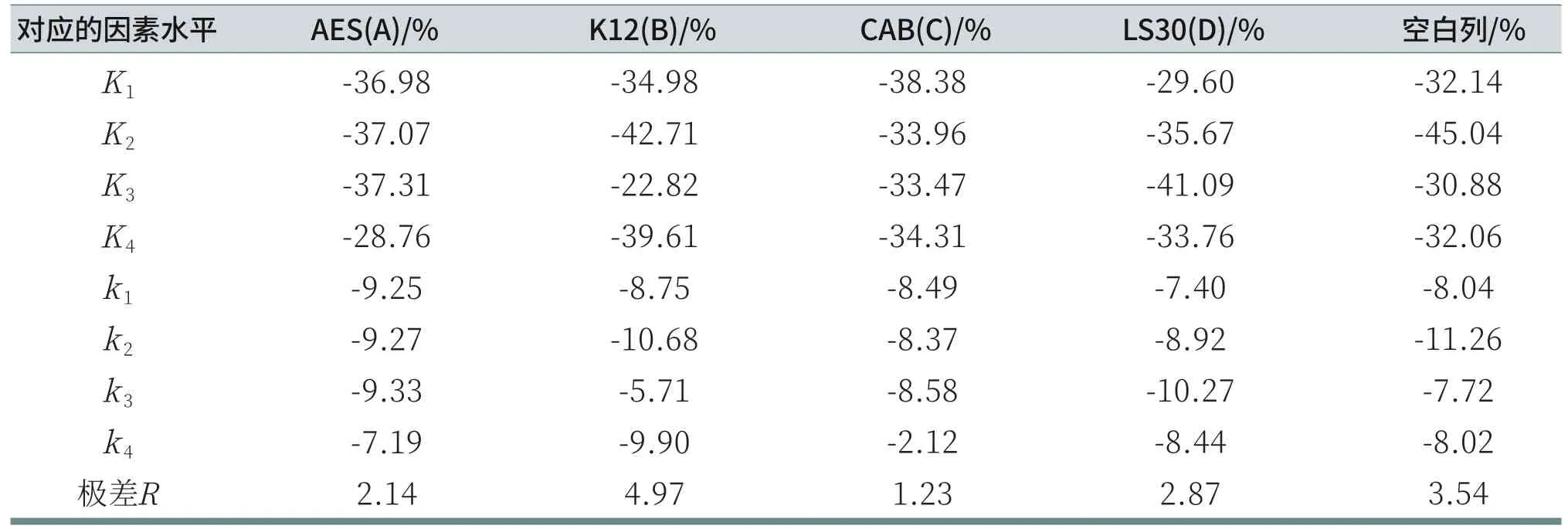
表8 洗后皮肤水分含量数据分析表
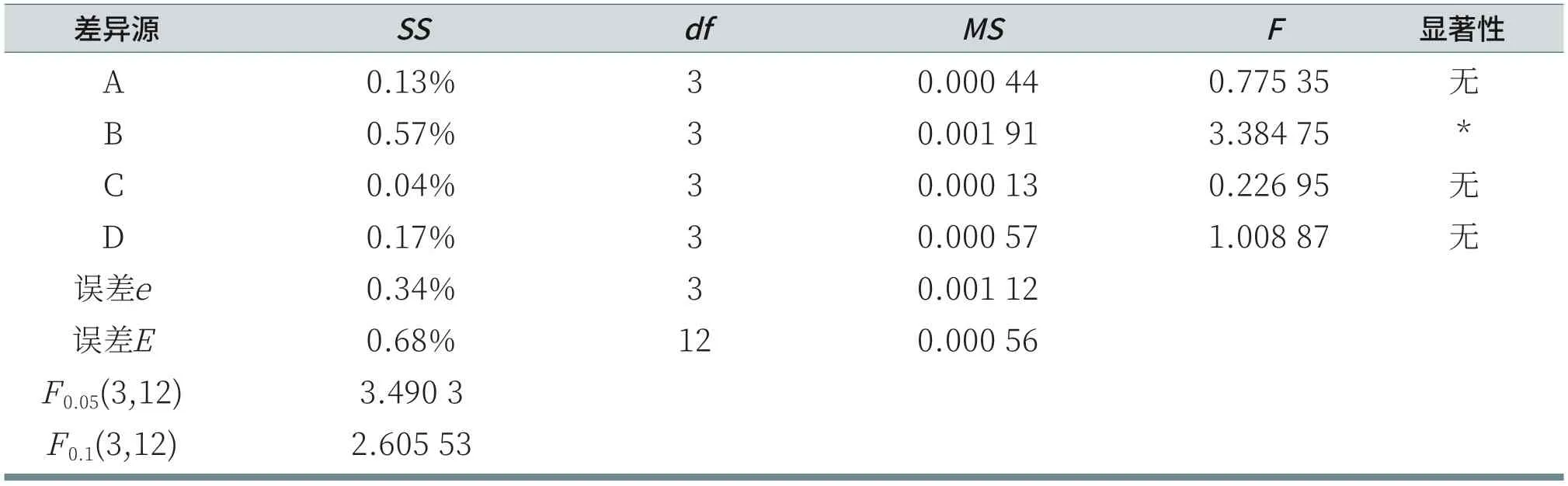
表9 洗后皮肤水分含量的方差和显著性分析表
2.4.2 四种表面活性剂与洗后皮肤水分含量的变化趋势
从上述正交试验分析可知,在设定的水平范围内,表面活性剂对洗后皮肤水分含量的影响不大,影响较为显著的是K12,但是由图2可知,K12也从后续的拟合分析中看不出明显趋势,因此可认为表面活性剂对洗后皮肤水分含量的影响不大。
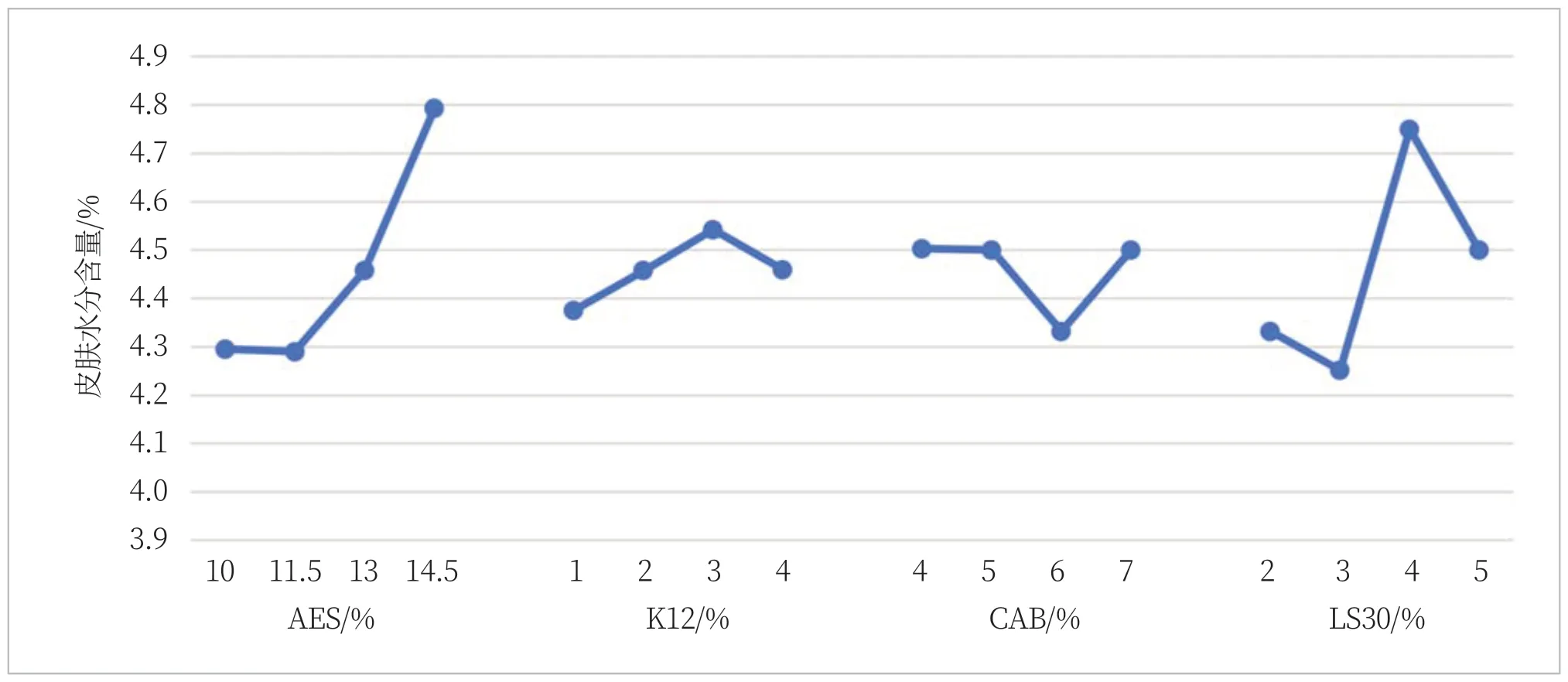
图2 四种表面活性剂洗后皮肤水分含量变化
2.5 鸡胚绒毛尿囊膜试验结果和分析
2.5.1 鸡胚评分的数据分析
由表10可知,由于RA>RD>RC>RB,所以各因素从主到次的顺序为:AES、LS30、CAB、K12。分析各列的K值,A因素列:K4>K3>K1>K2;B因素列:K3>K4>K2>K1;C因素列:K1>K2=K4>K3;D因素列:K3>K4>K1>K2。由于测试结果是评分越小,刺激性越低,所以,在给定的因素水平数里,刺激性最小的优质方案为AES:11.5%,K12:1%,CAB:6%,LS30:3%。但R空白列>RB>RC,说明K12和CAB对鸡胚评分的结果影响小,误差较大。由表11可知,对于给定显著性水平α=0.05,AES和LS30对鸡胚试验评分结果有显著影响;而K12和CAB对鸡胚试验评分结果无显著性影响。
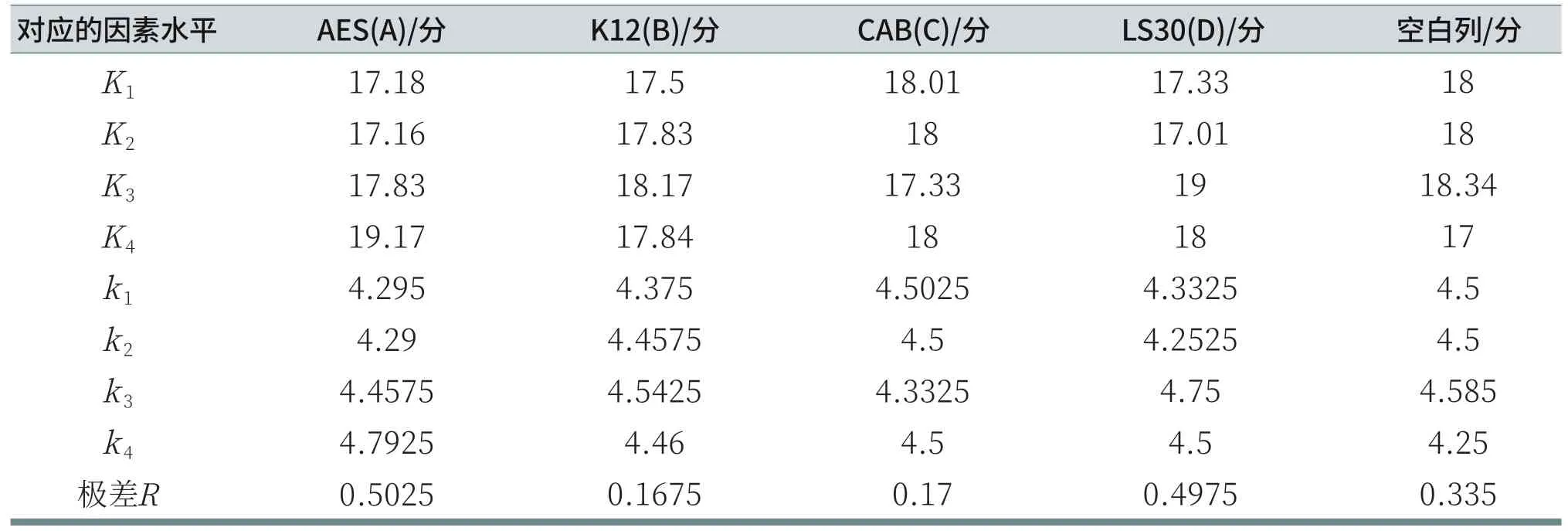
表10 鸡胚评分数据分析表
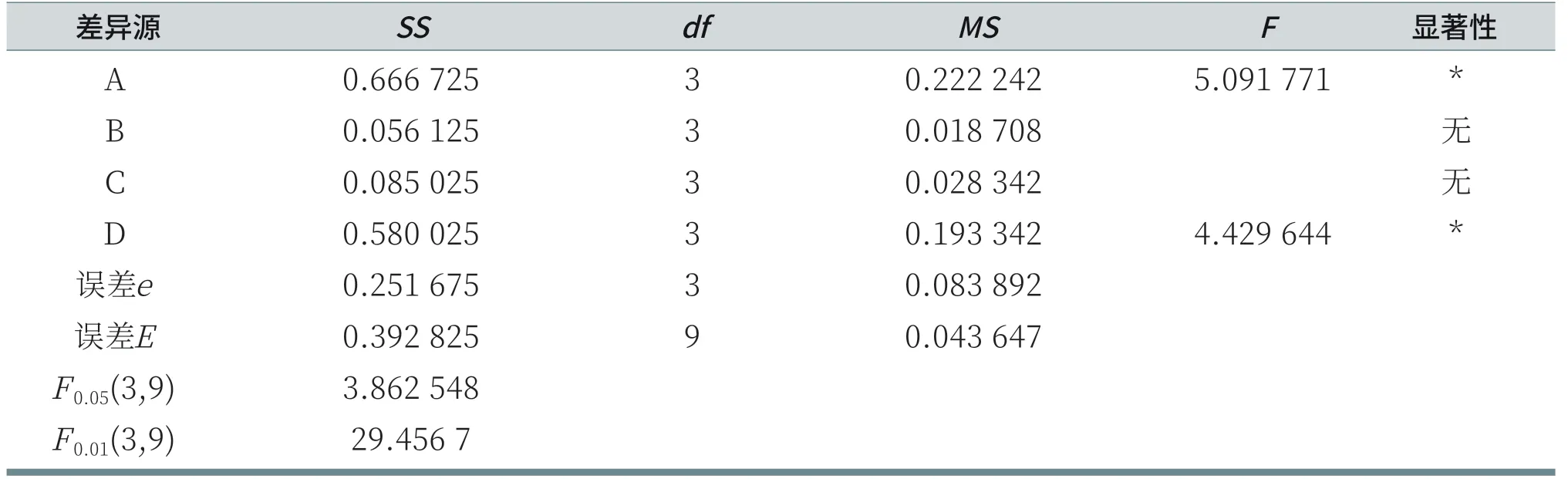
表11 鸡胚评分的方差和显著性分析表
2.5.2 四种表面活性剂与鸡胚评分的变化趋势
由图3可知,AES、K12、CAB、LS30单个因素在体系中的鸡胚评分影响趋势。从图3可明显看出规律:AES在11.5%之后评分结果突然增大,说明刺激性增大,在13%之后尤为明显;而LS30有助于降低鸡胚评分,在3%时效果最好;而K12和CAB无明显变化规律。
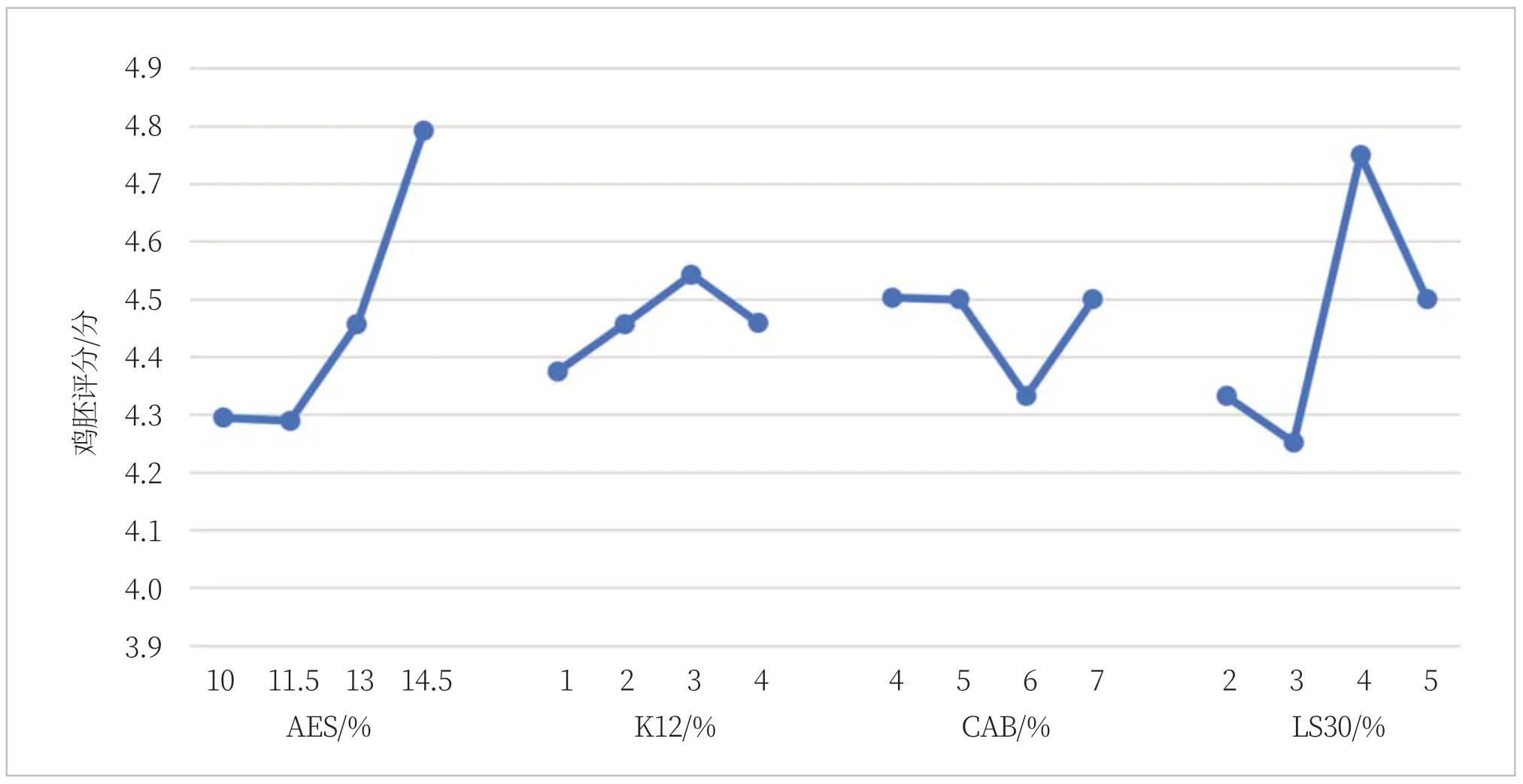
图3 四种表面活性剂鸡胚评分的变化趋势
3 结论
通过以上正交试验探讨AES、K12、CAB和LS30的最佳复配比例可发现,侧重指标不同,其最优方案也不同,整理见表12。由以上试验数据分析可知:

表12 AES、K12、CAB和LS30的最优方案整理
(1)泡沫高度与活性物多少不呈正相关,AES也并非用量越高泡沫越好,泡沫高度最高的水平是13%。
(2)表面活性剂对洗后皮肤水分含量的影响不大,并无明显的变化规律。
(3)AES在11.5%之后评分结果突然增大,说明刺激性增大,在13%之后尤为明显。而LS30有助于降低鸡胚评分,在3%时效果最好。
