Cd胁迫下接种根瘤菌对紫花苜蓿氮代谢的影响
2024-02-15孙文君吴基正李元
孙文君,吴基正,李元
(1.云南农业大学动物科学技术学院,昆明 650202;2.云南农业大学资源与环境学院,昆明 650202)
氮素被称为“生命元素”[1],在植物生命活动中居首要地位[2],占植物生长所需矿质元素的40%以上,是植物生长发育所必需的主要营养来源。目前,环境中的氮大多来源于空气中的N2,多数植物生长可利用的氮形态主要为而这些氮形态能否被利用取决于不同的氮转化效应,包括豆科植物-根瘤菌共生体系的固氮作用[2]。生物固氮能将大气中的分子态氮还原成氨,为植物提供氮素,可减少化肥的使用,在农业生产和环境保护方面发挥着重要作用[3]。
紫花苜蓿(Medicago SativaL.)是豆科苜蓿属深根性多年生牧草[4],有产量高、品质好、环境适应性强等特点,故有“牧草之王”的美称[5]。紫花苜蓿与根瘤菌形成固氮能力较强的生物固氮体系,根瘤菌为紫花苜蓿提供氨,可调节整个细胞的代谢水平以适应外界环境的胁迫,亦可通过外排、氧化或隔离等作用机制来解毒,使紫花苜蓿在重金属污染区域正常生长[6-8]。重金属镉(Cd)的生物毒性及化学活性较强,在生物体内不参与酶促反应与氮代谢过程,是生物生长的非必需元素,其含量超标会影响植物正常生长和细胞代谢,从而降低农作物的品质与产量,严重影响土壤的生态环境,目前土壤Cd污染已引起了国内外科研人员的广泛关注[9-11]。有研究发现在矿区自然分布的紫花苜蓿对Cd 的耐受能力高于Cr、Zn、Cu 和Pb 几种重金属[10]。紫花苜蓿被认为是修复Cd 污染土壤的理想作物[12]。但紫花苜蓿与根瘤菌的生物固氮过程极其复杂,易受到重金属、寒、旱等环境因素的影响[13],故探究紫花苜蓿根瘤菌氮代谢对Cd的响应具有重要意义。
目前,对于Cd 胁迫下紫花苜蓿的生理生化和生长特性已有较深入的研究,但关于接种根瘤菌后紫花苜蓿氮代谢对Cd响应的研究较少。本研究通过研究接种根瘤菌后紫花苜蓿氮代谢酶活和氮素含量对Cd污染土壤的响应,明确Cd 污染条件下紫花苜蓿接种根瘤菌的氮代谢机理,为Cd 污染土壤紫花苜蓿提高氮素累积,以及合理利用紫花苜蓿、根瘤菌提供基础性研究数据。
1 材料与方法
1.1 供试土壤与紫花苜蓿品种
试验于2021 年6—10 月在云南农业大学资源与环境学院试验基地温室大棚进行。供试土壤取自云南农业大学东校区后山农场,属红壤土,其pH值5.82,有机质含量为15.02 g·kg-1,全氮含量为1.77 g·kg-1,碱解氮含量为116.4 mg·kg-1,全磷含量为1.5 g·kg-1,有效磷含量为63.25 mg·kg-1,全钾含量为12.18 g·kg-1,速效钾含量为57.79 mg·kg-1,总Cd含量为0.38 mg·kg-1,经风干后的土样过筛并进行高温灭菌,混匀后装盆备用。
紫花苜蓿由云南农业大学动物科学技术学院草业科学实验室提供,品种为“ 维多利亚”和“WL525HQ”。
1.2 试验设计
采用温室土培试验,外源Cd(浓度为50 mg·kg-1,采用CdCl2·2.5H2O 与去离子水配制)与过2 mm 筛的土壤反复混合均匀,在温室下稳定7 d,种植紫花苜蓿至开花期前(种植期为100 d)。共分为8 个处理(表1),各处理重复3 次。试验用花盆规格为49 cm×15 cm×19 cm,每盆装入6.0 kg土壤。

表1 试验处理设置Table 1 The experimental treatments
1.2.1 种子萌发
挑选颗粒饱满、大小均匀的紫花苜蓿种子,依次用75%乙醇浸泡10 min、蒸馏水冲洗5 次,20%次氯酸钠浸泡10 min、蒸馏水冲洗5 遍后浸泡30 min,平铺在培养皿(9 cm)中,放入25 ℃的培养箱,催芽1 d。
1.2.2 根瘤菌培养
用营养琼脂培养基(牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g)培养中华根瘤菌225038菌株(北纳细胞微生物保藏管理中心),接种根瘤菌至固体培养基平板上。28 ℃培养3 d 后,挑取单个菌落接种到液体培养基中,28 ℃振荡培养制成菌悬液,培养至OD 值为0.8~1.2时可进行接种。
1.2.3 根瘤菌接种及处理
用无菌镊子将催芽至1~2 cm 的紫花苜蓿种子移入土壤中,在每株紫花苜蓿根周围加入1 mL 菌悬液,每个花盆中种植20 株,待紫花苜蓿长出第一片子叶时,补加等量菌悬液,于温室中培养,期间定时观察结瘤情况。
1.3 指标测定
待植株生长至100 d时,以盆为单位收获植株,将整株紫花苜蓿于105 ℃杀青30 min,后置于70 ℃烘至恒质量,研磨备用。总氮含量采用凯氏定氮法测定[14],硝态氮、铵态氮含量使用5%硫酸-过氧化氢提取比色法测定[15-16],游离氨基酸采用茚三酮溶液显色法测定[17],可溶性蛋白采用考马斯亮蓝法测定[18],脯氨酸含量采用酸性茚三酮法测定[19]。地上、地下部硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)、天冬酰胺合成酶(AS)和谷氨酸脱氢酶(GDH)的活性使用酶活性测定试剂盒(Solarbio,北京索莱宝科技有限公司)测定。
1.4 统计分析
数据用SPSS进行方差分析,以平均值±标准误差表示,用Origin 2018绘制相关图表。
2 结果与分析
2.1 接种根瘤菌对Cd胁迫下紫花苜蓿NR的影响
Cd 胁迫对紫花苜蓿的NR 活性产生不同程度的抑制作用(图1)。0 mg·kg-1Cd处理下,接种根瘤菌与不接种的维多利亚、WL525HQ 地上部NR 活性差异不显著(P>0.05),接种根瘤菌的WL525HQ地下部NR活性较不接种处理显著增强51.04%(P<0.05)。50 mg·kg-1Cd 处理下,与未接种相比,接种根瘤菌WL525HQ 地上部NR 活性提高164.66%(P<0.05),维多利亚地下部NR 活性提升99.46%(P<0.05)。与0 mg·kg-1相比,50 mg·kg-1Cd 处理未接种的维多利亚地上、地下部NR 活性分别下降29.89%、70.42%,WL525HQ 地上、地下部NR 活性分别下降85.01%、79.98%。

图1 硝酸还原酶(NR)活性对Cd胁迫的响应Figure 1 Response of NR activity to Cd stress
2.2 接种根瘤菌对Cd胁迫下紫花苜蓿NiR的影响
0 mg·kg-1Cd 处理下,接种根瘤菌与未接种的维多利亚植株的NiR 活性差异显著(P<0.05),地上、地下部NiR 活性分别提高12.99%、5.11%(P<0.05)。50 mg·kg-1Cd 处理下,与未接种组相比,接种根瘤菌维多利亚地上部NiR活性显著提高13.93%(P<0.05)。与0 mg·kg-1相比,50 mg·kg-1Cd处理未接种的维多利亚地下部NiR活性下降33.29%,WL525HQ地上、地下部NiR活性分别下降61.43%、63.67%(图2)。

图2 亚硝酸还原酶(NiR)活性对Cd胁迫的响应Figure 2 Response of NiR activity to Cd stress
2.3 接种根瘤菌对Cd胁迫下紫花苜蓿GS的影响
0 mg·kg-1Cd处理下,与未接种相比,接种根瘤菌的WL525HQ 地上、地下部GS 活性分别提高8.66%、30.56%(P<0.05)。但接种根瘤菌对维多利亚植株GS活性影响不显著(P>0.05)。与0 mg·kg-1相比,50 mg·kg-1Cd处理下未接种的维多利亚地上部GS活性降低11%(图3)。

图3 谷氨酰胺合成酶(GS)活性对Cd胁迫的响应Figure 3 Response of GS activity to Cd Stress
2.4 接种根瘤菌对Cd胁迫下紫花苜蓿GOGAT的影响
0 mg·kg-1Cd处理下,与未接种处理相比,接种根瘤菌显著提高WL525HQ 植株的GOGAT 活性(P<0.05),地上、地下部分别提升95.53%、38.34%。50 mg·kg-1Cd 处理下,接种根瘤菌WL525HQ 紫花苜蓿地下部GOGAT 活性显著提高8.42%(P<0.05),但接种根瘤菌对维多利亚植株GOGAT 活性影响不显著(P>0.05)(图4)。
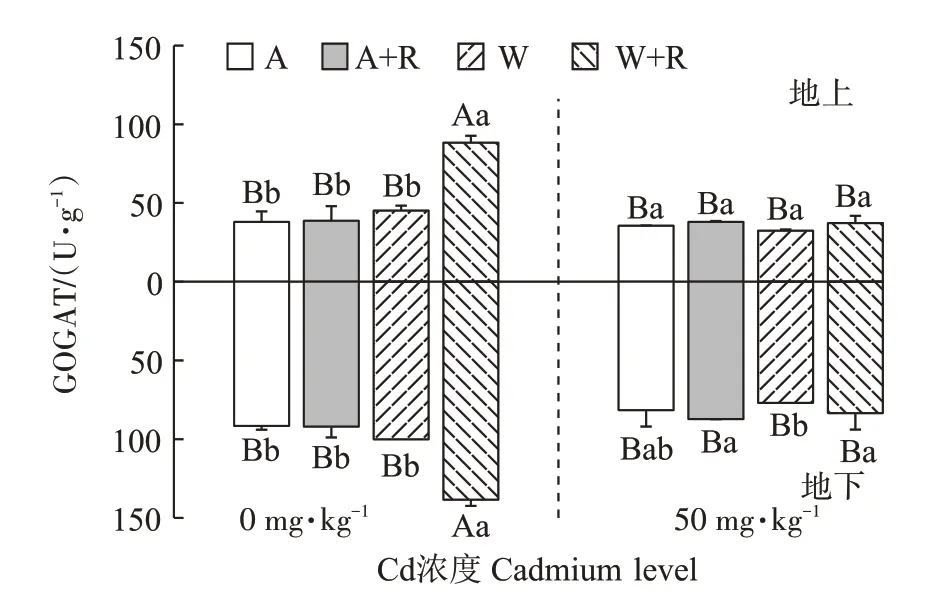
图4 谷氨酸合成酶(GOGAT)活性对Cd胁迫的响应Figure 4 Response of GOGAT activity to Cd stress
2.5 接种根瘤菌对Cd胁迫下紫花苜蓿AS的影响
0 mg·kg-1Cd处理下,与未接种处理相比,接种根瘤菌使维多利亚地上部AS 活性提升33.30%(P<0.05),WL525HQ 地上、地下部AS 活性分别显著增升24.37%、15.06%(P<0.05)。50 mg·kg-1Cd 处理下,接种根瘤菌WL525HQ 地上、地下部AS 活性分别增加43.36%、41.63%。与0 mg·kg-1相比,50 mg·kg-1Cd处理降低紫花苜蓿AS 活性,且Cd 对WL525HQ 的抑制作用较维多利亚更显著(P<0.05)(图5)。

图5 天冬酰胺合成酶(AS)活性对Cd胁迫的响应Figure 5 Response of AS activity to Cd stress
2.6 接种根瘤菌对Cd胁迫下紫花苜蓿GDH的影响
0 mg·kg-1Cd 处理下,接种根瘤菌与未接种紫花苜蓿植株的GDH 活性差异不显著(P>0.05)。50 mg·kg-1Cd 处理下,接种根瘤菌WL525HQ 植株地上、地下部的GDH 活性较未接种处理分别下降19.59%、50.91%(P<0.05)。与0 mg·kg-1相比,50 mg·kg-1Cd处理使WL525HQ 未接种根瘤菌植株地上、地下部GDH活性分别提升54.00%、135.00%(P<0.05),对接种根瘤菌维多利亚植株GDH 活性的影响不显著(P>0.05)(图6)。

图6 谷氨酸脱氢酶(GDH)活性对Cd胁迫的响应Figure 6 Response of GDH activity to Cd stress
2.7 接种根瘤菌对Cd胁迫下紫花苜蓿含氮物质的影响
0 mg·kg-1Cd 处理下,接种根瘤菌使维多利亚、WL525HQ 硝态氮含量比未接种处理分别提高15.03%、13.07%(P<0.05),WL525HQ可溶性蛋白含量提高12.08%,维多利亚游离氨基酸、脯氨酸含量增幅最大,分别为20.24%、71.03%(P<0.05),接种根瘤菌的WL525HQ 较未接种组总氮含量显著提高14.28%(P<0.05)。50 mg·kg-1Cd处理下,接种根瘤菌使维多利亚、WL525HQ 氨态氮含量增加6.87%、21.67%(P<0.05),可溶性蛋白含量增加6.24%、5.82%(P<0.05),游离氨基酸含量增加16.10%和18.70%(P<0.05),维多利亚脯氨酸、总氮含量增加67.92%、9.48%(P<0.05)。与0 mg·kg-1相比,50 mg·kg-1Cd处理降低未接种紫花苜蓿的硝态氮、氨态氮、可溶性蛋白及总氮含量,增加游离氨基酸及脯氨酸含量(P<0.05),未接种维多利亚、WL525HQ 硝态氮含量分别下降23.90%、55.55%(P<0.05),游离氨基酸含量增加42.17%、61.84%(P<0.05),同时50 mg·kg-1Cd 处理诱导紫花苜蓿的脯氨酸含量增多,维多利亚、WL525HQ 分别提高92.52%、85.85%(表2)。

表2 Cd对紫花苜蓿氮素形态和含量的影响Table 2 Effects of Cd on nitrogen form and content of alfalfa
3 讨论
3.1 Cd 胁迫下接种根瘤菌对紫花苜蓿氮代谢关键酶的影响
GS 和GOGAT 是植物氮代谢过程中合成氨基酸的主要酶。其中,GS 参与植株氮代谢途径的多个调节过程,也是影响氮同化的关键酶[31],通过与GOGAT结合催化谷氨酰胺合成谷氨酸,GS/GOGAT 循环对植物体内平衡具有重要的协同作用[32-33]。本研究发现Cd 对紫花苜蓿的GS 活性有一定的抑制作用(图3),当植物处于逆境(如受到Cd胁迫或营养缺乏)时,同化增强且蛋白质发生降解,使得NADH-GDH通路中的GDH 活性显著增大,诱导胁迫保护分子合成,根瘤菌能同时通过增强GS/GOGAT 循环、NADHGDH 模式以及增加NR、NiR 的还原产物,促进共生体系将无机氮转化为有机氮,从而抵抗不利环境的胁迫[34-36]。AS 是广泛存在于生物体内的一类氨基转移酶,能催化谷氨酰胺的氨基向天冬氨酸转移,天冬酰胺的形成与累积是一种解毒反应[37]。Lam等[38]利用分子生物学技术发现拟南芥AS 基因ASN1过表达使体内天冬酰胺累积量增多,改善了逆境中的氮素营养状况,证实AS对植物氮代谢以及氮的“源-库”关系调节具有至关重要的作用。
3.2 Cd胁迫下接种根瘤菌对紫花苜蓿含氮物质的影响
氮是植物体内核酸、氨基酸和蛋白质等大分子有机氮化合物的重要组成元素[39],能直接影响植物的正常生长、品质及产量等[40]。氨基酸含量在植物应对逆境胁迫中的作用尤为重要[41]。研究表明,在受到非生物胁迫时植物体内游离氨基酸含量不断增加[42]。本研究表明,与无Cd 处理相比,Cd 处理使紫花苜蓿的游离氨基酸含量增多,是由于细胞受到胁迫损伤,植物需积累大量游离氨基酸以抵御Cd 的毒害[43]。已有研究发现,较高含量的脯氨酸可以减弱逆境胁迫引起的渗透损伤[44],植物对脯氨酸的累积能力与抵御逆境的能力有一定的相关性[45],因而其可以作为胁迫指示剂。本研究中,接种根瘤菌处理使紫花苜蓿共生体系脯氨酸含量增多,说明接种根瘤菌的紫花苜蓿抗性有所提高,在处于相同逆境时,根瘤菌协助植株通过产生更多的脯氨酸来缓解Cd 的胁迫。这表明接种根瘤菌能够减少Cd 胁迫对紫花苜蓿造成的细胞损伤,增强胞间稳定性,维持细胞内外环境的平衡,从而使紫花苜蓿具有更强的氮代谢能力与渗透调节能力。有研究显示,豆科植物-根瘤菌共生系统的固氮量约占生物固氮总量的65%[46]。李凯等[47]也发现,接种根瘤菌的大豆产量及含氮量显著增加。本试验接种根瘤菌处理后也得出同样结果,两种紫花苜蓿的含氮量均有不同程度的提高,说明接种根瘤菌通过促进Cd胁迫下紫花苜蓿的氮代谢过程提高了植物对氮素的吸收。
4 结论
(1)Cd 胁迫影响紫花苜蓿氮代谢,通过接种根瘤菌调节氮代谢关键酶活性介导紫花苜蓿的氮代谢,缓解了Cd对紫花苜蓿氮代谢的毒害作用。
(2)接种根瘤菌使紫花苜蓿可溶性蛋白、游离氨基酸和脯氨酸含量增加,提高了紫花苜蓿的渗透调节能力。
因此,接种根瘤菌能通过调节紫花苜蓿氮代谢过程来缓解Cd造成的伤害,使紫花苜蓿积累更多的氮素。
