耐乙草胺促生菌筛选及其对玉米幼苗的促生效应
2024-02-15张凤麟黄宁李雷陈伟东季欣悦包英哲王鸿斌
张凤麟,黄宁,李雷,陈伟东,季欣悦,包英哲,王鸿斌
(1.吉林农业大学资源与环境学院,长春 130118;2.农业农村部盐碱土改良与利用(东北内陆盐碱地)重点实验室,长春 130118;3.吉林省商品粮基地土壤资源可持续利用重点实验室,长春 130118;4.吉林省公主岭市植检植保站,吉林 公主岭 136100)
玉米是吉林省主要粮食作物之一,为提高玉米产量,农民习惯施用大量的化肥和除草剂,导致土壤和水体受到污染,土壤微生物结构被破坏,保肥保水能力降低[1]。如何在保证作物产量的同时,改善和利用黑土地,充分发挥经济与粮食作物在黑土的生产潜力,是人们共同关注的热点问题。
植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)是指自由生活在土壤或附生于植物根系的一类可促进植物生长及其对矿质营养的吸收和利用,并能抑制有害生物的有益菌类[2]。PGPR 促生的方式主要有:①通过微生物固氮过程,将空气中的游离氮转变为植物可利用的氮素[3];②溶磷促生菌通过释放有机酸溶解土壤中难溶的磷元素,使植物获得可吸收的磷[4];③解钾促生菌通过与矿物质接触的直接作用方式或分泌多种物质的间接方式加速土壤中缓效态钾向交换性钾或水溶性钾转化,便于植物吸收利用[5]。除了促进植物吸收三大营养元素外,PGPR还有很多直接或间接的促生方式正在被挖掘。陈越等[6]分离筛选出产IAA(吲哚乙酸)能力高达141 mg·L-1的咸海鲜球菌属(Jeotgalicoccussp.)m-60,可以促进烟草种子萌发及幼苗生长。Lau 等[7]研究发现7 株可抑制土传病的促生菌,具有产生铁载体和几丁质酶的能力。明立伟等[8]在测定促生菌Bam688 时发现,该菌株具有提高作物抗氧化特性及维持渗透调节平衡的能力。宋扬[9]从40 种盐碱地土著植物的根际土壤中分离得到一株肠杆菌属细菌AD2-2,具有较强耐盐碱能力,能够分泌酸性物质降低植物根际pH 以促进盐碱条件下植株根系生长。De Araujo 等[10]研究发现RS59-6菌株具有在水分胁迫下促进玉米生长的潜力。PGPR 菌剂作为一种新型生物肥料,有效推动了有机农业的发展,在农业以及环境修复等方面具有良好应用前景。但目前已有的文献很少提及对除草剂有抗性的促生菌株,筛选出具有对除草剂具有抗性且有良好促生能力的促生菌,将是微生物菌剂开发的新方向。
鉴于此,本研究从吉林省梨树县施用乙草胺的玉米地中,挑选长势良好的玉米植株,收集其根际土壤,分离筛选出了两株耐乙草胺的优势菌,对其进行促生功能鉴定分析,并通过促发芽试验及盆栽试验探究其在田间施用的可行性,以期为利用微生物增产增效提供优质的微生物资源和理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试土壤
本试验样品取自吉林省梨树县西凤凰山村,供试土壤为施用乙草胺(东北玉米种植区最常用的除草剂之一)且长势较好的玉米植株根际土壤。
1.1.2 培养基
LB 培养基(Luria-Bertani 培养基):NaCl 10 g,蛋白胨10 g,酵母浸粉5 g,去离子水1 000 mL,pH 6.0~7.0。
改良Aleksandrov 培养基[11]:葡萄糖5 g,MgSO4·7H2O 0.5 g,FeCl30.005 g,CaCO30.1 g,Ca2(PO4)32 g,含钾矿物3 g,琼脂20 g,溴百里酚蓝0.1 g,去离子水1 000 mL。
Ashby 无氮培养基:蔗糖10 g,NaCl 0.12 g,K2HPO4·3H2O 0.5 g,CaCO31 g,MgSO4·7H2O 0.2 g,去离子水1 000 mL。
NBRIP 培养基:葡萄糖10 g,Ca2(PO4)35 g,MgCl25 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO40.1 g,去离子水1 000 mL。
L-TSB 培养基:色氨酸0.1 g,胰酪胨17 g,NaCl 5 g,K2HPO4·3H2O 2.5 g,葡萄糖2.5 g,大豆木瓜蛋白酶水解物3 g,去离子水1 000 mL。
改良CAS 培养基[12]:20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol·L-1CaCl2100 μL,MgSO42 mL,琼脂1.8 g,磷酸盐缓冲液5 mL,CAS染液5 mL。
1.1.3 盆栽样品
供试玉米品种为郑单958。
1.2 菌株初步筛选
称取根际土壤10 g,倒入带玻璃珠的100 mL 无菌水瓶中,振荡20 min,得到土壤悬液,再稀释1×105倍,备用[13]。根据乙草胺的大田施用量(5~10 mg·L-1),制作分别含有100、200、300 mg·L-1乙草胺的LB平板,用移液枪吸取100 μL 稀释液注入平板中,并用涂布棒涂布均匀,每个浓度重复3 次,置于30 ℃恒温培养箱中培养。结合菌落直径、菌落数量,选择优势菌落,用平板划线分离纯化3 代后接种到液体LB 培养基中进行富集。按1∶4的比例(0.2 mL甘油、0.8 mL菌液)保存于1 mL离心管中,-80 ℃保存。
1.2.1 解钾菌筛选
将保存的优势菌株制成菌悬液,采用点接法接种在Aleksandrov 固体培养基上,菌落生长且出现黄色晕圈,则说明具有解钾能力,根据晕圈大小初步确定菌株解钾能力强弱。
1.2.2 溶磷菌筛选
将优势菌株的菌悬液稀释,涂布于NBRIP 平板培养基上,28 ℃培养72 h,出现透明溶磷圈,则说明具有溶磷能力。
1.2.3 固氮菌筛选
采用稀释涂布法将优势菌株的菌悬液均匀涂布在Ashby无氮培养基上,28 ℃培养7 d,可以生长则视为具有固氮能力,根据菌落生长直径判断其固氮能力大小。
1.2.4 IAA分泌菌筛选
将具有以上功能的优势菌株接种于L-TSB 培养基中,28 ℃、200 r·min-1振荡48 h 后,8 000 r·min-1离心10 min。采用Salkowski 比色法,通过反应液颜色变化进行判断:颜色变为粉红色为具有分泌IAA 能力,根据颜色深浅判断分泌能力强弱。
1.2.5 产铁载体菌株筛选
将具有固氮、溶磷、解钾、产IAA 功能的菌株点接于CAS 平板上,置于28 ℃培养箱中培养3 d,若菌株产生铁载体,CAS 平板应由蓝色变为橙色(橙色铁螯合圈),根据橙色铁载体晕圈的大小初步确定菌株分泌铁载体的能力。
1.3 菌株促生能力的定量测定
1.3.1 菌株解钾量测定
将初筛时有解钾圈的菌株接种至100 mL Aleksandrov 液体培养基(不含溴百里酚蓝)中,以未接菌的培养基作为空白对照,30 ℃、100 r·min-1振荡5 d,培养结束时,检测培养基pH。10 000 r·min-1离心10 min。上清液用火焰分光光度计测定有效钾含量。
1.3.2 菌株溶磷量测定
将初筛中出现透明圈的菌株接种于装有100 mL NBRIP 液体培养基的250 mL 三角瓶中,不接菌的NBRIP 培养液为空白对照,28 ℃、180 r·min-1振荡5 d,测定培养基pH。10 000 r·min-1离心10 min,取2 mL 上清液与1 mL 钼锑抗混合剂混合后定容至50 mL,反应30 min,660 nm比色测定有效磷含量。
1.3.3 菌株分泌IAA水平测定
将初筛时呈粉红色的反应液置于紫外分光光度计中测定OD530值,随后代入标准曲线中计算IAA含量。
1.4 菌株鉴定
选取初筛与定量测定中促生能力较强的2 株优势菌株,对其进行测序。利用通用引物27F 和1492R作为上下游引物扩增目标菌株的16S rRNA 编码基因,将拼接得到的基因序列上传NCBI,利用BLAST进行同源性序列比对,采用Mega 7.0软件中的邻接法构建菌株的系统发育树。
1.5 优势菌株对玉米的促生效果验证
1.5.1 菌悬液的制备
将筛选的具有促生功能的细菌菌株接入100 mL的LB 培养基中,28 ℃、150 r·min-1振荡培养至OD600值约为1.500,用无菌水将其稀释至菌体浓度为1×108CFU·mL-1,作为菌悬液备用。
1.5.2 玉米种子的促发芽试验
挑选大小一致且无破损的玉米种子,用10%的次氯酸钠溶液将玉米种子浸泡10 min,再用无菌水反复洗涤种子。完成后将种子胚乳向上,平铺在垫有湿润无菌纱布的培养皿中,每个处理100 粒。以无菌水为对照,喷施不同菌种的菌悬液。25 ℃恒温黑暗培养3~5 d。观察并统计种子萌发率。发芽率=发芽种子数/供试种子数×100%。
1.5.3 玉米幼苗促生试验
采用盆栽方式检测抗性菌株对玉米幼苗的促生效果。取玉米种子按上述方法进行催芽,待玉米苗长出3片叶子时选取长势一致的植物进行移栽。在上口径21.3 cm、高20 cm的圆形花盆中进行试验,每盆装灭菌风干土3 kg,种3 颗玉米苗,每个处理6 盆。共设6个处理:空白对照(CK);单施乙草胺(A);单施自制JL7菌剂(JL7);乙草胺与JL7 菌剂混合(AJL7);单施自制JL16 菌剂(JL16);乙草胺与JL16 菌剂混合(AJL16)。移栽前一次性喷施200 mL混合液,其中乙草胺浓度为20 mg·L-1,活菌数约为1×106CFU·mL-1。盆栽放置于网室中,随机摆放,根据情况施加等量无菌水。待出现三叶一心后进行收样,测定并记录每个玉米植株的株高、茎粗、根直径、根长。
2 结果与分析
2.1 菌株筛选
从玉米根际土壤中分离获得23 株细菌,对各菌株进行耐乙草胺试验。根据初筛时的生长情况,将乙草胺最大浓度提高到700 mg·L-1。表1为不同乙草胺浓度下菌株的生长情况,其中5 株耐乙草胺能力较强的抗性优势菌株为JL3、JL7、JL9、JL16、JL21,最高抗乙草胺浓度可达700 mg·L-1。

表1 不同乙草胺浓度下菌株的生长情况Table 1 The growth of different strains under different acetochlor concentration
2.2 菌株的促生性能
对5 株抗乙草胺优势菌进行固氮、溶磷、解钾、分泌IAA、分泌铁载体的能力测定。结果表明:4株菌具有固氮能力,其中JL16 能力较强,生长菌落数最多,均值为113.33,与其他4 株菌产生的菌落数均有显著差异(P<0.05);5株菌均有溶磷功能,但各菌株溶磷效果差异显著,JL7溶磷指数(溶磷指数=透明圈直径/菌落直径)高达4.18,与JL3相比增加了237.10%;4株菌具有解钾能力,能力从大到小依次为JL7>JL3>JL9>JL16,JL7 的可溶性指数为16.22,JL16 则为0;JL3 和JL7 的主要代谢产物为IAA,反应颜色较深;JL7 和JL16 在CAS 铁载体检测培养基上生长时出现的橙色光晕较为明显。图1 为效果最为明显的JL7 和JL16两菌株的促生效果图。
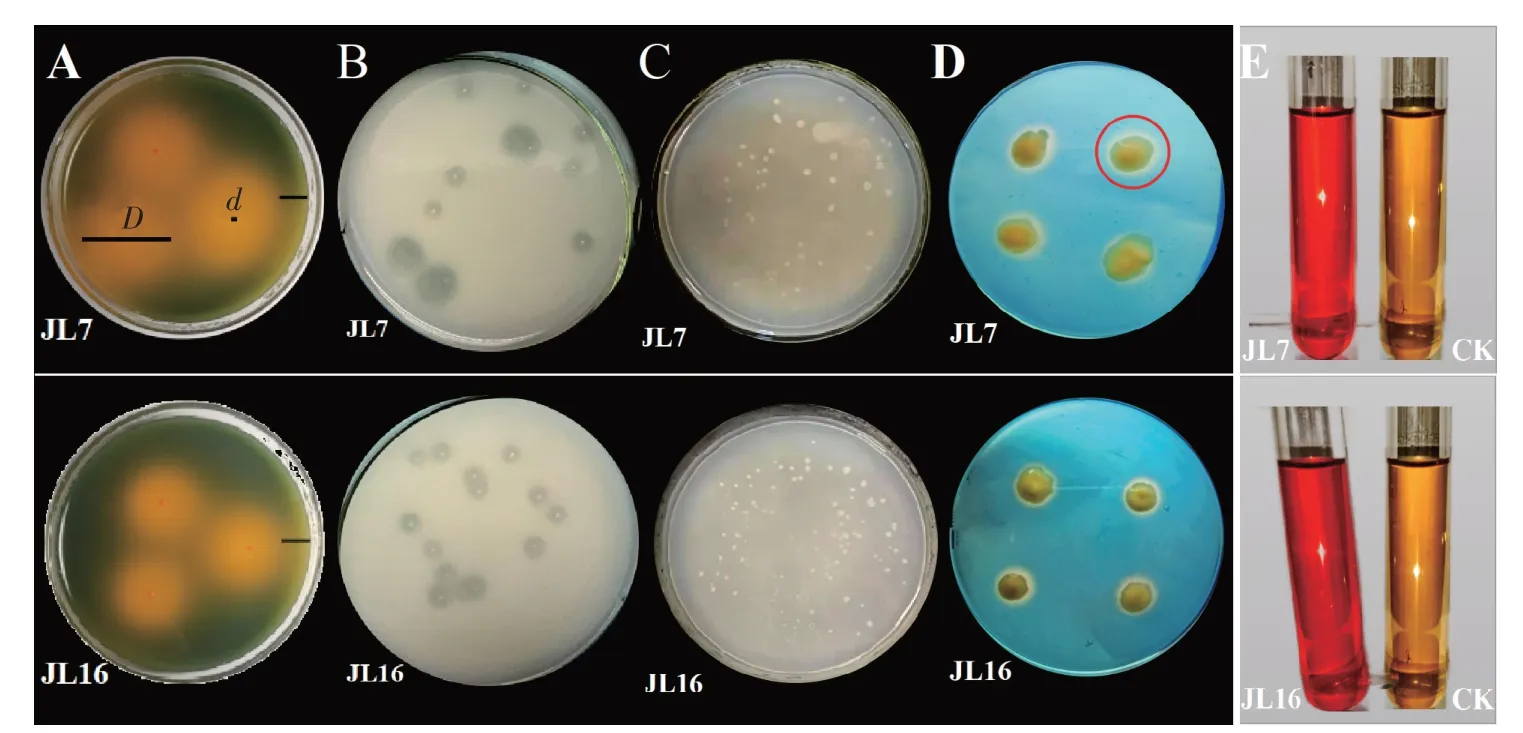
图1 部分菌株的促生能力效果图Figure 1 Renderings of the growth promoting ability of the strains
2.3 可溶性钾含量的动态变化
由图2可知,0~24 h为5株菌株的生长对数期,可溶性钾含量增加迅速。对5 株菌株的解钾量进行测定发现,溶钾能力依次为JL3>JL9>JL7>JL16>JL21>CK。JL21 的解钾量最低,为13.50 mg·L-1,JL3 解钾能力最强,解钾量高达47.50 mg·L-1,较CK 增加了295.83%,显著高于其他处理。24 h后,上清液中可溶性钾含量仍缓慢增加,这可能是第一批解钾菌死亡后释放细胞内的钾所致。

图2 不同菌株的解钾能力Figure 2 The potassium solubilization ability of different strains
在测定可溶性钾含量的同时测定其pH 值,结果如图3 所示。由图3 可知,JL3、JL7、JL9、JL16 菌株的菌悬液呈酸性,在菌株加入培养基后pH 迅速降低,JL9 最为明显,其pH 较CK 降低0.57 个单位,总体呈先快速下降后缓慢上升趋势。0~24 h,细菌快速繁殖,分泌大量强有机酸[14],导致pH 极速下降,生长对数期后菌株浓度保持稳定。72 h 后,pH 升高,这可能是溶液中的钾离子含量增加导致,具体机制有待进一步探究。120 h 后,JL9 的pH 为4.46,与其他菌株之间差异显著(P<0.05)。

图3 解钾过程中pH值的变化Figure 3 The change of pH value during potassium dissolution
2.4 可溶性无机磷含量的动态变化
由图4 可知,溶磷量在72 h 后保持稳定,120 h后,上清液含磷量大小依次为JL7>JL3>JL9>JL16>JL21>CK,JL7 的溶磷量为223.21 mg·L-1,相比CK 增加177.10 mg·L-1。在72 h时溶磷量略有降低,推测可能是由于后期培养基中营养成分缺少,微生物需吸收少部分可溶性磷来维持生长。

图4 不同菌株的溶磷能力Figure 4 The ability of different strains to dissolve phosphorus
微生物富集过程中会分泌甲酸、乙酸、乙醇酸等有机酸,从而降低上清液的pH值,使磷可溶性和有效性增强,供植物吸收和利用。这与图5 结果相符,可溶性磷含量与pH 呈反比,含量越高,pH 越低。24 h后,JL3、JL7、JL9 这3 株溶磷能力较强的菌株所在的培养基上清液的pH 在不同时间点出现少量回升,原因可能是微生物本身具有一定的调节pH 的能力,释放了氨基氮或产生的酸被微生物利用,导致pH 有一定上升。

图5 溶磷过程中pH值的变化Figure 5 The change of pH value during phosphorus dissolution
2.5 分泌IAA能力测定
由图6可知,JL3和JL7两菌株产IAA的能力显著高于其余3 株菌,IAA 产量分别为82.10 mg·L-1和82.40 mg·L-1。由于不同菌株的代谢产物不同,可以推断JL3 和JL7 通过吲哚-3-丙酮酸酯(IPyA)途径[15]合成大量IAA,故IAA 为其主要代谢产物。JL16 也能够产生IAA,但产量不大,故IAA 为其次要代谢产物,而JL9、JL21则不分泌IAA。

图6 不同菌株产IAA的能力Figure 6 IAA production capacity of different strains
2.6 优势菌株16S rRNA分子鉴定
对5株菌的促生能力进行对比,结果如图7所示。JL3、JL7、JL16 这3 株菌的综合能力较强,而JL7 与JL16 对乙草胺的抗性最强,所以对这2 株菌进行测序,并将获得的16S rRNA 基因序列上传NCBI 进行BLAST 比对,构建系统发育树,结果如图8 所示。由图8 可知,JL7 为肠杆菌属(Enterobactersp.),JL16 为醋菌属(Acetobactersp.)。
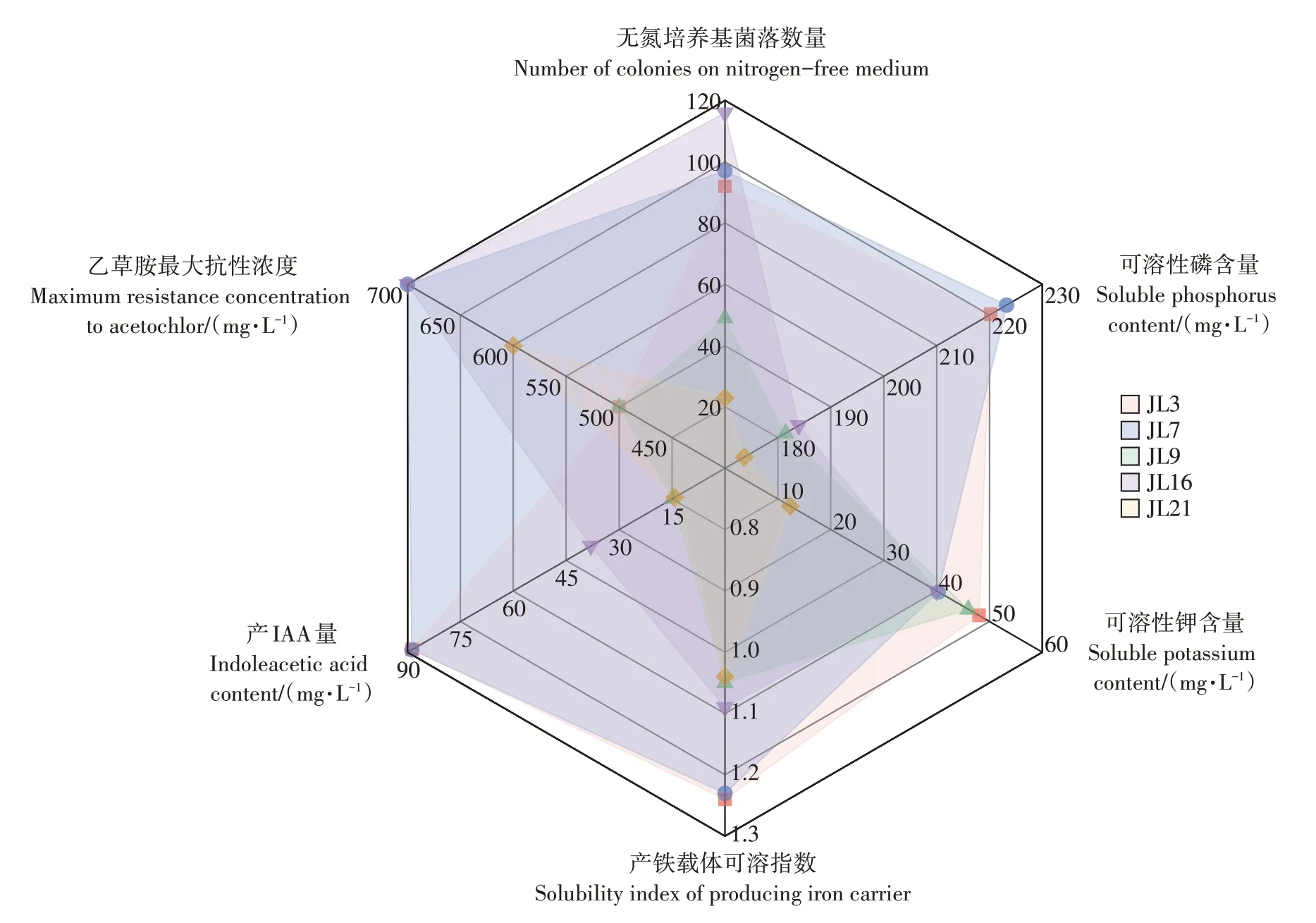
图7 不同菌株的促生能力Figure 7 Growth promoting ability of different strains
2.7 菌株对玉米种子的促发芽作用
表2 为不同处理对玉米种子发芽率的影响。由表2 可知,接种JL7 组的发芽速度较快,培养72 h 后,发芽率为81.75%。与CK 相比,JL7 和JL16 组的72 h发芽率分别增长了9.42、3.84 个百分点(P<0.05)。培养120 h 后,3 个处理的发芽率表现为JL7>JL16≈CK,JL7 比CK 增加6.51 个百分点(P<0.05)。以上结果说明,JL7 与JL16 菌株对玉米种子发芽有显著的促进作用,可以提高发芽率,其中JL7菌株能力最强。
经处理后的玉米种子长势如图9 所示。对这些玉米种子的芽长和根长进行测定,结果如表3 所示。接种JL16 组的长势最好,与CK 相比,芽长显著增加52.53%(P<0.05),根长增加23.22%,但无显著差异。接种JL7组的芽长比CK组增加28.16%,根长比CK组减少12.31%,但差异不显著。经分析可知,JL7 与JL16 菌株均对玉米地上部生长有促进作用,JL16 可以促进根系发育,但JL7 可能由于分泌了某些生长素,出现抑制根系生长的现象。

图9 JL7、JL16对玉米种子发芽的促进作用Figure 9 Growth promoting effect of JL7,JL16 strains on maize seed germination

表3 不同处理对玉米种子芽长和根长的影响Table 3 Effects of different treatments on seed bud length and root length of maize
2.8 菌株对玉米植株生长的促进作用
玉米盆栽试验结果如图10所示,表4为不同处理对玉米幼苗生长的影响。结果表明,JL7 和JL16 对玉米株高、茎粗、根长、根直径均有不同程度的促进作用,且在土壤中仍对乙草胺有一定抗性。当JL7 菌株单独接种时,玉米幼苗的根直径和茎粗显著大于CK,分别增加68.63%、30.67%,但其余指标增加不明显,且根长仍低于CK,与促发芽试验结果吻合。由此推测,JL7 菌株会产生某种生长素起到壮根壮苗的效果,但会在幼苗期抑制根系生长。单独接种JL16 菌株时,根直径、根长、茎粗、株高分别比CK 增加47.06%、28.61%、20.77%、21.53%。单独施用乙草胺时,玉米幼苗的根系生长受阻,茎粗较小,该结果与Li等[16]的研究结果相符,原因可能是玉米种子与乙草胺在土壤中接触,对乙草胺有一定的吸收和转运[17]。加入JL7 和JL16(处理AJL7、AJL16)后,乙草胺毒性明显减弱,说明两个菌株在与乙草胺混合后仍存活并起到促生作用。

图10 不同处理对玉米生长的影响Figure 10 Effects of different treatments on maize growth

表4 不同处理对玉米幼苗生长的影响Table 4 Effects of different treatments on growth of maize seedlings
3 讨论
植物促生菌具有改善土壤营养环境[18]、分泌植物生长激素[19]以及产生能够抑制病原菌的抗生素、溶解酶等[20-21]作用,已成为国内外研究的热点。
本研究从施用乙草胺的玉米根际土壤样品中分离获得了23 株细菌,通过乙草胺抗性试验,挑选出5株在含有较高浓度乙草胺的培养基中依然存活的抗性优势菌株,其中JL16的最高乙草胺耐受浓度为700mg·L-1,略高于陈森等[22]在施用乙·苄复配制剂的稻田土壤中分离筛选的黏质沙雷式菌(Serratia marcescens)、恶臭假单胞菌(Pseudomonas putida)和硝化还原假单胞菌(Pseudomonas nitroreducens)(耐受浓度600 mg·L-1)。罗玮等[23]分离获得了一株能以乙草胺为唯一碳氮源的铜绿假单胞菌,在200 mg·L-1乙草胺浓度下可以正常存活。目前已有研究大多探究乙草胺抗性菌株的降解途径及机理,而关于菌株既可以耐乙草胺又具备促生功能的研究鲜有报道。
通过不同的促生功能试验,本研究发现5 株细菌的固氮、溶磷、解钾、分泌铁载体、分泌IAA 能力有不同程度的差异。综合能力最强的两株菌分别为肠杆菌属的JL7 和醋菌属的JL16。吕朝阳等[24]曾筛选出一株有分泌IAA 和溶磷能力且对番茄有促生作用的阴沟肠杆菌(Enterobacter cloacae),王雪玲[25]研究发现通过抗生素抗性诱导后的5 株肠杆菌属细菌有较高的溶镉能力,且对油菜和芥菜有促生作用,而对醋菌属菌株的研究主要围绕固氮作用开展[26-27]。
在解钾试验中,5 种菌株作用后的培养基上清液中可溶性钾含量呈缓慢持续增加状态,该结果与Ebrahimi 等[28]的研究结果吻合,这是由于解钾菌在分解钾长石粉时,一部分钾存在于上清液中,另一部分被微生物细胞同化,积累在菌体中。部分微生物死亡后,不断释放细胞内的可溶性钾,一段时间后可溶性钾含量仍增加。这也可以解释pH先下降后上升的原因,微生物富集过程会分泌大量有机酸[29],从而降低上清液的pH值,但由于可溶性钾含量仍缓慢增加,故pH也有缓慢增长的趋势。
经过鉴定,耐乙草胺且促生能力最强的JL7 和JL16 菌株分别为肠杆菌属(Enterobactersp.)和醋菌属(Acetobactersp.)。目前已报道的植物根际促生菌大多为芽孢杆菌属(Bacillus)、假单胞菌属(Psewdomonas)、伯克霍氏菌属(Burkholderia)等[30-31],而现阶段国内外鲜见肠杆菌属(Enterobacter)和醋菌属(Acetobacter)作为植物根际促生菌的报道,其对乙草胺抗性等的相关报道更是少之又少。
盆栽试验中2 株细菌的促生能力结果表明,2 种菌株均对玉米种子的发芽与幼苗生长有促进作用。但JL7 出现了促进根系粗壮但抑制根伸长的情况,推测其可能分泌了某种壮根的生长素,但是会影响根系纵向发育,其机理尚不明确,有待进一步研究。在促生能力测定时,JL7 的综合能力强于JL16,但在盆栽试验中,施入JL16 菌悬液的处理却长势更好,可能由于土壤的酸碱度和原有无机盐含量更适合JL16 菌株的生长繁殖,并且可能存在降解残留乙草胺的情况,在后续研究中会对这一问题进行深入研究。
4 结论
本试验通过测定菌株的乙草胺抗性、促生能力及施加菌株对植株形态的影响,得到以下结论:
(1)筛选得到的2株优势菌株JL7和JL16,耐乙草胺浓度高达700 mg·L-1,并且在溶磷、解钾、固氮、产IAA、产铁载体方面均具有较强能力。
(2)经16S rRNA 分子鉴定,JL7 为肠杆菌属(Enterobactersp.),JL16为醋菌属(Acetobactersp.)。
(3)JL7、JL16 可以显著提高玉米种子的发芽率、缩短种子发芽时间,并且对玉米幼苗的根长、根直径、茎粗、株高等生长性状有显著促进作用。
综上所述,本研究分离得到的JL7、JL16 菌株既可以减轻乙草胺对植株的危害,还能进一步促进植株生长发育,具有良好的应用前景。研究可丰富植物促生菌的种类,为开发研制新的微生物源植物生长剂及微生物肥料提供原材料。
