广东番茄巨芽病植原体的分子鉴定
2024-02-06汤亚飞李正刚佘小漫于琳蓝国兵何自福
汤亚飞 李正刚 佘小漫 于琳 蓝国兵 何自福





摘要
2022年,对在广东省湛江市廉江市田间发现的疑似番茄巨芽病病株,利用分子生物学方法对其相关植原体进行了鉴定。以番茄病株叶片总DNA为模板,利用植原体16S rRNA基因通用引物R16mF2/R16mR1进行PCR扩增,获得了广东番茄巨芽病植原体(TBBGD2022)16S rRNA基因片段(1 430 bp,GenBank登录号为ON102780)。16S rRNA基因序列相似性分析显示,TBBGD2022与16SrⅡ组植原体菌株的相似性较高,为96.82%~100%,其中与隶属于16SrⅡV亚组的6个植原体株系相似性为100%。系统进化分析显示,TBBGD2022与16SrⅡ组各植原体株系聚类在一个大分支,并与16SrⅡV亚组成员聚类在一个小分支,亲缘关系较近。16S rRNA 基因相似系数分析表明,TBBGD2022与16SrⅡV亚组的参照株系‘Praxelis clematidea’ phyllody phytoplasma (GenBank登录号:KY568717) 的相似系数为1.00。上述研究结果表明,广东番茄巨芽病植原体隶属16SrⅡV亚组成员。本文首次报道在广东发现番茄巨芽病,通过其16S rRNA序列分析进一步确定了其相關植原体的分类地位,为该病害的防控提供了科学依据。
关键词
番茄巨芽病; 植原体; 16S rRNA; 分子鉴定
中图分类号:
S 436.412
文献标识码: A
DOI: 10.16688/j.zwbh.2022487
Molecular identification of phytoplasma associated with tomato big bud disease in Guangdong province
TANG Yafei, LI Zhenggang, SHE Xiaoman, YU Lin, LAN Guobing, HE Zifu*
(Institute of Plant Protection, Guangdong Academy of Agricultural Sciences, Key Laboratory of Green
Prevention and Control on Fruits and Vegetables in South China, Ministry of Agriculture and Rural Affairs,
Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640, China)
Abstract
In 2022, the suspected tomato big bud diseased plants were found in Lianjiang city, Zhanjiang city, Guangdong province. The related phytoplasma was detected and identified using molecular technology. The 16S rRNA gene fragment (1 430 bp, GenBank accession no. ON102780) of phytoplasma associated with tomato big bud disease in Guangdong province (TBBGD2022) was amplified from total DNA of diseased tomato plants using universal primers R16mF2/R16mR1. Sequence similarity based on 16S rRNA gene sequence showed that TBBGD2022 had higher similarity (96.82%-100%) with phytoplasmas from 16SrⅡ group, while had highest similarity (100%) with six phytoplasmas belonged to 16SrⅡV subgroup. Phylogenetic analysis showed that TBBGD2022 formed a large evolutionary branch with 16SrⅡ group phytoplasmas, and a small evolutionary branch with 16SrⅡV subgroup phytoplasmas. iPhyClassifier analysis for 16S rRNA gene showed that the similarity coefficient between TBBGD2022 and ‘Praxelis clematidea’ phyllody phytoplasma (GenBank accession no. KY568717) of the reference strain from 16SrⅡV subgroup was 1.00. These results showed that phytoplasma associated with tomato big bud disease in Guangdong province belonged to the 16SrⅡV subgroup. In this paper, tomato big bud disease was discovered firstly in Guangdong, and the taxonomic status of its related phytoplasma was further determined. The results provide the scientific basis for controlling tomato big bud disease in Guangdong province.
Key words
tomato big bud disease; phytoplasma; 16S rRNA; molecular identification
植原体是一类无细胞壁,难以人工培养的专性寄生于活性细胞的植物病原菌,由Doi等1967年发现并报道[1]。该病原菌属细菌界Bacteria柔膜菌纲Mollicutes植原体暂定属Candidatus (Ca.) genus Phytoplasma[23],主要通过取食植物韧皮部的叶蝉、木虱等刺吸式口器昆虫传播,也可通过嫁接或菟丝子传播。植原体的寄主种类多,可侵染1 000多种植物,常引起植株表现丛枝、花变葉、畸形、黄化、小叶等典型症状,严重影响全球各地农林业生产[4]。关于植原体的鉴定与分类,由于不能在人工培养基上进行分离、培养,目前主要依据其16S rRNA序列差异,以及rp、secY等保守基因序列、传播介体、天然植物寄主。截止到2019年6月,依据16S rRNA 基因核苷酸序列相似性、限制性片段长度多态性,国际上将已鉴定出的植原体划分为52个暂定种(‘Ca.Phytoplasma’)、34个组(group)和100多个亚组(subgroup)[4]。
番茄Solanum lycopersicum L.是广东省主要的蔬菜品种之一,在全省各蔬菜产区均有广泛种植。近几年,冬种番茄在粤西地区发展迅速,面积逐年增加,已成为湛江市(雷州、遂溪、廉江)、茂名市电白等地农民收入来源的主要经济作物。2022年以来,本团队调查中发现广东省湛江市廉江市的冬种番茄产区发生疑似番茄巨芽病的新病害,田间病株主要表现为叶小、顶部枝梢和花柄肥大、腋芽上丛生直立的不定芽等症状。
番茄巨芽病(tomato big bud disease,TBB)是由植原体引起的一种病害,最早发现于澳大利亚[5],已在美国[6]、意大利[7]、伊朗[8]、印度[9]、埃及[10]、约旦[11]、巴西[12]、中国[13]等多个国家有报道。在我国,唐伟文等1982年首次在海南发现番茄巨芽病[13],随后,该病害在新疆和云南也有报道[1415]。笔者采用分子生物学方法,对发生在广东省廉江市疑似番茄巨芽病的病株样品进行检测,进一步对相关植原体的16S rRNA基因进行克隆和序列分析,明确其分类地位,为防治该病害提供科学依据。
1 材料与方法
1.1 试验材料和试剂
5份疑似巨芽病的樱桃番茄病样2022年2月采集于广东省廉江市番茄种植地。植物基因组DNA抽提试剂盒(Easypure Plant Genomic DNA Kit)和大肠杆菌Escherichia coli T1化学感受态细胞购自北京全式金生物技术有限公司;Premix TaqTM、pMD 19T Vector购自宝生物工程(大连)有限公司。
1.2 病样总DNA的抽提
取番茄病样100 mg,利用植物DNA提取试剂盒抽提其总DNA,具体步骤参照按试剂盒说明书。总DNA溶解于40 μL 灭菌的超纯水中,-20℃冰箱保存备用。
1.3 16S rRNA基因的扩增
利用扩增植原体16S rRNA基因的通用引物R16mF2(5′CATGCAAGTCGAACGGA3′)/R16mR1(5′CTTAACCCCAATCATCGAC3′)[16],对待测病样总DNA进行PCR检测,预期扩增目的片段大小为1.4 kb。反应体系25.0 μL:待测样品总DNA 1.0 μL, Ex TaqTM Premix 12.5 μL,上游引物(10 μmol/L) 1.0 μL,下游引物(10 μmol/L) 1.0 μL,超纯水9.5 μL。反应程序:95℃ 预变性4 min;95℃ 1 min,55℃ 1 min,72℃ 90 s,35个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测PCR产物。
1.4 基因克隆与测序
将所获目的片段进行纯化、连接至pMD19T载体,采用热激法将其转化到大肠杆菌T1感受态细胞,吸取80.0 μL菌液涂布在含100 μg/mL Amp、40 μL/mL Xgal的LB固体培养基平板上,37℃ 倒置培养过夜;从每个平板随机挑取3个阳性单菌落送至生工生物工程(上海)股份有限公司进行测序。
1.5 序列分析
利用DNAStar的SeqMan对序列进行拼接,将所得DNA序列在GenBank数据库中进行BLASTn搜索,确定是否为植原体基因序列;利用在线分析工具MUSCLE,将所获得的16S rRNA基因序列与已报道的相关序列进行相似性分析。采用MEGA 6.06的最大似然法(maximum likelihood,ML)[17]构建基于16S rRNA基因的系统进化树,Bootstrap值设置为1 000。进一步将16S rRNA基因相关片段序列通过植原体在线分类软件iPhyClassifier进行虚拟RFLP分析和计算相似系数,确定其分类地位[18]。
2 结果与分析
2.1 田间症状
番茄病株田间主要表现为叶小、顶部枝梢呈淡紫色、肥大,直立向上呈圆锥形,花柄肥大、花萼显著膨大,在叶腋处长出1个粗短肥大的腋芽,在腋芽顶部丛生若干个不定芽,病株不结果或结出少量坚硬的圆锥形小果实(图1),与已报道的番茄巨芽病田间症状类似。
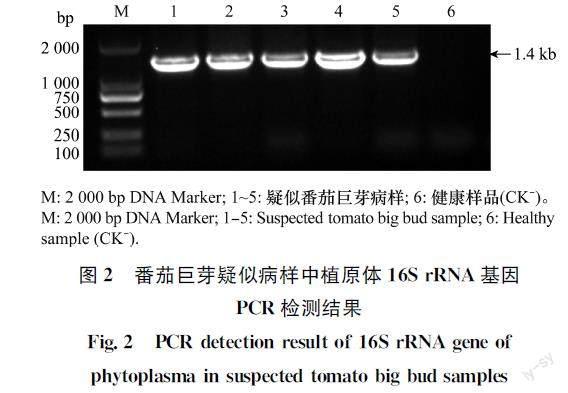
2.2 PCR检测结果
利用扩增植原体16S rRNA基因的引物R16mF2/
R16mR1对采集的5份番茄巨芽病疑似病样分别进行PCR检测,电泳结果显示(图2),能从5份病样中扩增出预期大小的目的片段,健康植株中未扩增出任何片段。这表明采集于广东省廉江市的番茄巨疑似病样中存在植原体,命名为广东番茄巨芽植原体(TBBGD2022)。
2.3 16S rRNA基因序列分析
克隆与测序分析结果表明,TBBGD2022的16S rRNA片段大小为1 430 bp (GenBank登录号为ON102780)。BLASTn结果显示,TBBGD2022与花生丛枝植原体组(16SrⅡ)成员的16S rRNA序列相似性最高。MUSCLE分析结果显示(表1):TBBGD2022与16SrⅡ组各植原体株系的16S rRNA基因序列相似性为96.82%~100%,与其他组植原体的相似性较低,为88.84%~91.42%;其中与来自中国海南、台湾、广东的隶属于16SrⅡV亚组的6个植原体株系以及来自印度的番茄巨芽病株系相似性最高,为100%。进一步比较发现,TBBGD2022与印度、中国、伊朗、澳大利亚、埃及、美国、新喀里多尼亚、坦桑尼亚、巴西报道的28个番茄巨芽植原体相关株系的16S rRNA基因序列相似性为88.84%~100%,其中與印度报道的TBBOT03株系相似性为100%,与中国报道的YNym、YM 株系相似性分别为99.93%、99.60%,而与中国新疆报道的ZYT3、syc1 株系相似性较低,为90.66%。
以柑橘黄龙病亚洲种广东株系(Candidatus Liberibacter asiaticus GuangdongHP,GenBank登录号为DQ432005)的16S rRNA序列为外组,利用MEGA 6.06的最大似然法对TBBGD2022与33个植原体株系进行系统进化分析,结果显示(图3),TBBGD2022与隶属于16SrⅡ组的15个番茄巨芽植原体株系及5个其他植原体株系聚集在一个大分支,亲缘关系较近;而与隶属于16SrⅠ、16SrⅢ、16SrⅥ、16SrⅨ、16SrⅫ组的13个番茄巨芽植原体株系亲缘关系较远。进一步以隶属于16SrⅠ组的翠菊黄化植原体(Aster yellows phytoplasma,GenBank登录号为AY389828)的16S rRNA序列为外组,对TBBGD2022与16SrⅡ组各亚组相关株系进行系统进化分析,结果显示(图4),其与16SrⅡA、16SrⅡD、16SrⅡV、16SrⅡP、16SrⅡQ和16SrⅡU等6个亚组植原体株系亲缘关系近,形成一个独立的大分支,其中与16SrⅡA、16SrⅡD、16SrⅡV 3个亚组亲缘关系最近。
2.4 16S rRNA基因序列的iPhyClassifier在线分析
利用植原体在线分类软件iPhyClassifier对TBBGD2022的16S rRNA基因中引物R16F2n/R16R2之间的片段进行虚拟RFLP分析,结果显示(图5):AluⅠ、BamH Ⅰ、Bfa Ⅰ、BstU Ⅰ、Dra Ⅰ、EcoR Ⅰ、Hae Ⅲ、Hha Ⅰ、Hinf Ⅰ、Hpa Ⅰ、Hpa Ⅱ、KpnⅠ、Sau3A Ⅰ、Mse Ⅰ、RsaⅠ、Ssp Ⅰ和TaqⅠ 17种限制性内切酶虚拟RFLP 图谱与16SrⅡV亚组的参考株系‘Praxelis clematidea’ phyllody phytoplasma (登录号:KY568717) 的酶切图谱相似性最高,相似系数为1.00,表明TBBGD2022属于16SrⅡV亚组成员。
3 结论与讨论
番茄巨芽病是番茄生产中一种毁灭性病害,植株一旦感染该病后,就无法正常开花结果。该病害1902年最早在澳大利亚发现,我国1982年最先在海南发现。2022年,本团队在广东廉江市发现了疑似番茄巨芽病新病害,PCR检测表明该病样感染了植原体,命名为广东廉江番茄巨芽植原体(TBBGD2022),属16SrⅡV亚组。本研究是番茄巨芽病在广东省发生的首次报道。
植原体是危害蔬菜作物的重要病原之一,已报道至少有16个组和超过21个亚组的植原体与蔬菜病害相关,其中与番茄巨芽病相关的至少有16SrⅠ、16SrⅡ、16SrⅢ、16SrⅤ、16SrⅥ、16SrⅨ、16SrⅫ 7个组的植原体[19]。我国海南、云南、新疆三省(自治区)有番茄植原体相关病害发生的报道,并对其进行了鉴定。唐伟文等通过症状、电镜观察、嫁接传染、抗菌素处理明确引起海南番茄巨芽病和丛枝病的病原为植原体[13],后续未见进一步相关研究报道。随着分子生物学技术的发展,Dong等明确与云南番茄黄化病有关的植原体属于16SrⅡA组[14]。Du等鉴定出与新疆番茄巨芽病相关植原体属于16SrⅥ组[15]。本文采用分子生物学技术明确与广东番茄巨芽病相关的植原体属于16SrⅡV亚组。可见,引起广东番茄巨芽病的植原体与我国新疆和云南株系存在差异,其中与新疆株系的差异较大,二者16S rRNA基因序列相似性仅为90.66%,且隶属不同组;与云南株系的差异较小,二者16S rRNA基因序列相似性99.93%,均隶属16SrⅡ组。
16SrⅡV亞组植原体是2017年首次从海南假臭草丛枝病样中鉴定出的一个新亚组[20],目前在绿豆Vigna radiata (L.) Wilczek[21]、大豆Glycine max (L.) Merr.[22]、皱子白花菜Cleome rutidosperma DC. Prodr.[23]、瓜叶栝楼Trichosanthes cucumerina L.[24]、一点红Emilia sonchifolia (L.) DC.[25]、皱叶烟草Nicotiana plumbaginifolia Viv.[26]、长序苋Digera muricata (L.) Mart.[27]、灰毛豆Tephrosia purpurea (L.) Pers.[28]、马松子Melochia corchorifolia L.[29]、花生Arachis hypogaea L.[30]已有报道。本文首次报道了在番茄上鉴定到16SrⅡV亚组植原体,为研究植原体多样性、分布以及病害防控提供了基础数据。
广东省地处热带和亚热带地区,常年高温高湿,物种资源丰富,植物和介体昆虫周年可生长与繁殖,为植原体在内的植物病害发生提供了十分有利的条件。广东地区已报道的植原体相关病害有花生丛枝病[3032]、水稻橙叶病[33]、茄子变叶病[34]、桉树黄化(丛枝)病[35]、桑树黄化矮缩病[36]、枣疯病[37]等,已给广东省农业生产造成了严重影响。本研究首次在广东湛江廉江发现植原体侵染引起的番茄巨芽病,该病害的病原TBBGD2022与发生在广东湛江遂溪的花生丛枝病[30]的病原分类地位一致,均为16SrⅡV亚组植原体。由此推测,该植原体病害极有可能通过介体昆虫在该区域蔓延。由于目前还缺乏有效防治植原体病害的药剂,防治传病介体昆虫对防控该类病害的扩散和发生至关重要。因此,下一步急需开展传菌介体昆虫种类鉴定、介体昆虫的田间带菌情况监测等研究工作,为植原体病害的防控提供科学依据。
参考文献
[1] DOI Y, TERANAKA M, YORA K, et al. Mycoplasma or PLT group like microorganisms found in the phloem elements of pants infected with mulberry dwarf, potato witches’broom, aster yellows or pauwlonia witches’broom [J]. Annals of the Phytopathological ;Society of Japan, 1967, 33(4): 259266.
[2] FIRRAO G, ANDERSEN M, BERTACCINI A, et al. ‘Candidcatus Phytoplasma’, a taxon for the wallless, nonhelical prokaryotes that colonize plant phloem and insects [J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(Pt 4): 12431255.
[3] RAZIN S, YOGEV D, NAOT Y. Molecular biology and pathogenicity of mycoplasmas [J]. Microbiology and Molecular Biology Reviews, 1998, 62(4): 10941156.
[4] 杨毅, 姜蕾, 李世访. 植原体分类鉴定研究进展[J]. 植物检疫, 2020, 34(5): 1320.
[5] COBB N A. Tomato blights [J]. Agricultural Gazette of New South Wales, 1902, 13: 410414.
[6] LEE I M, GUNDERSENRINDAL D E, DAVIS R E, et al. Revised classification scheme of phytoplasma based on RFLP analyses of 16S rDNA and ribosomal protein gene sequences [J]. International Journal of Systematic and Evolutionary Microbiology, 1998, 48(4):11531169.
[7] QUAGLINO F, COMASCHI C, CASATI P. et al. Molecular identification and characterization of phytoplasmas infecting tomato in North Italy [J]. European Journal of Plant Pathology, 2019, 153(1): 293299.
[8] SALEHI M, HOSSEINI S A E. The first report of a 16SrⅫA phytoplasma associated with tomato big bud disease in Iran [J]. Journal of Plant Pathology, 2016, 98(3): 692.
[9] MADHUPRIYA, KUMARI D A, VENNILA D S, et al. Increasing incidence of tomato big bud phytoplasma in Ranga Reddy District of Telangana State, India [J]. Indian Phytopathology, 2018,71(2): 207211.
[10]BEHIRY S. Detection of phytoplasmas associated with tomato witches’ broom and big bud disease in Egypt [J]. Journal of Plant Protection and Pathology, 2018, 9(9): 587590.
[11]ANFOKA G H A, KHALIL A B, FATTASH I. Detection and molecular characterization of a phytoplasma associated with big bud disease of tomatoes in Jordan [J]. Journal of Phytopathology, 2003, 151(4):223227.
[12]MELLO A, BEDENDO I P, CAMARGO L. Sequence heterogeneity in the 16s rDNA of tomato big bud phytoplasma belonging to group 16SrⅢ [J]. Journal of Phytopathology, 2010, 154(4): 245249.
[13]唐偉文, 骆学海, 张曙光, 等. 海南岛番茄巨芽病和番茄丛枝病的初步鉴定[J]. 植物病理学报, 1986, 16(2): 105108.
[14]DONG Jiahong, ZHANG Lei, MCBEATH J H, et al. ‘Candidatus Phytoplasma aurantifolia’related strain associated with tomato yellows disease in China [J]. Journal of General Plant Pathology, 2013, 79(5): 366369.
[15]DU Yejuan, MOU Haiqing, SHI Baoping, et al. Molecular detection and identification of a 16SrⅥ group phytoplasma associated with tomato big bud disease in Xinjiang, China [J]. Journal of Phytopathology, 2013, 161(11/12): 870873.
[16]GUNDERSEN D E, LEE I M. Ultrasensitive detection of phytoplasmas by nestedPCR assays using two universal primer pairs [J]. Phytopathologia Mediterranea, 1996, 35(3): 144151.
[17]TAMURA K, STECHER G, PETERSON D, et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 [J]. Molecular Biology and Evolution, 2013,30(12): 27252729.
[18]ZHAO Yan, WEI Wei, LEE I M, et al. Construction of an interactive online phytoplasma classification tool, iPhyClassifier, and its application in analysis of the peach Xdisease phytoplasma group (16SrⅢ) [J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59(10): 25822593.
[19]KUMAT S, NAGENDRAN K, RAL A B, et al. Global status of phytoplasma diseases in vegetable crops [J/OL]. Frontiers in Microbiology, 2019, 10: 1349. DOI: 10.3389/fmicb.2019.01349.
[20]YANGYi, JIANG Lei, TIAN Qian, et al. Detection and identification of a novel subgroup 16SrⅡV phytoplasma associated with Praxelis clematidea phyllody disease [J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(12): 52905295.
[21]CHEN Yenming, CHIEN Yuanyu, CHEN Yuhkun, et al. Identification of 16SrⅡV phytoplasma associated with mungbean phyllody disease in Taiwan [J]. Plant Disease, 2021, 105(9): 22902294.
[22]WANG Chienjui, CHIEN Yuanyu, LIAO Peiqing, et al. First report of 16SrⅡV phytoplasma associated with green manure soybean (Glycine max L.) in Taiwan [J]. Plant Disease, 2021, 105(7): 2012.
[23]CHIEN Yuyuan, TSAI Mingchen, CHOU Yuanlin, et al. Fringed spiderflower (Cleome rutidosperma) is a new host for purple coneflower witches’ broom phytoplasma, a 16SrⅡV subgroup strain in Taiwan [J]. Plant Disease, 2020, 104(4): 1247.
[24]WENG Yiying, LIOU Weicen, CHIEN Yuanyu, et al. First Report of 16SrⅡV peanut witches’ broom phytoplasma in snake gourd (Trichosanthes cucumerina L.) in Taiwan [J]. Plant Disease, 2021, 105(8): 2236.
[25]CHIEN Yuanyu, TAN Choonmeng, KUNG Yuehchen, et al. Lilac tasselflower (Emilia sonchifolia) is a new host for peanut witches’ broom phytoplasma, a 16SrⅡV subgroup strain in Taiwan [J]. Plant Disease, 2021,105(1): 211.
[26]LIAO Peiqing, CHEN Yuhkun, MEJIA H M, et al. Detection, identification, and molecular characterization of a 16SrⅡV subgroup phytoplasma associated with Nicotiana plumbaginifolia [J]. Plant Disease, 2022, 106(3): 805809.
[27]MEJIA H M, LIAO Peiqing, CHEN Yuhkun, et al. Detection, identification and molecular characterization of the 16SrⅡV subgroup phytoplasma strain associated with Digera muricata (L.) Mart. in Taiwan [J]. Plant Disease, 2022, 106(7): 17881792.
[28]YU Shaoshuai, ZHAO Ruiling, LIN Mingxing, et al. Tephrosia purpurea represents a new host of 16SrⅡV subgroup phytoplasma associated with witches’broom disease in China [J]. Plant Disease, 2021,105(8): 2235.
[29]YU Shaoshuai, WU Yuan, SONG Weiwei. Occurrence of a 16SrⅡV subgroup phytoplasma associated with witches’ broom disease in Melochia corchorifolia in China [J]. Plant Disease, 2022, 106(2): 754.
[30]汤亚飞, 林祺, 佘小漫, 等. 廣东花生丛枝病植原体的分子鉴定[J]. 植物保护, 2022, 48(5): 8390.
[31]陈慕容, 张曙光, 郑冠标, 等. 华南花生丛枝病发病规律及防治研究[J]. 广东农业科学, 1994(2): 3335.
[32]张曙光, 范怀忠. 华南花生丛枝病——由叶蝉传递的花生类菌原体性新病害的研究简报[J]. 华南农学院学报, 1981, 2(2): 104105.
[33]何园歌, 李舒, 郝维佳, 等. 水稻橙叶病分子检测及其在华南地区的发生与分布研究[J]. 中国植保导刊, 2016, 36(2): 912.
[34]LI Zhenggang, TANG Yafei, SHE Xiaoman, et al. First report of 16SrⅡD phytoplasma associated with eggplant phyllody in China [J]. Canadian Journal of Plant Pathology, 2019, 41(3): 339344.
[35]周国辉, 徐东林. 广东按树黄化(丛枝)病植原体分子鉴定与检测[J]. 植物保护学报, 2005, 32(4): 387391.
[36]刘清神, 许东林, 林盘芳, 等. 广州桑树植原体分子检测及多样性初探[J]. 蚕业科学, 2006, 32(1): 15.
[37]李正刚, 佘小漫, 汤亚飞, 等. 广东枣疯病植原体的鉴定[J]. 植物病理学报, 2019, 49(2): 281282.
(责任编辑:田 喆)
