小红尖椒对红酸汤的微生物群落结构及其品质的影响
2024-01-19刘金,王亮*
刘 金,王 亮*
(江苏大学 食品与生物工程学院,江苏 镇江 212013)
贵州黔东南是酸汤的发源地,该地区因气候潮湿,易流行腹泻等疾病,逐渐形成了“以酸代盐”的饮食习惯。酸汤不仅可以提高食欲,还可以帮助消化和止泻[1]。红酸汤的传统制作方法是将原料西红柿和辣椒去蒂洗净,并按照一定比例剁碎后,放在阴凉通风处自然发酵15~30 d即可食用[2-3]。红酸汤是用蔬菜自身附着的微生物或添加人工培养的乳酸菌为发酵剂,在厌氧环境下进行乳酸发酵而成的特色风味食品[4],通常被用来作为烹饪食品的调味品,并且可以促进消化、调节肠道菌群和增强免疫力[5]。
目前红酸汤的研究大多是关于优势菌的鉴定及发酵剂筛选。郑莎莎[6]利用从红酸汤中分离出来的优势乳酸菌(干酪乳杆菌H1)进行接种发酵。王若曦[7]对收集到的样品进行高通量测序,红酸汤的优势菌门主要是厚壁菌门,优势菌属主要为乳杆菌属。XIONG K X等[8]从自然发酵酸汤中筛选出一株产酸能力强的优势菌株,通过高通量测序鉴定为布氏乳杆菌,将此菌株作为外源细菌接种到酸汤中,发现其可以加速乳酸的形成,有利于抑制亚硝酸盐的积累。ZHOU X J等[9]接入混合的优势菌株发酵,发现接种红酸汤发酵的细菌多样性低于普通发酵的酸汤。宫路路等[10]对辣椒酸汤中的细菌群落进行高通量测序,并用传统培养法对乳酸菌进行分离鉴定,分离菌株为乳酸菌和芽孢杆菌,与测序结果一致。然而,关于红酸汤制作方法,尤其是添加小红尖椒对红酸汤微生物多样性的研究还比较少。
随着16S测序技术和生物信息学的发展和进步,高通量测序技术得到了广泛的应用[11-12],因此本研究使用高通量测序技术研究加入小红尖椒对红酸汤发酵的微生物结构的影响,同时测定理化指标,比较两组不同原料的红酸汤之间的差异,有助于揭示小红尖椒对红酸汤发酵过程中的微生物群落多样性的影响,以期确定小红尖椒在红酸汤发酵中的潜在效益,为红酸汤的产业化生产和工艺优化提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料小番茄、小红尖椒、食用盐:市售;500 mL食品级泡菜坛:湖南宝升塑业科技开发有限公司。
1.1.2 主要试剂
亚铁氰化钾、乙酸锌、冰乙酸、硼酸钠、盐酸、盐酸萘乙二胺、对氨基苯磺酸(均为分析纯):青岛高科技工业园海博生物技术有限公司;亚硝酸钠、氢氧化钠(均为分析纯):南京翼飞雪生物科技有限公司。
1.1.3 培养基
MRS培养基:高教研(北京)科技有限公司;标准平板计数琼脂培养基:南通飞宇生物科技有限公司。
1.2 仪器与设备
FE28pH计:梅特勒-托利多仪器有限公司;ZCZY-CS8V型摇床:上海知楚仪器有限公司;SW-CJ-2FD型超净工作台:苏州空泰空气技术有限公司;HY160冷冻离心机:湖南赫西仪器装备有限公司;DGL-100GL高压蒸汽灭菌锅:浙江力辰仪器科技有限公司;Varioskan LUX型酶标仪:赛默飞世尔科技(中国)有限公司;HH-4S型恒温水浴锅:上海捷呈实验仪器有限公司。
1.3 实验方法
1.3.1 不同原料的红酸汤制作工艺
不加小红尖椒(F)的红酸汤制作方法:将新鲜的小番茄去蒂、清洗,将小番茄和3%的食用盐放入搅拌机中搅拌约40 s,将制备好的红酸汤放入坛子中,每坛250 mL,共3坛,编号为F1~F3,混匀放入后25 ℃条件下恒温培养15 d。
加入小红尖椒(FL)的红酸汤制作方法:在上述条件中,加入去蒂、清洗的小红尖椒,小番茄和小红尖椒的比例为5∶1,其他发酵条件相同,编号为FL1~FL3。
1.3.2 样品采集
发酵时间设为0、1 d、3 d、5 d、7 d、11 d、13 d、15 d。进行取样时,将每坛红酸汤样品混匀取样1 mL用于微生物数量的测定,再取10 mL用于pH、总酸、亚硝酸盐的测定。发酵结束时,取样1 mL加入灭菌生理盐水,10 000 r/min、4 ℃条件下离心10 min,收集沉淀,-80 ℃冰箱保存,直至测序。取样时均采用五点法(样品的四周和中心位置)取样,且取样过程均在超净工作台完成。
1.3.3 理化指标的测定
参照GB 5009.237—2016《食品pH值的测定》,校准带有温度补偿器的pH计测定pH值;参照GB12456—2021《食品中总酸的测定》测定总酸(totalacid,TA),总酸含量以乳酸计;参照GB5009.235—2016《食品中氨基酸态氮的测定》测定样品的氨基酸态氮(amino acid nitrogen,AAN)。
1.3.4 微生物数量的测定
参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》、GB 4789.2—2023《食品安全国家标准食品微生物学检验菌落总数测定》的方法分别进行乳酸菌总数、菌落总数的测定。
1.3.5 DNA提取及测序
采用基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取红酸汤样本的DNA,细菌通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因的V4区进行扩增。PCR扩增条件为:95 ℃预变性30 s,28个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s),最后72 ℃延伸5 min,接着对扩增DNA进行检测、纯化与回收。本研究中的红酸汤样本委托天津诺禾致源生物信息科技有限公司完成,采用Illumina Miseq平台进行测序。
1.3.6 数据分析
所有实验均重复3次,经Illumina Miseq测序后所得的原始数据经拼接、去杂、优化后得到有效序列。使用Uparse对所有序列按97%相似水平进行操作分类单元(operational taxonomic unit,OTU)划分,再将OTU的代表序列与SILVA数据库(132.8版本)比对进行物种注释分析。R语言软件使用ggplot2绘制物种组成柱状图和核心微生物;用vegan包计算α多样性指数,并计算组间贝叶斯距离(Bray-Curtis)进行β多样性分析,基于在线网站(http://huttenhower.sph.harvard.edu/galaxy/)进行组间线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)。本研究中统计分析及绘图主要在R软件(R 4.2.0)和origin 2021中完成。
2 结果与分析
2.1 不同原料的红酸汤理化指标
2.1.1 不同原料红酸汤的pH和总酸变化
pH和总酸是发酵蔬菜成熟的重要标志[13]。由图1a可知,两组的pH在第3天均快速下降,FL组的pH下降的比F组较快,在发酵终点达到pH3.24,而F组的pH为3.55。由于发酵过程中是乳酸菌占主导地位,乳酸菌的迅速繁殖和有机酸的积累[14],使得两组的总酸从第三天开始快速增长,在第11天开始达到最高点并保持稳定。同时FL组的总酸远高于F组的总酸,原因可能是添加了辣椒导致有机酸的快速积累[15],FL组在发酵终点时以1.68%远高于F组的0.98%。可知,加入小红尖椒的的红酸汤与对照组相比表现出了更好的产酸能力,不仅缩短了红酸汤的发酵周期,而且还提高了可滴定酸含量。

图1 不同原料的红酸汤pH(a)和总酸(b)的变化Fig.1 Changes of pH (a) and total acid (b) of red sour soup with different raw materials
2.1.2 不同原料红酸汤的氨基酸态氮变化
氨基酸态氮是判断发酵产品发酵程度的特性指标,主要源于原料中蛋白质的分解。由图2可知,两组的氨基酸态氮含量呈现上下波动的趋势,F组的氨基酸态氮在0.12%~0.13%之间波动,FL组的含量则在0.14%~0.15%之间波动,FL组的值略高于F组,有可能是添加了小红尖椒,使得FL组含有较多的蛋白质不断被分解[15]。
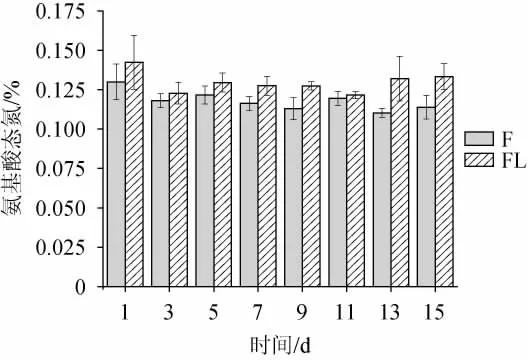
图2 不同原料的红酸汤氨基酸态氮的变化Fig.2 Changes of amino acid nitrogen in red sour soup with different raw materials
2.2 不同原料对红酸汤微生物数量变化的影响
由图3可知,两组的乳酸菌和菌落总数的变化趋势一致,均是先快速上升然后趋于稳定。其中乳酸菌呈显著正相关(P<0.05),表示乳酸菌在发酵过程中占重要地位[16]。两组的乳酸菌和菌落总数均在第1天开始增长,第5天上升到最高点,然后开始趋于稳定。在发酵过程中,FL组的乳酸菌和菌落总数均高于F组,发酵结束时,FL组的乳酸菌达到了7.94 lg CFU/g,F组的乳酸菌仅有7.14 lg CFU/g。FL组的乳酸菌高于F组,原因可能是FL组加入了小红尖椒,辣椒发酵过程中乳酸菌会快速生长、繁殖[17],同时大量的乳酸菌有利于病原微生物和腐败微生物的发酵和控制[18-19]。因此基于传统培养法,小红尖椒的加入可以保证优势菌群的生长繁殖,显著提高乳酸菌的丰度和竞争力,从而降低有害杂菌的生长,保证红酸汤的品质。

图3 不同原料的红酸汤乳酸菌(a)和菌落总数(b)的变化Fig.3 Changes of lactic acid bacteria counts (a) and total colonies counts (a) in red sour soup with different raw materials
2.3 细菌群落结构多样性分析
2.3.1 测序数据及OTU统计结果
6个样品经高通量测序得到的原始下机序列、有效序列和OTU数目如表1所示。去除原始测序数据中的接头信息,低质量碱基,未测出的碱基和嵌合体等干扰信息,最终得到的有效序列为73 443~86 772条,平均有效序列为81 661条。将有效序列以97%的相似水平进行OTU聚类,所有样本共得到451个OTU,未加小红尖椒的红酸汤共有221个OTU,加入小红尖椒的红酸汤共有292个OTU。由表1可知,所有样品的覆盖率(goods_coverage)均>0.99,覆盖率越高,说明样本中序列未被检测出来的概率越小。根据物种丰度而绘制的稀释曲线见图4。由图4可知,随着测序深度的加深,曲线几乎都处于平缓,说明本次测序的质量和深度可反映样本中微生物的多样性和丰富度。
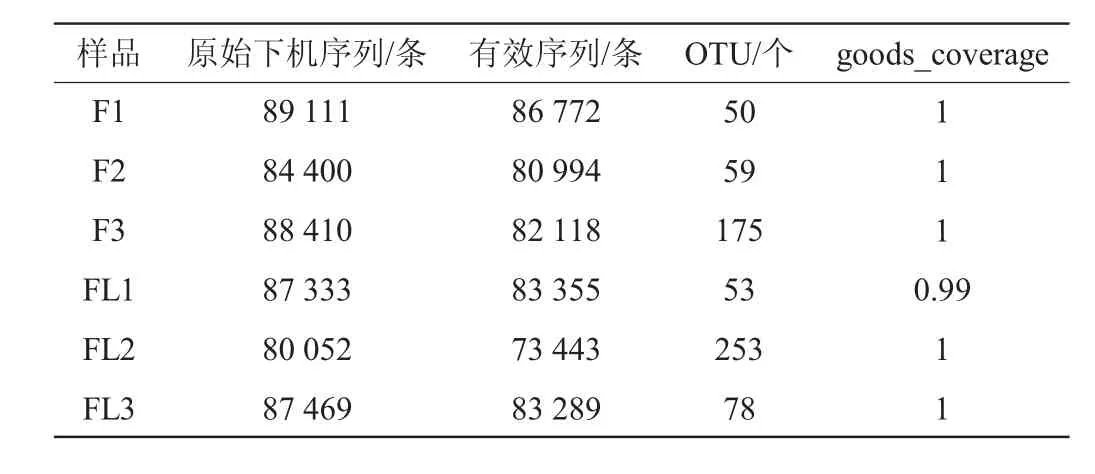
表1 测序序列数及操作分类单元数统计结果Table 1 Statistical results of sequence number and operational taxonomic unit number

图4 红酸汤样本微生物稀疏性曲线Fig.4 Rarefaction curves of microorganism red sour soup samples
2.3.2 细菌群落α多样性分析
Chao1指数常用来估计物种总数,Chao1指数越大,OTU数目越多,样本物种数就越多。Shannon和Simpson指数综合考虑了物种的丰富度和分布的均匀度,其中Shannon指数越大,说明群落多样性越高。Pielou_e指数仅反映均匀度,数值越大,越均匀[20]。两组样品的α多样性指数见表2。由表2可知,FL组的Chao1指数平均高于F组,同时FL2的Chao1和Shannon指数最高,而F1的Chao1指数和F3的Shannon指数最低,一定程度上说明FL组的物种多样性更高、物种数目更多。同时FL组的Simpson指数较F组略高,FL3的Simpson指数最高,说明FL组的物种丰富度更高。FL组的Pielou_e指数普遍高于F组,表示FL组的物种分布较均匀。相较于对照组,添加小红尖椒后增加了红酸汤的微生物多样性。
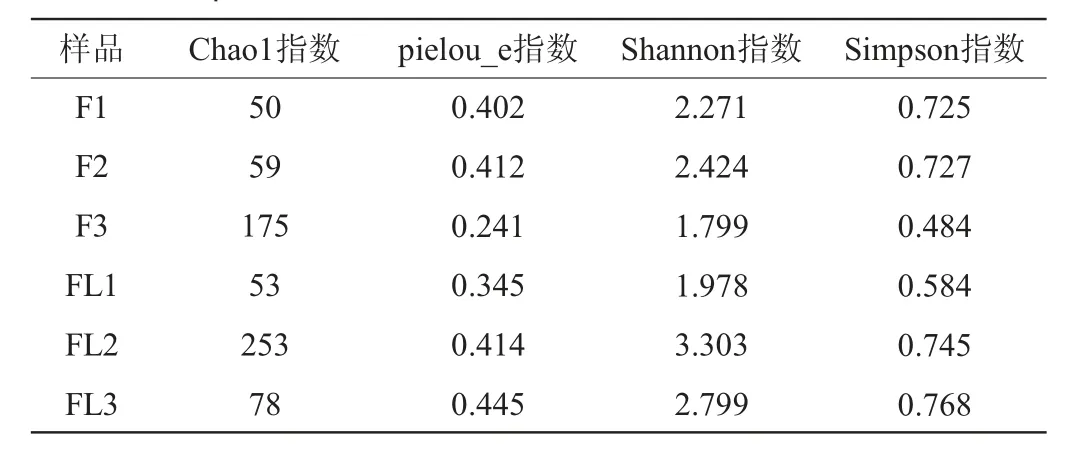
表2 不同原料的红酸汤细菌群落Alpha多样性分析Table 2 Alpha diversity analysis of bacterial communities in red sour soup from different raw materials
2.3.3 不同原料红酸汤细菌群落的α多样性分析
非度量多维尺度分析(non-metric multidimensional scaling,NMDS)是一种将多维空间的研究对象(样本或变量)简化到低维空间进行定位、分析和归类,同时又保留对象间原始关系的数据分析方法。基于加权UniFrac进行的NMDS分析用于进行不同原料的红酸汤的细菌群落的差异[21]。由图5可知,F1和F2的细菌群落相似度高,FL1和FL2也更相似,但是很明显F3距离F1、F2距离更远,说明未加小红尖椒的红酸汤细菌群落差异较大[22]。

图5 不同原料的红酸汤细菌群落非度量多维尺度图Fig.5 Non-metric multidimensional scaling diagram of bacterialcommunitiesinred sour soup from different raw materials
2.4 细菌群落结构组成分析
从门水平对不同原料的红酸汤的细菌菌群结构进行分析,结果见图6。
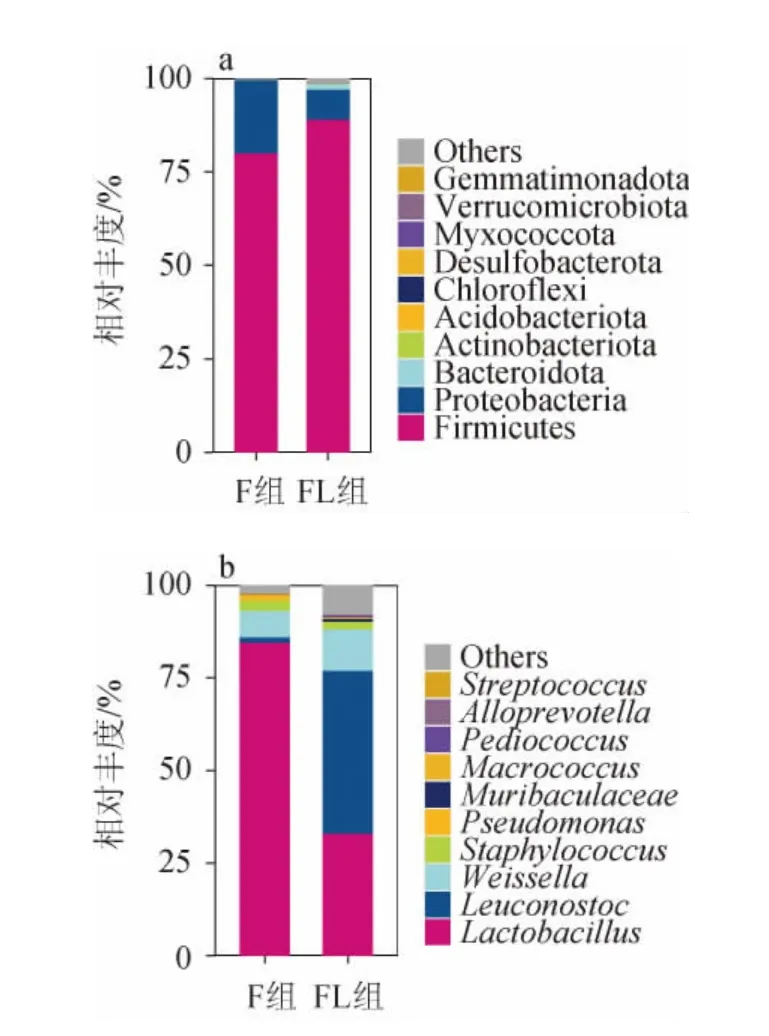
图6 不同原料的红酸汤细菌群落在门(a)和属(b)水平的相对丰度Fig.6 Relative abundances of bacterial communities in red sour soup from different raw materials at phylum(a)and genus(b)levels
由图6a可知,厚壁菌门(Firmicutes)和变形杆菌门(Proteobacteria)是两组红酸汤中共同的优势门(相对丰度>1%),该结果与之前的研究结果类似[5,9,20,23-24]。厚壁菌门在FL组的相对丰度更高,达到89.06%,在F组仅占80.09%。变形杆菌门由F组的19.56%下降到FL组的7.99%。此外,FL组中的优势门还有拟杆菌门(Bacteroidota)(1.47%)。较F组相比,FL组的厚壁菌门丰度提高8.97%,但是变形菌门的相对丰度大幅下降了11.57%,并且拟杆菌门成为优势菌门。宫路路等[24]也在辣椒红酸汤中发现了拟杆菌门的存在,猜测添加辣椒可能会在一定程度上促进厚壁菌门和拟杆菌们的生长,并且抑制变形菌门的生长。
从属水平对不同原料的红酸汤的细菌菌群结构进行分析,结果见图6b。由图6b可知,两组的优势属几乎一致,但是在两组的占比不同。F组的优势属(相对丰度>1%)为乳酸杆菌(Lactobacillus)(85.17%)、明串珠菌(Leuconostoc)(1.51%)、魏斯氏菌(Weissella)(7.14%)、葡萄球菌(Staphylococcus)(2.89%)、假单胞菌(Pseudomonas)(1.16%)。FL的优势属为乳酸杆菌(Lactobacillus)(36.24%)、明串珠菌(Leuconostoc)(44.86%)、魏斯氏菌(Weissella)(12.41%)、葡萄球菌(Staphylococcus)(2.26%)。
在属水平上,F组中除了乳酸杆菌以85.17%占绝对优势,还检测出了低丰度的葡萄球菌、假单胞菌。有研究表明,假单胞菌属被认为是腐败菌,可导致植物腐烂并能够感染人类伤口,甚至导致败血症[25]。此外,假单胞菌广泛存在于环境中,在日常发酵蔬菜中很常见,可附着在原料表面,容易导致西红柿、卷心菜、生菜、黄瓜等发酵蔬菜腐败变质[14,26]。因此推测F组的假单胞菌可能来自于原料小番茄的表面或者制作过程中。同时,金黄色葡萄球菌可引起食源性中毒、恶心和呕吐[27]。
小红尖椒的加入,使得FL组中葡萄球菌和假单胞菌相对丰度减少,ZHANG Y等[27]在辣椒酱里也发现辣椒会抑制葡萄球菌、假单胞菌等腐败菌的生长。另外,明串珠菌的丰度也从1.51%上升到44.86%,成为丰度最高的优势菌属。ZHOU X J等[9]也发现明串珠菌是红酸汤发酵过程中的优势菌属。以小红尖椒和小番茄为原料制成的红酸汤,在发酵过程中的优势菌属为乳酸杆菌、明串珠菌、魏斯氏菌,宫路路等[24]研究的酸汤也以番茄和辣椒为主要原材料,研究也表明乳酸杆菌是红酸汤发酵的优势菌属。乳酸杆菌通过新陈代谢能够产生乳酸从而降低pH,抑制有害菌和腐败菌等微生物的生长,因此乳酸杆菌在发酵蔬菜中广泛存在[28]。
综上,小红尖椒的加入可以显著的提高红酸汤的微生物多样性,同时可以有效的减少自然红酸汤发酵中产生的有害微生物,从而减低食用风险,提高红酸汤品质。
2.5 细菌群落差异性分析
2.5.1 LEfSe分析及生物标志物
利用LEfSe分析找到两组红酸汤样品在丰度上有显著差异的物种。图7展示了LDA分值大于2.0的差异物种,分别作为F组和FL组的生物标志物(即Biomaker),图中柱形图长度代表LDA分值的大小,长度越长即分值越高,说明该物种在两组之间的差异较大。F组仅鉴定出属水平上的芽孢杆菌属(Bacillus)1个生物标志物,而FL组生物标志物分类到属水平的有乳酸杆菌、魏斯氏菌、明串珠菌属、片球菌属(Pediococcus)、环丝菌属(Brochothrix)、肠球菌属(Enterococcus)、嗜冷杆菌属(Psychrobacter)、乳球菌属(Lactoccus),在目、纲、种水平都只有一个生物标志物,分别为Enterbacterales、Erwiniaceae、Lactobacillus acidipiscis。FL组中LDA分值最高的生物标志物是明串珠菌属。
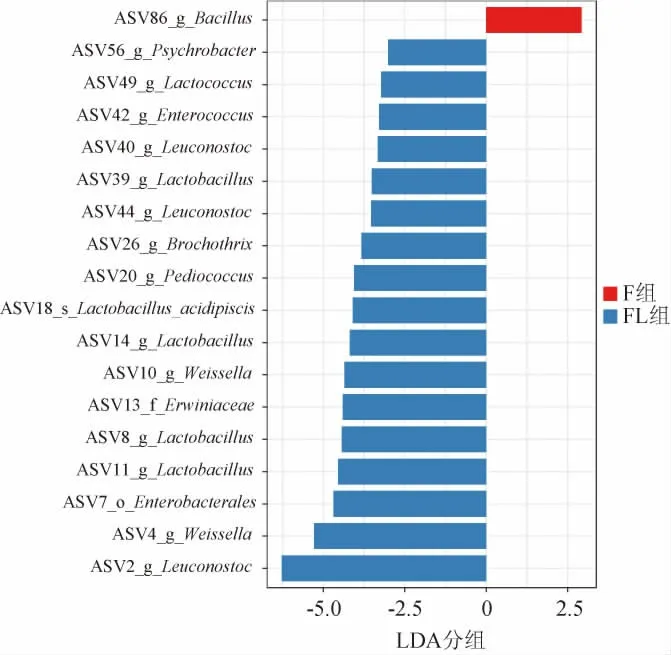
图7 基于操作分类单元水平的F和FL组微生物群落的线性判别分析效应大小Fig.7 Linear discriminant analysis effect size of microbial communities in F and FL groups based on operational taxonomic unit level
2.5.2 生物标志物与理化指标的相关性分析
为了探讨生物标志物与理化之间的关系,绘制了生物标志物与理化指标之间的Spearman相关性热图。pH和总酸是影响发酵蔬菜的重要指标,酸性条件可以抑制腐败菌的生长[29]。由图8可知,F组的杆菌属与总酸呈负相关,而FL组的除了ASV4.g.Weissella、ASV7.o.Enterobacterales、ASV13.f.Erwiniaceae外,其余14个生物标志物均与总酸呈显著性正相关(P<0.05),这解释了假单胞菌和葡萄球菌成为F组中的优势菌属,而FL组抑制了假单胞菌和葡萄球菌的丰度。氨基酸态氮是从原料中产生的游离氨基酸,F组的杆菌属与氨基酸态氮呈负相关,而FL组的所有标志物均与氨基酸态氮呈正相关,这也解释了图2中FL组的氨基酸态氮含量高于F组。
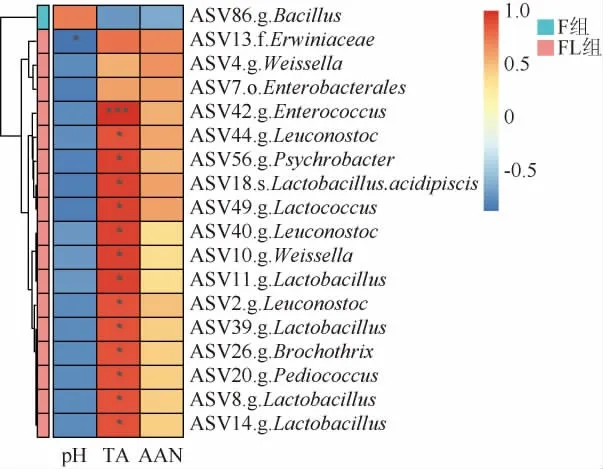
图8 线性判别分析效应大小鉴定的生物标志物与理化参数的相关性分析Fig.8 Correlation analysis between biomarkers identified by linear discriminant analysis effect size and physicochemical parameters
3 结论
本研究基于Illumina MiSeq高通量测序技术探讨不同原料对红酸汤微生物群落结构的影响,并结合理化进行分析。理化结果表明,FL组比F组具有更低的pH、较高的总酸和氨基酸态氮;FL组的乳酸菌数量和菌落总数均高于F组。测序结果表明,F组的绝对优势菌属为乳酸杆菌,FL组的优势菌属为乳酸杆菌、明串珠菌、魏斯氏菌;F组的生物标志物与总酸呈负相关,而FL组中大部分生物标志物与总酸呈显著性正相关(P<0.05)。通过对不同原料的红酸汤的理化和微生物区系的研究,发现添加小红尖椒的红酸汤具有更好的发酵优势,为红酸汤的产业化生产和工艺优化提供理论基础。
