绵羊卵泡中抗氧化酶表达的研究
2024-01-12岱红艳张家新
岱红艳,白 雪,张 宁,张家新
(1.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区羊遗传育种与繁殖重点实验室,内蒙古呼和浩特 010018;3.农业农村部肉羊遗传育种重点实验室,内蒙古 呼和浩特 010018)
卵巢的基本功能单位是卵泡, 卵泡由不同类型的细胞组成,其中,卵泡膜细胞和颗粒细胞是重要的体细胞, 它们的生理特性决定了卵泡发育能力和卵母细胞质量。在卵泡发育过程中,三级卵泡阶段开始形成卵泡腔。 卵泡直径的增大主要依靠颗粒细胞和卵泡膜细胞的增殖以及卵泡液的积累[1]。 随着卵泡的发育,其体积逐渐增大,对腺苷三磷酸(adenosine triphosphate,ATP)的需求也增加,但是在ATP 产生过程中也会形成大量的副产物,如活性氧(reactive oxygen species,ROS)。 正常水平的ROS 对卵泡发育至关重要,通过信号传导调节卵泡各种生理功能, 包括减数分裂恢复、排卵、黄体维持和消退[2]。但过量的ROS 则会引起细胞的氧化损伤并诱导细胞凋亡, 对卵巢功能和卵母细胞质量产生有害影响,因此,维持卵泡中ROS水平在正常范围内对卵母细胞成熟非常重要。 调节细胞内抗氧化功能的关键酶主要有超氧化物歧化酶 (superoxide dismutase,SOD)、 过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX) 和 过 氧 化 物 酶(peroxidase,PRDX)。 大量研究发现,在小鼠[3]、大鼠[4]、山羊[5]、牛[6]等动物的卵泡中都可以检测到SOD、CAT 和GPX 的活性,PRDX 在动物卵泡中的表达情况仍鲜见报道, 然而这些抗氧化酶在绵羊不同直径卵泡中的表达情况鲜有报道。鉴于此,笔者系统地研究了绵羊不同直径有腔卵泡发育过程中卵泡液ROS 含量、总抗氧化能力(total antioxidant capacity,TAC)以及SOD、CAT、GPX、PRDX 的活性变化,分析了不同直径卵泡的膜细胞、壁层颗粒细胞、卵丘细胞中Cu/Zn-SOD、CAT、GPX3、PRDX6 基因的mRNA 相对表达水平差异, 为进一步研究绵羊卵泡抗氧化功能的调节机制提供理论依据。
1 材料与方法
1.1 样品采集
1.1.1 卵巢的采集
于2020 年11 月至2022 年12 月, 从内蒙古呼和浩特市某屠宰场收集10~12 月龄、体重相近、健康的小尾寒羊的卵巢(共50 个),将采集的卵巢放入生理盐水中,快速带回实验室处理。
1.1.2 卵泡液的收集
在卵巢表面选取不同直径的有腔卵泡 (大腔≥6.0 mm,中腔2.0~6.0 mm,小腔≤2.0 mm)抽取卵泡液, 液氮保存后用于后续抗氧化酶活性的检测。
1.1.3 卵泡膜细胞的收集
用生理盐水清洗卵巢后,纵向剖开,将卵巢皮质剪成小条,剥开小腔、中腔、大腔卵泡,PBS 液清洗3 次,剖开卵泡,用刀刮除卵泡内壁以便清除壁层颗粒细胞,再用PBS 液清洗3 次,用眼科剪尽可能将卵泡膜剪碎后加液氮碾碎,使细胞完全分离。
1.1.4 壁层颗粒细胞的收集
使用10 mL 注射器分别抽取小腔、中腔、大腔卵泡的内容物,利用体视显微镜挑选出卵丘-卵母细胞复合体(cumulus-oocyte complexs,COCs)。 将剩余的壁层颗粒细胞悬浮液在室温条件下1 500 r/min离心5 min,弃上清液,回收下层细胞沉淀,用PBS液清洗3 次后离心,冻存用于后续试验[7]。
1.1.5 卵丘细胞的收集
将COCs 用涡旋仪振荡15 min, 剔除裸卵后收集分散的卵丘细胞,用PBS 清洗3 次,在室温条件下1 500 r/min 离心5 min,弃上清液,保存细胞沉淀冻存备用[7]。
1.2 蛋白浓度的检测
检测ROS 含量、TAC 以 及SOD、CAT、GPX、PRDX 活性时需要将卵泡液适当稀释后再进行测定,因此,根据BCA 蛋白浓度测定试剂盒(武汉博士德生物工程有限公司)分别对绵羊大腔、中腔、小腔卵泡的卵泡液进行蛋白浓度检测。在96 孔板中依次加入准备的标准品和待测样品各20 μL,之后在每个测定孔中再加200 μL BCA 工作液,孵育箱设置37 ℃,摇床孵育20 min 后,使用酶标仪(美国Bio-Tek 公司) 在562 nm 波长下测定吸光度值,根据要求计算出样品的蛋白浓度,最后乘以稀释倍数[8]。
1.3 总抗氧化能力的检测
根据总抗氧化能力检测试剂盒(上海碧云天生物技术有限公司) 对卵泡液中的TAC 进行检测。 首先准备过氧化物酶工作液以及大腔、中腔、小腔卵泡的卵泡液各10 μL、适量准备ABTS 工作液,并设置空白对照组,依次加入96 孔板中,室温孵育6 min 之后在414 nm 下测定吸光度值, 最后通过标准曲线计算出总抗氧化能力[8]。
1.4 活性氧检测
根据活性氧检测试剂盒(北京索莱宝科技有限公司)对卵泡液中的ROS 水平进行检测,使用1∶1 000 无血清培养液稀释DCFH-DA,使其浓度为10 μmol/L,细胞培养箱内设置为37 ℃孵育20 min,在488 nm 激发波长、525 nm 发射波长下, 用酶标仪检测荧光强度。
1.5 抗氧化酶活性检测
1.5.1 SOD 活性的检测
使用超氧化物歧化酶活性检测试剂盒 (上海碧云天生物技术有限公司)对卵泡液中的SOD 活性进行检测。 准备卵泡液样品、SOD 检测缓冲液、WST-8 酶和工作液, 依次加入96 孔板中37 ℃孵育30 min。 之后使用酶标仪在450 nm 下测定吸光度值,最后按要求计算卵泡液中的SOD 活性[8]。
1.5.2 CAT 活性的检测
根据过氧化氢酶活性检测试剂盒 (上海碧云天生物技术有限公司)对卵泡液中的CAT 活性进行检测。首先设置空白对照组,1∶50 稀释不同直径有腔卵泡的卵泡液样品, 准备过氧化氢酶检测缓冲液和过氧化氢溶液,加入96 孔板中并用摇床混匀,25 ℃孵育5 min 后加入终止液。 离心管中加入40 μL 过氧化氢酶检测缓冲液,再加入10 μL 上述反应体系轻轻混匀。 在96 孔板中先加入10 μL上述反应液,再加200 μL 显色工作液。 25 ℃孵育15 min,用酶标仪在520 nm 下测定吸光度值,根据要求计算出CAT 活性[8]。
1.5.3 GPX 活性的检测
使用总谷胱甘肽过氧化物酶检测试剂盒 (上海碧云天生物技术有限公司)对卵泡液的GPX 活性进行检测。 准备GPX 检测缓冲液和GPX 检测工作液,1∶50 稀释样品后加入96 孔板中, 充分混匀,之后加40 μL GPX 检测工作液,室温下孵育15 min 后立刻加10 μL 过氧化物试剂溶液充分混匀,用酶标仪在340 nm 下测定吸光度值,10 min之内连续测定5 次,最后根据要求计算GPX 活性[8]。
1.5.4 PRDX 活性的检测
使用过氧化物酶活性检测试剂盒 (苏州格锐思生物科技有限公司) 对卵泡液的PRDX 活性进行检测,在96 孔板中依次加入卵泡液样品和试剂盒内的试剂一、 试剂二、 试剂三, 混匀后立即在470 nm 处读取吸光度值A1,1 min 后读取吸光度值A2,最后根据要求计算出PRDX 活性[8]。
1.6 卵泡膜细胞、壁层颗粒细胞和卵丘细胞的总RNA 提取和抗氧化酶基因mRNA 相对表达量的qPCR 检测
卵泡膜细胞、 壁层颗粒细胞和卵丘细胞总RNA 提取使用TransZol Up 试剂盒(北京全式金生物技术股份有限公司), 使用TaKaRa 反转录试剂盒将总RNA 反转录为cDNA。 根据GenBank 中公布的绵羊cDNA 序列,利用BLAST 设计抗氧化酶基因引物(见表1)。 引物由生工生物工程(上海)股份有限公司合成。 根据荧光定量PCR 试剂盒TB GreenRPremix Ex TaqTMⅡ(TaKaRa 公司)说明书进行qPCR 试验, 对不同直径有腔卵泡中Cu/Zn-SOD、CAT、GPX3 和PRDX6 基因的mRNA 表达量进行相对定量分析。 将β-actin 作为内参基因,利用2-ΔΔCt法计算上述抗氧化酶基因mRNA 在绵羊卵泡膜细胞、 壁层颗粒细胞和卵丘细胞中的相对表达量。
1.7 统计分析
使用SAS 9.2 软件进行F 检验统计分析,所有试验重复3~5 次,P<0.01 表示差异极显著,P<0.05表示差异显著,P>0.05 表示差异不显著。
2 结果与分析
2.1 绵羊不同直径有腔卵泡的卵泡液中总抗氧化能力和总活性氧含量检测结果
分别对不同直径有腔卵泡的卵泡液中的TAC和ROS 含量进行测定。 如图1 所示,从小腔卵泡到大腔卵泡,卵泡液中的TAC 呈上升趋势,但差异不显著(P>0.05);从小腔卵泡到大腔卵泡,卵泡液中的ROS 含量呈下降趋势, 但差异不显著(P>0.05)。
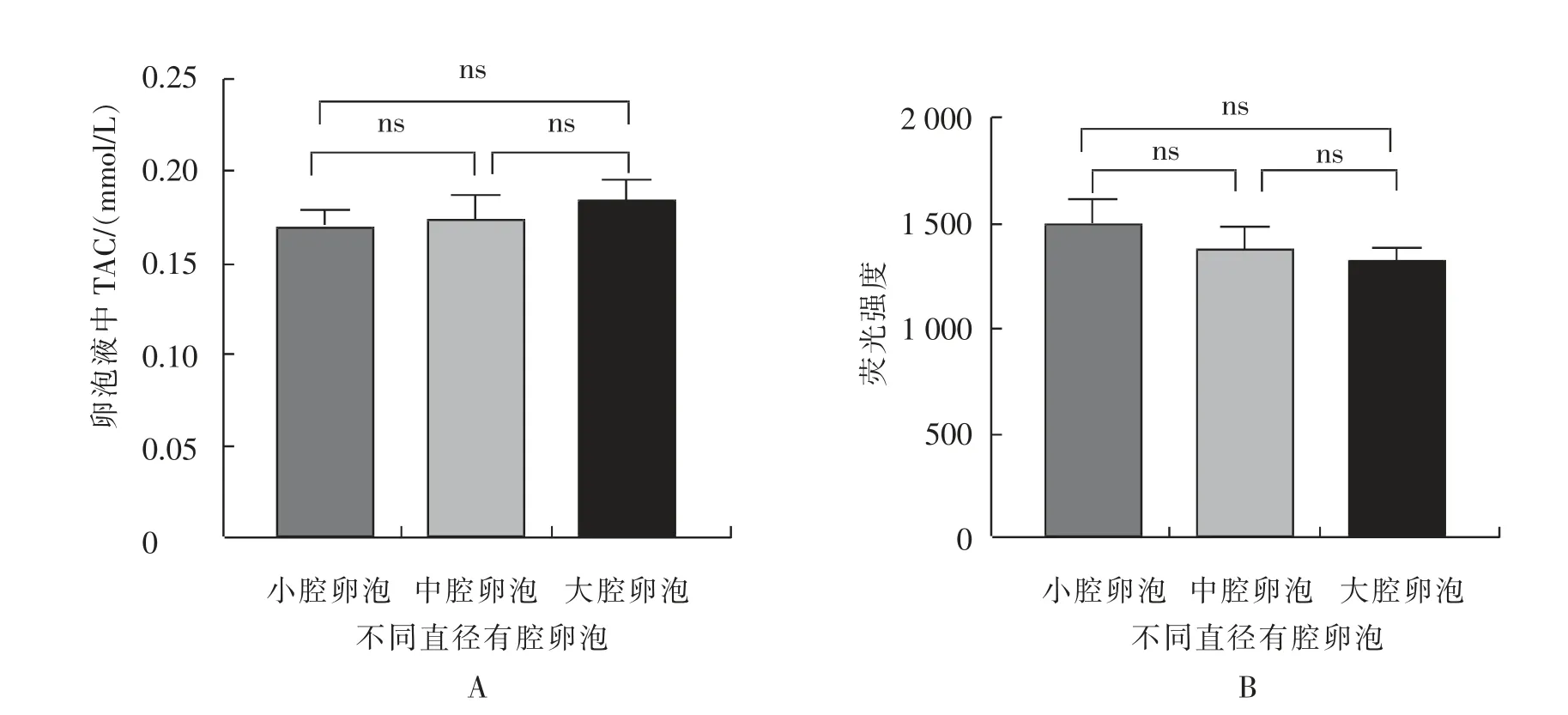
图1 绵羊不同直径卵泡中卵泡液总抗氧化能力和活性氧含量测定结果
2.2 绵羊不同直径卵泡液中抗氧化酶活性检测结果
如图2 所示,小腔卵泡中卵泡液的SOD 活性与中腔卵泡无显著(P>0.05)差异,但极显著(P<0.01)高于大腔卵泡,中腔卵泡的卵泡液中的SOD活性显著(P<0.05)高于大腔卵泡。 在卵泡液CAT活性方面,中腔卵泡和大卵泡极显著(P<0.01)高于小腔卵泡,且两者间无显著(P>0.05)差异。 小腔卵泡的卵泡液中的GPX 活性极显著(P<0.01)高于大腔卵泡, 而中腔卵泡与小腔卵泡和大腔卵泡差异不显著(P>0.05)。 卵泡液PRDX 活性从小腔卵泡到中腔卵泡再到大腔卵泡呈极显著(P<0.01)下降趋势。
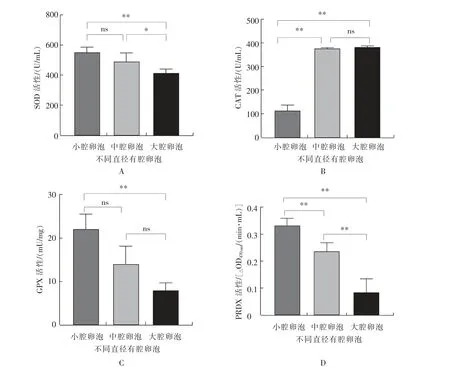
图2 绵羊不同直径卵泡的卵泡液中抗氧化酶活性
2.3 绵羊不同直径卵泡中卵泡膜细胞、壁层颗粒细胞和卵丘细胞的Cu/Zn-SOD 基因mRNA 相对表达量检测结果
如图3 所示, 小腔卵泡中卵泡膜细胞的Cu/Zn-SOD 基因的mRNA 相对表达水平极显著 (P<0.01)高于中腔卵泡和大腔卵泡,中腔卵泡与大腔卵泡差异不显著(P>0.05)。 如图4 所示,小腔卵泡中壁层颗粒细胞的Cu/Zn-SOD 基因mRNA 相对表达水平极显著(P<0.01)高于中腔卵泡和大腔卵泡,中腔卵泡与大腔卵泡差异不显著(P>0.05)。 如图5 所示,卵丘细胞中Cu/Zn-SOD 基因的mRNA相对表达水平在中腔卵泡中极显著(P<0.01)高于小腔和大腔卵泡,且大腔卵泡极显著(P<0.01)高于小腔卵泡。
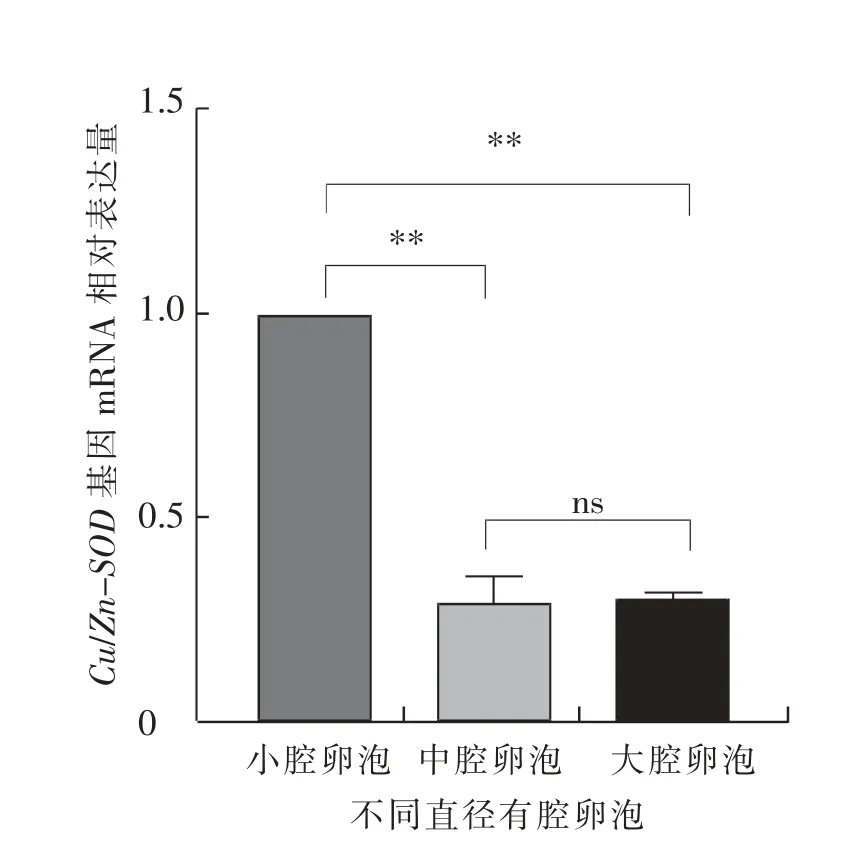
图3 绵羊不同直径卵泡的卵泡膜细胞中Cu/Zn-SOD 基因的mRNA 相对表达水平

图4 绵羊不同直径卵泡的壁层颗粒细胞中Cu/Zn-SOD基因的mRNA 相对表达水平

图5 绵羊不同直径卵泡的卵丘细胞中Cu/Zn-SOD基因的mRNA 相对表达水平
2.4 绵羊不同直径卵泡中卵泡膜细胞、壁层颗粒细胞和卵丘细胞的CAT 基因mRNA 相对表达量检测结果
如图6 所示, 大腔卵泡中卵泡膜细胞的CAT基因mRNA 相对表达水平极显著(P<0.01)高于小腔卵泡和中腔卵泡, 小腔卵泡与中腔卵泡差异不显著(P>0.05)。 如图7 所示,大腔卵泡中壁层颗粒细胞的CAT 基因mRNA 相对表达水平极显著(P<0.01)高于小腔卵泡和中腔卵泡,且小腔卵泡显著(P<0.05)高于中腔卵泡。 如图8 所示,小腔卵泡中卵丘细胞的CAT 基因mRNA 相对表达水平极显著(P<0.01)低于中腔卵泡和大腔卵泡,且中腔卵泡显著(P<0.05)低于大腔卵泡。
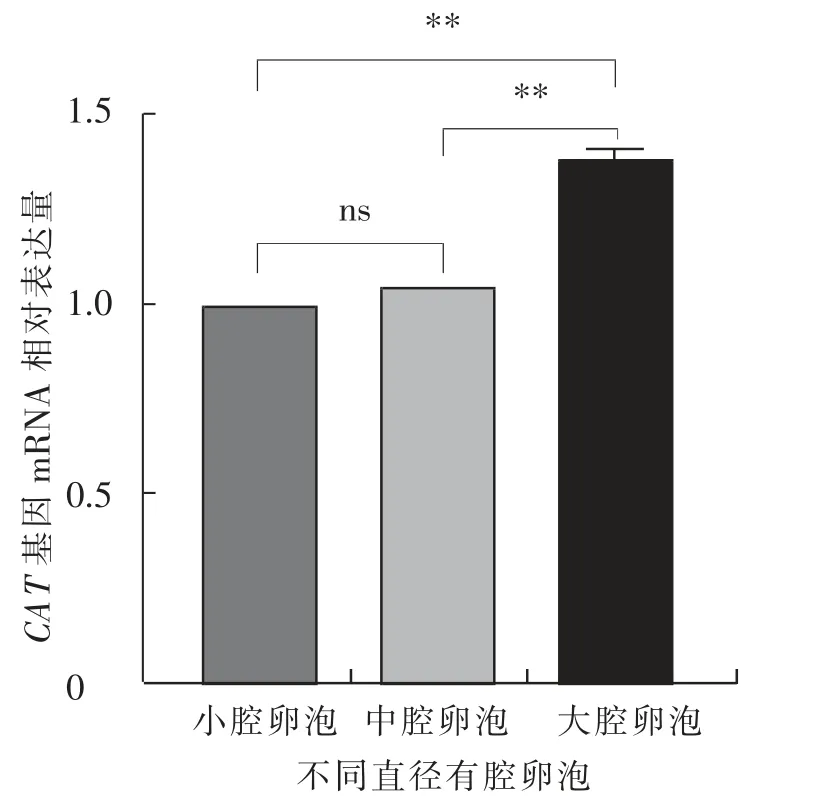
图6 绵羊不同直径卵泡的卵泡膜细胞中CAT基因的mRNA 相对表达水平

图7 绵羊不同直径卵泡的壁层颗粒细胞中CAT基因的mRNA相对表达水平
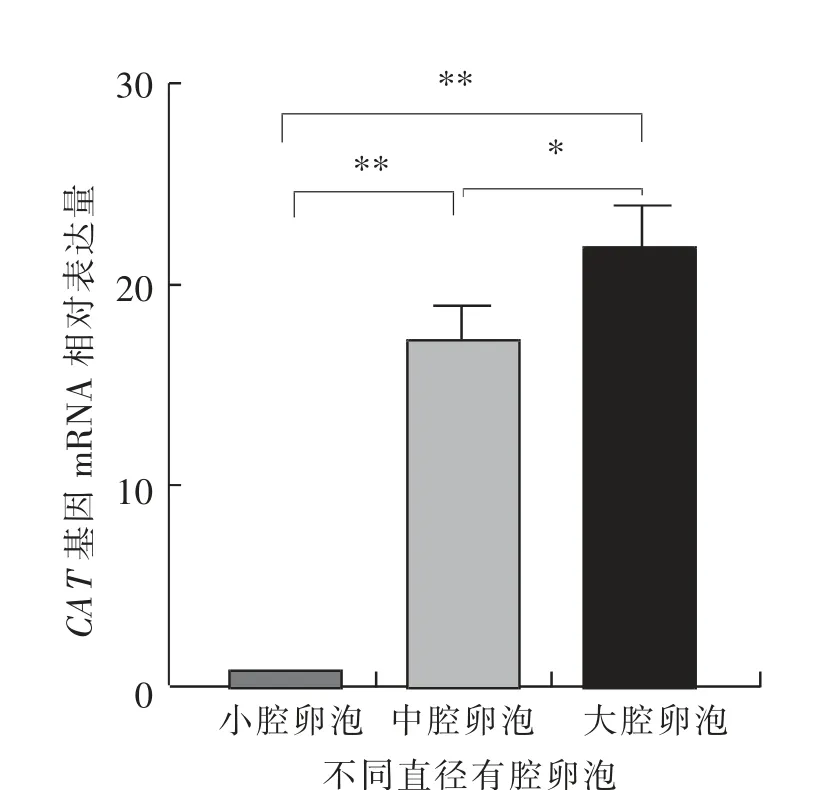
图8 绵羊不同直径卵泡中卵丘细胞中CAT基因的mRNA 相对表达水平
2.5 绵羊不同直径卵泡中卵泡膜细胞、壁层颗粒细胞和卵丘细胞的GPX3 基因mRNA 相对表达量检测结果
如图9 所示,小腔卵泡中卵泡膜细胞的GPX3基因mRNA 相对表达水平极显著(P<0.01)高于中腔卵泡和大腔卵泡, 中腔卵泡与大腔卵泡差异不显著(P>0.05)。 如图10 所示,小腔卵泡中壁层颗粒细胞的GPX3 基因mRNA 相对表达水平极显著(P<0.01)高于中腔卵泡和大腔卵泡,中腔卵泡与大腔卵泡差异不显著(P>0.05)。 如图11 所示,卵丘细胞中GPX3 基因的mRNA 相对表达水平在中腔卵泡中极显著(P<0.01)高于小腔卵泡和大腔卵泡,且中腔卵泡与大腔卵泡差异不显著(P>0.05)。

图9 绵羊不同直径卵泡的卵泡膜细胞GPX3基因的mRNA 相对表达水平

图10 绵羊不同直径卵泡壁层颗粒细胞中GPX3 基因的mRNA 相对表达水平

图11 绵羊不同直径卵泡卵丘细胞中GPX3基因的mRNA 相对表达水平
2.6 绵羊不同直径卵泡中卵泡膜细胞、壁层颗粒细胞和卵丘细胞的PRDX6 基因mRNA 相对表达量检测结果
如图12 所示, 小腔卵泡中卵泡膜细胞的PRDX6 基因mRNA 相对表达水平极显著 (P<0.01)高于中腔卵泡和大腔卵泡,且中腔卵泡极显著(P<0.01)高于大腔卵泡。 如图13 所示,小腔卵泡中壁层颗粒细胞的PRDX6 基因mRNA 相对表达水平极显著 (P<0.01) 高于中腔卵泡和大腔卵泡,中腔卵泡与大腔卵泡差异不显著(P>0.05)。 如图14 所示,卵丘细胞中PRDX6 基因的mRNA 相对表达水平在中腔卵泡中极显著(P<0.01)高于小腔卵泡和大腔卵泡, 小腔卵泡与大腔卵泡差异不显著(P>0.05)。
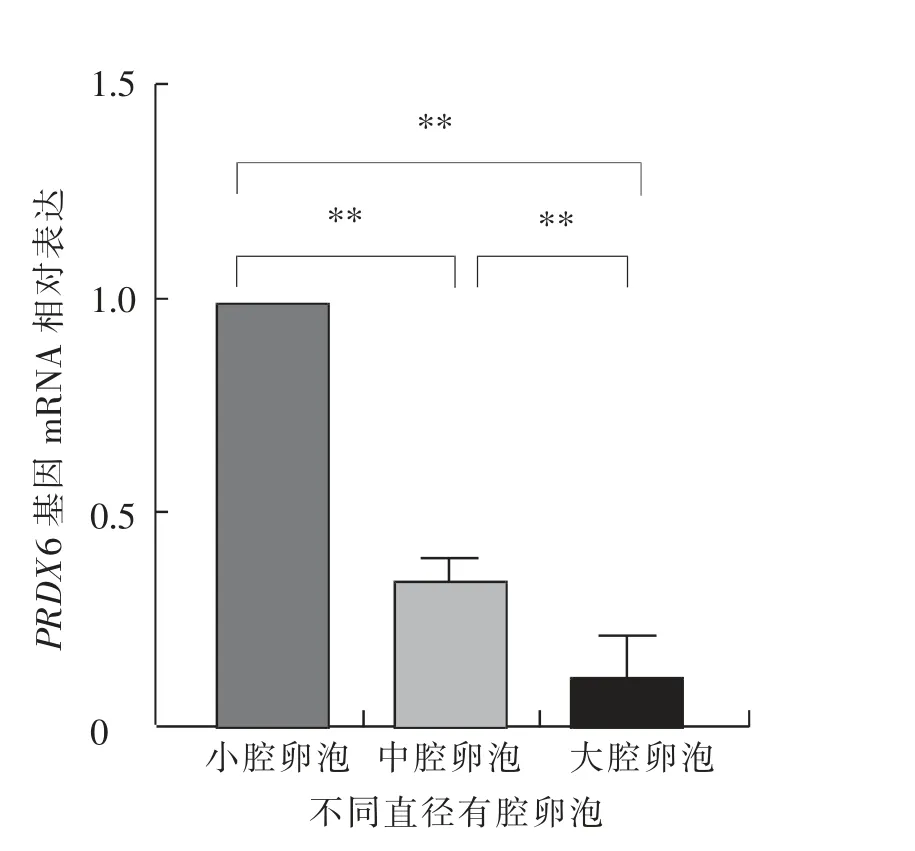
图12 绵羊不同直径卵泡的卵泡膜细胞中PRDX6基因的mRNA 相对表达水平
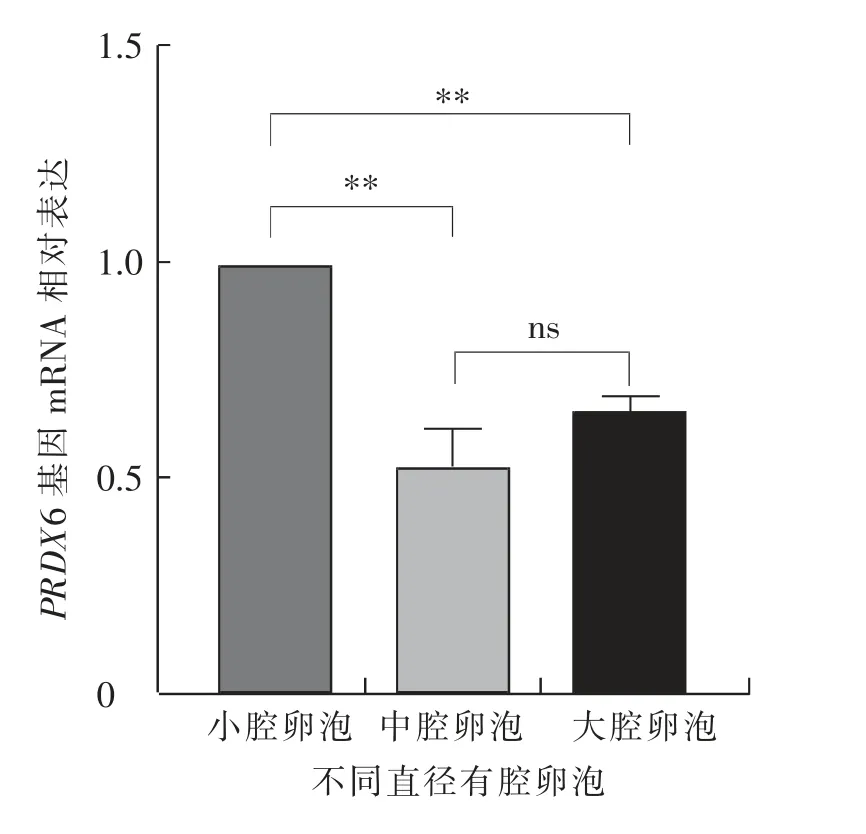
图13 绵羊不同直径卵泡壁层颗粒细胞中PRDX6基因的mRNA 相对表达水平
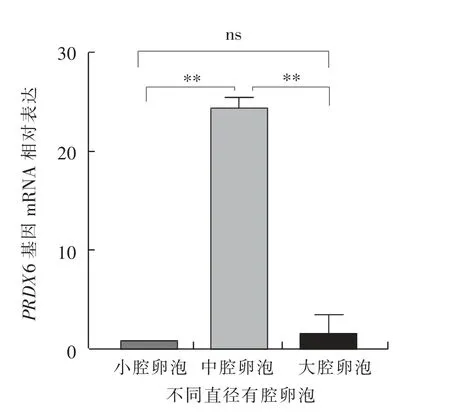
图14 绵羊不同直径卵泡卵丘细胞中PRDX6基因的mRNA 相对表达水平
3 讨论
卵泡主要由卵母细胞、 颗粒细胞和卵泡膜细胞组成, 卵泡膜细胞通过两个主要方面参与卵泡的全面发育:一是雄激素的合成和分泌,二是为颗粒细胞和卵母细胞发育提供能量和信号交换。 随着卵泡发育, 颗粒细胞又分为壁层颗粒细胞和卵丘细胞两类, 卵丘细胞的主要功能是保证卵母细胞的生长和发育,而壁层颗粒细胞起到屏障作用,维持卵泡结构并发挥主要类固醇激素合成的功能[9]。 随着卵泡发育,类固醇生成和代谢需求不断增强[10-11],ROS 生产也不断升高,卵泡面临的氧化应激也随之增加。 卵母细胞和体细胞的分泌物组成了卵泡液微环境, 可通过分子和生化途径调节卵巢功能。 卵泡液中的活性氧很容易与细胞内其他分子(例如蛋白质、脂质及DNA)反应,并可能导致细胞损伤和功能破坏[12],研究表明,尽管在不同动物的卵泡中可以检测到抗氧化酶的表达,但相关酶的活性和分子表达有着明显的种属差异性[5,13],因此,有必要明确绵羊不同直径卵泡中相关抗氧化酶的表达模式。
活性氧(ROS)是正常细胞代谢的副产物[14],当ROS 异常增高时会对机体产生毒害作用。 机体能够通过清除过多的ROS 使细胞内ROS 保持一定水平,这种能力称为总抗氧化能力。总抗氧化能力是酶类和非酶类抗氧化剂成分的总和, 本试验结果表明, 从小卵泡到大卵泡的卵泡液TAC 和ROS 含量无明显变化, 这与人的从小卵泡液到大卵泡液中TAC 和ROS 含量的趋势相一致[15],并且在猪的卵泡中,ROS 含量也没有随着卵泡的增大而增加[16-17]。 这说明在动物卵泡发育过程中,ROS含量和TAC 能够维持在一定的水平。
SOD 是一种抗氧化酶, 可高效地去除超氧阴离子,SOD 由3 种同工酶组成: ①铜/锌SOD(Cu/Zn-SOD,SOD1),位于线粒体的细胞质、细胞核和膜间隙中[18];②锰SOD(Mn-SOD,SOD2),存在于线粒体基质中;③细胞外SOD(EC-SOD、SOD3)[19]。Cu/Zn-SOD 是一种高度保守且丰富的金属酶,可催化超氧自由基歧化为过氧化氢和分子氧[20-21]。Cu/Zn-SOD 通过清除细胞毒性超氧自由基和产生可用于氧化和调节下游靶点活性的过氧化氢,在氧化应激保护和氧化还原信号传导中发挥双重作用。 细胞质Cu/Zn-SOD 缺乏导致黄体生成减少和血清P4 水平降低[22],这与卵巢中ROS 产生增加有关[9]。在本研究中,卵泡液中SOD 的活性从小卵泡到大卵泡呈下降趋势。 Combelles 等[6]对牛卵泡的研究表明,与大卵泡相比,小卵泡中的SOD 水平最高。 这表明,随着绵羊卵泡发育,对SOD 的需求逐渐下降。另外本研究结果表明,壁层颗粒细胞和卵泡膜细胞Cu/Zn-SOD 基因的mRNA 水平从小卵泡到大卵泡呈下降趋势, 而卵丘细胞中Cu/Zn-SOD 基因的mRNA 表达水平呈先上升后下降趋势, 可能是卵母细胞加速了卵丘细胞的发育速度导致从小卵泡到大卵泡中的卵母细胞获得发育能力和非常活跃的新陈代谢, 在此过程中会产生大量活性氧,因此,需要Cu/Zn-SOD 升高来中和卵母细胞的细胞质中的自由基, 以保证正常细胞功能的自由基和过氧化氢之间的平衡。 说明随着卵母细胞的成熟, 壁层颗粒细胞和卵丘细胞的抗氧化酶的表达呈区域性表达, 为了保护卵母细胞正常代谢,免受氧化损伤,两种细胞根据功能的不同及各抗氧化酶对应的功能和细胞内定位不同,表达相应发生改变。
过氧化氢酶(CAT)是一种酶促抗氧化剂,主要参与维持ROS 产生与降解的平衡,可以将H2O2转化为H2O 和O2,防止过氧化,在保护卵巢免受潜在的氧化损伤方面起着关键作用。在本研究中,卵泡液中的CAT 活性从小卵泡到大卵泡呈极显著上升趋势, 这表明随着绵羊卵泡发育, 对CAT的需求逐渐上升。 Basini 等[9]的研究结果表明,在猪卵泡液中CAT 活性在大卵泡中最高,这与本研究结果相似,但在牛的卵泡液中,与中腔和大腔卵泡相比,CAT 活性在小卵泡的卵泡液中最高[6],由此看来,CAT 在卵泡中的活性表达模式可能存在物种差异。随着卵泡腔的增大,CAT 基因的mRNA在卵泡膜细胞、 壁层颗粒细胞和卵丘细胞中的表达都呈现上升的趋势,对山羊[5]的研究结果表明,与小腔和中腔卵泡相比, 大腔卵泡颗粒细胞中的过氧化氢酶活性增加了3 倍, 这与本研究结果相似。在卵泡发育过程中,由于卵母细胞自身无法合成CAT[23-24],因此大卵泡需要更多的CAT 来维持卵泡内以及卵母细胞内的氧化还原平衡。
GPXs 可以消除机体产生的过氧化氢和有机氢过氧化物(主要是脂质过氧化物ROOH),降低活性氧对机体的破坏作用。 谷胱甘肽过氧化物酶GPX3 是该家族中唯一的细胞外成员, 可催化H2O2的还原和脂质过氧化物防止膜过氧化[25]。 本研究结果表明,与中腔和大腔卵泡的卵泡液相比,小腔卵泡液中的GPXs 活性明显升高。 Basini 等[9]测定了不同直径猪卵泡的卵泡液中的GPXs,结果也发现小卵泡液中的GPXs 活性更高,此外GPX3在卵泡膜细胞和卵泡壁层颗粒细胞中的mRNA 水平从小腔卵泡到大腔卵泡呈极显著下降趋势,这说明由于在小腔卵泡时SOD 表达升高所产生的过氧化氢增多导致小腔卵泡中的卵泡膜细胞和壁层颗粒细胞需要高表达GPX3,GPX3 的mRNA 水平在小腔、中腔、大腔卵泡卵丘细胞中呈先上升后下降趋势, 中腔卵泡极显著高于小腔卵泡和大腔卵泡中表达。 这说明卵丘细胞通过增强卵母细胞中的GPX 含量,在保护卵母细胞免受氧化应激诱导的细胞凋亡方面具有关键作用[25]。
过氧化物酶6(PRDX6)是一种普遍表达的非硒依赖性谷胱甘肽过氧化物酶, 可直接清除H2O2(或其他低分子量氢过氧化物)[26]。据报道,PRDX6控制卵丘-卵母细胞复合物和早期胚胎中过氧化氢的水平[27]。 在本研究发现,卵泡液中PRDXs 的活性和卵泡膜细胞和壁层颗粒细胞中PRDX6 基因的mRNA 水平从小腔卵泡到大腔卵泡呈下降趋势。 这说明小腔卵泡中需要更多的抗氧化酶的参与,来保证卵泡和卵母细胞的发育。在mRNA 水平上,PRDX6 基因在不同直径卵泡的卵丘细胞中呈先上升后下降趋势,有研究称,在牛卵母细胞体外成熟过程中,PRDX6 基因上调[28]。 CX37 作为通道连接蛋白, 介导卵丘和卵母细胞之间物质的双向传递,而卵母细胞在生长发育过程中,其自身的代谢会导致大量的H2O2, 从而需要卵丘细胞高表达的PRDX6 去除过量的H2O2,达到维持卵母细胞正常生长所处的环境稳态。
总的来说,绵羊卵泡发育过程中,不同直径卵泡的总抗氧化能力和总活性氧无显著变化。但Cu/Zn-SOD、CAT、GPX3 和PRDX6 在卵泡不同细胞区域的表达存在明显差异。 这表明在卵泡发育过程中, 各种抗氧化酶存在复杂的协同机制来持续维持卵泡内环境的氧化还原稳态, 保证卵泡和其中的卵母细胞正常发育, 但具体作用机制仍需进一步研究。
4 结论
绵羊不同直径有腔卵泡的TAC 和ROS 含量无 显 著 变 化, 但 抗 氧 化 酶SOD、CAT、GPX 和PRDX 在不同直径卵泡中的基因表达水平和活性具有空间特异性, 说明绵羊有腔卵泡抗氧化功能的调节是多因素协同的过程。
