韭菜灰霉病菌对嘧霉胺和咯菌腈抗性评价及抗性菌株适合度分析
2024-01-08张艳丽张艺潇陈燕玲
张艳丽,陈 娟,张艺潇,陈燕玲
(1.平凉市农产品质量安全与检验检测中心 甘肃平凉 744000; 2.甘肃省农业科学院 兰州 730000)
韭菜是我国栽培区域最广泛的蔬菜之一。近年来,在韭菜种植过程中灰霉病时常发生,成为影响韭菜安全生产的重要因素之一。韭菜灰霉病是由灰葡萄孢菌(Botrytis cinerea)引起的一种病害[1],直接影响韭菜的产量和品质。防治韭菜灰霉病的登记农药有腐霉利、嘧霉胺和咯菌腈3 种。腐霉利作为二甲酰亚胺类杀菌剂在我国有20~30 年的使用历史,已表现出灰霉病菌对腐霉利的敏感性下降[2],且腐霉利在蔬菜中检出的农药残留频率最高[3-4]。研究表明,其他蔬菜上灰霉病菌对嘧霉胺的抗性频率已达到43.64%[5],不同地区灰霉病菌对嘧霉胺的抗性水平有差异,但其抗性菌株的适合度鲜有报道。咯菌腈对灰霉病菌菌丝生长有较高的抑制作用,在国内已有灰霉病病菌对咯菌腈产生抗性的报道[6]。陈淑宁等[7]研究表明,在咯菌腈药剂条件下,灰霉病菌敏感菌株可以在竞争中淘汰掉多重抗性菌株。目前在甘肃省内还没有关于韭菜灰霉病菌对嘧霉胺和咯菌腈抗药性的报道,且GB 2763-2021[8]中还未规定嘧霉胺在韭菜中的最大残留限量值。为此,笔者通过对甘肃省7 个地州市(张掖、武威、陇南、庆阳、平凉、兰州、白银)的韭菜灰霉病菌进行分离及敏感性检测,并对其进行抗性评价,以期研究抗性菌株的适合度,用于指导甘肃省境内田间韭菜种植的科学用药和杀菌剂抗性管理。
1 材料与方法
1.1 供试材料
99.9%嘧霉胺、咯菌腈原液1000 μg·mL-1,由北京莱铂锐科技有限公司提供。嘧霉胺、咯菌腈原液用丙酮配制成100 μg·mL-1母液,冰箱冷藏保存。马铃薯葡萄糖琼脂培养基(PDA)[9]用于韭菜灰霉病菌对咯菌腈的敏感性测定;L-asp 培养基[10]用于韭菜灰霉病菌对嘧霉胺的敏感性测定。
试验于2020 年3-11 月在甘肃省陇中(兰州、白银),陇东(庆阳、平凉市),陇南和河西(张掖、武威市)等7 个市的设施大棚内开展。采集韭菜灰霉病病叶,采用何烈干等[11]的方法纯化分离菌株,得到54 株菌株,经形态学和分子生物学鉴定为灰葡萄孢菌(Botrytis cinerea)[12],所有菌株在4 ℃下保存。菌株命名以“采样市州+序列号”表示。
1.2 敏感基线建立及抗性水平测定
采用抗药性鉴定MIC 法(最低抑制浓度法),在分离出的54 株灰霉病菌菌落边缘打取直径5 mm的菌丝块,分别接种至含系列浓度的嘧霉胺和咯菌腈的L-asp、PDA 培养基上,每处理3 次重复。在25 ℃培养12 d 后,不能或几乎不能在该培养基上生长的药剂浓度为嘧霉胺和咯菌腈对韭菜灰霉病菌的最低抑制浓度,以此划分敏感菌株和抗性菌株。
采用菌丝生长速率法[11]分别测定韭菜灰霉病菌对嘧霉胺、咯菌腈的敏感性,对嘧霉胺敏感菌株浓度(ρ)设定分别为0.05、0.1、0.5、1.0、2.0 μg·mL-1,抗性菌株浓度设定分别为1.0、2.0、3.0、5.0、10.0 μg·mL-1;咯菌腈浓度设定分别为0.01、0.05、0.1、0.2、0.3 μg·mL-1。以不加药剂作为对照,将打取的菌饼(5 mm)接种于平板培养基上,每处理3 次重复,在25 ℃恒温培养6 d。采用十字交叉法测定菌落直径,利用Graphpad prism 5.0 软件处理后得出EC50值。
分别选取嘧霉胺压力下32 株和咯菌腈压力下54 株菌株EC50值进行正态分布验证,以符合该正态分布所有菌株的平均EC50值为敏感基线,作为比较抗性有无和抗性水平高低的标准。根据抗性菌株与敏感基线EC50的比值确定抗性倍数[13],1≤抗性倍数≤5 时,为低抗菌株(LR);5<抗性倍数≤10 时,为中抗菌株;抗性倍数>10 时,为高抗菌株。
1.3 抗性菌株稳定性测定
在嘧霉胺压力下,挑选菌株PL-2(低抗)、BY-6(中抗)和LZ-3(高抗);在咯菌腈压力下选取菌株QY-6(低抗菌株)分别在L-asp 和PDA 无药培养基上连续转代培养8 次后,分别测定第2、4、6、8 代菌株对药剂的敏感性,比较继代前后菌株间抗药性水平(EC50)差异。
1.4 抗性菌株适合度测定
1.4.1 抗/敏菌株菌丝生长速率及产孢量的测定选取菌株ZY-3、PL-2、BY-6、LZ-3 和PL-4、QY-6,在其菌落边缘打取直径5 mm 菌饼,分别接种于L-asp、PDA 平板上,在25 ℃下培养,分别测量生长12、24、48、72 和96 h 后的菌落直径,计算菌株生长速率。将上述菌株继续培养10 d 后,用10 mL 无菌水冲洗孢子,尼龙纱布过滤,定容后采用血球计数板计数。每个菌株3 次重复。
1.4.2 抗/敏菌株致病性测定 采用任璐等[14]的方法。将采集到的同叶位韭菜叶清洗消毒后,制成3 cm 的叶盘。分别配置嘧霉胺、咯菌腈最低抑制浓度溶液,将叶盘浸入药液2 min 后,晾干,以浸入无菌水为对照;将1.4.1 中制备的孢子液稀释至1×104个·mL-1,均匀喷洒于叶盘,放入无菌培养皿中,每皿4 片,每处理3 次重复,用透明坐标纸统计叶盘发病面积,按公式(1)计算发病率。
1.4.3 抗/敏菌株分生孢子竞争力测定 参照史晓晶等[15]的方法,对嘧霉胺和咯菌腈的敏感菌株与抗性菌株孢子液按体积比1∶1 配置成不同的组合:Cp1 为ZY-3+PL-2,Cp2 为ZY-3+BY-6,Cp3 为ZY-3+LZ-3,Cf4 为PL-4+QY-6。将孢子混合液用毛笔涂抹于无菌韭菜叶片上,在25 ℃培养,发病后打取1 cm 病斑叶片悬浮于嘧霉胺、咯菌腈最低抑制浓度溶液中继续培养,记录病斑数量并观察病斑是否扩大,每个处理检测病斑数50 个。按公式(2)计算抗性突变体频率。
1.5 数据处理
采用Microsoft Office 2010 进行数据的整理与表格绘制;采用Graphpad prism 5.0 软件进行数据处理和分析,数值采用“平均数±标准差”表示。
2 结果与分析
2.1 敏感基线建立及抗性水平测定
所测嘧霉胺、咯菌腈最低抑制浓度(MIC)分别为4.80、0.15 μg·mL-1。54 株菌株对嘧霉胺和咯菌腈的EC50值变化范围分别为0.280~6.280 μg·mL-1、0.019 2~0.146 0 μg·mL-1。采用Graphpad prism 5.0软件通过KS normailty 验证,其中32 株菌株对嘧霉胺和54 株菌株对咯菌腈敏感性(EC50)均符合正态分布(p>0.01)(图1),因此可将这32 株灰霉病菌株对嘧霉胺的平均EC50值(0.407 7±0.401 7)和54 株灰霉病菌株对咯菌腈的平均EC50值(0.085 9±0.312 1)作为敏感基线。

图1 甘肃韭菜灰霉病菌对嘧霉胺和咯菌腈的敏感性Fig.1 Sensitivity to pyrimethanil and fludioxonil of Chinese chive gray mold in Gansu province
由表1 可知,采集的54 株韭菜灰霉病菌株,有19 株对嘧霉胺产生抗性,抗性频率为35.2%。各地区均已出现不同抗性的菌株,高抗菌株出现在陇中(兰州、白银)和河西(武威)地区,陇南地区抗性菌株均为低抗菌株。54 株灰霉病菌中仅有5 株对咯菌腈产生抗性,均为低抗菌株,抗性频率为9.3%(表2)。
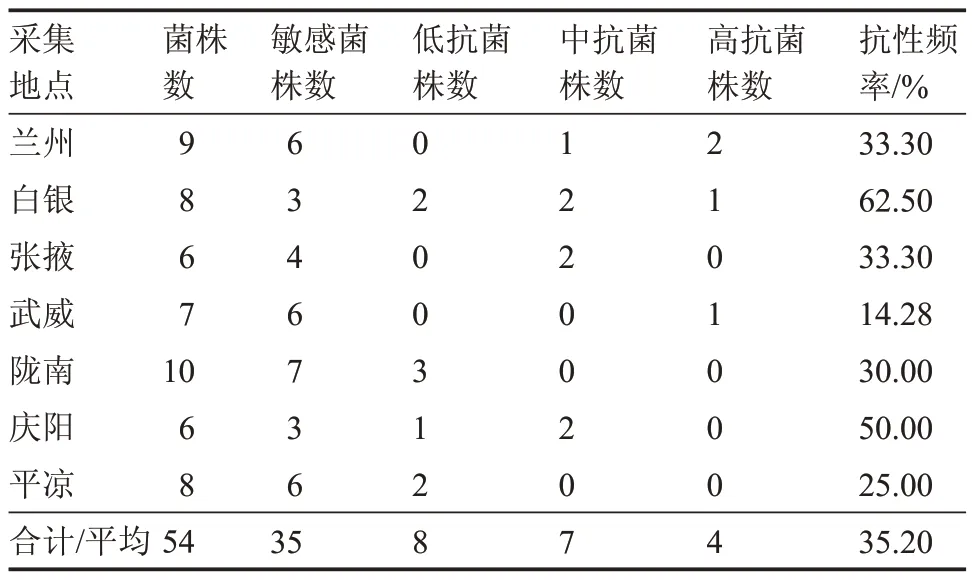
表1 甘肃各地韭菜灰霉病菌抗嘧霉胺分布Table 1 Distribution of pyrimethanil in chinese chiv gray mold in Gansu province

表2 甘肃各地韭菜灰霉病菌抗咯菌腈分布Table 2 Distribution of fludioxonil in chinese chiv gray mold in Gansu province
2.2 抗性菌株遗传稳定性
对嘧霉胺和咯菌腈的不同抗性菌株在连续转接8 代后,各EC50值通过Graphpad Prism 5.0 系统t检测分析(图2)。在嘧霉胺压力下,菌株BY-6 和LZ-3 转代后的EC50与转代前相比差异不显著;菌株PL-2 转接第6 代的EC50与转代前比较差异显著,且第8 代与第6 代差异显著。在咯菌腈压力下,菌株QY-6 转代前后的EC50无显著差异。
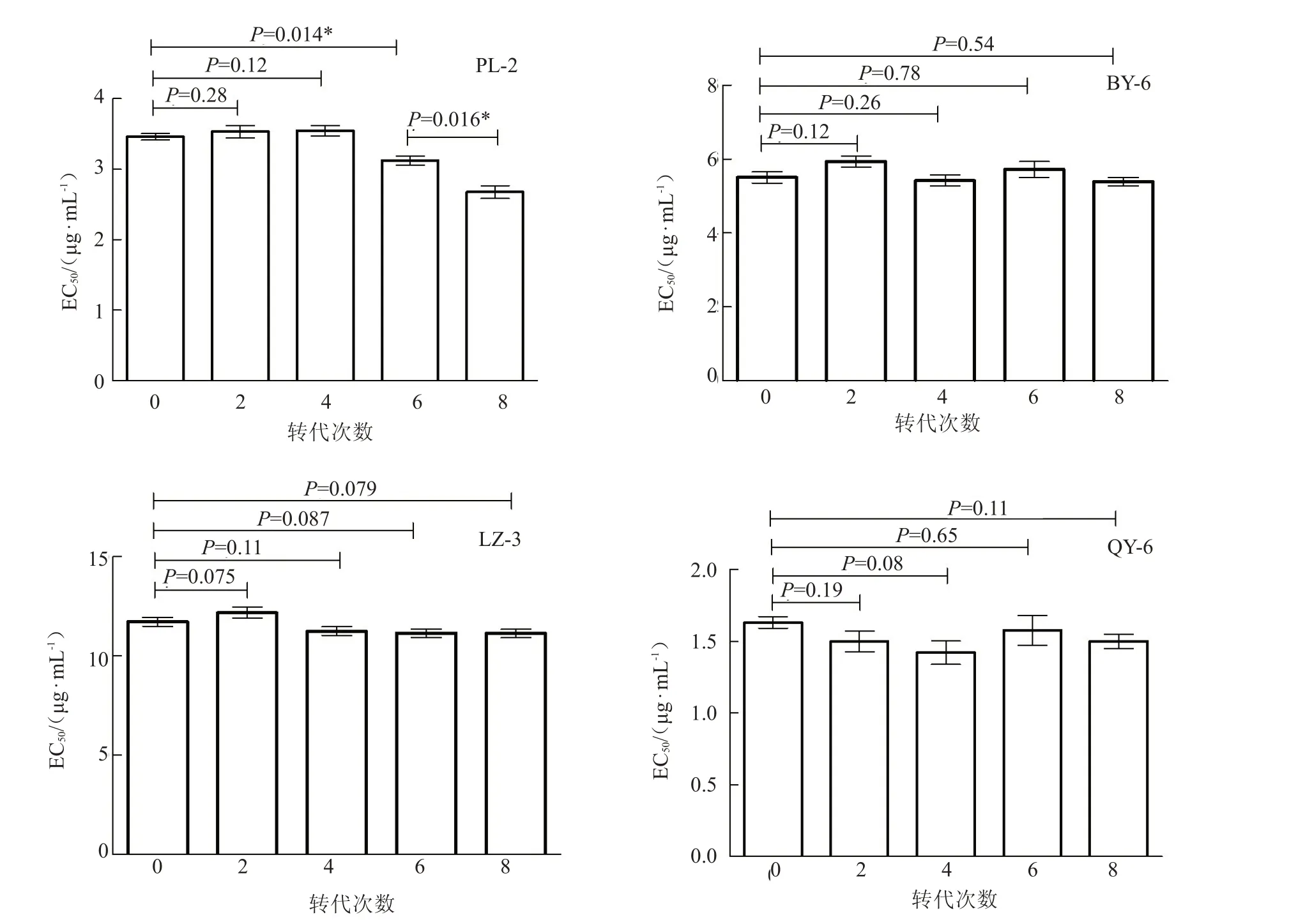
图2 韭菜灰霉病菌对嘧霉胺及咯菌腈抗性遗传稳定性Fig.2 Genetic stability of resistance to pyrimethanil and fludioxonil in Chinese chive gray mold
2.3 抗性菌株适合度测定
2.3.1 抗/敏菌株菌丝生长速率及产孢量的测定由表3 可见,对嘧霉胺敏感性而言,不同菌株的菌丝生长速率有所差异,敏感菌株ZY-3 的生长速率最快,抗性菌株PL-2 和BY-6 的生长速率显著高于LZ-3;在产孢量方面,LZ-3 和BY-6 间无显著性差异,但LZ-3 显著高于ZY-3 和PL-2,BY-6 显著高于ZY-3。对咯菌腈敏感性而言,敏感菌株PL-4 和抗性菌株QY-6 的生长速率无显著差异,但产孢量PL-4 显著高于QY-6。
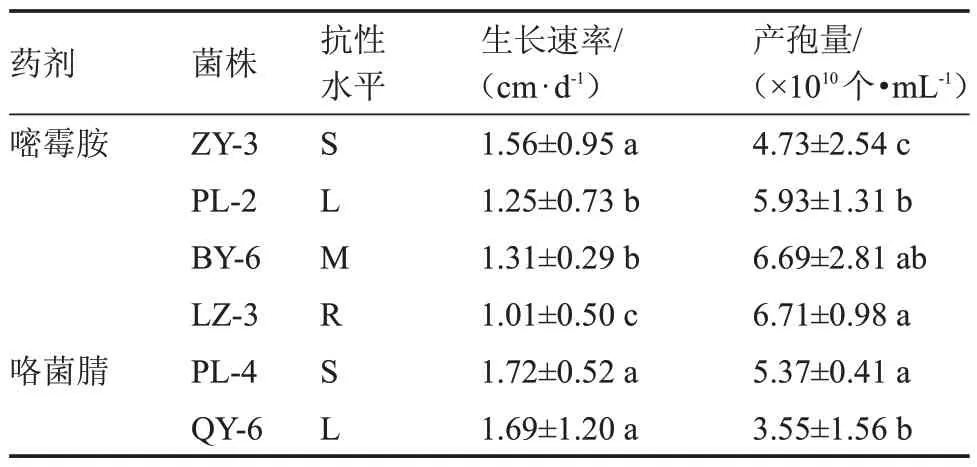
表3 抗/敏菌株的生长速率及产孢量Table 3 The growth rate and spore production of resistant and sensitive strains
2.3.2 抗/敏菌株致病性测定 由图3 可知,在无嘧霉胺药剂处理的叶盘上,各抗性菌株的发病率均显著低于敏感菌株ZY-3,菌株发病率从高到低依次为:ZY-3>PL-2>BY-6>LZ-3;在嘧霉胺处理的叶盘上,各抗性菌株发病率均显著高于敏感菌株ZY-3,其中菌株PL-2 发病率显著低于BY-6 和LZ-3。在无咯菌腈药剂处理的叶盘上,低抗菌株QY-6 的发病率显著低于敏感菌株PL-4,在咯菌腈处理的叶盘上两者的发病率无显著差异。
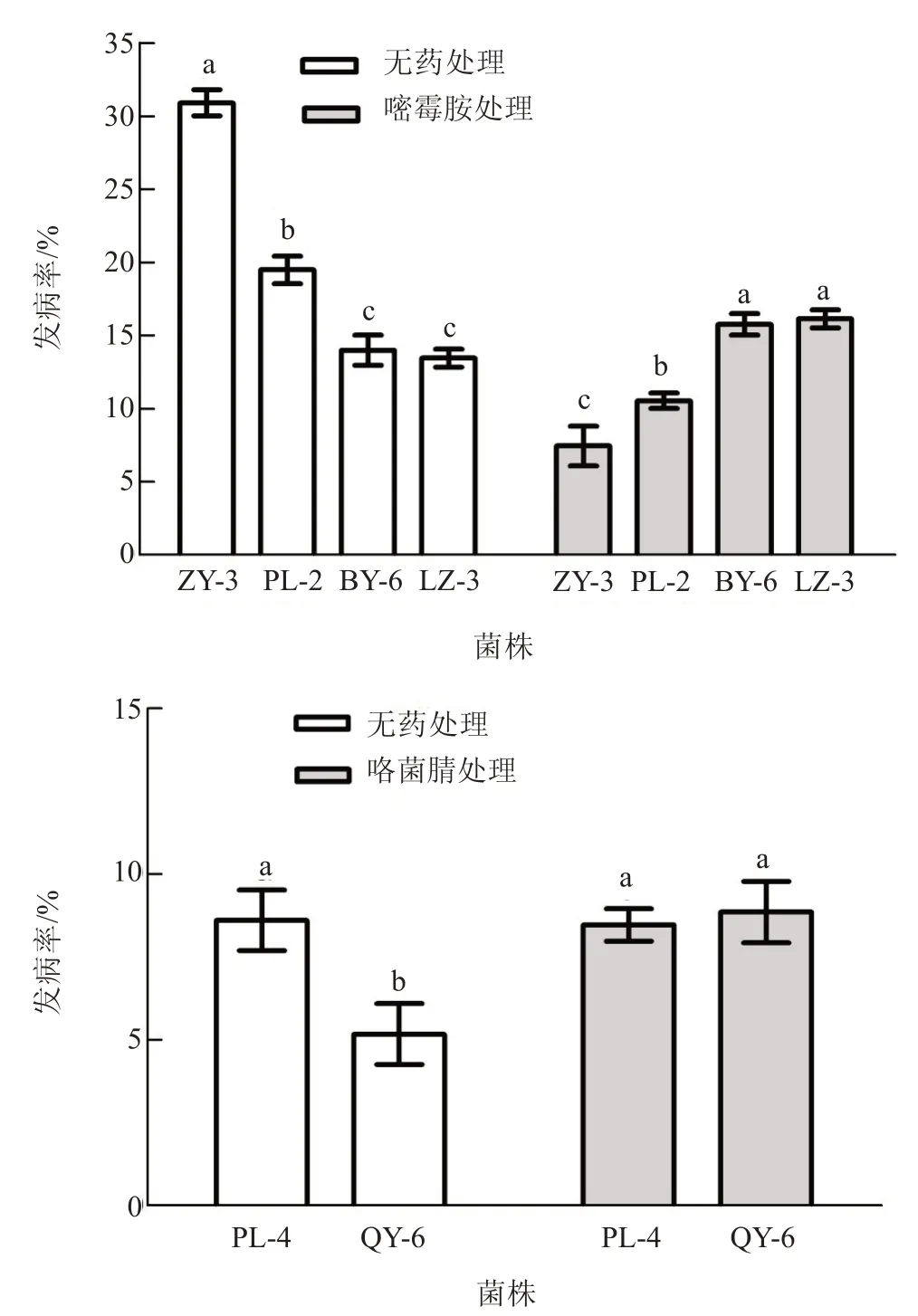
图3 抗/敏菌株发病率Fig.3 Pathogenic frequency of resistant and sensitive strains
2.3.3 抗/敏菌株分生孢子竞争力测定 由图4 可知,组合Cp1、Cp2、Cp3 及Cf4 中,敏感菌株侵染所致的病斑频率均高于抗性菌株,说明敏感菌株孢子竞争力强于抗性菌株。在组合Cp1~Cp3 间,组合Cp3 中的抗性菌株孢子竞争力最大。在组合Cf4中,抗性菌株孢子竞争力达到了48%,几乎与敏感菌株持平。

图4 抗/敏菌株孢子竞争力Fig.4 Spore competitiveness between resistant and sensitive isolate
3 讨论与结论
在甘肃省境内采集分离得到的54 株韭菜灰霉病菌,对嘧霉胺的抗性表现为中抗、高抗水平,且具有地域性特点,高抗菌株出现在陇中(兰州、白银)和河西地区(武威),陇东地区(庆阳、平凉)以中、低抗菌株为主,陇南均为低抗菌株。甘肃省境内韭菜灰霉病菌对嘧霉胺的敏感性处于下降趋势,这与贾晓华[10]、Shattock[16]、纪明山等[17]研究结果相符。嘧霉胺属于苯氨基嘧啶类杀菌剂,但是苯氨基嘧啶类杀菌剂作用靶点单一,容易产生抗药性[17],在农药压力选择下,中、高抗菌株将占据有利的选择优势,逐渐成为主导菌株,不利于韭菜灰霉病菌的防治。采集的5 株韭菜灰霉病菌经检测对咯菌腈产生了低抗药性,与普继雄等[3]研究一致。相关研究表明,灰霉病菌对咯菌腈抗性适合度低于野生菌株,优势种群不易形成[18-19],这也可能是抗性菌株比率较低的原因。对不同抗性菌株进行遗传稳定性分析,结果表明,转代培养8 次后,低抗菌株对嘧霉胺的敏感性差异显著,有向敏感菌株转变的趋势;中、高抗菌株敏感性无显著变化,抗性水平可稳定遗传。韭菜灰霉病菌对嘧霉胺产生低抗药性初期,应加强田间菌株敏感性动态变化及抗药性监测,及时掌握其抗性水平的动态变化,适时调整用药策略,可避免抗性菌株向中、高抗性发展。对咯菌腈产生低抗药性的菌株转接8 代后抗性水平可稳定遗传。
在抗性风险评价中,营养生长、繁殖能力、抗性菌株致病性等适合度参数是评价抗性风险的重要指标,特别是营养生长和繁殖能力,能够快速生长繁殖就意味着适合度更高[20]。当韭菜灰霉病菌对嘧霉胺和咯菌腈产生抗性后,抗性菌株适合度的群体变化会在田间有所体现。通过对适合度研究,表明对嘧霉胺、咯菌腈产生抗性的菌株其菌丝生长速率均低于其敏感菌株,但是产孢量却高于敏感菌株,这与史晓晶等[15]研究结果一致。任璐等[14]的研究表明,在相同生长环境中,抗性菌株菌丝生长速率、产孢量、致病力等适合度指标均低于敏感菌株,笔者的研究在产孢量方面与其不一致。有研究表明,适合度与环境条件有密切关系[21],这可能是因为室内培养为抗性菌株提供了充足养分、适宜温度等条件,有利于抗性菌株孢子产生,因此特定环境对适和度的影响还有待进一步研究。对嘧霉胺产生抗性的菌株,环境适合度下降,特别是中、高抗菌株,适合度显著低于低抗菌株,与敏感菌株不具有竞争优势,在田间不易形成优势群体。对咯菌腈产生抗性的低抗菌株致病性低于敏感菌株,但是孢子竞争力几乎与敏感菌株保持相当水平。这表明对咯菌腈产生抗性的低抗菌株有一定的生存能力,有必要重视可能发展成为优势菌群的风险。
甘肃省部分区域韭菜灰霉病菌对嘧霉胺已经产生了中、高水平抗药性,但是抗性菌株适合度指标均下降,生存能力下降,在与敏感群体生存竞争中不占优势。韭菜灰霉病菌对咯菌腈的抗性水平较低,但低抗菌株表现一定的适合度,生产中应避免单一使用该药剂,防止抗性菌株成为田间优势菌群。同时应加强田间抗性监测,根据不同区域韭菜灰霉病菌对药剂的抗性水平,科学制定防治策略以期达到缓解韭菜灰霉病菌对嘧霉胺和咯菌腈的抗药性压力,有望延长此类药剂的使用年限。
