负载型贵金属催化剂催化氧化VOCs的研究进展
2024-01-07赵港国王建申桂建舟
赵港国,张 迪,王建申,桂建舟,刘 丹
(1.天津工业大学 化学学院,天津 300387;2.天津工业大学 化学工程与技术学院,天津 300387;3.天津工业大学材料科学与工程学院,天津 300387)
挥发性有机物(VOCs)通常指常压下沸点温度在50~260 °C 之间的有机化合物[1-3]。VOCs 种类繁多、来源广泛,人类的生产生活是VOCs的主要来源之一,这其中包括汽车尾气、化学溶剂和能源制造等过程产生的VOCs,此外,火山喷发、森林火灾等也会排放大量的VOCs[4-7]。多数VOCs 具有一定毒性、刺激性并易燃易爆[8-10]。过量的VOCs排放会对环境和人类健康造成诸多危害,如人们长期接触VOCs,将引发呼吸类疾病、神经系统疾病等[11-15]。此外,VOCs 也是造成雾霾和光化学烟雾的主要原因之一[16-17]。为控制VOCs 的排放,我国于2010 年将VOCs 列为四大主要空气污染物之一,并制定了严格的排放标准[14,18-19]。
目前,通常采用回收和销毁两种技术对VOCs进行处理。回收方法主要包括物理吸附、吸收、冷凝和膜分离等方式[20],而销毁技术则主要包含热氧化、催化氧化、光催化降解以及等离子体催化等技术[21-24]。相较于其他方法,催化氧化法具有较低的反应温度、较少的能耗以及较高的效率,被认为是去除VOCs 的有效途径之一[25-27]。高效催化剂的设计与开发是VOCs催化氧化的核心。目前,VOCs催化氧化的催化剂主要分为两种,即贵金属催化剂和过渡金属氧化物催化剂。与过渡金属氧化物催化剂相比,贵金属催化剂可实现低温下VOCs 的高效去除,因而备受关注[28-29]。本文介绍负载型贵金属催化剂催化氧化VOCs 的研究进展,总结VOCs 催化氧化的反应机理,贵金属的种类以及载体性质对VOCs催化氧化活性的影响。
1 负载型贵金属催化剂催化氧化VOCs机理
1.1 机理概述
VOCs 氧化的反应顺序不同,每种机理的有效性很大程度上取决于催化剂(活性金属和载体)的性质以及VOCs 分子的种类,因此很难概括。如图1 所示,目前研究学者提出了不同的反应机理:Langmuir-Hinshelwood(L-H)机理,即VOCs 分子与气相中的氧吸附在固体催化剂上,在表面上发生反应后,产物再脱附的过程;Eley-Rideal(E-R)机理,即气相中的氧被吸附到催化剂上,然后气相中吸附的氧和VOCs 分子之间进行反应;Mars-van Krevelen(MvK)机理,该反应包括两步,第一步是催化剂表面的活性氧物种(吸附氧物种或晶格氧)与VOCs分子发生反应,催化剂被还原;第二步是还原的催化剂与气相氧反应,催化剂被氧化,故该机理又被称为氧化-还原机理。在大多数负载型贵金属催化剂的VOCs催化氧化反应中,一般遵循L-H机理,少数反应遵循E-R机理;而当载体是过渡金属氧化物时,由于催化剂中氧空位参与了VOCs 催化氧化的进程,使部分反应遵循MvK机理。
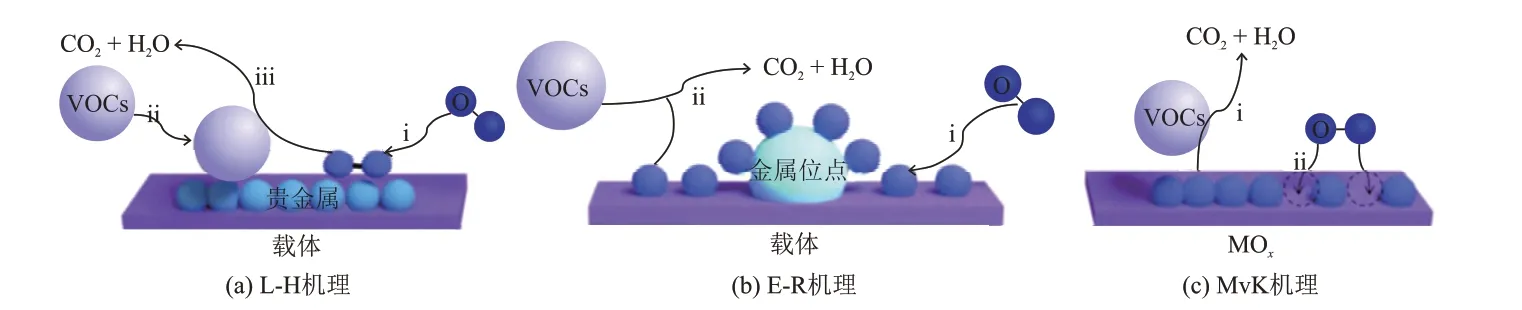
图1 3种负载型贵金属催化剂催化氧化VOCs反应机理[30]Fig.1 Mechanism of VOCs oxidation catalyzed by three supported noble metal catalysts[30]
1.2 机理研究进展
WANG 等[31]研究发现甲苯最初吸附在Pt/TiO2催化剂的活性位点上。在苯开环反应之前可能会发生两种催化氧化途径。在第一种途径中,部分吸附的甲苯发生歧化反应生成苯和对二甲苯,对二甲苯进一步发生异构化反应生成邻二甲苯。在另一种途径中,吸附的甲苯被表面活性氧依次氧化生成苯甲醇、苯甲醛和苯甲酸。随着反应温度的升高,最终,两种途径下反应的中间产物进一步氧化裂解,最后,小分子有机中间体被完全氧化成二氧化碳和水。
LⅠU 等[32]通过浸渍法制备了Ag/CeO2催化剂,并应用于萘的催化氧化。表征结果证明Ag可作为氧泵为CeO2提供氧物种,萘的氧化反应遵循MvK机理,萘的吸附和二氧化碳的脱附对反应影响不大,而催化剂中活性氧的数量和氧的再生是该反应的控速步骤。
CHEN 等[33]采用原位红外和质谱结合的方法,针对在不同气氛(H2或O2)下预处理的Ag/MCM-41催化剂,探究了HCHO 催化氧化的机理。结果表明,与H2预处理的Ag 催化剂相比,在500 °C 下用O2预处理的Ag 催化剂对HCHO 氧化具有很高的活性,如图2 所示,甲酸盐、CO 等物种是HCHO 在Ag/MCM-41催化剂上氧化的主要反应中间体。
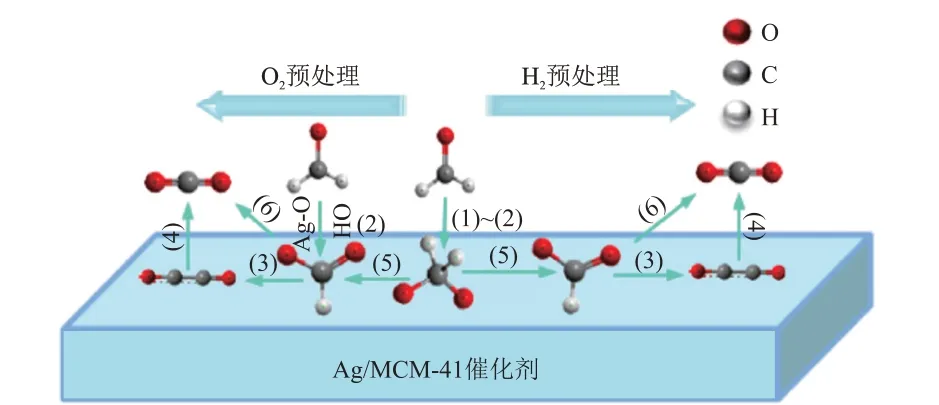
图2 Ag/MCM-41催化剂上HCHO吸附和氧化机理[33]Fig.2 Adsorption and oxidation mechanisms of HCHO over Ag/MCM-41 catalysts[33]
PENG 等[34]制备了Pt/CeO2催化剂,通过研究反应机理,证明了暴露的铂原子和CeO2表面的氧缺陷(Ov)是控制反应速率的关键。如图3 所示,反应物分子被表面金属原子吸附并活化,与此同时,载体上的氧缺陷作为分子氧的活化位点。
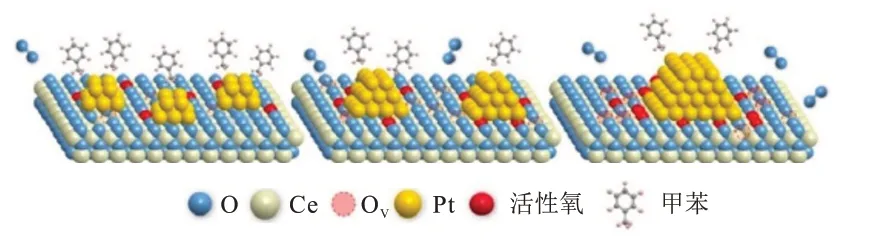
图3 甲苯在Pt/CeO2催化剂上催化氧化示意图[34]Fig.3 Schematic diagram of catalytic oxidation of toluene over Pt/CeO2 catalysts[34]
WANG等[35]制备了Pt/TiO2催化剂,借助原位红外检测到了甲苯催化氧化过程中的反应中间体。这些中间体包括了苯、对二甲苯、邻二甲苯、苯甲醛、邻苯二甲酸、马来酸酐、衣康酸酐、丙酮和乙酸等,并最终转化为水和二氧化碳。在此基础上,研究者提出了甲苯催化氧化的反应路径,如图4所示。作者认为苯甲醛是最稳定的表面中间体,其氧化速率是决定甲苯氧化速率的决定因素。
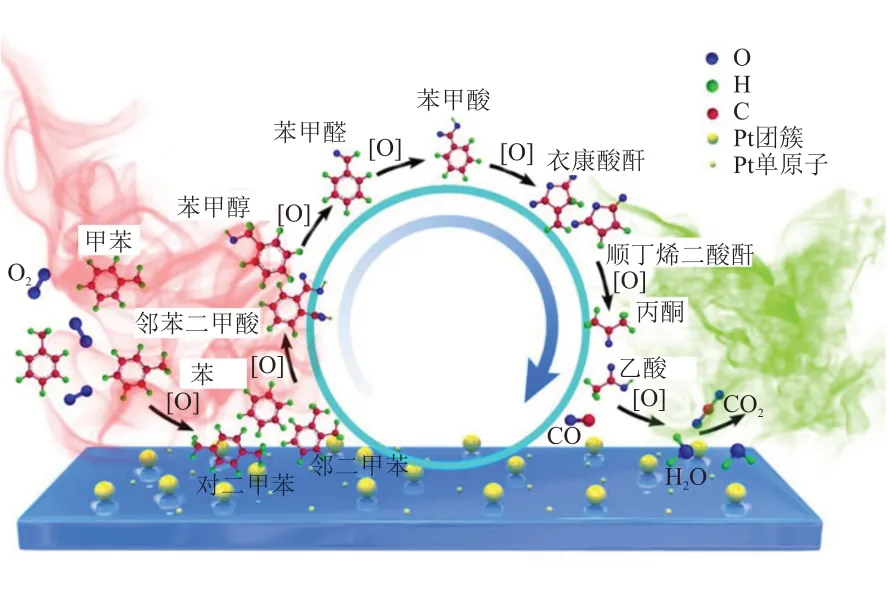
图4 甲苯在Pt/TiO2催化剂上催化氧化的反应路径[35]Fig.4 Reaction pathway of toluene catalytic oxidation over Pt/TiO2 catalysts[35]
2 负载型贵金属催化剂催化氧化VOCs研究
2.1 贵金属活性物种对VOCs催化氧化活性的影响
2.1.1 Pt系催化剂
与其他贵金属催化剂相比,Pt 系催化剂具有较高的活性和选择性,因而备受青睐。影响Pt 系催化剂活性的因素有很多,其中,金属Pt 颗粒的大小是影响催化剂催化活性的关键因素之一[34,36-37]。PENG 等[34]通过乙二醇还原法合成了不同Pt 粒径(1.3~2.5 nm)的Pt/CeO2催化剂,并用于甲苯催化氧化。性能测试结果表明,Pt/CeO2-1.8 催化剂对甲苯催化氧化活性最高,t90(VOCs 转化率为90%时的反应温度)为143 °C。表征结果证明,随着Pt颗粒尺寸的改变,Ce3+和氧空位的含量增加,并且Pt/CeO2-1.8催化剂具有最优的低温还原性。CHEN等[38]通过改进的乙二醇还原法得到了一系列具有可控的Pt 粒径(1.2~2.2 nm)的Pt/Al2O3催化剂。结果表明,具有1.2 nm Pt粒径的Pt/Al2O3催化剂在145 °C下表现出最佳的苯催化氧化活性。这是因为随着Pt 粒径的减小,吸附氧含量增加,使催化剂降解苯的能力增强。
为了进一步降低Pt的粒径,研究者尝试制备单原子催化剂[39-41]。ZHANG 等[41]采用一锅法将单原子Pt 掺杂到MnO2中,与纯MnO2催化剂相比,Pt 的掺杂极大地提高了室温下甲苯降解的催化活性。在质量空速为300000 mL/(g·h)、28 °C 条件下实现了质量浓度为1.7 mg/m3的甲苯的完全转化;80 °C条件下实现了质量浓度为41 mg/m3的甲苯的完全转化。MnO2纳米片中的锰缺陷和氧缺陷能有效地稳定单原子Pt,并且形成的羟基自由基是甲苯在低温条件下被完全氧化的主要原因。YANG等[42]制备了具有三维有序介孔结构的Fe2O3,并采用还原的方法将Pt以单原子的形式负载于Fe2O3中。与纳米Pt颗粒催化剂相比,单原子Pt 催化剂中苯的t90为198 °C。作者认为,Pt 的原子利用率是决定催化性能的关键因素。
除了改变Pt的粒径以外,制备方法对催化剂活性的影响也较为显著。KONDRATOWⅠCZ 等[43]分别通过多元醇还原法和浸渍法将Pt 负载在ZrO2空心球上。相比于浸渍法,多元醇还原法制备的催化剂催化氧化甲苯的t90为172 °C,其主要原因为多元醇还原法形成了更稳定的Pt 纳米颗粒以及更高含量的Pt0,最终使催化剂在VOCs 催化氧化中表现出优异的活性。PAULⅠS 等[44]通过不同Pt 前驱体制备得到了一系列Pt/Al2O3催化剂。以甲苯催化氧化为模型的反应发现,由Pt(NH3)4(OH)2作为前驱体制备的催化剂催化氧化甲苯的t90约为230 °C,而采用含氯的前体制备的两种催化剂的活性均低于无氯前体制备的催化剂。
综上,影响Pt系催化剂的因素主要是Pt的粒径以及贵金属与载体之间的相互作用。在相同负载量的条件下,通过不同的方法将贵金属负载到载体上,Pt的粒径越小,原子利用率越高,贵金属与载体之间的相互作用越强,所制备的催化剂的活性越好。近年来,贵金属单原子催化剂具有以原子级分散在基底材料上提高贵金属的原子利用率的优点,使单原子催化剂在VOCs催化氧化中作为一种新型的催化材料受到关注。
2.1.2 Pd系催化剂
近年来,Pd系催化剂也被用于VOCs的去除[45-47]。YANG等[48]制备了Pd/LaFe0.97O3催化剂,并对该催化剂进行了氮气再焙烧。表征结果表明,再焙烧后,催化剂中的Pd 粒径从大于 10 nm 降低到2 nm 以下,并且催化剂催化甲烷的活性有了明显提升。SANTOS 等[49]通过不同制备方法制备了Pd/TiO2催化剂。研究发现,液相还原沉积法比浸渍法制备的Pd粒径更小、活性更高,在240 °C 左右即可实现甲苯的完全氧化。MARCⅠNKOWSKⅠ等[50]制备了Pd单原子催化剂。研究表明,单原子Pd 的添加能够降低甲醇C—H 键断裂的活化能,从而提高催化活性。
HUANG等[47]通过H2预处理的方法制备了一系列Pd/Al2O3催化剂。研究发现,预处理并不影响Pd颗粒的大小,但显著改变了Pd0/Pd2+的物质的量之比。Pd 的价态对邻二甲苯催化氧化的活性影响较大,金属Pd 是反应的活性中心。GUO 等[51]制备了一系列的Pd/KⅠT-CeO2催化剂,在187 °C 条件下可以实现苯的90%转化。模拟计算结果表明,苯倾向于吸附在Pd 纳米颗粒上,并通过Pd 纳米颗粒和KⅠT-CeO2载体的协同作用而被活化。具有高Pd0浓度、丰富的氧物种和较好的低温还原性的催化剂具有良好的反应活性。
与Pt系相比,Pd系催化剂表现出良好的耐热性和耐热烧结性,且Pd 金属价格相对较低廉,具有更广阔的应用前景,通过不同制备方法以及处理手段即可调变Pd 系催化剂对VOCs 催化氧化的反应活性。
2.1.3 其他单一催化剂
除了Pt、Pd 外,也有其他贵金属作为活性组分用于VOCs 去除,如Au、Ag 等。由于Au 具有稳定的化学性质,长期以来一直被认为是惰性金属[52]。GRⅠSEL 等[53]通过浸渍法以及沉积沉淀法制备了不同的Au/Al2O3催化剂,研究发现采用沉积沉淀法(尤其是沉淀剂为尿素)制备的催化剂效果最佳,这主要归因于采用尿素作为沉淀剂使得溶液的pH更为稳定,因此获得了最小的Au颗粒,从而提高了Au的原子利用率,使得甲烷在620 °C 左右实现了完全转化。
JⅠAN等[19]通过将Au原位还原到α-MnO2上,并调整α-MnO2暴露出不同晶面来优化金属活性中心与载体之间的相互作用,促使Au/α-MnO2-110 催化剂具有更多的表面氧空位,该催化剂催化丙烷的t90为216 °C。ZHANG 等[54]制备了一种Au/α-Fe2O3纳米片催化剂,用于异丙醇去除反应,并取得较好效果。Au 纳米粒子负载到α-Fe2O3纳米片上会削弱Fe—O键,增加催化剂中的氧空位,提高催化剂的低温还原性,并使催化剂具有更多的中等酸性位点,最终有利于催化反应的进行。
1994年,ⅠMAMURA等[55]发现,Ag/CeO2具有优异的HCHO低温氧化性能。而Ag催化剂作为一种性能优异的催化氧化催化剂,目前已有多篇报道[56-58]。YU 等[57]采用水热法和浸渍法制备了一系列的Ag/CeO2催化剂,并用于低温催化氧化HCHO。研究发现,Ag纳米粒子可以促进表面化学吸附氧的活化,使得HCHO在100 °C左右即可完全氧化。LⅠ等[59]设计了一种双功能ZSM-5-Ag 催化剂,该催化剂通过酸性ZSM-5 活化HCHO 并生成甲酸甲酯反应中间体,后续甲酸甲酯更易被Ag 氧化使污染物被消除,最终使HCHO在65 °C被完全氧化。
相比于Pt、Pd 系催化剂,Au、Ag 系催化剂的活性虽然不高,但是由于其价格低廉,储量丰富,同样受到了科研工作者的亲睐,研究者通过调变贵金属的颗粒尺寸以及提高贵金属与载体之间的协同作用,更好地提高了催化剂的反应性能。
2.1.4 双金属催化剂
在VOCs 催化氧化催化剂中,常见的双金属包含Pt-Pd[60]、Au-Pd[61]、Pt-Au[62]和Pd-Mn[63]等。
YANG 等[63]分别将Pt、Mn 和Pt-Mn 负载在ZSM-5 载体上,用于丙酮催化氧化。结果表明,与单一金属催化剂相比,双金属催化剂呈现出更小的纳米颗粒尺寸、更丰富的酸性位点、更高的Pt0比例和更丰富的活性氧物种,将丙酮氧化的t90降低至165 °C。
ZHAO 等[64]在Pd/TiO2催化剂中添加了少量Mn,用于丙酮催化氧化。Mn 的添加使催化剂催化活性有了明显的提升,使得丙酮氧化的t90降低至256 °C。表征结果显示,Pd0.01Mn0.2/TiO2催化剂具有良好的低温还原性和丰富的吸附氧物种。YANG 等[60]通过在Pd/γ-Al2O3上添加Pt,提高了PdO的含量和Pd物种的供氧能力,降低了催化剂表面上CO 的含量,抑制了CO 因发生歧化反应生成积炭,最终提高了甲苯的催化氧化和抗积炭能力。KAREEM 等[65]通过调变Pd 与Au 原子比制备了一系列的催化剂并应用于丙烷的氧化反应中。结果表明,Pd55Au45/Al2O3催化剂具有最高的催化活性,丙烷氧化的t90为280 °C。
一般而言,当引入第二种金属时,能够提升催化剂的催化反应活性。这是由于金属的协同效应,如电子传递等。通过调节不同金属的原子比例,可以将协同效应发挥到最大,表现出远高于单金属催化剂的性能,大大降低了催化剂的使用成本。近年来负载型贵金属催化剂在VOCs催化氧化中的对比如表1所示。贵金属催化剂常用的活性组分通常是Pd、Pt、Au 和Ag,在多数VOCs 催化氧化反应中,Pd系催化剂的活性优于Au、Ag催化剂,但略低于Pt系催化剂。
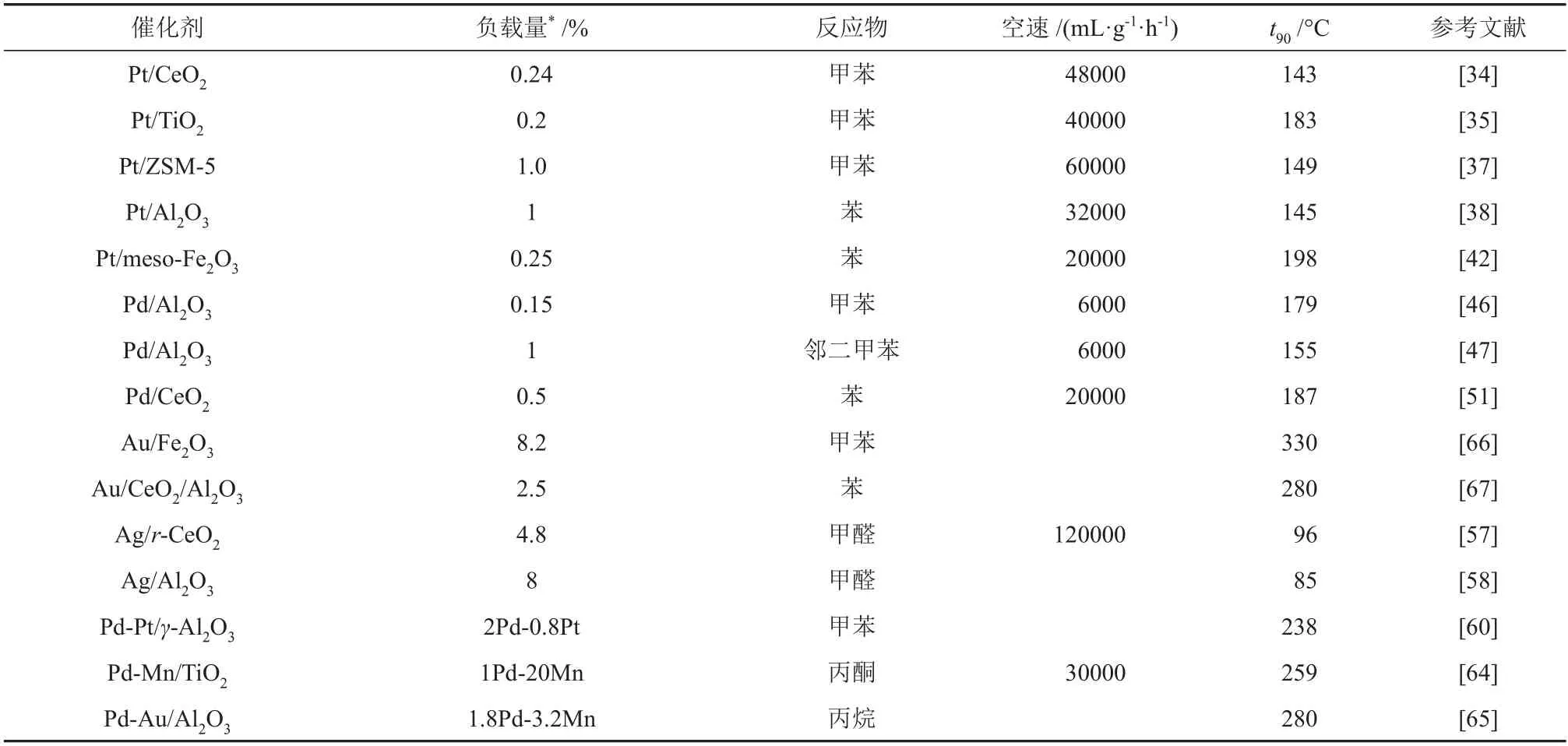
表1 不同贵金属活性物种的负载型贵金属催化剂在VOCs催化氧化中的对比Table 1 Comparison of supported noble-metal catalysts with different noble metal active species in VOCs catalytic oxidation
2.2 载体种类对VOCs催化氧化活性的影响
负载型贵金属催化剂的载体大致可以分为两大类:一类是惰性载体,常见的惰性载体包含Al2O3[68-69]、分子筛[37,63]和MgO[70]等;另一类是非惰性载体,也称为还原性载体。常见的还原性载体包括CeO2[34]、MnOx[71]和Co3O4[72]等。
2.2.1 惰性载体
一般情况下,载体本身不具有催化活性位点,仅起分散、锚定贵金属活性组分、提供合适的酸性位点以及与活性组分产生相互作用以调变催化剂活性的作用。
为了研究载体的酸性位点对催化剂的影响,GAN等[69]采用加入不同沉淀剂的方法,得到了不同表面性质的Al2O3载体,并用于甲苯催化氧化。研究表明,具有弱强度和中等强度的酸性位点有利于甲苯的吸附和二氧化碳产物的解吸,使甲苯在180 °C即可完全氧化。MA 等[68]合成出了具有多级孔的Al2O3和ZnO 微球,并负载Pd。相比于商用的Al2O3和ZnO,Pd 的分散度具有明显地提升,Pd 位点和载体中的Brønsted酸位点可以与乙酸乙酯反应生成乙烯和乙醇,最终转化为水和二氧化碳,其中Pd/Al2O3催化剂的性能最佳,乙酸乙酯氧化的t90为277 °C。JⅠANG 等[73]通过调节n(Si)/n(Al)制备了一系列的Pt/NaZSM-5 催化剂,并用于丙烯的催化氧化。研究发现,载体n(Si)/n(Al)的增加有利于丙烯的吸附,并能进一步促进丙烯氧化。HE 等[74]也制备了Pd/ZSM-5 催化剂,用于苯、甲苯和乙酸乙酯的催化氧化反应。
WU等[75]制备了3种具有不同疏水性的载体,结果显示,载体的疏水性对反应影响巨大。当采用疏水性强的载体时,反应生成的水不会占据活性位点,从而有更多的活性位点暴露出来与反应物分子接触,使得甲苯在150 °C就能够被完全氧化。
对于负载型催化剂而言,载体的特性极其重要,如具有大比表面积的载体可以更好的分散贵金属,提高贵金属的原子利用率;具有合适酸碱度的载体有利于反应物和生成物的吸/脱附[69];具有良好疏水性的载体可以提高催化剂的抗水气能力[75]。
2.2.2 还原性载体
一般来说,催化剂的性能很大程度上取决于金属与载体之间的相互作用。MO等[76]首先制备了具有不同晶相的MnO2,而后负载Pt 用于甲苯催化氧化。研究发现,Pt 纳米粒子和MnO2之间的相互作用能够调变催化剂低温还原性、表面价态以及表面晶格氧物种,从而使甲苯的t90降低至170 °C。WANG 等[14]分别通过水热法与溶胶凝胶法,在MnO2纳米管上负载了Ni-Fe尖晶石和Pt纳米颗粒,通过提高载体的比表面积和吸附氧含量,使苯氧化的t90降低至113 °C,大大提升了催化活性。
载体的形貌也可以影响催化活性。HUANG等[77]采用浸渍法将Ru负载到具有不同形貌的CeO2载体上,以探究形貌对催化性能的影响。结果表明,不同形貌载体的表面氧空位数量不同,导致催化活性存在差异,其中纳米棒的Ru/CeO2催化剂性能最佳,氯苯氧化的t90为280 °C。
WANG 等[78]发现在载体上添加一定量油酸可以显著改善贵金属的分散度,从而提高了催化剂的催化性能。GUO 等[79]通过氮掺杂和加入CeO2对氧化石墨烯进行修饰,以提高载体的缺陷程度,增大比表面积和氧空位的浓度,使催化剂在30 °C 就能将HCHO 完全氧化。ZHANG 等[80]发现,在HCHO催化氧化过程中,碱金属的添加能够对反应起到促进作用。在15 °C下,添加质量分数为1%和2% Na的Pt/TiO2样品,便可实现对HCHO高达96%和100%的转化率。而无Na的Pt/TiO2在15 °C时HCHO转化率仅为19%。当在Pt/TiO2催化剂中添加碱金属时,可以稳定催化剂表面上原子分散的Pt-O(OH)x-碱金属物质,显著提高HCHO氧化活性。
对于还原性载体,由于反应过程金属的价态能够发生转变,容易形成氧缺陷,这使得催化剂具有了优异的储氧和释氧能力,还原性载体不但能起到分散贵金属的作用,还能直接或者间接的参与催化反应,为反应提供活性氧物种及活性位点。不同负载型贵金属催化剂在VOCs催化氧化中的对比如表2所示。负载型贵金属催化剂载体的主要作用是对活性组分进行分散和锚定并增加催化剂的热稳定性,可以通过调变载体的形貌、比表面积、孔道结构以及酸碱性质等因素来影响催化剂的活性。
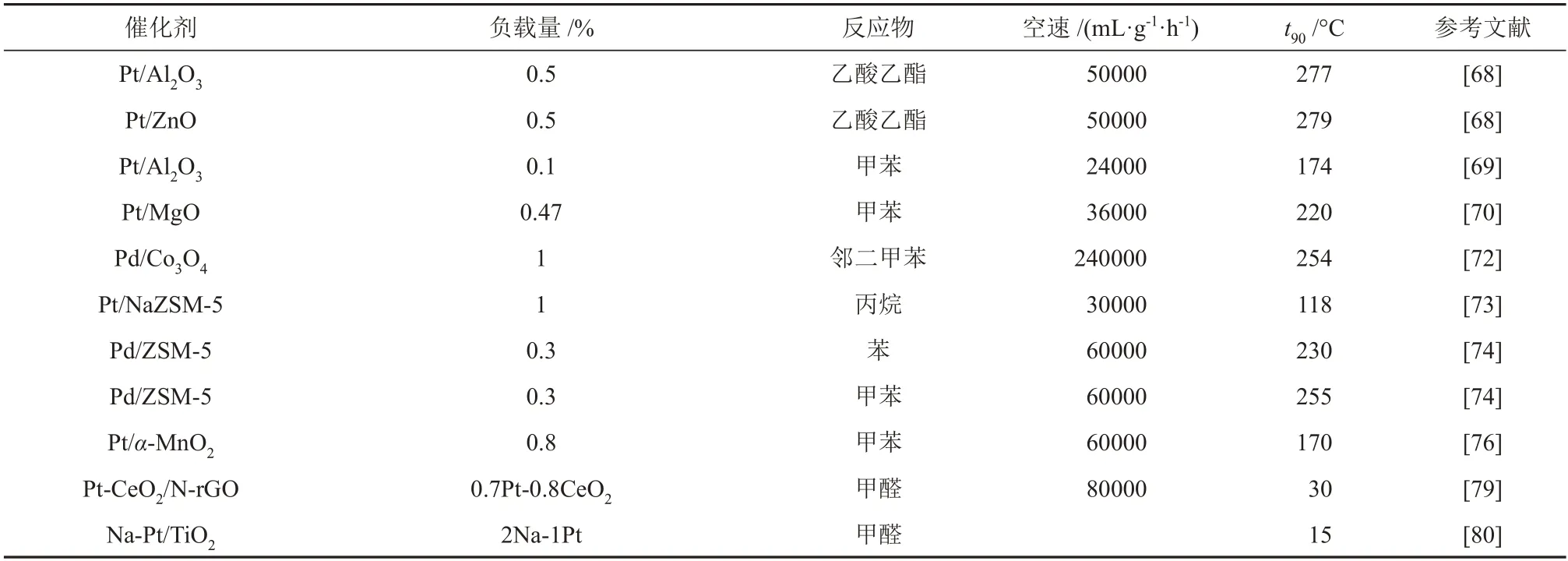
表2 不同载体种类的负载型贵金属催化剂在VOCs催化氧化中的对比Table 2 Comparison of supported noble-metal catalysts with different support types in VOCs catalytic oxidation
3 结语与展望
经过数十年的努力,负载型贵金属催化剂在VOCs去除方面有了长足的发展。本文综述了不同贵金属活性组分和载体与催化剂性能之间的关系,包括了单一金属催化剂、多金属催化剂以及常用的载体对催化剂性能的影响。尽管贵金属催化剂有起燃温度低、催化活性高等优势,但在实际应用中,贵金属催化剂仍易受S、Cl等元素的毒害,可以通过引入第二组分金属、选择合适的载体去提高催化剂的热稳定性和抗中毒的能力,从而达到降低催化剂的使用成本的目的。
值得说明的是,实际工业废气的成分相对复杂,而当前研究者大多探究催化剂对单一组分VOCs 的催化氧化性能以及反应机理,而对多组分VOCs 催化氧化的研究相对较少。因此,探究多组分VOCs 催化氧化的性能,得到适合多组分复杂体系中VOCs 降解的高效催化剂,将是今后科研人员努力的方向之一。相信随着研究者的不断努力,人们对VOCs 催化氧化的反应机理将有更清晰的认知,催化剂的结构与性能之间的关系会更加明确,使催化氧化技术在工业领域的应用更为广泛。
