酶解食品源蛋白质制备生物活性肽的研究进展
2024-01-03张昂徐威郭青松
张昂,徐威,郭青松
(1.濮阳职业技术学院 生物与食品工程学院,河南 濮阳 457000;2.合肥工业大学 食品与生物工程学院,安徽 合肥 230601;3.安徽国肽生物科技有限公司,安徽 宣城 242100)
生物活性肽(bioactive peptide,BP)是嵌入在主要食物蛋白质中的特定肽基序,一旦从它们的母体蛋白质中释放出来,能展现出优异的似激素或药物的活性作用,从而在人体健康方面发挥重要作用[1]。大多数的生物活性肽在母体蛋白质中包含2~20 个氨基酸的特定多肽序列,虽然不同分子片段的复杂程度有差异,但生物活性肽的分子量大多都在6 000 Da 以下。食品来源的生物活性肽在开发功能性食品或保健品以及预防和管理许多慢性病方面具有巨大潜力。众多学者研究发现,生物活性肽具有抗氧化、降血压、抗炎、抑菌、抑制血栓形成和提高免疫力等功能[1-3]。
目前,生物活性肽的制备方法主要有化学提取法、微生物发酵法、生物合成法和酶解法。化学提取法能成熟地运用于生物活性肽的制备,是4 种方法中应用最广泛的,但提取过程中要消耗大量化学试剂,同时存在环境污染大、设备成本高等缺点;微生物发酵法制备的生物活性肽具有成本低、产量高等优点,但在发酵过程中发酵时间不易控制,且发酵过程易受微生物感染,会造成安全问题;利用生物合成法制备生物活性肽具有高纯度和成熟的优势,但这种方法成本较高,产率却很低;与其他生物活性肽制备方法相比,酶解法具有反应过程易控制、重复性好、成本低、能耗低等优点,因此被广泛用于工业化生产多肽,使用不同的蛋白酶切割母体蛋白质能产生具有不同活性的肽段。
蛋白质分子大多拥有复杂的三维结构,这使得蛋白质底物与酶的接触频率降低,最终使酶解法制备活性肽的应用存在一定限制[2]。当前研究表明,在酶解前可适当改变蛋白质底物的结构和性质,提高酶对蛋白质底物的敏感性,从而达到提高酶解效率的目的。通过加热、氧化、高压、剪切等方式使蛋白质分子内部结构被破坏的同时发生轻微变性,蛋白质发生解折叠,结构变松散,隐藏在内部的酶切作用位点暴露,改善酶解效果。不同的前处理方式对蛋白质结构和性质造成的影响不同,因而对后续酶解法制备活性肽促进效果也有差异。本文主要介绍酶解法制备生物活性肽的前处理技术和酶解产物的结果和性质分析,同时对酶解产物的纯化及鉴定、肽活性研究方法进行综述,以期为酶解法制备生物活性肽的相关研究提供参考。
1 预处理
1.1 化学法
1.1.1 传统酸碱处理
作为一种传统处理方式,酸或碱处理在预处理过程中运用十分广泛,酸或碱分别能与蛋白质的碱性、酸性基团结合,使得蛋白质分子内部及分子之间的非共价键断裂,造成蛋白质非螺旋结晶区结构的破坏,水分子更容易进入螺旋内部,水合作用因而加速,蛋白质结构被进一步破坏,蛋白质结构变得舒展松散,利于后续酶解过程。张玲[3]研究了酸处理对酶法提取罗非鱼皮胶原多肽的影响,结果表明酸预处理时间低于4 h 可获得较高品质的明胶。强碱可使蛋白巯基与二硫键发生消除反应或交换反应,对蛋白理化特性影响较大;吕莹等[4]研究了碱处理对酶法提取核桃肽抗氧化活性的影响,结果表明经过碱液预处理操作,核桃肽更易与溶液中的酶分子相互作用,肽的抗氧化活性和得率均高于其他处理组。虽然酸碱处理作为预处理手段能在一定程度上提高酶解效率,但是若酸碱浓度过高或处理时间过长,可能会导致蛋白质共价键特别是肽键断裂,蛋白质聚集,不利于后续的酶解过程。
1.1.2 氧化前处理
氧化是导致水产品质量劣化、鲜度下降和风味丧失的主要原因之一。水产品中蛋白氧化作用明显,活性氧的作用、氧化应激的二次副产物攻击都会造成蛋白质氧化。蛋白质氧化后结构发生改变,对酶的亲和力增强,蛋白质更易发生水解、聚合、交联作用。有研究表明,对蛋白质进行氧化前处理后,其某些氨基酸残基会发生变化,导致氨基酸侧链发生交联,这可能会改变蛋白酶的识别位点,最终起到促进酶解的作用。刘晏玮[5]利用H2O2氧化预处理蓝蛤,结果显示当H2O2浓度为5 mmol/L 和20 mmol/L 时,蓝蛤的水解度从25%提高至26%、27%,如继续增加H2O2浓度,蓝蛤水解度降低。这是因为在较低H2O2浓度时,H2O2产生的自由基作用于蛋白质,攻击了蛋白质的侧链,使得蛋白质肽链的构象发生轻微改变,更有利于酶发挥作用,提高水解度。有研究表明,温和的氧化条件可以使蛋白质部分疏水性基团暴露,从而提高酶的消化率,但在剧烈的蛋白质氧化条件下,蛋白质会发生聚合作用,会损害消化率,降低蛋白质的敏感性[6]。
1.2 酶法
当样品基质比较复杂时,在酶解过程中,各种成分间可能存在干扰,在进行酶解操作前利用特定的酶预处理样品,可使酶解效率大幅度提高。例如,在酶解动物性蛋白时,脂肪含量对酶解效率会产生显著影响,传统去除脂肪通常运用挤压或化学方法,这很容易导致产品污染和营养物质的损失。Yao 等[7]探究脂肪酶预处理对提高牛骨蛋白酶解效果影响,结果表明当底物浓度9%、初始pH7.5、脂肪酶用量0.08%、40 ℃培养4 h 时,可使牛骨蛋白的水解率提高8.19%。这是因为利用脂肪酶预处理动物蛋白,可以特异性地水解油脂的酯键,从而催化油脂的水解,使其游离出长链脂肪酸和甘油,提高酶解效率。与此结果类似,赵谋明等[8]利用胃蛋白酶前处理大豆蛋白,大豆蛋白回收率、水解度及酶解产物的抗氧化能力指数分别提高了39.9%、35.9%和38.5%。
1.3 物理法
1.3.1 加热技术
热预处理过程简单,不添加任何化学试剂,是一种环境友好型处理方法,能改善酶解处理存在的时间长、效率低等问题。酶解前对蛋白质进行适当的热预处理可以使蛋白质微变性,暴露出可能隐藏的酶切位点,提高酶解效率[9]。美拉德反应、脂质氧化反应等在加热过程中都可能会发生,这会造成许多风味前体物质发生降解,降解产物会相互反应形成多种挥发性化合物,从而提高产物呈味特性。加热温度和时间对风味特征具有重要的影响,许多呈味物质的变化与加热温度和加热时间有关[10]。李学鹏等[11]研究热预处理对蓝蛤酶解物的影响,结果表明加热温度70 ℃、加热时间10 min 时,有利于降低苦味值。张玲[3]对低温脱脂核桃进行加热预处理,与直接酶解相比,核桃肽的得率从18.46%提高至47.3%。
1.3.2 超声波技术
超声波技术是基于频率高于人类听力阈值(>16 kHz)的机械波的一种新型非热物理加工技术。超声波产生的效应(空化效应、机械效应、热效应)可以提高酶解效率,其中空化效应是主动力,可以促进传质并增加底物和酶之间的接触频率,改变底物构型。在酶解前对原料进行超声预处理,可有效提高酶解效率及转化率。Kangsanant 等[12]探究超声预处理对罗非鱼蛋白水解物的抗氧化的影响,结果显示,70 W 超声波预处理30 min 时,罗非鱼水解液清除DPPH 自由基的能力提高了33%,还原能力提高了45%。许晶等[13]利用超声预处理大豆蛋白,酶解产物水解度提高了4%,羟自由基清除率提高了8%。但是,超声波的功率、作用时间与蛋白质水解度不呈现正相关关系,超声功率过高、超声时间过长会破坏蛋白酶结合位点和蛋白酶自身结构,使得蛋白酶活性下降,影响酶解效果,从而降低水解率[14]。
1.3.3 超高压技术
超高压处理也被称为高压处理或高压静压处理,与传统的热处理工艺相比,超高压技术不仅能保证食品的质地、形状、色泽,还能保证食品的风味和营养特性。作为一种新技术,超高压被用来处理蛋白质溶液,压力能使蛋白质疏水基团和-SH 基团部分暴露出来,蛋白质在疏水相互作用下逐渐展开,增加肽在酶消化部位的暴露,有利于后续的酶解。Zhao 等[15]利用400 MPa 超高压处理蘑菇脚蛋白10 min,肽提取率提升了3 倍,酶解蛋白水解度从11%提高至23%;Garcia-Mora 等[16]利用超高压处理风信子蛋白,在300 MPa压力作用下,利用Savinas 蛋白酶水解蛋白的水解度提升了近4 倍,这说明高压会破坏非共价和二硫键,使得蛋白质不稳定性提升,低分子量多肽浓度增加,蛋白质水解度增加。
研究表明,当前处理作用压力大于400 MPa 时,蛋白质后续的酶解水解度反而降低[17],这是因为随着压力的增大蛋白质结构变的越来越松散,继续增大压力,蛋白质暴露的基团又会以新的疏水相互作用和形成—SH 键重新聚集在一起,不利于酶解。
1.3.4 高压均质技术
高压均质是一种非热加工技术,均质过程中不添加化学试剂,同时它成本低、效率高,因此被广泛应用于食品加工中[18]。高压均质作用下,悬浊液状态的物料快速通过特殊结构的狭窄中断阀间隙,在此过程中,物料受到高速剪切、高频振荡、空穴现象和湍流撞击等机械力作用,使得物料颗粒尺寸减小、蛋白质构象结构改变、物理化学性质变化[19]。陈剑兵等[20]利用高压均质技术前处理菜籽蛋白,从0~150 MPa,压力越大,碱性蛋白酶酶解菜籽蛋白的促进效果越明显,水解度从10%提高至14%,这是因为高压均质使蛋白质结构变得松散舒展,蛋白质分子的次级键在高压均质处理后被破坏,更多的肽键得以暴露,肽键与蛋白酶作用几率增大,蛋白质水解度提升。赵飞[21]利用高压均质处理大豆分离蛋白,结果发现经高压均质处理的大豆分离蛋白酶解产物水解度提高了143%,抗氧化活性显著提高了30%。
2 酶解产物的纯化及鉴定
大分子的蛋白质经过蛋白酶酶解后获得不同分子量的肽段,肽的分子量及结构影响着肽段的生理活性,为获得活性较高的肽段,需要对酶解后得到的产物进行纯化。纯化流程如图1 所示,通常使用膜分离技术(超滤、纳滤)对酶解产物中不同分子量大小的组分进行初步的分离,利用离子交换色谱或凝胶色谱对膜分离后显示出最高活性的组分进行二次分离,最后使用反相高效液相色谱对活性最高的组分进行鉴定前的纯化。除此之外,盐析法[22]、电泳法[23-24]、层析技术[25-27]等也常应用于蛋白质酶解产物的纯化。
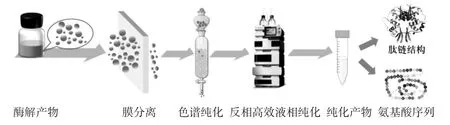
图1 酶解产物的纯化及鉴定流程图Fig.1 Flow chart of purification and identification of products of enzymatic hydrolysis
纯化后的生物活性肽一般需要进行氨基酸序列的鉴定及肽链结构的表征。通常采用质谱技术对未知肽链进行氨基酸序列的鉴定,利用核磁共振、紫外光谱、傅立叶变换红外光谱等对肽链进行结构分析。除此之外,电泳技术[28-29]、Edman 降解法[30-31]、圆二色谱法[32-33]也可用于活性肽的鉴定。大多数情况下,研究者们需将上述多个方法联合使用来分离目标活性多肽及鉴定肽链的氨基酸序列和结构特征[34-36]。
3 酶解产物结构特点
3.1 活性肽分子量
目前,主流用酶的来源包括3 种:微生物源(碱性蛋白酶、中性蛋白酶和风味酶);动物源(胃蛋白酶和胰蛋白酶);植物源(菠萝蛋白酶和木瓜蛋白酶)[37]。酶解法制备生物活性肽时,原料和蛋白酶种类的差异都会对酶解产物产生影响,水解度的不同将直接影响酶解产物的分子量。研究表明,相比高分子量的肽段,低分子量的肽段活性更高,这主要是由于小肽很容易通过肠道上皮细胞进而被人体吸收与目标物质结合发挥作用。
You 等[38]用木瓜蛋白酶酶解泥鳅,比较了不同分子量泥鳅蛋白水解液超滤组分抗氧化能力,分子量小于3 kDa 的多肽组分抗氧化能力最高,可能是小分子量的肽能与自由基结合得更充分。与此结果类似,在血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性中,小分子的肽显示出更高的降血压活性,Ghassem 等[39]用酶解法从鲤鱼中制备降血压肽,其中分子量791.155 Da 和1 085.841 Da 的两个片段有很高的血管紧张素转换酶活性,IC50值分别为0.45 μmol/L和0.63 μmmol/L。在抗癌活性中,不同来源的抗癌活性多肽的相对分子质量在300~1 950 Da 之间,分子量小的肽段有更高的抗癌活性,相对分子质量较低的多肽具有更大的分子迁移率和扩散性,增加了多肽与癌细胞成分的相互作用,抗癌活性也随之增强,Umayaparvathi等[40]酶解牡蛎分离出相对分子质量为515.29 Da 的抗癌肽。而鉴定出来的抗菌肽的相对分子质量大多数大于1 000 Da,Tang 等[41]酶解鳀鱼得到分子量为1 104.662 2 Da 的抗菌肽;Ennaas 等[42]酶解大西洋鲭得到相对分子质量分别为1 094.7、1 042.5、1 111.6、1 102.5 Da 的4 种抗菌肽。大多数抗菌肽都是阳离子和两亲性的,具有亲水和疏水表面,它们的抗菌作用是通过在微生物膜上形成气孔或扰乱微生物膜的完整性而引起的。
3.2 活性肽氨基酸组成
肽活性的产生与多肽链中疏水性氨基酸、芳香族氨基酸、酸性或碱性氨基酸以及含硫氨基酸的数量、在碳链中所处的位置密切相关[43]。疏水氨基酸(缬氨酸、色氨酸、酪氨酸、亮氨酸、异亮氨酸、组氨酸、脯氨酸)可以改善多肽在脂质中的溶解度,促进多肽与自由基的相互作用,从而提高抑制脂质过氧化的能力,除此之外,还可以增强生物膜中的多肽和多不饱和脂肪链之间的接触;芳香氨基酸(苯丙氨酸、色氨酸、酪氨酸)能形成一个稠密的芳香环,利于多肽对金属离子的螯合作用,芳香氨基酸在清除自由基的过程中能向缺乏电子的自由基提供质子,形成稳定的活性氧物种,有研究表明,含有组氨酸残基的多肽具有很强的螯合金属离子、清除羟基自由基和抑制脂质过氧化的能力,主要是因为组氨酸侧链上的咪唑基可以参与供氢和电子转移;酸性或碱性氨基酸可以通过带电的侧链基团与金属离子形成络合物,从而螯合金属离子;含硫氨基酸侧链上的巯基可以通过提供氢原子清除自由基[43]。
缬氨酸、脯氨酸、酪氨酸、亮氨酸、丙氨酸、赖氨酸、甲硫氨酸等疏水氨基酸能增强多肽的抗氧化肽活性,色氨酸、苯丙氨酸这两种芳香族氨基酸的抗氧化活性与它们作为自由基清除剂的能力有关,而酪氨酸的抗氧化活性归因于酚作为氢供体的特殊能力,Chen 等[43]酶解大豆蛋白检测到6 种抗氧化肽,活性多肽包括5~16 个氨基酸残基,N-末端含有疏水性缬氨酸、亮氨酸,氨基酸序列中含有脯氨酸、组氨酸或酪氨酸,通过比较28 个结构归属,发现脯氨酸-组氨酸-组氨酸三肽单元是影响大豆蛋白水解物抗氧化活性的活性中心。生物活性肽的抗癌活性与其抗氧化活性相关,因为当自由基产生时,氧化就会发生,自由基过量会对蛋白质和DNA 造成氧化损伤,从而导致癌症,能增强抗氧化活性的结构在一定层度对抗癌活性有促进作用。ACE 抑制肽的抑制作用完全依赖于酶的一级结构和选择,其N-端或C-端的氨基酸种类不同,对ACE 抑制肽的抑制作用也不同。甘氨酸、脯氨酸和亮氨酸能增强活性肽的ACE 抑制活性,Lee 等[44]从轮虫皮肤中提取的血管紧张素转换酶抑制肽(脯氨酸-甘氨酸-脯氨酸-亮氨酸-甘氨酸-亮氨酸-亮氨酸-苏氨酸-甘氨酸-脯氨酸),分子量为975.38 Da,在末端含有脯氨酸和亮氨酸,在N-端含有甘氨酸和亮氨酸。此外,C 端的脯氨酸、苯丙氨酸或酪氨酸以及N-端的缬氨酸和异亮氨酸也显示出较强的ACE 抑制活性。例如,Fahmi 等[45]从罗非鱼鳞片中分离出结构为缬氨酸-异亮氨酸-酪氨酸的降压肽。抗菌肽中富含疏水性氨基酸(甘氨酸、丙氨酸、脯氨酸及酸性氨基酸谷氨酸),富含甘氨酸残基的高疏水性肽可结合富含脂多糖的疏水性细菌膜,进而具有更高的抗菌活性。
表1 为不同来源的多肽的结构与性质。
4 肽活性评价方法
目前,评价多肽活性的方法主要有化学方法、体外细胞生物学方法和体内动物实验方法。自由基的清除作用、金属离子的螯合能力、抑制脂质过氧化反应都是典型的化学法评价多肽原蛋白肽的抗氧化活性的手段,多肽抑制微生物生长的能力是常用的评价多肽抗菌活性的化学方法;体外细胞生物学方法一般用于评估多肽对特定细胞或细胞系的活性,比如,可以用基于细胞的试验来评估多肽对癌细胞增殖的抑制能力;体内动物实验测定法用于评估多肽在生物体内的活性,如多肽的降压活性可以用高血压的动物模型来评估,肽的抗癌活性可以用癌症的动物模型来评估。总的来说,体外、体内和基于细胞的试验的组合经常被用来评估生物活性肽的活性,同时还有其他分析技术,如质谱法和核磁共振光谱法来进行结构定性。曹振海等[58]用DPPH 自由基清除率、还原力表征暗纹东方鲀鱼皮制备的胶性。王珊珊[59]采用去卵巢大鼠模型,探讨鱼骨胶原肽对骨质疏松症的预防。体外细胞试验能直接反映生物活性肽对损伤细胞的保护作用。与体外化学方法相比,细胞生物学分析比化学分析更具生物学意义,因为这种方法涉及几个方面,包括细胞对抗氧化化合物的摄取、分布和代谢。与体内动物实验相比,细胞生物学可以弥补体内动物实验法成本高、耗时长的缺陷。但是,在细胞培养过程很容易造成污染,多数细胞试验使用的是传代细胞,在一定程度上不能反映体内的真实情况。樊金娟等[60]利用大鼠红细胞证明了米糠抗氧化肽具有体外抗氧化作用。
5 展望
生物活性肽在各个行业有广泛的潜在应用,包括功能食品、营养品和药品。在功能性食品中,可以添加生物活性肽来提高产品的营养价值和健康效益。例如,具有抗高血压活性的肽可以添加到食品中以帮助降低血压。在营养品中,生物活性肽可以作为补充剂来促进健康和预防疾病。在医药方面,生物活性肽可以作为候选药物来治疗各种疾病,如癌症和心血管疾病。利用酶解法从植物源、动物源、微生物源物质中制备生物活性肽是当前研究较为热门的领域。但是酶解法制备生物活性肽的技术还存在一定的问题:1)生物活性肽的分离纯化过程存在耗时长、成本高的缺点,因此需要开发更高效、更节能的分离纯化方法,且目前的工作主要集中在活性肽的制备、纯化和表征上,而活性肽的结构与活性之间的关系还没有很好地建立起来,活性肽的活性机制在分子水平上还没有得到很好的阐述;2)由于缺乏对活性肽的吸收、分布、代谢、排泄、毒理和致敏等方面的信息,限制其在市场上的生产和应用。因此,活性肽的安全性和质量有待进一步评价。随着未来科学技术的进步和这些肽在体内的不断投入研究,这些肽的分子机制将在全基因水平得到验证。该领域的未来研究应集中在以开发标准化的方法制备、纯化和鉴定生物活性肽,包括使用高通量筛选方法来识别新的生物活性肽,以及使用先进的分析技术,如采用质谱和核磁共振光谱表征肽。此外,需要进行更多地研究来了解生物活性肽的作用机制,这有助于设计和优化具有改进特性的新肽。最后,改善多肽在体内的生物利用度和稳定性是一个关键的研究领域,可以探索使用纳米技术和封装等策略来改善生物活性多肽对目标组织的传递。未来科研领域与产业界的合作将有利于实现活性肽商业化应用的长远目标。
