凝胶过滤层析结合液相色谱-串联质谱法测定血清中游离甲状腺激素
2024-01-02邹海飞邓顺艳
邹海飞,李 敏,邓顺艳,夏 兵,周 燕*
(1.中国科学院成都生物研究所,四川 成都 610041;2.中国科学院成都有机化学研究所,四川 成都 610041;3.中国科学院大学,北京 101408)
三碘甲腺原氨酸(Triiodothyronine,T3)和甲状腺素(Thyroxine,T4)是两种主要的甲状腺激素,其分泌量的增多或减少均可导致甲状腺功能障碍,并可增加心血管疾病[1]、糖尿病并发症[2]和妊娠并发症[3]的发生风险。正常情况下,T3、T4 分别约99.7%和99.97%与特异的血浆蛋白相结合,仅有0.3%和0.03%为游离状态,简称为FT3和FT4[4]。而游离激素假说认为,甲状腺激素的游离形式才是其活性部分,与生物效应密切相关[5]。FT3和FT4的测定不受血清结合蛋白的影响,是甲状腺功能体外实验的灵敏指标,可作为甲亢、甲减、甲状腺肿、重症感染发热等疾病的辅助诊断[6]。
由于血清中FT3 和FT4 临床检测的重要性,50 多年来研究者们相继开发了测定FT3 和FT4 的不同方法。但由于游离甲状腺激素的浓度极低,FT3的血液浓度为1.4~6.0 pg/mL,FT4为8.0~20.0 pg/mL[7]。并且结合态与游离态之间的内源性平衡易受到扰乱,使得其检测结果的重复性、稳定性较差。因此,临床上准确检测游离甲状腺激素仍然十分困难,极具挑战性。目前,临床实验室通常通过免疫分析方法或物理分离方法检测FT3 或FT4。通过免疫法间接测定的FT3、FT4 含量易因其动态平衡被破坏而有误[8-9]。尤其是在妊娠期,由于其结合蛋白的显著变化和嗜异性抗体的存在,使得免疫测定结果不准确[10]。美国甲状腺协会建议,在妊娠期测定FT4 的最佳检测方法为液相色谱-串联质谱(LC-MS/MS)法[11]。该法分析灵敏度高、特异性好[12-13],已成为国外检测人血清中FT3、FT4的金标准方法[14]。在结合态与游离态之间的内源性平衡受干扰最小的情况下,从血清中分离出FT3 和FT4 是该方法前处理环节的关键[15]。经过多年的发展与改进,平衡透析和超滤已成为较为成熟和完善的物理分离技术,然而这两种方法均因其自身的局限性,尚未推广到大多数临床实验室[15-16]。
凝胶过滤层析(GFC),利用分子筛作用和选择性洗脱,可以实现蛋白结合态和游离态的快速分离,加之凝胶载体的惰性高、吸附力弱,能够减小对内源性平衡的干扰。1979年,Romelli等[17]将凝胶过滤层析用于游离甲状腺激素测定,证实了该方法不会显著改变血清中的游离激素水平。在此基础上,本研究拟采用GFC 技术,通过进一步优化,减少样本量,简化操作步骤,建立可靠的快速前处理方法,实现高通量样本检测,使其适用于临床检测实验室。在此基础上,基于LC-MS/MS 技术建立高灵敏检测方法,以实现临床游离甲状腺激素的高灵敏、稳定、快速检测,为甲状腺激素临床相关疾病的诊断、预防、治疗、预后和监测等提供支撑。
1 实验部分
1.1 仪器与装置
LCMS-8050 CL 岛津液相色谱三重四极杆质谱仪(日本Shimadzu 公司);PCWJ-10超纯水机(成都品成科技有限公司);涡旋混匀仪(金坛区白塔新宝仪器厂);QB-8002 96孔板混匀仪(海门市其林贝尔仪器制造有限公司);BT25S 型十万分之一电子天平(德国Sartorius 公司);BCY9602 96 孔正压装置、BCN9602 96 孔氮吹仪(深圳逗点生物技术有限公司);FiveEasy Plus FE28 pH 计(上海梅特勒-托利多仪器有限公司);平衡透析装置(北京汇智和源生物技术有限公司)。
1.2 试剂与材料
甲醇、甲酸(色谱纯,美国Fisher公司);超纯水(杭州娃哈哈公司);氢氧化钠(分析纯,成都金山化学试剂有限公司);磷酸二氢钠二水合物和三(羟甲基)氨基甲烷盐酸盐(Tris-HCl)(上海阿拉丁生化科技股份有限公司);无水磷酸氢二钠(分析纯,上海迈瑞尔化学技术有限公司);Proclin 300 抑菌剂、羟乙基淀粉和牛血清白蛋白(上海源叶科技有限公司);表面活性剂Triton X-100(上海毕得医药科技股份有限公司);纳他霉素(上海麦克林生化科技有限公司);氯化钠(成都市科龙化工试剂厂);Sephadex LH-20 96孔过滤板、96孔提取板、96孔收集板、96孔进样板(纳谱分析技术(苏州)有限公司)。
1.3 样 品
T3 标准品(98%,批号:21A043-C3,上海甄准生物科技有限公司);T4 标准品(98%,批号:21A034-F6,上海甄准生物科技有限公司);T3 内标(T3-13C12,同位素丰度为99.3%,纯度为94.2%,批号:PR-30090,青岛腾龙微波科技有限公司);T4 内标(T4-13C6,同位素丰度 ≥ 99%,纯度 ≥ 98%,批号:22T021-T2,上海甄准生物科技有限公司)。血清样品均来自淄博市中医医院的剩余样本,样本的收集及使用已取得医院伦理委员会批准。
1.4 标准溶液和内标溶液的配制
分别准确称取T3、T4 标准品各10.0 mg,用5%氨水-甲醇溶解,并定容于10 mL 棕色容量瓶,分别配制得到质量浓度为1.0 mg/mL 的T3、T4 标准储备溶液。用30%甲醇水稀释标准储备溶液,配制得到质量浓度分别为2、4、10、20、50、100、150、200 pg/mL的系列标准工作溶液。将内标储备溶液用30%甲醇水稀释,配制得到T3-13C12、T4-13C6质量浓度均为200 pg/mL的混合内标工作溶液。
1.5 质控品的制备
准确吸取50 µL Proclin 300、50 µL 0.1 mg/mL 纳他霉素、50 µL Triton X-100,称取0.9 g 氯化钠、5.0 g 羟乙基淀粉、5.0 g 牛血清白蛋白,搅拌至完全在纯水中溶解后,使用超纯水稀释至100 mL。使用0.45 µm 滤膜对稀释后的溶液进行过滤,收集滤液,得到空白基质。将不同质量浓度的T3、T4混合标准溶液添加到空白基质中,配制得到低、中、高质量浓度(分别为10、50、150 pg/mL)的质控品。
1.6 样品前处理
Sephadex LH-20 凝胶小柱预处理:依次使用2 mL 20%乙醇水、2 mL 超纯水进行活化,再用4 mL磷酸盐缓冲液(PB,0.1 mol/L,pH 7.4)进行平衡。取150 µL血清加载至经预处理的Sephadex LH-20凝胶小柱,正压装置压入填料内,依次用4 mL Tris-HCl缓冲液(0.1 mol/L,pH 7.4)、150 µL甲醇进行洗涤,以去除结合蛋白的甲状腺激素,弃去洗涤液。然后用1.5 mL 甲醇对游离的甲状腺激素进行洗脱,收集洗脱液,于室温下氮气吹干,加入150 µL混合内标工作溶液,振荡混匀2 min,待分析。
1.7 分析条件
1.7.1 色谱条件Shim-pack Velox SP-C18色谱柱(2.1 mm× 50 mm,1.8 µm);流动相:A 相为0.002%甲酸水溶液,B 相为甲醇;流速:0.3 mL/min;柱温:45 ℃;进样量:30 µL;梯度洗脱:0~0.5 min,30% B;0.5~5 min,30%~98% B;5~7 min,98% B;7.01~9 min,98%~30% B。
1.7.2 质谱条件离子源:电喷雾离子源(ESI);数据扫描方式:正离子模式;测定方式:多反应监测(MRM)模式;脱溶剂气温度:600 ℃;加热块温度:400 ℃;接口电压:4.0 kV;雾化气流速:3.0 L/min;干燥气流速:5.0 L/min;加热气流速:15.0 L/min。各目标物的保留时间、MRM 监测离子对、碰撞电压等参数见表1。

表1 各化合物的保留时间与MRM质谱参数Table 1 Retention times and MRM mass spectrometry parameters of each compound
2 结果与讨论
2.1 分析条件的优化
2.1.1 质谱参数的优化由于羧基和氨基的存在,甲状腺激素可在正电离模式和负电离模式下检测,但实验发现T3、T4在ESI正离子采集模式下的灵敏度更高。将T3、T4、T3-13C12、T4-13C6标准溶液进行Q1母离子扫描分析,扫描范围为m/z100~1 000。分别调整脱溶剂气温度、接口电压、加热块温度、雾化气流速、干燥气流速、加热气流速等参数,使母离子响应增强,噪音降低。经过优化,T3、T4、T3-13C12、T4-13C6产生的Q1 信号最高,以稳定的[M+H]+为母离子,m/z分别为651.6、777.4、663.7、783.5。根据前体离子进行产物离子的自动优化,选择离子丰度高、干扰小且稳定的子离子作为定量离子,次强的作为定性离子。最佳的质谱参数如“1.7.2”所示。
2.1.2 色谱条件的优化考察了Waters XBridge Phenyl(2.1 mm×50 mm,5 µm)、Shim-pack GISS C18(2.1 mm×50 mm,1.9 µm)、Shim-pack Velox SP-C18(2.1 mm×50 mm,1.8 µm)3 种色谱柱对目标化合物的分离效果。结果表明,Shim-pack Velox SP-C18色谱柱对目标化合物的信号响应更高,峰形更好,因此选择该色谱柱进行样品分离。分别考察了纯水、甲酸水(0.1%、0.05%、0.02%、0.01%、0.005%、0.002%)、氨水(0.1%、0.01%、0.002%)、0.002%乙酸水、0.1%甲酸+2 mmol/L 乙酸铵-水溶液作为流动相A,甲醇、乙腈、50%甲醇-乙腈、0.1%甲酸+2 mmol/L 乙酸铵-甲醇溶液作为流动相B时待测物的响应强度,最终选择0.002%甲酸水溶液和甲醇作为流动相。经梯度优化,使得样品中T3 及其同分异构体反三碘甲腺原氨酸(rT3)和T4具有良好的分离效果(见图1)。

图1 T3、rT3和T4的MRM色谱图(A)与局部放大图(B)Fig.1 MRM chromatograms of T3,rT3,T4(A) and local enlarged image of A(B)
2.2 前处理条件的优化
2.2.1 尺寸排阻填料及填料量的优化考察了羟丙基葡聚糖凝胶Sephadex LH-20、葡聚糖凝胶Sephadex G-25、大孔树脂TOYOPEARL HW-40F、硅胶微球BioCore SEC-150 的分离性能。将凝胶溶胀,湿法装柱,SPE 凝胶小柱经过活化、平衡、上样、淋洗(1~8 管,用缓冲液洗去蛋白结合态)、洗脱(9~16管,用甲醇洗脱游离态),每管收集0.5 mL,分别进行检测,并将血清样品与标样的检测结果进行比对。以FT4为例,如图2A 所示,根据结合态与游离态的分段情况,最终选用羟丙基葡聚糖凝胶Sephadex LH-20。

图2 填料种类(A)和填料量(B)的优化结果Fig.2 Optimization results of filler type(A) and filler quantity(B)
进一步考察了Sephadex LH-20填料量分别为5、10、15、20、30、40、60、100、150 mg时的分离效果。如图2B 所示,当填料量在5~40 mg 之间时,分离得到的FT3、FT4 趋于稳定;而当填料量大于40 mg 时,分离得到的FT3、FT4 明显增多,说明部分与蛋白结合的T3、T4 发生了解离。因此,选用Sephadex LH-20填料量为15 mg,此时FT3、FT4的提取分离效果最好。
2.2.2 孵育时间及血清稀释倍数的优化为模拟体内平衡过程,考察了在37 ℃下,孵育时间分别为0、0.5、1、1.5、2 h 的影响。结果显示,随着孵育时间的延长,分离得到的FT3、FT4 含量增多,因此选择不孵育。进一步考察了血清稀释倍数分别为0、0.5、1、1.5、2 倍的影响,结果表明,随着血清稀释倍数的增加,分离得到的FT3、FT4含量增多,因此选择不稀释。
2.2.3 淋洗液的优化淋洗液主要用于洗去结合蛋白,一般用水或缓冲液。考察了Tris-HCl 缓冲液(0.1 mol/L,pH 7.4)、PB 缓冲液(0.1 mol/L,pH 7.4)、0.9% NaCl 水溶液、超纯水、PBS 缓冲液(0.1 mol/L,pH 7.4)、HEPES 缓冲液(pH 7.4)的淋洗效果。图3A 结果显示,Tris-HCl 缓冲液、PB 缓冲液、0.9% NaCl 水溶液、HEPES 缓冲液的淋洗效果相近,考虑到溶液配制过程以及实验重复性,最终选用淋洗液为Tris-HCl缓冲液(0.1 mol/L,pH 7.4)。
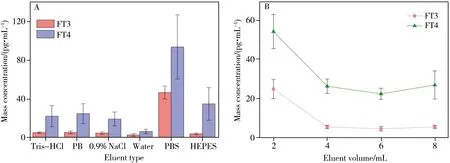
图3 淋洗液种类(A)和淋洗液体积(B)的优化结果Fig.3 Optimization results of eluent type(A) and volume(B)
考察了Tris-HCl 缓冲液(0.1 mol/L,pH 7.4)体积分别为2、4、6、8 mL 时的淋洗效果。如图3B 所示,当填料量为15 mg,上样量为150 µL 时,淋洗液体积达到4 mL 以上时提取效果较好,因此选择淋洗液体积为4 mL。
2.3 方法学验证
2.3.1 线性范围、检出限及定量下限按“1.4”配制系列标准工作溶液,浓度从低到高依次进行检测,每个浓度水平测定3次。通过LabSolutions Ver.5.60软件进行数据处理,以标准溶液的质量浓度为X轴,标准品和内标的峰面积比值为Y轴,进行线性回归分析。结果显示,FT3、FT4 分别在2~200 pg/mL、4~200 pg/mL范围内呈良好线性关系,相关系数(r2)分别为0.999 9、0.999 5。
将不同质量浓度的T3、T4 混合标准溶液添加到空白基质中,配制得到质量浓度分别为8、4、2、1 pg/mL 的样品,按“1.6”方法前处理后进行检测。分别以信噪比S/N>3 和S/N>10 确定方法的检出限(LOD)和定量下限(LOQ),得到FT3、FT4的检出限分别为1、2 pg/mL,定量下限分别为2、4 pg/mL。
2.3.2 基质效应基质效应(ME)一般通过比较目标物在样品基质和空白溶剂中的信号响应进行评价。取6 个不同人体的血清样品按“1.6”方法进行提取后,分别添加低、中、高浓度(10、50、150 pg/mL)的混合标准溶液,每个浓度水平平行制备3 份,将上述样品和标准溶液进行质谱测定。参照文献方法[18]进行计算,一般认为ME 在85%~115%范围时,没有明显的基质效应影响。结果显示,FT3、FT4在低、中、高浓度的基质效应为85.8%~114%,说明没有明显的基质效应。
2.3.3 回收率按“1.5”方法制备得到低、中、高浓度的质控样品,每个浓度平行制备3 份,按“1.6”方法前处理后上机检测;同时将相同浓度的T3、T4混合标准溶液上机检测。通过比较质控样品与标准溶液的测定值,计算得到FT3和FT4的回收率分别为85.8%~103%和89.7%~107%。
2.3.4 准确度与精密度按“1.5”方法配制低、中、高3 个浓度水平的质控样品,每个浓度平行制备6 份,按“1.6”方法前处理后上机检测,得到批内准确度及批内相对标准偏差(RSD)。通过3 个分析批连续三天进行检测,得到批间准确度及批间RSD。结果显示:FT3 和FT4 的批内和批间RSD 分别为3.4%~10%和1.8%~8.8%,批内和批间准确度分别为85.4%~110%和89.1%~102%。
2.4 方法对比
将建立的凝胶过滤层析法(GFC)与平衡透析法(ED)同时用于95 例血清样本的检测。按“1.6 ”方法和ED 方法(参照CLSI C45-A 指导文件[19])分别对血样进行前处理,然后按“1.7”仪器条件进行检测。使用IBM SPSS Statistics 26 和MedCalc 统计软件(v. 20.0.0)对检测结果进行配对t检验分析、Passing-Bablok 回归分析和Bland-Altman 一致性分析。如图4 所示,本研究建立的GFC/LC-MS/MS 法与ED/LC-MS/MS法的测定结果无统计学差异(P>0.05),两种方法之间存在较好的一致性。

图4 凝胶过滤层析和平衡透析法测定结果的Passing-Bablok回归分析(A、C)和Bland-Altman图(B、D)Fig.4 Passing-Bablok regression analysis(A,C) and Bland-Altman diagram(B,D) of the determination results of gel filtration chromatography and equilibrium dialysis
3 结 论
本研究基于凝胶过滤层析进行前处理,结合LC-MS/MS 分析,建立了血清中游离甲状腺激素FT3和FT4的高通量、高灵敏检测新方法。将该方法应用于95例血清样本的检测,结果与平衡透析法存在较好的一致性。本方法快速(5 h)、简便,受干扰因素相对较少,更便于临床推广。该方法可为临床实验室游离甲状腺激素的快速、高效、准确检测提供参考。
