替米考星对胞内金黄色葡萄球菌的抗菌活性
2024-01-02鞠牧洁刘金环蒋永涛冷楠楠罗万和
鞠牧洁,刘金环,蒋永涛,冷楠楠,罗万和
(1.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300 ; 2.塔里木大学动物科学与技术学院,新疆 阿拉尔 843300)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)严重危害奶牛健康养殖[1]。金黄色葡萄球菌作为一种常见的兼性胞内菌,具有多种免疫逃避机制,可在宿主细胞内持续存活,使得宿主免疫系统和抗生素难以将其完全清除,进而引起胞内细菌感染[2,3]。Siwczak等[4]研究发现,金黄色葡萄球菌能以小菌落变异体(Small colony variant,SCV)形式靶向感染M2型巨噬细胞,并在胞内持续增殖,这与慢性和隐性奶牛乳腺炎的反复感染密切相关。
由于宿主细胞对胞内金黄色葡萄球菌具有一定的保护作用,导致常规药物难以渗透到胞内金黄色葡萄球菌的感染部位,难以达到有效的治疗浓度和时间[5,6]。例如,氨基糖苷类药物有较强的极性,被摄入细胞内的药物达不到有效杀菌浓度,最终导致金黄色葡萄球菌产生耐药性[7,8];四环素类药物膜渗透率较低,且金黄色葡萄球菌的细胞膜对四环素类药物有主动外排作用,难以杀灭细菌[9];β-内酰胺类药物一直是治疗革兰阳性菌的首选抗生素,但由于其不合理使用导致越来越多的细菌对其产生严重的耐药性[10]。大环内酯类药物具有较强的膜渗透性,其中替米考星是一种半合成的大环内酯类抗生素,对多种革兰阳性菌和部分革兰阴性菌、支原体和螺旋体等均具有良好的抗菌活性[11,12]。由胞内金黄色葡萄球菌引起的奶牛乳腺炎的典型特征是持续性和反复性感染,因此对于奶牛乳腺炎的治疗应首选长效制剂。而替米考星具有良好的抗生素后效应,其半衰期长,生物利用度高,且口服给药后靶部位药物浓度高于血浆药物浓度[13,14]。研究发现,替米考星对金黄色葡萄球菌的最小抑菌浓度(Minimum inhibitory concentration,MIC)为 2 μg/mL,推测替米考星对胞内金黄色葡萄球菌同样具有较强的抗菌活性[15]。
本试验以金黄色葡萄球菌ATCC 29213为靶细菌,以小鼠单核巨噬细胞(RAW264.7)为载体细胞,在构建金黄色葡萄球菌感染细胞体系的基础上,测定胞内金黄色葡萄球菌生长曲线、MIC、最低杀菌浓度(Minimum bactericidal concentration,MBC)、防突变浓度(Mutant prevention concentration,MPC)、耐药突变选择窗(Mutant selection window,MSW)、抗菌后效应(Post-antibiotic effect,PAE)和杀菌曲线,旨在探究替米考星对胞内金黄色葡萄球菌的抗菌活性,为防治胞内金黄色葡萄球菌感染提供参考资料。
1 材料与方法
1.1 试验材料
1.1.1 药品和试剂 替米考星溶液,购自山东雨泽银丰动物药业有限公司,批号:20201101;Dulbecco's Modified Eagle Medium(DMEM)培养基、四甲基偶氮唑蓝(Methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)和磷酸盐缓冲液,均购自武汉默瑞斯生物科技有限公司;胰蛋白酶大豆肉汤(Tryptic soytone broth,TSB)培养基和甘露醇盐琼脂(Mannitol salt aga,MSA)培养基,均购自鼎源生物技术有限公司。
1.1.2 主要仪器 二氧化碳培养箱,长沙长锦科技有限公司产品;PCR仪,山东恒美电子科技有限公司产品;Micro Screen高通量实时微生物生长仪,广州湘喜生物科技有限公司产品;酶联免疫检测仪,北京凯奥科技有限公司产品。
1.1.3 试验菌株 金黄色葡萄球菌标准菌株(ATCC 29213),由塔里木大学动物科学与技术学院提供。
1.2 金黄色葡萄球菌的培养 将复苏的金黄色葡萄球菌加入TSB培养基中,培养18~24 h。复苏后的金黄色葡萄球菌传代培养3次以上。
1.3 RAW264.7细胞的培养 将RAW264.7细胞复苏后,加入DMEM培养基,培养24 h后传代。
1.4 金黄色葡萄球菌感染细胞体系的构建 向铺有RAW264.7细胞的24孔板中加入金黄色葡萄球菌(1×107CFU/mL)(模型组)或者DMEM培养基(对照组),培养1 h后加入0.5 mL庆大霉素(100 μg/mL),共同孵育30 min以杀灭细胞外的金黄色葡萄球菌,因庆大霉素无法透过生物膜屏障,所以对胞内菌株无杀灭作用 [庆大霉素对金黄色葡萄球菌的90%最低抑菌浓度(90% minimum inhibitory concentration,MIC90)为1 μg/mL][16,17]。使用PBS冲洗残留的庆大霉素后,用细胞裂解液裂解被感染的细胞,并涂布于MSA平板。若金黄色葡萄球菌生长良好,则可初步判断金黄色葡萄球菌感染细胞体系构建成功。通过PCR方法进一步验证金黄色葡萄球菌感染细胞体系是否构建成功。PCR引物序列(nuc基因)见表1,由生工生物工程(上海)股份有限公司合成。PCR扩增反应体系(50 μL)和程序参照参考文献[18],分别以灭菌去离子水和金黄色葡萄球菌ATCC 29213为阴性和阳性对照。
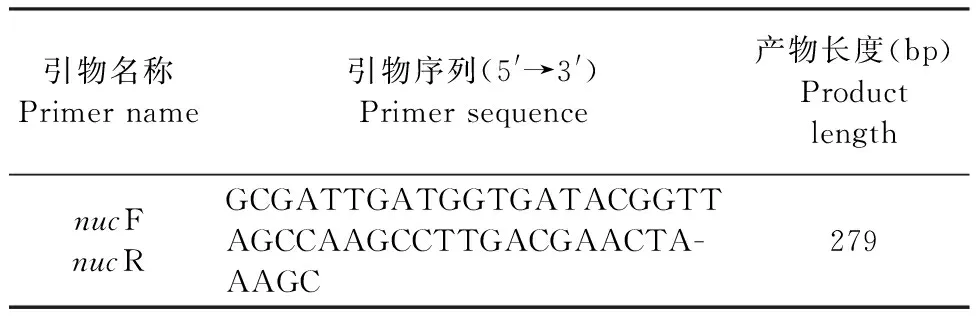
表1 PCR引物信息Table 1 PCR primer information
1.5 胞内金黄色葡萄球菌在RAW264.7细胞中生长曲线的测定 将构建好的感染细胞体系置于培养箱中,分别在培养0、0.5、1、2、3、4、6、8、12、18、24和48 h时,吸弃细胞培养液,用PBS清洗3次。加入细胞裂解液,以释放出胞内细菌。使用Micro Screen高通量实时微生物生长仪测定金黄色葡萄球菌的浓度,以菌液浓度与培养时间的关系绘制金黄色葡萄球菌在RAW264.7细胞中的生长曲线。
1.6 替米考星对RAW264.7细胞活力的影响 将200 μL RAW264.7细胞悬液(细胞浓度为1×104个/mL)接种于96孔培养板中培养24 h,每孔加入含有128、64、32和16 μg/mL替米考星的DMEM基础培养液,同时设置空白组(仅有DMEM培养基)和对照组(仅有细胞和DMEM培养基)。培养6、12和24 h后,使用酶联免疫检测仪于490 nm处测定吸光度(Optical density,OD)值,进而计算细胞存活率[16]。
1.7 替米考星对胞内金黄色葡萄球菌MIC和MBC的测定 在感染细胞体系中分别加入倍比稀释的替米考星溶液(浓度为128、64、32、16、8、4、2、1、0.5、0.25、0.125和0.062 5 μg/mL),并设阴性对照(只有细胞)和阳性对照(只有细菌和细胞)。培养18~24 h后,经细胞裂解液释放出胞内细菌,并使用Micro Screen高通量实时微生物生长仪测定细菌浓度。
1.8 替米考星对胞内金黄色葡萄球菌MPC的测定 将感染细胞体系置于培养箱培养,待细菌浓度达1×107CFU/mL后,离心,重悬,调节细菌浓度约为1×109CFU/mL。加入含有不同浓度替米考星(4、2、1、1/2和0×MIC)的细胞培养基,置于培养箱中培养18~24 h后,初始防突变浓度(Initial mutation prevention concentration,MPCpr)为无菌落生长的最低药物浓度。以MPCpr为基础,按20% MPCpr重复以上步骤,得到最终MPC和MSW(MSW=MIC-MPC)。
1.9 替米考星对胞内金黄色葡萄球菌PAE的测定 在感染细胞体系中分别加入不同浓度替米考星(4、2和1×MIC),使用Micro Screen高通量实时微生物生长仪测定不同时间点(0、1和2 h)的细菌浓度,计算PAE[14]。
1.10 杀菌曲线的绘制 在感染细胞体系中分别加入不同浓度替米考星(4、2、1、1/2和0×MIC),并设空白对照(同体积的DMEM培养基)。在共同孵育0、1、2、4、8、12、18、24和48 h后,经裂解液释放出胞内细菌,使用Micro Screen高通量实时微生物生长仪测定细菌浓度,以孵育时间为横坐标,细菌浓度为纵坐标绘制杀菌曲线。
2 结果
2.1 金黄色葡萄球菌感染细胞体系的构建 MSA平板观察结果如图1A所示,对照组MSA平板无金黄色葡萄球菌生长,而模型组中被感染的细胞释放出金黄色葡萄球菌后,在MSA平板上生长良好。PCR结果如图1B所示,金黄色葡萄球菌扩增产物为279 bp。综合以上结果表明,已成功构建金黄色葡萄球菌感染细胞体系,可用于后续试验。
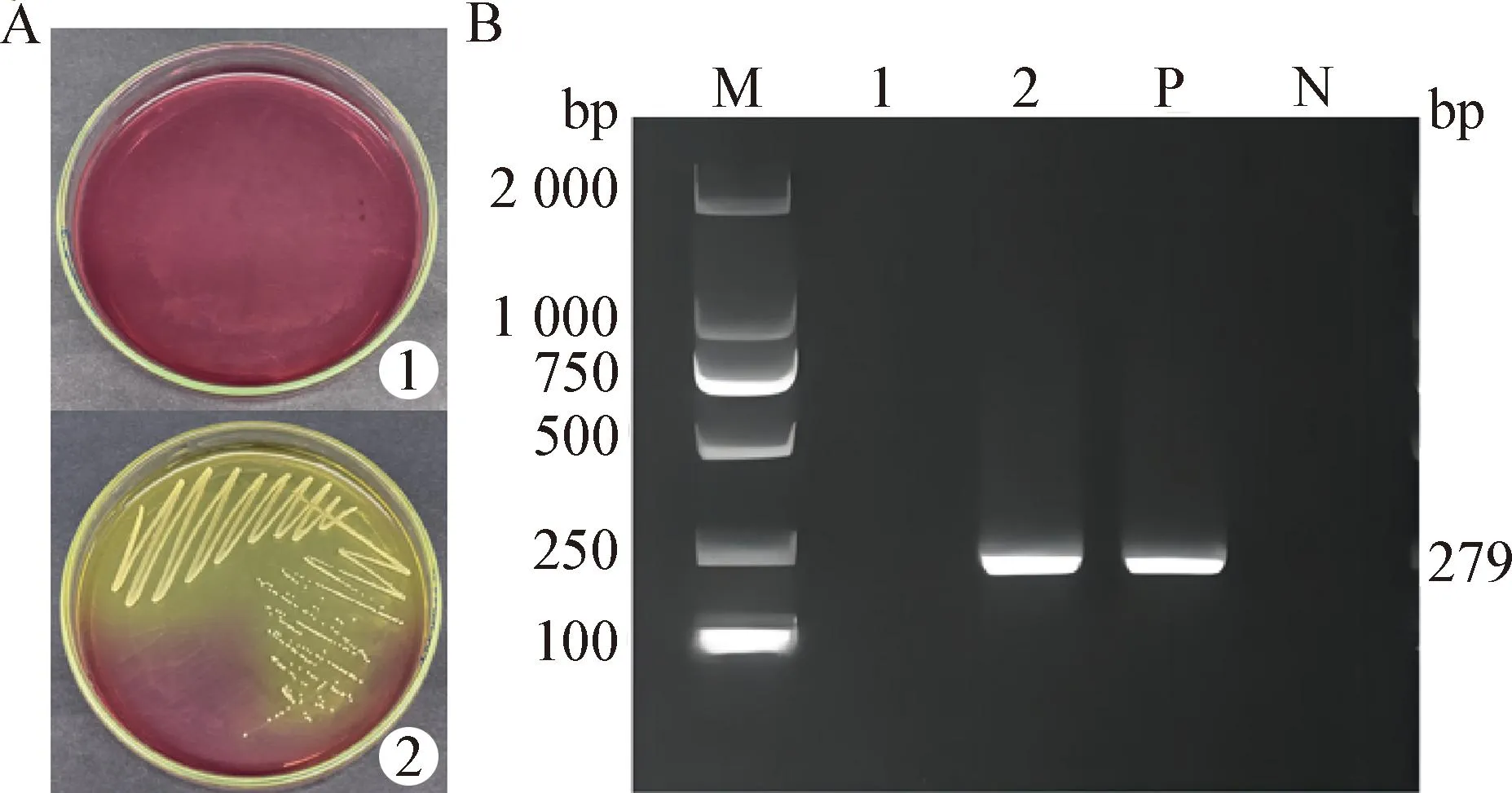
图1 金黄色葡萄球菌感染RAW264.7细胞体系的构建Fig.1 Construction of RAW264.7 cells system infected by Staphylococcus aureusA:MSA平板观察(1:对照组; 2:模型组); B:胞内金黄色葡萄球菌的PCR检测(M:DL2 000 DNA相对分子质量标准; 1:空白孔; 2:待测孔; P:阳性对照; N:阴性对照)A:MSA plate observation (1:Control group; 2:Model group); B:PCR detection of intracellular Staphylococcus aureus (M:DL2 000 DNA relative molecular weight standard; 1:Blank hole; 2:Test hole; P:Positive control; N:Negative control)
2.2 胞内金黄色葡萄球菌在RAW264.7细胞中生长曲线的测定 如图2所示,在0.5、1、2、3和4 h时,胞内金黄色葡萄球菌生长缓慢,故0~4 h为迟缓期;在6、8、12和18 h时,胞内金黄色葡萄球菌生长迅速,细菌浓度快速增加,故4~18 h为对数期,且此时细菌致病力最强;在24 h时,胞内金黄色葡萄球菌生长数与死亡数相似,故18~24 h为稳定期;在48 h时,死亡细菌浓度逐渐上升,活菌浓度逐渐减少,故24~48 h为衰亡期。
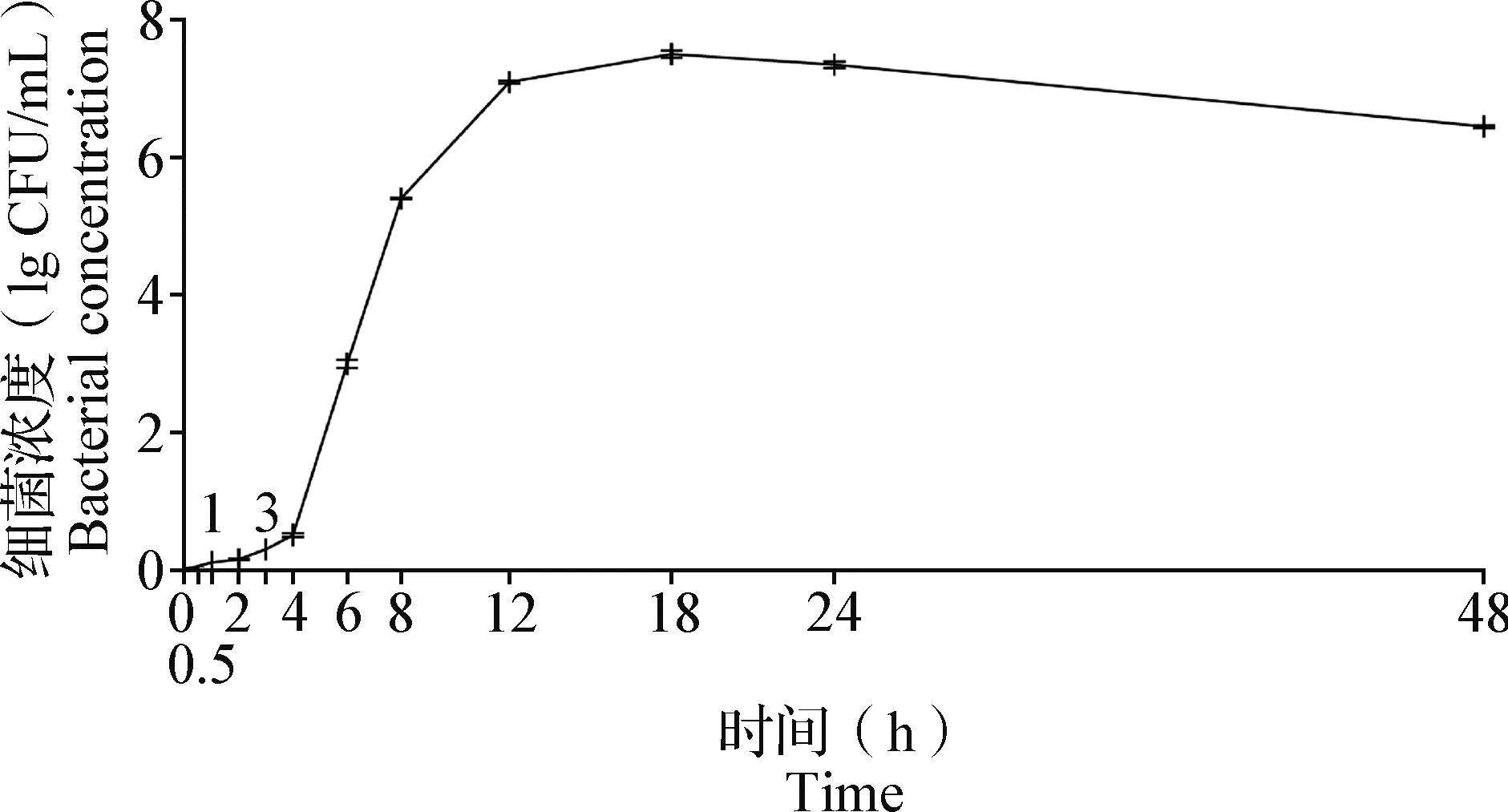
图2 金黄色葡萄球菌在RAW264.7细胞中的生长曲线(Mean±SD,n=3)Fig.2 Growth curve of Staphylococcus aureus in RAW264.7 cells (Mean±SD,n=3)
2.3 替米考星对RAW264.7细胞活力的影响 如图3所示,细胞存活率会随着替米考星浓度和孵育时间的增加而降低,但浓度为128 μg/mL替米考星与RAW264.7细胞共同孵育24 h时,细胞存活率仍然高于80%。结果表明,替米考星对RAW264.7细胞无毒性作用。
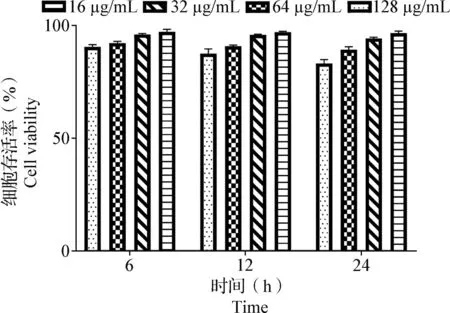
图3 替米考星对RAW264.7细胞活力的影响(Mean±SD,n=3)Fig.3 Effects of tilmicosin on cell viability of RAW264.7 cells (Mean±SD,n=3)
2.4 替米考星对胞内金黄色葡萄球菌MIC、MBC、MPCpr、MPC和MSW的测定 经测定,替米考星对胞内金黄色葡萄球菌的MIC和MBC分别为4和8 μg/mL;MPCpr为16 μg/mL,最终MPC为12.8 μg/mL,故MSW范围为4~12.8 μg/mL。
2.5 替米考星对胞内金黄色葡萄球菌PAE的测定 结果如表2所示,当替米考星与胞内金黄色葡萄球菌共同孵育1 h时,随着替米考星浓度的增大,产生PAE的时间略微延长;当替米考星与胞内金黄色葡萄球菌的共同孵育2 h时,产生PAE的时间明显延长。结果表明,随着时间的增加,产生PAE的时间明显延长,表现出明显的时间依赖性的杀菌特点。另外,随着药物浓度的增大,产生PAE的时间也随之延长。

表2 替米考星对胞内金黄色葡萄球菌的抗菌后效应Table 2 PAE of tilmicosin against intracellular Staphylococcus aureus
2.6 杀菌曲线的绘制 如图4所示,替米考星对胞内金黄色葡萄球菌具有明显的抗菌活性,随着替米考星浓度的增大,杀菌效果随之增强。
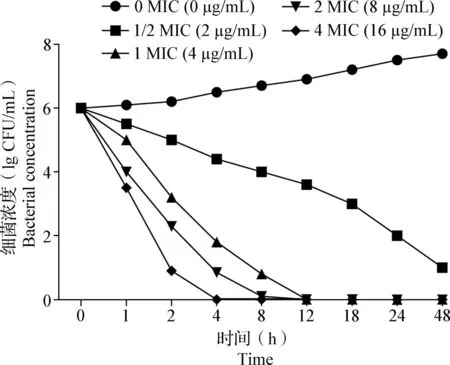
图4 替米考星对胞内金黄色葡萄球菌的杀菌曲线(n=3)Fig.4 Bactericidal curve of tilmicosin against intracellular Staphylococcus aureus(n=3)
3 讨论
由金黄色葡萄球菌引起的奶牛乳腺炎会引起牛奶产量和质量下降,给奶牛养殖业带来巨大损失。金黄色葡萄球菌作为一种常见的兼性胞内菌,可在宿主细胞内持续存活,从而巧妙地抵御抗生素杀伤作用和宿主免疫系统杀菌作用[19]。M2型巨噬细胞主要负责在感染后期的组织修复,随着胞内金黄色葡萄球菌的不断增殖,使巨噬细胞死亡裂解释放金黄色葡萄球菌,从而感染周围健康组织形成脓肿,这与奶牛长期、反复感染金黄色葡萄球菌性乳腺炎密切相关[20]。替米考星对金黄色葡萄球菌的抗菌活性较强,且具有良好的组织穿透性,可作为治疗胞内金黄色葡萄球菌感染的优选药物[21]。Martínez-Cortés 等[22]研究证明,替米考星是一种有效的乳腺炎症调节剂,可通过调节丝裂原活化蛋白激酶磷酸化、活性氧自由基产生和促炎细胞因子分泌等,来修复由金黄色葡萄球菌感染引起的细胞损伤,有助于维持牛乳腺上皮细胞的正常生理功能。
本试验通过测定替米考星对胞内金黄色葡萄球菌的MIC、MBC、MPC、MSW和PAE,发现替米考星对胞内金黄色葡萄球菌有较强抗菌活性,明确了替米考星对胞内金黄色葡萄球菌的杀菌特点具有明显的时间依赖性,对于制定替米考星治疗奶牛乳腺炎的合理给药方案具有重要意义,并且可避免耐药性的产生。MSW对探究替米考星对胞内菌的耐药性有很好的参考价值,当药物浓度在4~12.8 μg/mL时,替米考星对胞内金黄色葡萄球菌有较好的临床治愈率,但也容易出现耐药突变体的选择性富集[15]。所以选择替米考星治疗胞内金黄色葡萄球菌感染时,药物浓度至少≥12.8 μg/mL,即在杀灭敏感株和耐药菌株的同时,又可避免胞内金黄色葡萄球菌耐药性的产生[23]。PAE可延长抗菌药物和细菌之间的作用时间,在一定范围内,产生PAE的时间长短与药物浓度和作用时间成正比[24]。本试验中替米考星对胞内金黄色葡萄球菌的PAE结果显示,随着作用时间的增加,产生PAE的时间明显延长,即替米考星对胞内金黄色葡萄球菌的杀菌特点具有明显的时间依赖性(时-效关系)。根据这一特点可以适当增加替米考星的给药浓度和延长作用时间,提高药物在胞内的停留时间,以获得更好的杀菌效果。药效学作为药动学-药效学模型(Pharmacokinetic-pharmacodynamic modeling,PK-PD modeling)的重要组成部分,对于研究药物在体外的抗菌活性有参考价值[25-27]。本试验替米考星对胞内金黄色葡萄球菌的杀菌特点具有明显的时间依赖性,可判断其PK-PD拟合参数为T>MIC。因此,本试验有望增强替米考星对胞内金黄色葡萄球菌的抗菌活性,对于替米考星的合理使用具有一定的参考价值。本试验中替米考星对胞内金黄色葡萄球菌的MIC和MBC值为分别为4和8 μg/mL,而替米考星对金黄色葡萄球菌ATCC 29213体外抑菌的MIC为2 μg/mL[15]。这可能是由于宿主细胞对金黄色葡萄球菌具有一定的保护作用,使渗透进入胞内的药物浓度偏低,所以导致替米考星对胞内金黄色葡萄球菌的MIC偏大[5,6,7,28]。其次由于体外培养和细胞内环境的差异,也可能会对胞内金黄色葡萄球菌产生一定的影响[29]。
本试验虽证明了替米考星在治疗胞内金黄色葡萄球菌感染中具有较好的抗菌活性,但也存在一定的局限性,在体外构建的胞内金黄色葡萄球菌感染模型较为简单,无法反映由胞内金黄色葡萄球菌感染所引起奶牛乳腺炎的复杂程度。故在本试验基础上,后续将开展替米考星对由胞内金黄色葡萄球菌引发奶牛乳腺炎的临床疗效评价,以此验证在本试验中的关键发现。
