鲢鱼重组cystatin C的抑菌活性及抑菌机理初探
2023-12-29徐小烽李树红钱邓帆郭淇羽李冉李龙飞岑永好段志豪韩学艳米辰
徐小烽,李树红,钱邓帆,郭淇羽,李冉,李龙飞,岑永好,段志豪,韩学艳,米辰
(四川农业大学 食品学院,四川 雅安,625014)
我国水产资源丰富,水产品肉鲜味美、营养丰富,深受消费者喜爱。但水产品内源酶活性高,且携带多种来自水体的微生物,易腐败变质,因此冷藏是水产品重要的贮藏方式。此外高效、低毒的生物防腐剂也常用于食品保鲜。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》仅允许抑制革兰氏阳性菌(G+)的生物防腐剂即乳酸链球菌素应用于水产食品保鲜,但其在偏中性的环境下稳定性较差,也易被酶水解[1]。而在冷藏水产品中,除了存在部分G+葡萄球菌属[2]、芽孢杆菌属[3]等腐败微生物,革兰氏阴性菌(G-)气单胞菌属、假单胞菌属、希瓦氏菌属微生物是货架期终点最常见的优势腐败菌[4-6]。水产品加工废弃物本身富含天然的抗菌蛋白,若将其应用于水产品保鲜,既能提高食品安全性,又充分利用了水产资源。
cystatins属于一类半胱氨酸蛋白酶抑制因子,具有专一性抑制半胱氨酸蛋白酶的活性,包含cystatin C、cystatin D、cystatin E/M等形式,是一类低分子质量(约13 kDa)蛋白质。在水产品加工废弃物鱼卵、鱼皮、鱼肝脏等组织,均发现了cystatins活性。目前已发现陆生动植物源cystatins具有抑菌活性[7-8],而对鱼源cystatins抑菌研究有限。本团队首先发现了鲢鱼卵cystatin C能抑制冷藏鲢鱼肉片中的G-假单胞菌J-4[9],之后发现其对G-铜绿假单胞菌[10]、草莓假单胞菌和荧光假单胞菌也有抑菌效果[11]。此外,仅YU等[12]报道了牙鲆重组cystatin C对鱼病相关的G-病原菌,以及G+金黄色葡萄球菌、枯草芽孢杆菌有抑制作用。鱼源cystatin C作为一种对部分G-及G+有抑菌活性的天然抗菌蛋白,在pH 4~9稳定性好[13],且能抵抗半胱氨酸蛋白酶的水解,有望被开发为水产食品生物防腐剂。因此阐明鱼源cystatin C的抑菌活性及作用机制,具有一定的理论和现实意义。一般认为小分子的抗菌蛋白或抗菌肽,主要与细菌细胞膜相互作用,从而导致菌体裂解死亡[14]。目前仅BLANCA等[15]从形态学上观察了重组人唾液cystatin C对G+粪肠球菌和变形链球菌的抑制作用。而鱼源cystatins抑制G+及G-的相关机制未见报道。
为此,本文在团队前期研究基础上,通过测定抑菌圈直径(diameter of inhibition zone,DIZ)、最低抑菌浓度(minimal inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC),评价鲢鱼(Hypophthalmichthysmolitrix)重组cystatin C(HmCystatin C)对从冷藏水产品中分离的腐败希瓦氏菌、中间气单胞菌、荧光假单胞菌、腐生葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的抑菌活性;分析了HmCystatin C对两株敏感受试菌生长曲线的影响,并从HmCystatin C与菌体及其细胞壁成分的结合、对细胞壁和细胞质膜通透性影响方面,初步探究HmCystatin C的抑菌机理。
1 材料与方法
1.1 材料与试剂
HmCystatin C根据实验室前期确定的方法制备[16],由转入鲢鱼cystatin-pet-30a的工程菌大肠杆菌(EsherichiacoliBL(DE3)进行原核表达、纯化,微滤除菌后保存。纯度为95%,比活性为1 428.57 unit/mg。
G-:腐败希瓦氏菌(Shewanellaputrefaciens)、荧光假单胞菌(Pseudomonasfluorescens)、铜绿假单胞菌(Pseudomonasaeruginosa)、中间气单胞菌(Aeromonasmedia)以及G+:腐生葡萄球菌(Staphylococcussaprophyticus)、枯草芽孢杆菌(Bacillussubtilis),由四川农业大学食品学院水产品科学研究室分离并保存。
脂多糖(lipopolysaccharide, LPS)(来源于铜绿假单胞菌ATCC 27316,纯度≥98%),北京索莱宝科技有限公司;肽聚糖(peptidoglycan, PGN)(来源于金黄色葡萄球菌,BR级),上海源叶生物科技有限公司;Anti-His tag Antibody,武汉博士德生物工程有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L),碧云天生物技术有限公司;EL-TMB显色试剂盒、N-苯基-1-萘胺(N-phenyl-1-naphthylamine, NPN),生工生物工程(上海)股份有限公司;重组鼠硫氧还原蛋白(Trx-His-tag),上海钰博生物科技有限公司;碱性磷酸酶试剂盒,南京建成生物科技有限公司;NB、NA培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
THZ-98AB恒温振荡培养箱、LRH-250生化培养箱,一恒科学仪器(上海)有限公司;TGL-18M高速冷冻离心机,上海卢湘仪离心机仪器有限公司;Varioskan Flash荧光酶标仪,美国赛默飞世尔科技公司;DDS-307电导率仪,上海仪电科学仪器股份有限公司;DYCN-40G转印电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 受试菌的活化及菌悬液的制备
将受试菌接种于NA培养基过夜培养,挑取单菌落接种至NB培养基,扩大培养24 h(37 ℃,150 r/min),以1%接种量接种至新鲜NB培养基,培养至对数生长期,用平板计数法确定菌液浓度后,适当稀释备用。
1.3.2 DIZ的测定
滤纸片扩散法[17]测定HmCystatin C对6株受试菌的DIZ。HmCystatin C用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)溶解至3.75 mg/mL,取40 μL 滴加在含菌培养皿表面的滤纸片上,3个平行。以无菌PBS做阴性对照,测定DIZ值。并选择抑制效果突出的受试菌,滴加40 μL不同质量浓度(0.937 5、1.875、3.75、7.5 mg/mL)的HmCystatin C溶液,以确定剂量依赖关系。
1.3.3 MIC和MBC的测定
采用二倍稀释法[18]测定HmCystatin C对6株受试菌的MIC和MBC。将14 mg/mL的HmCystatin C分别稀释至7、3.5、1.75、0.875 mg/mL。酶标孔中加HmCystatin C溶液和菌悬液各100 μL,各孔加入20 μL 的0.01%刃天青溶液(蓝色)显色。以空白培养基为阴性对照,不含HmCystatin C的菌液作为阳性对照。37 ℃培养24 h后,以不变色的蓝色微孔中样品的最小质量浓度为MIC。在各试验组中取蓝色微孔中菌液100 μL,平板涂布后培养并观察,以无菌生长的HmCystatin C最小质量浓度为MBC。
1.3.4 HmCystatin C对典型受试菌生长曲线的影响
选择HmCystatin C抑制效果最好的G-和G+各一株作为典型受试菌。菌悬液(OD600=0.6)中加入HmCystatin C至终浓度为1× MIC,以仅含受试菌组为对照,每2 h取样测定24 h内600 nm处吸光度。
1.3.5 HmCystatin C与典型受试菌的结合
参考CHEN等[19]方法,测定HmCystatin C与G-和G+典型受试菌的结合情况。菌悬液离心(3 500×g,5 min)后收集菌体沉淀,用无菌PBS洗涤并重悬至OD600=0.8,加入HmCystatin C至终浓度为1× MIC,室温孵育1 h后离心,并用适量无菌PBS洗涤菌体沉淀,3次重复后收集菌体沉淀和最后一次的菌体洗涤液。阳性对照为HmCystatin C组,阴性对照以Trx-His-tag替代HmCystatin C,进行SDS-PAGE以及Western blot检测HmCystatin C与细菌的结合情况。
1.3.6 HmCystatin C与LPS及PGN结合
采用ELISA法[19]测定HmCystatin C与LPS和PGN的结合情况。酶标板中加入适量LPS和PGN溶液过夜包被,再加入终浓度分别为0,0.5×MIC,1×MIC,1.5×MIC,2× MIC的HmCystatin C。先后经小鼠抗His-tag抗体和辣根过氧化物酶标记的山羊抗小鼠IgG (H+L)孵育并洗涤,用TMB试剂显色后于450 nm处检测吸光度。以等量无菌PBS溶液替代LPS或PGN溶液作阴性对照。
1.3.7 HmCystatin C对典型受试菌细胞完整性影响
1.3.7.1 典型受试菌G-细胞外膜渗透性测定
参考HELANDER等[20]方法,评估HmCystatin C对典型受试菌G-铜绿假单胞菌细胞外膜的破坏程度。将各浓度(0,0.5×MIC,1×MIC,1.5×MIC,2×MIC)的HmCystatin C分别与受试菌混合,以等量BSA代替HmCystatin C为对照组,加入20 μL的0.25 mmol/L NPN溶液,用荧光酶标仪于激发波长350 nm、发射波长420 nm下检测荧光强度。
1.3.7.2 典型受试菌G+细胞壁渗透性测定
取典型受试菌G+腐生葡萄球菌测定其碱性磷酸酶(alkaline phosphatase,AKP)含量。在受试菌中加入HmCystatin C使其终浓度分别为0.5× MIC和1× MIC,37 ℃,150 r/min培养,以仅含菌悬液组作为对照,5 h内定时取样,离心后取上清液参考试剂盒方法测定AKP含量。
1.3.7.3 HmCystatin C对典型受试菌细胞内膜通透性影响
参考HELANDER等[20]方法,测定胞内泄露物β-半乳糖苷酶含量变化,反映HmCystatin C对典型受试菌(G-及G+)细胞内膜通透性影响。受试菌悬液中加入等体积的邻硝基苯-β-D-半乳糖苷(2-nitrophenyl β-D-galactopyranoside,ONPG)溶液及HmCystatin C(0.5× MIC、1× MIC),阴性对照组以等量0.5%(质量分数)NaCl溶液代替HmCystatin C。于酶标仪420 nm处测定100 min内各时间点的吸光值。
1.3.7.4 典型受试菌菌液电导率的测定
参考TAO等[21]方法。离心收集G-及G+典型受试菌菌体沉淀,PBS洗涤后重悬至1×106CFU/mL,加入HmCystatin C使终浓度分别为0.5×MIC,1×MIC。37 ℃,150 r/min培养,5 h内定时取样,离心后取上清液测定电导率。以仅含菌悬液作为对照组。以各培养时间点与0 h点对应的电导率值之差表示电导率增值。
1.3.8 数据统计分析
采用Origin 2017软件进行绘图,SPSS Statistics 27进行数据统计分析,实验重复3次,取测定结果的平均值,数据用平均值±标准误差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 HmCystatin C对受试菌DIZ、MIC和MBC的测定
HmCystatin C对6株受试菌的DIZ、MIC和MBC如表1及图1所示。除G+枯草芽孢杆菌外,HmCystatin C对G-腐败希瓦氏菌、荧光假单胞菌、铜绿假单胞菌、中间气单胞菌以及G+腐生葡萄球菌均有抑制效果。对腐生葡萄球菌的DIZ[(15.4±0.02) mm]最大,其次是铜绿假单胞菌[(12.7±0.04) mm],而对腐败希瓦氏菌的DIZ[(10.3±0.1) mm]最小。且腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌和荧光假单胞菌对HmCystatin C有相似的敏感性,MIC均为3.5 mg/mL。结合腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌MBC值(3.5 mg/mL)可知,HmCystatin C对这3株菌的抑制效果最好;对腐败希瓦氏菌的抑菌效果较弱,其MIC和MBC均为7 mg/mL。该结果与抑菌圈直径的趋势符合。腐败希瓦氏菌是有氧冷藏海水鱼中特定的腐败微生物[6],因此淡水鲢鱼来源的cystatin C可能对其抑菌效果有限。从HmCystatin C剂量依赖实验(表2、图2)可知,随着HmCystatin C浓度增加,铜绿假单胞菌、中间气单胞菌及腐生葡萄球菌的DIZ依次增加。尤其腐生葡萄球菌在HmCystatin C质量浓度为1.875 mg/mL时仍呈现明显的抑菌圈。冷藏水产品中常见的优势腐败菌,如假单胞菌属、气单胞菌属和希瓦氏菌属,产尸胺和腐胺的能力强[4-5],G+腐生葡萄球菌也是水产品中典型产组胺的优势菌[2],严重影响水产品品质;HmCystatin C对除G+枯草芽孢杆菌外的受试G-和G+腐败菌均有明显抑制作用,因此其作为水产品保鲜剂具有潜在优势。

表1 HmCystatin C对6株受试菌的DIZ、MIC及MBCTable 1 DIZ, MIC, and MBC of HmCystatin C against six tested bacteria
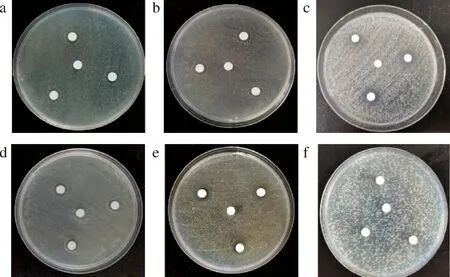
a-铜绿假单胞菌;b-中间气单胞菌;c-荧光假单胞菌; d-腐败希瓦氏菌;e-腐生葡萄球菌;f-枯草芽孢杆菌图1 HmCystatin C对6株受试菌的抑菌活性Fig.1 Antibacterial activity of HmCystatin C against six tested bacteria

表2 不同浓度HmCystatin C对3株受试菌DIZ的影响 单位:mm
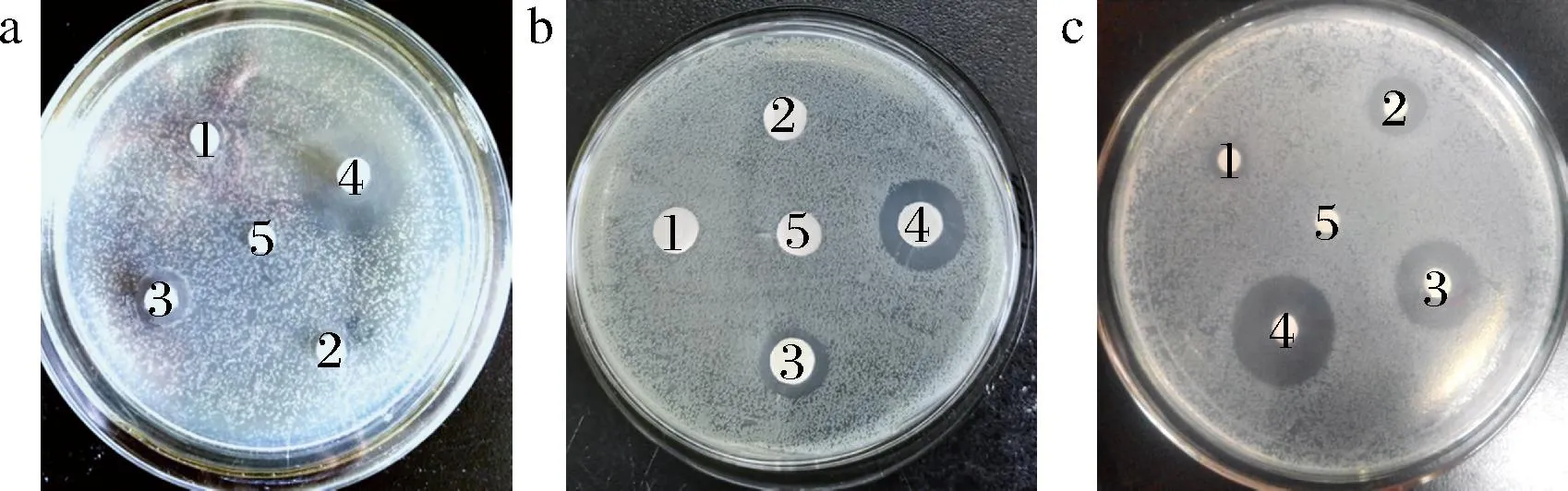
1-0.937 5 mg/mL;2-1.87 5 mg/mL;3-3.75 mg/mL; 4-7.5 mg/mL;5-PBS a-铜绿假单胞菌;b-中间气单胞菌;c-腐生葡萄球菌图2 不同浓度HmCystatin C对3株受试菌的抑菌效果Fig.2 Antibacterial effect of different concentrations of HmCystatin C on three tested bacteria
2.2 HmCystatin C对典型受试菌生长曲线的影响
以抑制效果最好的G-铜绿假单胞菌和G+腐生葡萄球为典型受试菌,测定HmCystatin C对其生长曲线的影响(图3)。相比对照组典型的细菌生长模式,HmCystatin C在1× MIC水平下,对两株受试菌的生长都表现明显抑制(P<0.01);铜绿假单胞菌培养24 h 内无增殖迹象(图3-a);腐生葡萄球菌培养6 h后OD600值稍有增加,但增殖速度极显著低于对照组(P<0.01)(图3-b);结果表明,鲢鱼重组HmCystatin C在1× MIC下能够抑制受试菌对数生长期快速分裂增殖,表现出显著的生长抑制效果。
2.3 HmCystatin C与典型受试菌菌体结合
由图4可知,阳性对照组及两实验组均有明显的条带,阴性对照组和最后一次菌体洗涤液组均未显色,说明HmCystatin C与菌体孵育后,能结合到G-铜绿假单胞菌和G+腐生葡萄球菌菌体表面。此外铜绿假单胞菌实验组比腐生葡萄球菌实验组的条带更明显,说明HmCystatin C与G-铜绿假单胞菌结合能力更强。HmCystatin C(Genebank序列号:AGW15355.1)氨基酸序列中富含带正电荷的Lys,这可能有利于其利用N端带正电荷的序列与细菌表面的负电荷发生静电吸引[22]。此外,BROGDEN[23]认为抗菌肽能结合到细胞表面,主要是与G+细胞壁中带负电荷的磷壁酸质相互作用,这种结合使得抗菌肽能够通过细胞壁(壁磷壁酸和膜磷壁酸)并与细菌质膜相互作用,从而发挥抑菌作用。尽管目前尚未知HmCystatin C与细菌细胞壁结合的具体方式和位点,但可推测HmCystatin C能够结合到细菌表面是其进一步发挥抑菌作用的前提。

1-HmCystatin C阳性对照;2-腐生葡萄球菌实验组; 3-腐生葡萄球菌阴性对照;4-腐生葡萄球菌最后一次洗涤液; 5-铜绿假单胞菌实验组;6-铜绿假单胞菌阴性对照组; 7-铜绿假单胞菌最后一次洗涤液图4 HmCystatin C与铜绿假单胞菌和腐生葡萄球菌 结合的Western blot分析Fig.4 Western blot analysis of HmCystatin C binding to P.aeruginosa and S.saprophyticus
2.4 HmCystatin C与LPS和PGN结合
LPS和PGN分别是G-和G+细胞壁的主要成分。ELISA检测发现,HmCystatin C能与LPS和PGN结合(图5),其与LPS的亲和性强于PGN,并且随着蛋白浓度增大,与LPS的结合趋势增强。结合Western blot检测结果,推测HmCystatin C结合在菌体表面,很可能涉及与细胞壁主要成分LPS和PGN的相互作用,是进一步突破细胞壁屏障发挥抑菌作用的前提。BLANCA等[15]通过透射电镜也观察到,G+粪肠球菌和变形链球菌经重组人cystatin C在37 ℃处理24 h后,肽聚糖层被破坏,cystatin C穿透细胞壁。

图5 HmCystatin C与LPS和PGN的结合Fig.5 Binding of HmCystatin C to LPS and PGN
2.5 HmCystatin C对典型受试菌细胞完整性的影响
2.5.1 HmCystatin C对典型受试菌细胞壁通透性的影响
2.5.1.1 HmCystatin C对G-铜绿假单胞菌细胞外膜的影响
G-细胞壁由细胞外膜和细胞间质层组成。当G-细胞外膜被破坏,NPN可进入胞内疏水介质中,发出强烈的荧光。在各浓度的HmCystatin C作用下,铜绿假单胞菌的荧光强度值相比对照组极显著增加(P<0.01),尤其在1× MIC的HmCystatin C浓度范围内,菌液的荧光强度迅速升高,此后趋缓(图6)。上述结果说明HmCystatin C破坏了G-铜绿假单胞菌细胞壁,破坏程度与HmCystatin C浓度呈正相关。而通常G-细胞壁的渗透性与其外膜层的LPS密切关系[24]。这与上述HmCystatin C对LPS具有较强亲和性的结果一致。推测HmCystatin C通过与细胞壁表面的LPS吸附结合,可能破坏并穿透铜绿假单胞菌细胞壁外膜层,继而发挥抑菌作用。
2.5.1.2 HmCystatin C对G+腐生葡萄球菌细胞壁的影响
AKP存在于细胞壁与细胞膜之间,当细胞壁被破坏后,AKP泄露。HmCystatin C对细菌细胞壁的影响程度,可通过AKP含量变化来衡量。由图7可知,腐生葡萄球菌对照组中,在5 h内AKP的含量没有明显变化,而在HmCystatin C的两个处理组中,AKP有不同程度外泄。随着HmCystatin C浓度的增加和作用时间的延长,泄露的AKP含量升高。说明HmCystatin C对G+腐生葡萄球菌细胞壁具有破坏作用。BLANCA等[15]从形态学上观察到,重组人cystatin C也能够使G+粪肠球菌和变形链球菌细胞壁断裂。

图6 HmCystatin C对铜绿假单胞菌细胞壁通透性的影响Fig.6 The effect of HmCystatin C on cell wall permeability of P.aeruginosa
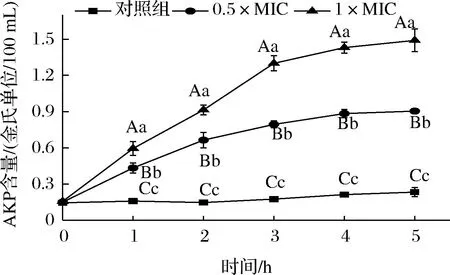
图7 HmCystatin C对腐生葡萄球菌细胞壁通透性的影响Fig.7 The effect of HmCystatin C on cell wall permeability of S.saprophyticus
2.5.2 HmCystatin C对典型受试菌细胞质膜通透性的影响
2.5.2.1 HmCystatin C对典型受试菌细胞内膜的影响
当受试菌细胞内膜被破坏,胞内的β-半乳糖苷酶渗出,因此其含量变化反映受试菌细胞内膜通透性的变化[25]。在HmCystatin C作用下,铜绿假单胞菌(图8-a)和腐生葡萄球菌(图8-b)OD420值均比对照组大(P<0.01),且随着HmCystatin C浓度增加而增大。上述结果说明,经HmCystatin C处理后,G-铜绿假单胞菌和G+腐生葡萄球菌细胞内膜被破坏,影响菌体正常生长。BLANCA等[15]从形态学上也观察到,重组人cystatin C能够使G+粪肠球菌和变形链球菌细胞质膜断裂,细胞质内容物渗出。
2.5.2.2 HmCystatin C对典型受试菌电导率的影响
当抗菌物质作用于细菌,细胞膜被破坏,胞内电解质泄露,培养液的电导率上升,因此菌液电导率的变化反映了细菌细胞质膜通透性的变化[26]。
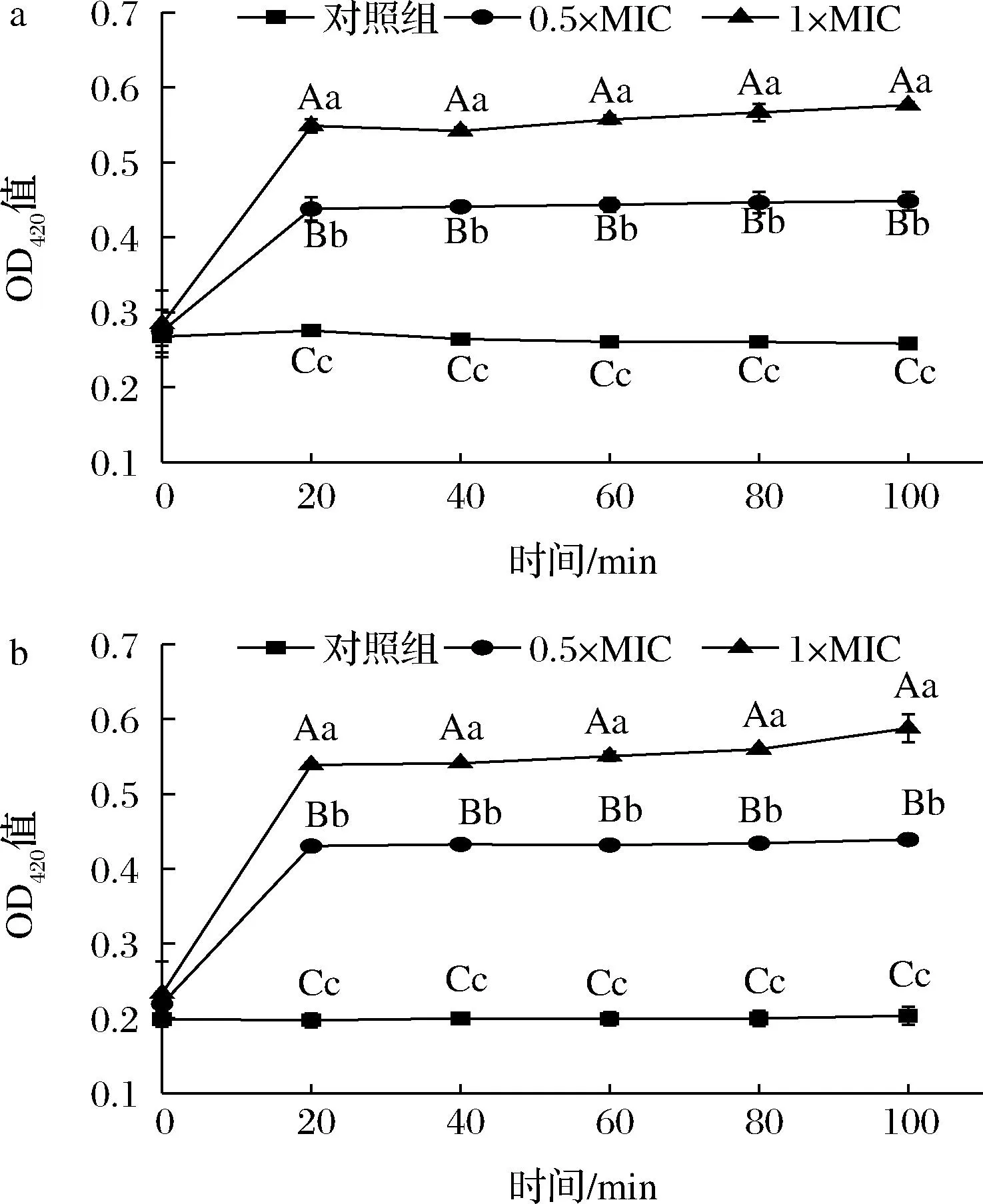
a-铜绿假单胞菌;b-腐生葡萄球菌图8 HmCystatin C对铜绿假单胞菌和腐生葡萄球菌 内膜通透性的影响Fig.8 The effect of HmCystatin C on the inner membrane permeability of P.aeruginosa and S.saprophyticus
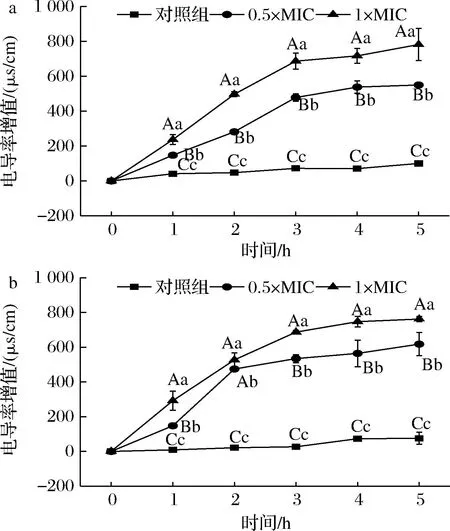
a-铜绿假单胞菌;b-腐生葡萄球菌图9 HmCystatin C对铜绿假单胞菌和腐生葡萄球菌 菌液电导率的影响Fig.9 The effect of HmCystatin C on conductivity of P.aeruginosa and S.saprophyticus suspension
经HmCystatin C处理后,两种受试菌的电导率增值均极显著高于对照组(P<0.01),且与HmCystatin C浓度呈正相关(图9)。这与对受试菌细胞壁通透性影响结果一致,也与抑菌圈表现出HmCystatin C剂量依赖关系相符。该结果可进一步验证HmCystatin C能够破坏铜绿假单胞菌和腐生葡萄球菌细胞质膜的完整性,使细胞膜通透性增强。
3 结论
本文研究了HmCystatin C对水产品腐败菌的抑菌活性和抑菌机制。除枯草芽孢杆菌外,HmCystatin C对其余5株受试菌均有抑菌效果,且腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌对HmCystatin C更敏感。1× MIC的HmCystatin C即能抑制铜绿假单胞菌和腐生葡萄球菌对数生长期快速分裂增殖,抑菌效果显著。Western blot结果表明,HmCystatin C能与G-和G+典型受试菌菌体结合,且与G-典型受试菌铜绿假单胞菌体结合能力更强。ELISA分析进一步发现,HmCystatin C能与G-和 G+细胞壁成分即LPS和PGN发生结合,且与LPS的结合能力更强。因此HmCystatin C结合到细菌表面,可能是其发挥抑菌作用的必要前提。此外,HmCystatin C作用后,G-和G+典型受试菌细胞壁和细胞膜通透性明显增加,细胞内电解质、AKP和β-半乳糖苷酶出现不同程度的泄漏。综上结果,我们推测HmCystatin C可能首先吸附到菌体表面并与细胞壁成分结合,进而破坏了细胞完整性,导致细胞壁和细胞膜通透性增加,细胞内容物外泄,最终造成菌体死亡,但HmCystatin C对G-和G+的作用方式和机制可能有所差异,相关抑菌机理待进一步研究。HmCystatin C对水产品中常见的G-和G+优势腐败菌均表现良好的抑制作用,具有作为高效生物防腐剂的潜在优势,本文研究结果对今后鱼源cystatin C应用于水产品防腐保鲜具有指导意义。
