参桃软肝方抑制人肝癌细胞HepG2活性的作用机制研究*
2023-12-28黄海福付艳丽符必谦赖思思
黄海福,付艳丽,符必谦,赖思思
(1. 广州中医药大学深圳医院 深圳 518000;2. 深圳市中医肿瘤医学中心 深圳 518000)
肝细胞癌(Hepatocellular carcinoma,HCC)是全球范围内第六大常见癌症,也是导致癌症相关死亡的第三大原因[1]。HCC 因发病率高、恶性程度高、强侵袭与转移、预后差而广受关注[2]。2018 年全球肝癌发病人数达到84.1 万人,死亡人数高达78.2 万人,其中HCC占肝癌病例的75%-85%[3]。近年来,HCC 的发病率在世界范围内持续上升,在治疗方面,主要为局部和系统治疗,包括经动脉放射栓塞、化疗栓塞或消融治疗及靶向免疫治疗等[4-5]。中医药在治疗HCC 方面具有较好的疗效[6],国医大师、著名中医肿瘤学家周岱翰教授根据多年的临床经验,创立了具有健脾养肝、软坚消癥之效的经典抗肝癌方药——“参桃软肝方”,重视整体治疗观念,组方药性平和、攻补适中、补正不留瘀、活血不伤正,集“扶正、化瘀、软坚、生新”和保护、干预、调节于一体。在临床中发现其具有改善肝功能、抑制肝癌、延长肝癌患者的生存期等功效[7],但其具体作用机制尚未完全明确。故本研究主要探讨了参桃软肝方抑制人肝癌细胞HepG2活性的作用及机制。
1 实验材料
1.1 细胞
人肝癌细胞HepG2株购于中科院细胞库。
1.2 药物与试剂
参桃软肝片由西洋参10 g、桃仁15 g、当归6 g、大黄10 g、丹参20 g、仙鹤草20 g、牛黄1 g 组成,饮片由上海中医药大学附属龙华医院提供。胎牛血清(Fetal bovine serum,FBS)、DMEM(含各种氨基酸和葡萄糖的培养基)高糖基础培养基、青链霉素溶液(Penicillin-streptomycin solution,PS)、胰酶细胞消化液(含酚红)购于HyClone 公司;四甲基噻唑蓝(Methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、乳酸脱氢酶细胞毒性检测试剂盒(LDH Assay Kit)购自Sigma 公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒、蛋白上样缓冲液、RIPA裂解液、磷酸酶抑制剂片剂(PhosStop)、苯甲基磺酰氟(Phenylmethanesulfonylfluoride or phenylmethylsulfonyl luorid,PMSF)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配制试剂盒、极超敏增强型化学发光试剂(Enhanced chemiluminescence,ECL)化学发光试剂盒、SDS-PAGE 电泳液、Western blot 转膜液、蛋白分子量标准(Marker)购自碧云天公司;RNA 提取试剂盒、互补脱氧核糖核酸(complementary DN,cDNA)反转录试剂盒、反应混合物(Master Mix)等Real-time PCR试剂购自Roche公司。
1.3 仪器
CO2 恒温细胞培养箱ESCO(CCL-170B-8)、A2 型二级生物安全柜ESCO Airstream(AC2-8S1)、酶标仪TECAN(M200 PRO)、旋转蒸发仪上海贤德实验仪器有限公司(XD-2000A)、冷冻离心机Hettich(MIKRO 200R)、电泳仪BIO-RAD(PowerPac Basic)、电转仪BIORAD(170-3940)、化学发光成像仪GE Healthcare(AM600),实时荧光定量PCR仪Roche(LC96),梯度PCR仪Gene Atlas(G02),去离子水仪Milli-Q(Direct 8)。
1.4 参桃软肝方的提取
取西洋参10 g、桃仁15 g、当归6 g、大黄10 g、丹参20 g、仙鹤草20 g 加入10 倍(810 mL)Mili-Q 水大火烧开后转小火煎煮30 min,倒出药液。加入8倍(720 mL)Mili-Q水大火烧开后转小火煎煮30 min,合并煎液,加入人工牛黄1 g 溶解,用滤纸过滤得滤液。将滤液用1000 r/min-1离心15 min 后,取上清。将上清用旋转蒸发仪浓缩后,氮吹吹干,最终得到药物重量为24.665 g,得率为34.739%,保存于-20℃冰箱。称取100 mg参桃软肝方水提物,加入1 mL DMSO溶解,制成100 mg·mL-1母液备用,在文章均称为参桃软肝方。
1.5 乙醇沉淀法分离参桃软肝方醇提上清和沉淀
将参桃软肝方水提物加入乙醇至75%,放入4℃冰箱混匀提取过夜。将参桃软肝方提取液1000 r/min-1离心15 min 后,取上层为参桃软肝方醇提上清,下层为参桃软肝方醇提沉淀,分别将参桃软肝方上清和沉淀氮吹干,用DMSO溶解上清和沉淀,在文章均称为参桃软肝方醇提上清和沉淀。
2 实验方法
2.1 MTT法检测人肝癌细胞HepG2的活性
将人肝癌细胞HepG2 在含10% 胎牛血清的DMEM 培养液中培养,待细胞长至对数生长期时,将细胞按照1×104个/皿接种于96孔板中,于37℃、5% CO2培养箱培养24 h。分别按照空白对照组、参桃软肝方不同浓度组(100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1)或按照空白对照组、参桃软肝方(1000 μg·mL-1)组、参桃软肝方(1000 μg·mL-1)+不同浓度抑制剂组、不同浓度抑制剂组进行加药,于37℃、5% CO2培养箱培养24 h。弃去上清,每孔加入新鲜配制的MTT溶液(5 mg·mL-1)20 μL,于37℃、5% CO2培养箱继续培养4 h,弃去上清,每孔加入100 μL DMSO,在摇床上轻轻摇晃5 min,用酶标仪测定490 nm处的各实验组的吸光度(OD490),计算各组细胞的存活率。
2.2 LDH 活性检测试剂盒检测人肝癌细胞HepG2 的LDH释放
将对数生长期的人肝癌细胞HepG2,按照1×104个/孔接种于96 孔板中,于37℃、5% CO2培养箱培养24 h。分别按照空白对照组、参桃软肝方不同浓度组(100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1)干预24 h,取细胞上清进行LDH释放检测。
2.3 Real-time PCR 检测人肝癌细胞HepG2 中IL-1β基因的mRNA表达
将对数生长期的人肝癌细胞HepG2,按照1×105个/皿接种于直径6 cm 的培养皿中,按照空白对照组、参桃软肝方不同浓度组(100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1)干预24 h。用TRIzol 提取总RNA,测RNA 的浓度。使用cDNA 反转录试剂盒将RNA 反转录成cDNA。在Light Cycle 96 real-time PCR 平台,采用SYBGREEN PCR Master Mix 试剂盒,检测IL-1β 和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因mRNA 表达,引物序列为:IL-1β(前引物5’-CACGATGCACCTGTACGATCA-3’,后引物5’-GTTGCTCCATATCCTGTCCCT-3’)、GAPDH(前引物5’-CACCATCTTCCAGGAGCGAG-3’,后引物5’-GACTCCACGACGTACTCAGC-3’)。将IL-1β 基因的mRNA 表达水平归一化至内参基因GAPDH。用双ΔCt法计算IL-1β基因的相对表达。
2.4 Western blot 检测人肝癌细胞HepG2 中Cleavaged Caspase-1、Akt、ERK、P-ERK、Caspase-3、PARP、Bcl2、Bax蛋白表达
将处于对数生长期的人肝癌细胞HepG2 按照1×105个/皿接种于6cm 培养皿中,培养24 h 后,按照空白对照组、参桃软肝方不同浓度组(100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1)分别干预24 h。提取细胞总蛋白,用BCA 试剂盒进行蛋白浓度测定。加入上样缓冲液(Loading buffer)后于95℃蛋白变性5 min。以20 μg 的蛋白量分别进行电泳,电泳完毕后进行,按照0.25 A,1 h将蛋白转移到聚偏二氟乙烯(Polyvinylidene difluoride,PVDF)膜上。转膜完毕后,将转好的膜放入5%脱脂奶粉封闭液中封闭4 h,取出用PBST 清洗3 次,每次5 min。用特异性的一抗Cleavaged Caspase-1 或Akt 或ERK 或P-ERK 或Caspase-3 或PARP 或Bcl2 或Bax 或GAPDH,1:1000 稀释后,于4℃孵育过夜。第2 天将PVDF 膜取出PBST 清洗3 次,每次5 min,放入对应的二抗,常温孵育2 h 后磷酸缓冲液+聚山磷脂-20(Phosphate buffered saline+tween-20,PBST)清洗3 次,每次5 min,最后将PVDF 膜放入显影液中(A 液∶B 液=1∶1),放入化学发光成像系统中进行显影以及拍照。使用Image J软件进行灰度值分析,以GAPDH为内参,计算蛋白的表达量。
2.5 统计方法
所有实验均重复3 次以上,使用GraphPad Prism 5软件进行作图分析,实验数据采用均值±标准差(±s)表示,组间数据比较采用单因素方差分析(One-way ANOVA)或t检验进行组间比较,当P<0.05 时为差异具有统计学意义。
3 实验结果
3.1 参桃软肝方对人肝癌细胞HepG2活性的影响
如图1所示,在人肝癌细胞HepG2上,与空白对照组相比,100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1参桃软肝方干预组,细胞活性分别降为92.61%±5.06%、60.06%±8.03%、36.31%±4.04%,其中300 μg·mL-1、1000 μg·mL-1参桃软肝方干预组与对照组相比,差异具有统计学意义(P<0.001)。以上结果表明,随着参桃软肝方浓度的增加,人肝癌细胞HepG2 活性的抑制率显著升高,并具有浓度依赖性。说明参桃软肝方能有效抑制人肝癌细胞HepG2的活性。
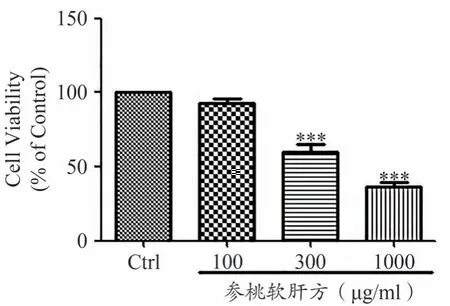
图1 参桃软肝方抑制人肝癌细胞HepG2活性
3.2 参桃软肝方对人肝癌细胞HepG2 乳酸脱氢酶(LDH)释放的影响
细胞LDH 的释放,是衡量细胞毒性的重要指标。如图2所示,在人肝癌细胞HepG2上,与空白对照组相比,100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1参桃软肝方干预组,细胞LDH 的释放含量分别为空白对照组的1.08±0.02、1.12±0.02、1.85±0.42 倍,其中1000 μg·mL-1参桃软肝方干预组与空白对照组相比,差异具有统计学意义(P<0.01)。以上结果表明,高浓度参桃软肝方能促进人肝癌细胞HepG2中LDH 的释放,对人肝癌细胞具有一定的毒性作用。
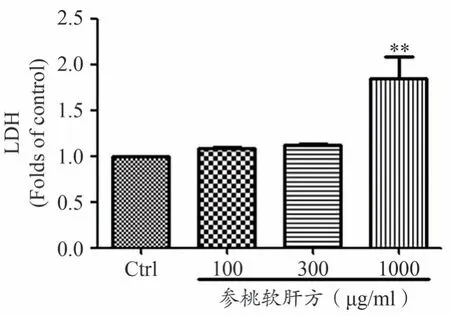
图2 参桃软肝方促进人肝癌细胞HepG2中LDH释放
3.3 参桃软肝方对人肝癌细胞HepG2 焦亡标志物IL-1β和Cleavaged Caspase-1表达的影响
如图3所示,在人肝癌细胞HepG2上,与空白对照组相比,1000 μg·mL-1参桃软肝方干预组下调IL-1β基因的mRNA 表达,差异具有统计学意义(P<0.05)。与空白对照组相比,1000 μg·mL-1参桃软肝方干预组降低Cleavaged Caspase-1 的蛋白表达,差异具有统计学意义(P<0.01)。以上结果表明,高浓度参桃软肝方能抑制人肝癌细胞HepG2 焦亡标志物IL-1β 和Cleavaged Caspase-1 的表达。说明参桃软肝方降低肝癌细胞活性,很可能通过阻断细胞焦亡过程起作用的。
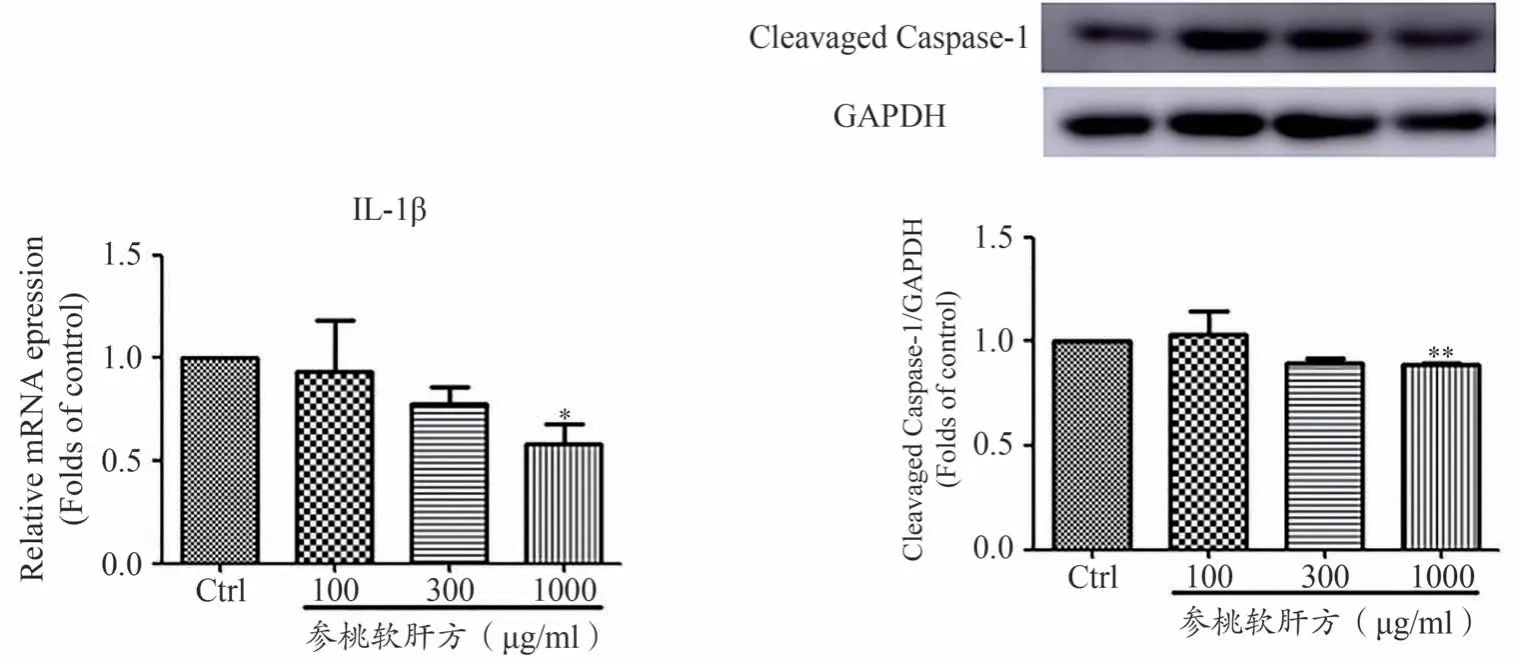
图3 参桃软肝方抑制人肝癌细胞HepG2焦亡标志物IL-1β和Clevaged Caspase-1的表达
3.4 参桃软肝方对人肝癌细胞HepG2 中Akt/ERK 信号通路的影响
如图4所示,在人肝癌细胞HepG2上,与空白对照组相比,1000 μg·mL-1参桃软肝方干预组,降低Akt 蛋白的表达,差异具有统计学意义(P<0.05),而ERK 及其磷酸化表达未见明显变化。以上结果表明,参桃软肝方能抑制人肝癌细胞HepG2 中Akt 信号传导,而不影响ERK及其磷酸化。说明抑制Akt蛋白表达及其信号传导是参桃软肝方抑制肝癌细胞活性的重要分子机制。
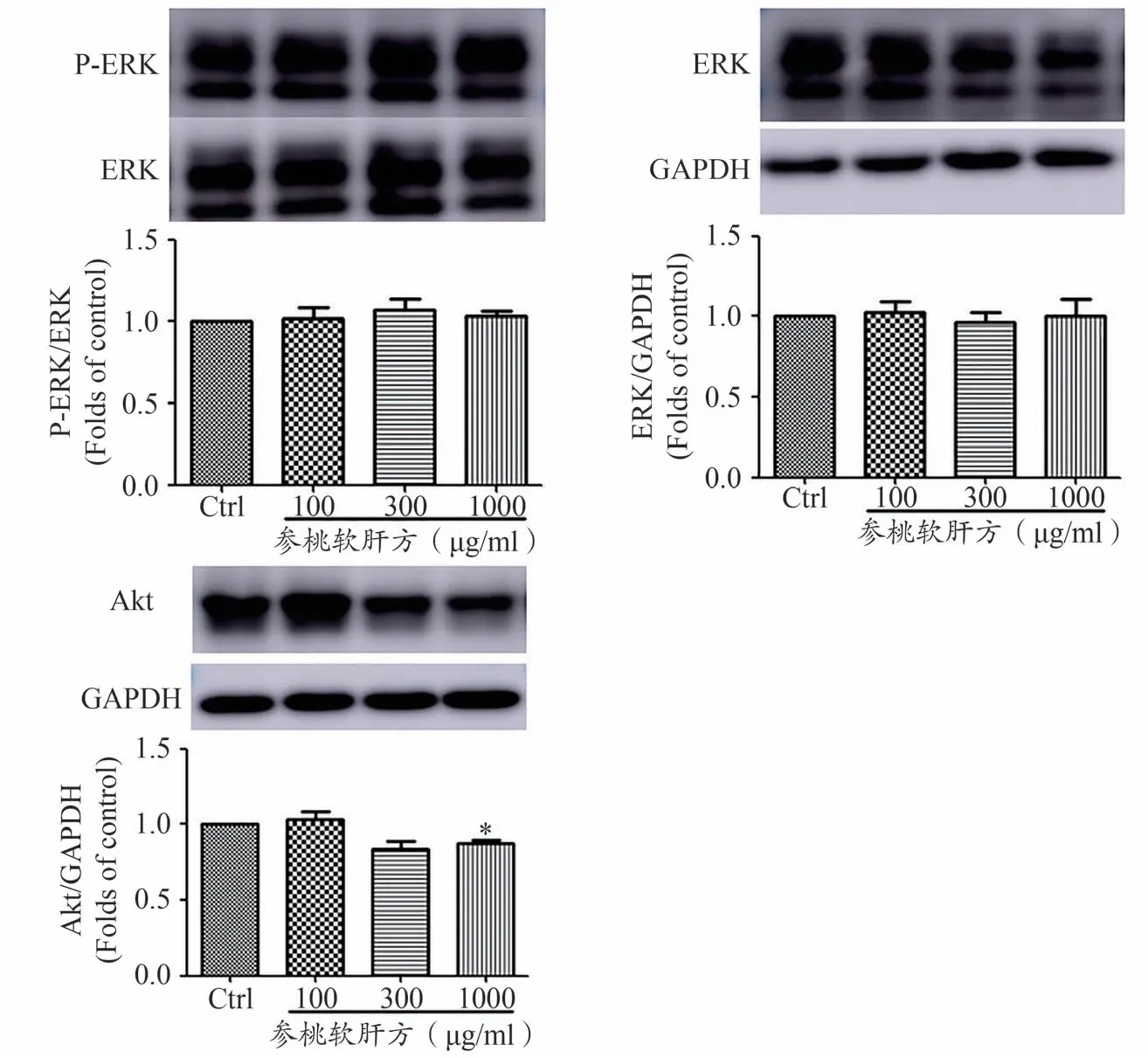
图4 参桃软肝方对人肝癌细胞HepG2中ERK和Akt蛋白表达的影响
3.5 参桃软肝方对人肝癌细胞HepG2 凋亡信号通路的影响
如图5所示,在人肝癌细胞HepG2上,与空白对照组相比,1000 μg·mL-1参桃软肝方干预组上调Caspase3蛋白的表达,差异具有统计学意义(P<0.05),而PARP、Bcl2、Bax 蛋白表达量未见明显改变。以上结果表明,参桃软肝方很可能激活人肝癌细胞HepG2中Caspase3 依赖的凋亡相关信号通路,促进Caspase 3蛋白表达是参桃软肝方抑制肝癌细胞活性的重要分子机制。
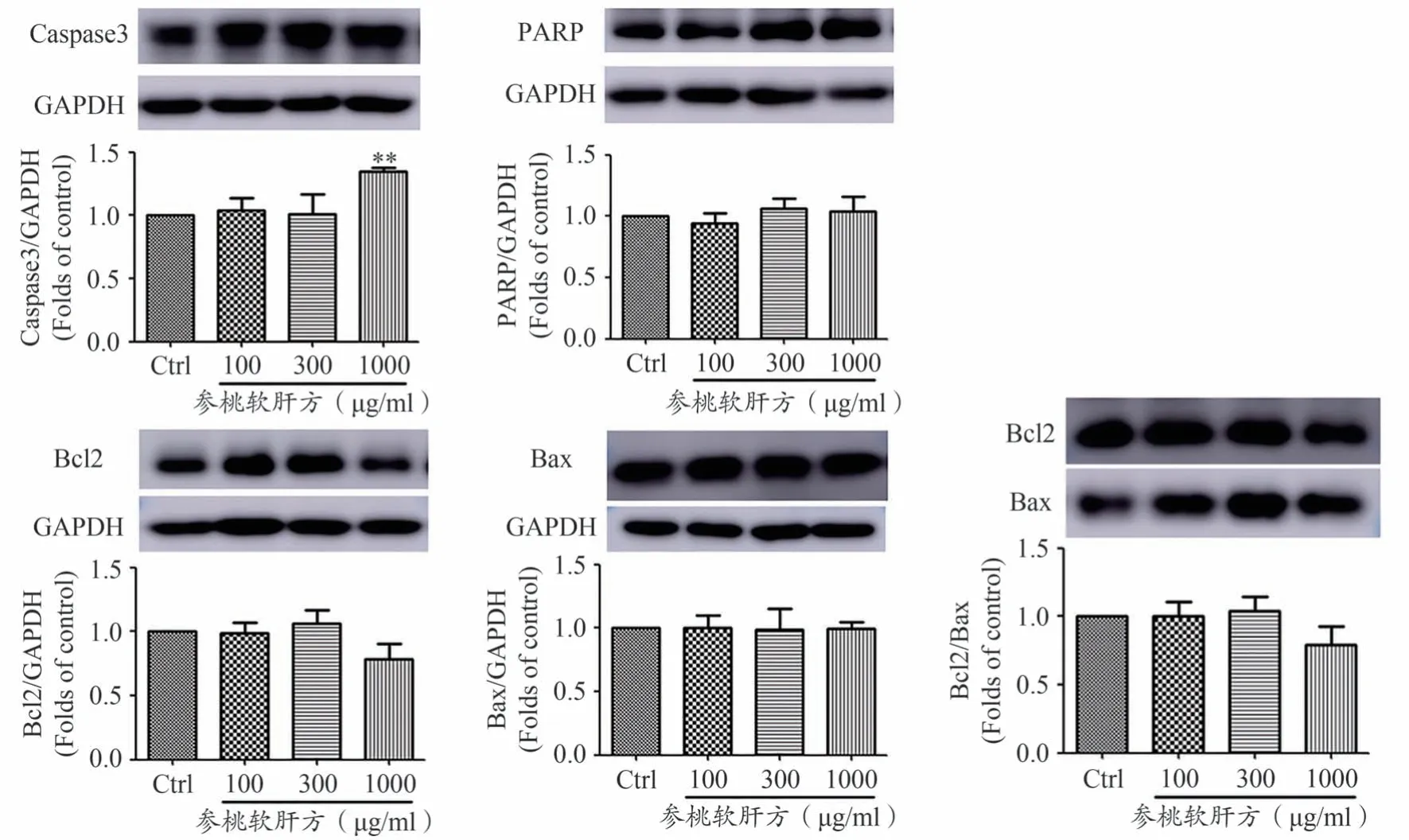
图5 参桃软肝方对人肝癌细胞HepG2中Caspase3、PARP、Bcl2、Bax蛋白表达的影响
3.6 凋亡、自噬、铁死亡、细胞坏死抑制剂及PI3K/Akt/MAPK 信号通路抑制剂对参桃软肝方抑制人肝癌细胞HepG2活性的影响
如图6所示,在人肝癌细胞HepG2上,与空白对照组相比,1000 μg·mL-1参桃软肝方能有效抑制细胞活性,差异具有统计学意义(P<0.001)。但加入不同浓度的凋亡抑制剂Z-VAD(5、10、20、40 μmol·L-1),自噬抑制剂Wortmanin(0.25、0.5、1、2 μmol·L-1),铁死亡抑制剂Ferrostatin-1(2.5、5、10、20 μmol·L-1),细胞坏死抑制剂Necrostatin-1(10、20、40、80 μmol·L-1),PI3K 抑制剂LY294002(0.25、0.5、1、2 μmol·L-1),Akt抑制剂Akti(0.1、0.3、1、3 μmol·L-1),MEK 抑制剂MEKi(0.1、0.3、1、3 μmol·L-1),JNK 抑制剂JNKi(0.1、0.3、1、3 μmol·L-1)后,对参桃软肝方抑制人肝癌细胞HepG2 活性没有显著的影响。以上结果表明,参桃软肝方抑制人肝癌细胞HepG2 细胞活性,很可能与细胞凋亡、自噬、铁死亡、细胞坏死及PI3K/Akt/MAPK信号传导无关。
3.7 参桃软肝方醇提上清和沉淀对人肝癌细胞HepG2活性的影响
为了进一步研究参桃软肝方抑制肝癌细胞活性的有效成分,通过乙醇沉淀的方法,分离了参桃软肝方醇提上清和沉淀。如图7 所示,在人肝癌细胞HepG2上,与空白对照组相比,100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1l、3000 μg·mL-1参桃软肝方醇提上清干预组,对细胞活性的成活率分别为96.75%±15.51%、82.10%±21.25%、80.97%±5.05%、46.42%±6.55%,其中3000 μg·mL-1参桃软肝方醇提上清干预组与空白对照组相比,差异具有统计学意义(P<0.01)。100 μg·mL-1、300 μg·mL-1、1000 μg·mL-1、3000 μg·mL-1参桃软肝方醇提沉淀干预组,细胞活性分别降为100.12%±9.89%、90.34%±4.42%、87.71%±15.82%、45.20%±4.91%,其中3000 μg·mL-1参桃软肝方醇提沉淀干预组与空白对照组相比,差异具有统计学意义(P<0.01)。以上结果表明,3000 μg·mL-1参桃软肝方醇提上清和沉淀对人肝癌细胞HepG2活性的抑制率达到50%左右,参桃软肝方在1000 μg·mL-1时细胞活性就降到50%左右,说明参桃软肝方抑制肝癌细胞的活性优于参桃软肝方醇提上清和沉淀。
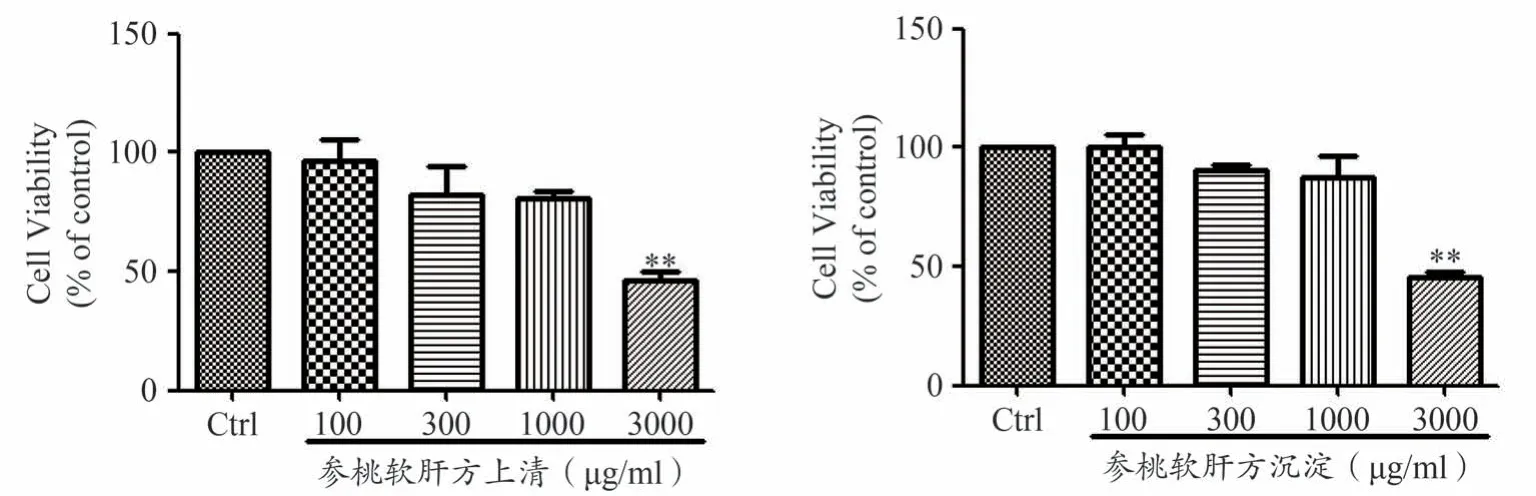
图7 参桃软肝方醇提上清和沉淀抑制人肝癌细胞HepG2活性
3.8 凋亡、自噬、铁死亡、细胞坏死抑制剂及PI3K/Akt/MAPK 信号通路抑制剂对参桃软肝方醇提上清和沉淀抑制人肝癌细胞HepG2活性的影响
如图8所示,在人肝癌细胞HepG2上,与空白对照组相比,3000 μg·mL-1参桃软肝方醇提上清能有效抑制细胞活性,差异具有统计学意义(P<0.05)。但加入不同浓度的凋亡抑制剂Z-VAD(5、10、20、40 μmol·L-1),自噬抑制剂Wortmanin(0.25、0.5、1、2 μmol·L-1),铁死亡抑制剂Ferrostatin-1(2.5、5、10、20 μmol·L-1),细胞坏死抑制剂Necrostatin-1(10、20、40、80 μmol·L-1),PI3K 抑制剂LY294002(0.25、0.5、1、2 μmol·L-1),Akt抑制剂Akti(0.1、0.3、1、3 μmol·L-1),MEK 抑制剂MEKi(0.1、0.3、1、3 μmol·L-1),JNK 抑制剂JNKi(0.1、0.3、1、3 μmol·L-1)后,对参桃软肝方醇提上清抑制人肝癌细胞HepG2活性没有显著的影响。
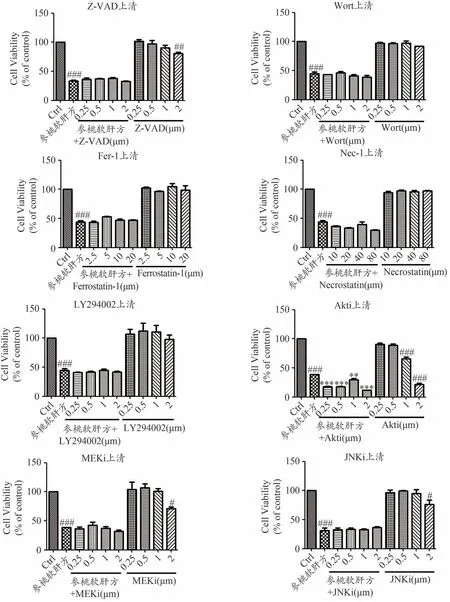
图8 凋亡、自噬、铁死亡、细胞坏死抑制剂及PI3K/Akt/MAPK信号通路抑制剂对参桃软肝方醇提上清抑制人肝癌细胞HepG2活性的影响
如图9所示,在人肝癌细胞HepG2上,与空白对照组相比,3000 μg·mL-1参桃软肝方醇提沉淀能有效抑制细胞活性,差异具有统计学意义(P<0.001)。但加入不同浓度的凋亡抑制剂Z-VAD(5、10、20、40 μmol·L-1),自噬抑制剂Wortmanin(0.25、0.5、1、2 μmol·L-1),铁死亡抑制剂Ferrostatin-1(2.5、5、10、20 μmol·L-1),细胞坏死抑制剂Necrostatin-1(10、20、40、80 μmol·L-1),PI3K 抑制剂LY294002(0.25、0.5、1、2 μmol·L-1),Akt抑制剂Akti(0.1、0.3、1、3 μmol·L-1),MEK 抑制剂MEKi(0.1、0.3、1、3 μmol·L-1),JNK 抑制剂JNKi(0.1、0.3、1、3 μmol·L-1)后,对参桃软肝方醇提沉淀抑制人肝癌细胞HepG2活性没有显著的影响。
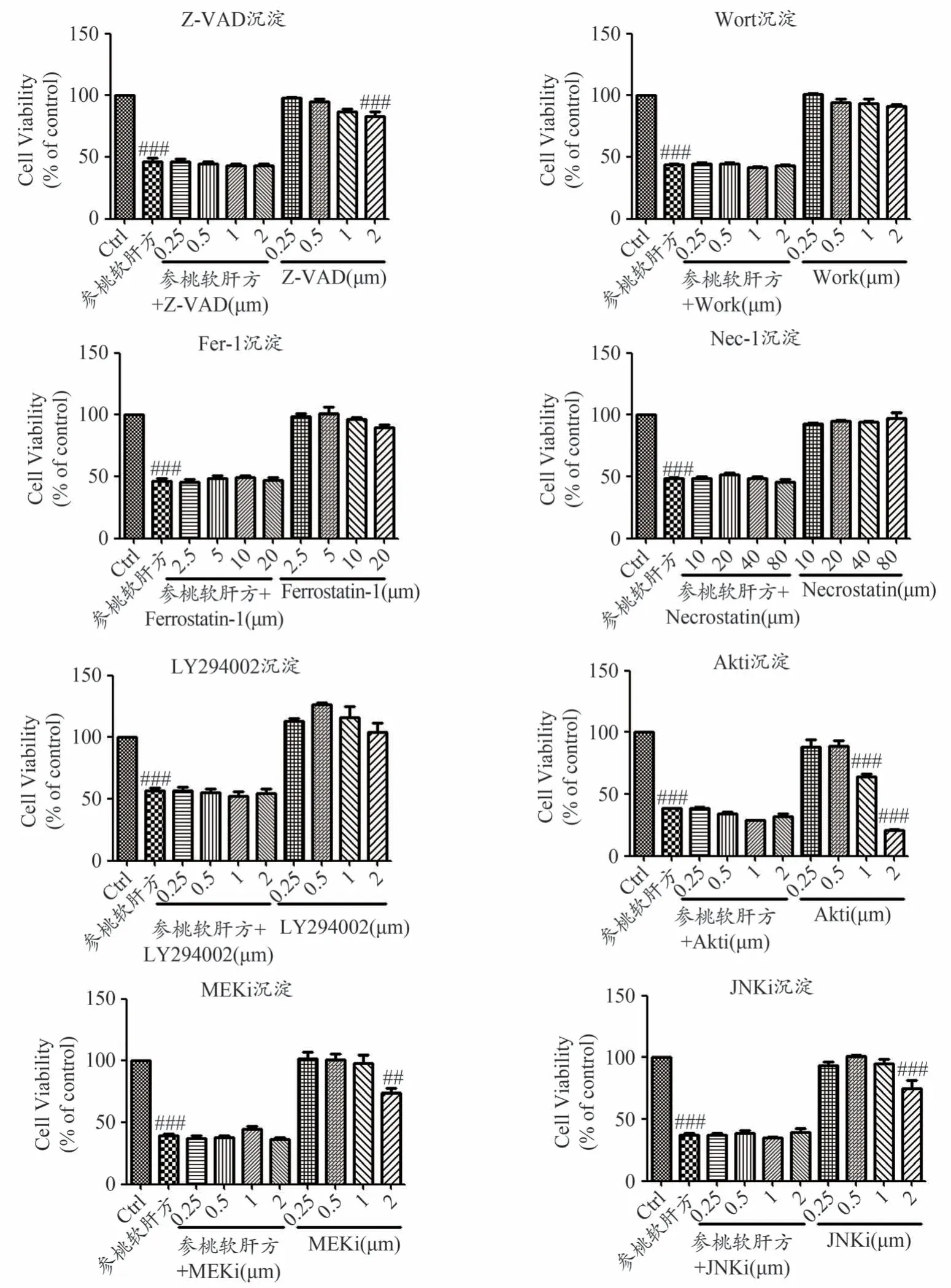
图9 凋亡、自噬、铁死亡、细胞坏死抑制剂及PI3K/Akt/MAPK信号通路抑制剂对参桃软肝方醇提沉淀抑制人肝癌细胞HepG2活性的影响
以上结果表明,参桃软肝方醇提上清和沉淀抑制人肝癌细胞HepG2 细胞活性,很可能与细胞凋亡、自噬、铁死亡、细胞坏死及PI3K/Akt/MAPK 信号传导无关。
4 讨论
HCC 是当今世界最常见的恶性肿瘤之一,也是癌症相关死亡的主要原因[8]。肝癌起病隐匿,潜伏期长、恶性程度高、生存期短、生存质量差、且治疗棘手素有“癌中之王”之称[9]。HCC 的发生与乙型肝炎病毒感染、丙型肝炎病毒感染、酒精或进食含黄曲霉素的食物等暴露接触高度相关[10-11]。另外,肥胖、糖尿病、代谢综合征等代谢性疾病与非酒精性脂肪性肝病也被逐渐成为HCC的危险因素[12-13]。HCC五年内的复发率高达50%-80%,而五年生存率低于5%[14-15]。目前,对于肝癌患者主要采取外科手术、肝动脉栓塞化疗、微创治疗、分子靶向治疗等方法,虽然近年来诊断和治疗技术取得较大发展,但因其复发转移率高,肝癌患者的5年生存率仍较低[16-17]。
近年来,随着中医药的不断进展,在肿瘤治疗方面,中医药联合手术、放疗、化疗、分子靶向及免疫治疗,可以改善症状,减少治疗后复发转移,延长生存期[18-19]。现代研究显示,中药可以调节微环境中各类免疫细胞,从而改善肿瘤免疫的微环境,增强抗肿瘤作用,许多中药复方通过多途径、多靶点、多效应发挥抗肿瘤转移的功效[20-21]。因此,从中医药中发掘治疗肿瘤转移的有效方药意义重大。肝为刚脏,主升主动、主疏泄,喜条达而恶抑郁,肝藏血,体阴而用阳。国医大师、著名中医肿瘤学家周岱翰教授认为,本病发生的病因病机是因邪毒内聚,肝失疏泄,致肝气郁滞,郁而化火,郁火内灼,耗伤阴血,使肝阴耗损,肝血不藏而妄行,肝旺克脾则脾气虚损,肝损及肾则肾水亏枯[22]。在临床实践中发现“参桃软肝方”具有改善肝功能、抑制肝癌、延长肝癌患者的生存期等功效,但其具体作用机制尚不明确[23-24]。
研究发现参桃软肝方能显著抑制人肝癌细胞HepG2 的活性及LDH 的释放,增加细胞毒性,对肝癌细胞具有较好地杀伤作用。经过进一步的研究发现,参桃软肝方通过下调Akt 蛋白的表达,上调Caspase3的表达。因此,参桃软肝方抑制肝癌细胞活性的机制很可能是依赖于Akt 的下调和Caspase3 的激活。而Akt 和Caspase3 广泛参与了细胞的程序性死亡。细胞程序性死亡是一种保守的细胞自杀进化过程,对真核生物的发展和完整性至关重要,与多种疾病有关,包括发育障碍、免疫缺陷、自身免疫疾病、神经退行性变和癌症[25]。细胞程序性死亡的传统方式主要有凋亡、自噬、坏死性凋亡,新发现的有细胞焦亡和铁死亡等[26]。研究发现参桃软肝方降低人肝癌细胞HepG2中焦亡标志物IL-1β 和Clevaged Caspase-1 的表达,说明参桃软肝方降低肝癌细胞活性,很可能不是通过促进细胞焦亡,而是抑制细胞焦亡。进一步选用细胞凋亡抑制剂Z-VAD、自噬抑制剂Wortmanin、铁死亡抑制剂Ferrostatin-1、细胞坏死抑制剂Necrostatin-1 对参桃软肝方抑制肝癌细胞活性进行干预,探讨不同类型细胞程序性死亡在参桃软肝方抗肝癌中的扮演的角色。实验结果表明,Z-VAD、Wortmanin、Ferrostatin-1、Necrostatin-1对参桃软肝方抑制人肝癌细胞HepG2活性无影响,说明参桃软肝方抑制肝癌细胞活性很可能与细胞凋亡、自噬、铁死亡、细胞坏死无关。
丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)信号通路通过多种细胞机制调控多种生物过程,与细胞增殖、分化、迁移、衰老和凋亡有着密切的联系,共同调控细胞程序性死亡[27]。在肿瘤疾病中,通过调控MAPK 信号通路抑制肿瘤细胞的生存能力和迁移能力,促进肿瘤细胞的凋亡[28]。磷脂酰肌醇3-激酶(PI3K)是一个脂质激酶酶的大家族,当PI3K 被激活后,进一步催化磷酸化磷脂酰肌醇(PIP2)和磷脂酰肌醇3(PIP3),可启动下游信号通路如Akt的激活,参与细胞生长、增殖、自噬和凋亡[29-30]。PI3K/Akt是最常见的致癌信号通路之一,MAPK 信号通路也在肿瘤细胞的生长和分化中发挥重要作用[31]。而参桃软肝方抑制了PI3K/Akt/MAPK 信号通路中核心信号分子Akt 的表达,说明阻断PI3K/Akt/MAPK 信号传导很可能是参桃软肝片抑制肝癌细胞活性的重要机制分子之一。因此,进一步选用PI3K/Akt 及MAPK 相关信号通路的抑制剂,检测其对参桃软肝方抑制肝癌细胞活性的影响。实验结果表明,LY294002、Akti、MEKi、JNKi 等PI3K/Akt/MAPK 相关抑制剂对参桃软肝方抑制人肝癌细胞HepG2 活性的没有明显影响,参桃软肝方抑制肝癌细胞活性很可能与PI3K/Akt/MAPK 信号传导不是直接相关可能是通过AKT 相关的其他调控的上下游起作用的。
目前,中医药抗肿瘤研究多集中在中药单药、单药提取物、单体成分等方面,而中药复方对于抗肿瘤的研究较少。中药复方具有复杂的活性成分及作用靶点,在抗肿瘤治疗中对增加现有治疗的疗效、减轻毒副作用、调节免疫力等方面有独特的优势。参桃软肝方主要由西洋参、桃仁、当归、大黄,丹参、仙鹤草、人工牛黄组成,通过传统水提得到参桃软肝方,为了进一步发现其有效组分,通过乙醇沉淀法,将总体物分离成两部分,即醇提上清和沉淀,发现参桃软肝方醇提上清和沉淀能抑制肝细胞活性。凋亡、自噬、铁死亡、细胞坏死抑制剂及PI3K/Akt/MAPK信号通路的抑制剂同样对醇提上清和沉淀抑制人肝癌细胞活性无明显影响。说明参桃软肝方传统水提总提物抑制肝癌细胞活性的作用优于醇提上清和沉淀。提示,参桃软肝方的醇提上清和沉淀对抗肝癌作用可能存在协同作用。
本研究局限性有两点:第一是没能找到参桃软肝方抑制Akt 信号的上下游相关因子,后续实验需进一步深入研究其作用机制;第二是没能发现参桃软肝方抗肝癌的主要活性成分,后续实验需要进一步优化提取工艺,明确主要活性成分,为参桃软肝方的进一步开发应用提供科学依据。
因此,得出以下结论:参桃软肝方具有抑制肝癌细胞活性抗肝癌的作用,其作用机制可能与自噬、坏死性凋亡等程序性死亡方式无关;参桃软肝方抑制Akt 蛋白表达和促进Caspase3 蛋白表达,但进一步研究发现不是通过经典PI3K/Akt/MAPK 信号传导通路抑制细胞活性,我们推测可能是通过Akt 的其他上下游蛋白起作用的;参桃软肝方降低焦亡标志物IL-1β和Cleavaged Caspase 1 表达,很可能阻断细胞焦亡过程。另外,本研究发现参桃软肝方比醇提上清和沉淀抗肝癌活性好,其醇提上清和沉淀很可能存在协同抗肝癌的作用。
