克罗恩病肛管直肠狭窄的外科治疗进展
2023-12-28李金融竺李贝陈泽芃乔立超贡钰霞杨柏霖
李金融,竺李贝,陈泽芃,乔立超,贡钰霞,杨柏霖,竺 平,2
1. 南京中医药大学附属医院肛肠科(南京 210029)
2. 宿迁市中医院肛肠科(江苏宿迁 223801)
克罗恩病(Crohn disease,CD)是一种可以累及全消化道的透壁性炎症性病变。CD 累及肛管直肠,局部慢性炎症和溃疡反复发作和修复,导致肛管直肠的纤维化和狭窄形成,约有17%~22%的肛周CD 患者会出现肛管直肠狭窄[1]。肛管直肠狭窄的出现往往预示着肠道尤其是结直肠病变未得到有效控制,常伴发持续的直肠炎、复杂性肛瘘和直肠阴道瘘等。这部分患者通常预后较差,约57%的患者需行造口转流或直肠切除,对患者的生活质量造成不良影响[2]。目前关于CD 肛管直肠狭窄的相关研究较少,如何为患者提供最佳的临床评估和治疗方案是目前亟待解决的问题。本文对CD 肛管直肠狭窄的外科治疗方法进行了回顾和总结,以期为临床专科医生进行临床决策提供参考。
1 临床表现和分类
CD肛管直肠狭窄可表现出不同的临床特征。轻中度狭窄通常无明显症状,仅在行内镜检查或肛门直肠指检时偶然发现,可能和轻中度狭窄患者仍能正常排出不成形的粪便有关,因此容易被延误诊断。当出现明显的排便困难甚至梗阻时已发展为重度狭窄[3]。CD 肛管直肠狭窄的临床症状包括排便困难、大便变细、肛门疼痛、黏液血便、肛门失禁、里急后重和排便不尽感,严重影响患者的生活质量[4]。肛管直肠狭窄通常与其他严重的肛周病变相伴发,如复杂性瘘管、溃疡、外痔或直肠炎等,因此体格检查时需仔细辨别和详细记录。在一项纳入70 例CD 患者的回顾性研究中,多数直肠狭窄的患者同时伴有肛瘘(61%)和肛周脓肿(50%),而在无狭窄的对照组中分别只有34%和17.1%[5]。
CD 肛管直肠狭窄的Cardiff 分类最早由Hughes 等提出[6-7]。Cardiff 分类将肛管直肠狭窄分为肛管狭窄和直肠狭窄,以及可逆性狭窄(S1)和不可逆性狭窄(S2),见表1。S1 型狭窄多与炎症反应有关,药物治疗或扩肛治疗通常有效;S2 型狭窄多与纤维性增生有关,一般需要外科手术治疗。美国胃肠病协会(American Gastroenterological Association,AGA)提出一种简化分类方法,只纳入纤维性肛管直肠狭窄,狭窄长度<2 cm 为膜状狭窄,狭窄长度≥2 cm 则为管状狭窄[8]。

表2 CD肛管直肠狭窄的外科治疗方法Table 2. Surgical treatments of CD anorectal stricture
2 临床评估
准确描述肛管直肠狭窄的参数对于制定治疗计划至关重要。为了实现这一目标,CD 肛管直肠狭窄的评估应包括局部查体、直肠磁共振成像(magnetic resonance imaging,MRI)、内镜检查和组织活检[9],以获得包括狭窄口径、狭窄高度(狭窄下缘距肛缘的高度)、狭窄长度、直肠周围纤维浸润的程度、对肛门直肠功能的影响、伴发其他病变(溃疡、瘘管、脓肿和肿瘤)以及肠道炎症特别是直肠炎的活动程度等重要参数。肛门直肠指检可以初步判断狭窄高度及狭窄口径。检查者食指可以通过的狭窄通常是轻度狭窄,但能感到异常的紧绷感,中重度狭窄则无法通过检查者的食指甚至是小指(图1-A)。更准确的狭窄口径测量需要借助不同型号的硬质扩肛器,以稍有阻力可以置入的扩肛器型号作为狭窄口径(图1-B)。通常使用硬质扩肛器或者手指在麻醉下进行评估(examination under anesthesia,EUA),优点如下:①避免检查给患者造成疼痛不适,提高检查的完成度;②可以充分准确评估患者伴有的其他肛周病变;③可以区分括约肌痉挛所导致的可逆性狭窄(S1)和由纤维化导致的不可逆性狭窄(S2)。如果狭窄在麻醉状态下松弛和张开,则是S1 型狭窄,反之则可能是S2 型狭窄[3]。
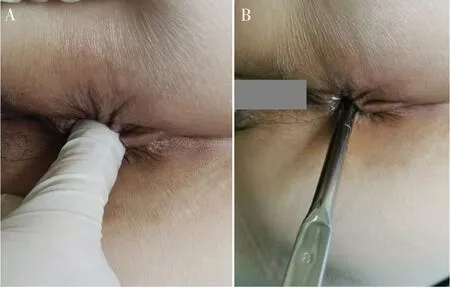
图1 CD肛管直肠狭窄高度和口径的评估Figure 1. Assessment of height and caliber of CD anorectal stricture
欧洲炎症性肠病外科治疗共识意见中推荐将MRI 作为CD 肛周瘘管性病变的重要评估手段[10]。需要注意的是,MRI 对CD 肛管直肠狭窄的诊断敏感性较低[11],因此直肠MRI 检查无法代替CD肛管直肠狭窄的临床评估,而应作为临床诊断后的主要影像学评估手段,为临床医生提供关于狭窄的长度、高度、严重程度、伴发的瘘管性病变、是否有潜在癌变,以及对治疗的反应情况等信息。一项纳入58 名CD 患者的研究显示,MRI 显示的肠壁增厚和内镜下的直肠炎有显著相关性,而且在不同放射科医生之间具有较好的可重复性[12]。肛管直肠在生理状态下通常呈闭合状态,给MRI辨识直肠腔和直肠壁带来一定困难,从而影响直肠狭窄的评估和测量。本研究团队所在中心的解决方法如下:在直肠MRI 检查前将一根16F 的导尿管置入直肠内,导尿管球囊内注入4~6 mL 的气体,并将导尿管球囊下拉至狭窄段上方。该方法可以清晰显示MRI 直肠狭窄段的全貌,并起到标志直肠腔的作用,从而完善CD 肛管直肠狭窄的信息参数(图2)。
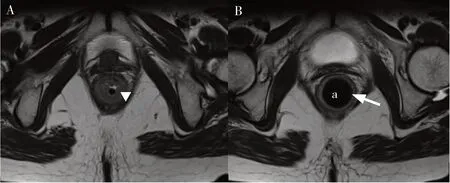
图2 置入导尿管后的直肠MRI成像(T2WI,横断面)Figure 2. MRI imaging of the rectum after catheter placement (T2WI, cross section)
3 治疗
与肛周瘘管性病变不同,CD 肛管直肠狭窄的相关研究多是回顾性研究,缺乏对照组且样本量小,因此在治疗流程方面尚无基于高等级证据的共识意见。对于无症状的轻度狭窄,除常规的CD 药物治疗外可暂不做额外处理,但需制定随访方案,密切追踪狭窄进展情况。对于伴有排便困难、肛门疼痛、大便失禁或慢性肠梗阻等症状的患者,则应尽快完善临床、影像及内镜评估,明确狭窄性质及严重程度,并制定药物和手术相结合的治疗方案。评估和治疗流程见图3。
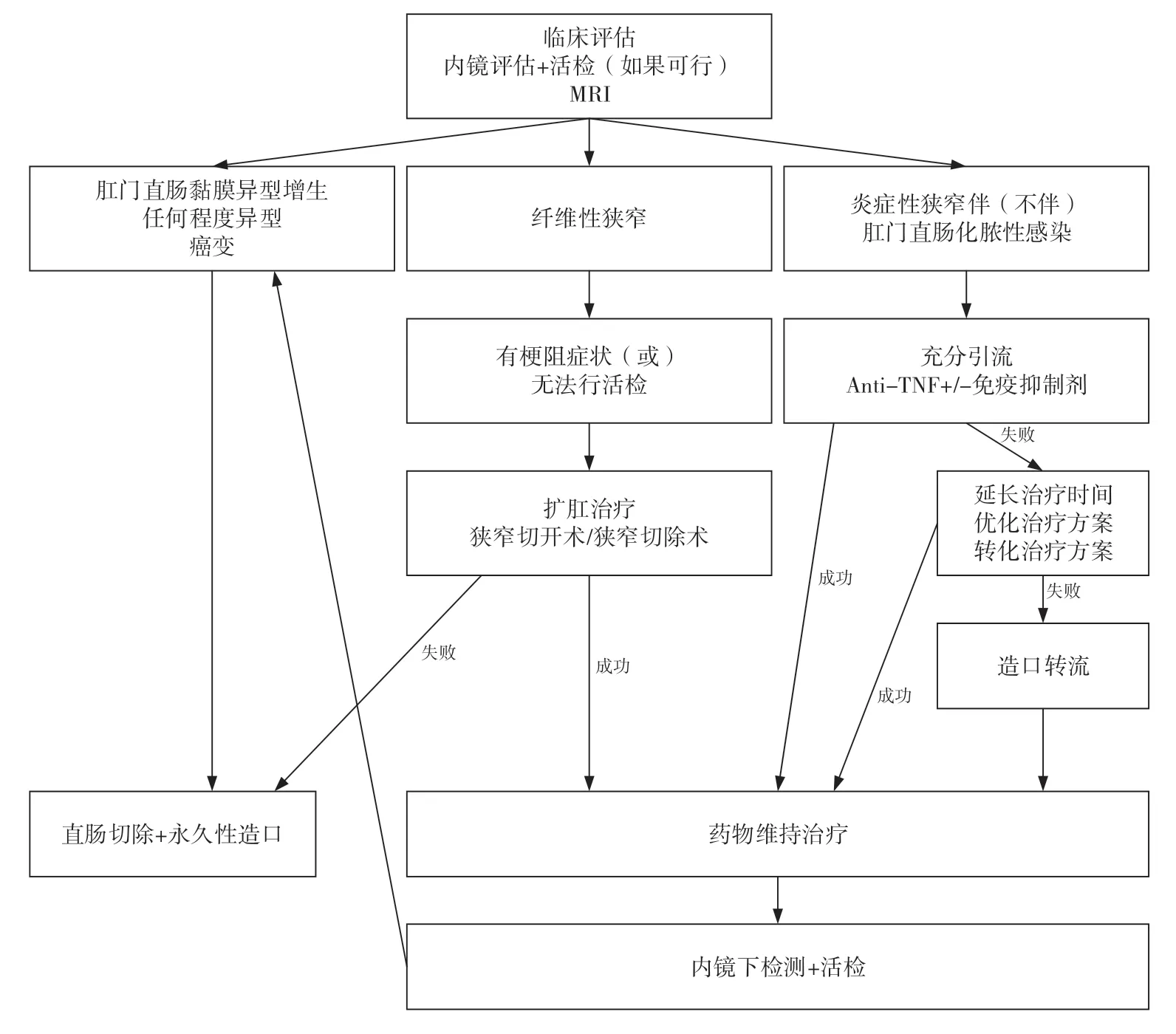
图3 CD肛管直肠狭窄的评估和治疗流程[9](改编)Figure 3. Algorithm for evaluation and treatment of CD anorectal stricture[9](modified)
3.1 器械扩肛治疗
扩肛治疗是轻中度纤维性狭窄的一线治疗方式,也是防止狭窄复发的重要手段。扩肛治疗可以通过手指或借助硬质扩张器来完成。扩肛的目的是逐渐拉伸增生的纤维组织,同时避免组织过度损伤,导致狭窄加重和肛门功能下降。初始的扩肛治疗可以在门诊或手术室内在麻醉状态下完成,以能够通过狭窄进行内镜检查和活检为宜。扩肛前需要对肛门及会阴部进行彻底检查,评估是否伴有肛管直肠炎症、溃疡、感染性病变或肿瘤等。Hughes 等的研究中有18%的患者在扩肛后出现了肛周脓肿和直肠周围瘘管的进展,可能和扩肛引起的直肠壁损伤和粪便污染有关[7]。由于直肠炎症使直肠壁更容易发生损伤,增加肛管直肠周围感染的风险,因此对伴有直肠炎或已有肛周感染的患者进行扩肛时需特别谨慎。指导患者出院后持续扩肛以维持效果,从能适应狭窄口径的扩肛器开始,逐渐过渡到16 或18 mm 扩肛器,扩肛频率为每周2 次,至少维持3 个月。目前尚无临床试验或前瞻性数据来评估扩肛治疗CD 肛管直肠狭窄的疗效或持久性。一项关于CD 肛管直肠狭窄的回顾性研究纳入了33 名接受扩肛治疗的患者,接近70%的患者只需要一到两次扩肛就能明显改善症状[7]。另一项回顾性研究纳入10名接受Bougie 扩张器扩张的CD 肛管直肠狭窄患者,首次扩肛后所有患者的狭窄症状均有明显改善;在10 年的随访过程中,扩肛的间隔时间逐渐延长,扩肛频率逐渐降低,提示长期、规律地扩肛能够维持治疗效果[13]。一项纳入22 例CD 肛管直肠狭窄患者的回顾性研究中,英夫利昔单抗治疗后的3 年随访中有54.5%的狭窄获得完全缓解,而其中50%的患者在英夫利昔单抗治疗后进行了扩肛治疗,提示英夫利昔单抗联合扩肛治疗可能会提高疗效[1]。
3.2 内镜下球囊扩张
内镜下球囊扩张术(endoscopic balloon dilatation,EBD)是在内镜引导下将球囊输送至管腔狭窄处进行扩张的方法。EBD 最初被广泛用于回肠狭窄的治疗,并逐渐扩展至结直肠狭窄的治疗中[14-15]。一项回顾性研究纳入5 例接受EBD或EBD 联合类固醇注射治疗的直肠狭窄患者,其中3 例(60%)患者手术成功且无复发,1 例(20%)患者行2 次扩张后无复发,仅1 例(20%)患者术后并发穿孔需要进行手术[16]。由于EBD 的施力方向呈放射状,且在扩张过程中不完全受操作者控制,易损伤直肠前壁及临近脏器(如阴道、尿道等),导致直肠穿孔、括约肌损伤及医源性阴道瘘的风险较高[17]。
3.3 经肛狭窄切开(切除)术
对扩肛治疗无效的患者可采用狭窄切开或狭窄切除术。经肛狭窄切开术是治疗中低位CD 肛管直肠狭窄的常用手术方式。通过肛肠拉钩充分暴露狭窄下缘,在血管钳的引导下沿肛管纵轴放射状切开狭窄环。对于膜状狭窄,电刀或超声刀在截石位3 点、6 点或9 点位切开狭窄环即可(图4-A,图4-B)。对于较为严重的管状狭窄,单纯放射状切开无法有效扩张管腔口径或术后很快复发,采用狭窄切除术环形切除狭窄部位的纤维化组织可以获得较好的效果(图4-C)。沿管腔后壁切除可以避免损伤前侧的阴道或前列腺,切除深度仍以内括约肌纤维为标记,尽可能减少肛门括约肌损伤,切除的程度以无明显阻力通过食指为标志。CD患者术后伤口愈合不良的风险较高,术后及时有效的药物(如生物制剂)治疗,可以有效促进狭窄切除术后的创面修复。
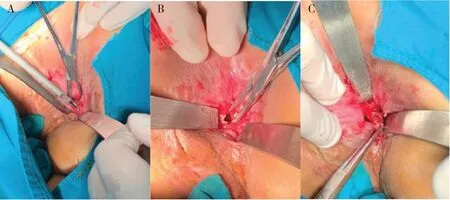
图4 经肛狭窄切开术与经肛狭窄切除术Figure 4. Transanal strictotomy and transanal stricture resection
3.4 内镜下狭窄切开术
高位直肠狭窄可采用内镜下狭窄切开术(endoscopic stricturotomy,ES),即在内镜视野下用电切刀(IT 刀、针刀等)切开或切除狭窄组织,以扩张狭窄部位的管腔口径。一项研究纳入85 例接受ES 治疗的CD 肠道狭窄患者,手术即时成功率为100%,但55.9%的患者需要再次接受ES 单独治疗或ES 联合EBD 治疗,其中5 例肛管直肠狭窄患者需要再次接受ES 干预的比例高达70%[16]。另一项来自日本的多中心研究同时纳入了原发性CD 狭窄和继发性吻合口狭窄,ES的即时成功率同样是100%,但有45%的患者需要再次内镜下干预[18]。在我国,一项回顾性研究纳入接受ES 治疗的13 例原发性CD 肛管直肠狭窄患者,手术即时成功率达100%,但有62%的患者需要再次接受ES 治疗[19]。由于ES 是在直视下进行操作,相比于EBD 而言更容易精准控制切开的方向、位置和深度,降低了医源性损伤的可能。一项病例对照研究将这两种内镜治疗方案进行了比较,结果显示ES 的近远期效果均优于EBD,后期需要手术干预的比例也更低。ES 组虽然没有穿孔事件发生,但治疗相关出血的发生率显著高于EBD[20]。2020 年《CD 肠道狭窄内镜治疗临床指南》推荐将ES 用于CD 肛管直肠狭窄的治疗[21]。但其可行性和效果有待进一步的研究。
3.5 其他保留括约肌技术
此外,保留括约肌技术也有小型病例报道。Lee 等对15 例扩肛无效的肛管直肠狭窄患者行经肛Heineke-Mikulicz 狭窄成形术,其中包括7 例CD 肛管直肠狭窄。具体操作步骤如下:分别在左右侧后方纵行切开狭窄段,切开纤维化狭窄全层至正常组织,注意避免损伤肛门括约肌,用3-0可吸收缝线横行缝合切口,以达到扩大管腔的目的。手术的即时成功率100%,术后随访12 个月,共有2 例复发,其中1 例复发可能和术后未进行有效药物治疗有关,复发患者再次行经肛狭窄成形术均获得成功[22]。
直肠袖套推移术最初被用于CD 复杂性肛瘘和直肠阴道瘘的治疗[23-24]。Simmang 等应用该技术治疗2 名合并直肠阴道瘘的CD 肛管直肠狭窄患者。适合进行该手术的患者需要近端直肠组织正常、肛门括约肌复合体完整且会阴部无感染。其要点在于从狭窄远端环形切开黏膜,沿黏膜下层向头侧游离,直到可以将正常直肠下拉并行无张力的直肠肛管吻合。2 名患者均行回肠造口并在术后6 个月成功回纳,除了轻度急便感之外,控便功能良好,术后12 和15 个月随访时狭窄和阴道瘘未复发[25]。
3.6 造口粪便转流
粪便刺激在CD 患者的狭窄、瘘管和脓肿等肛周病变的进展中起重要作用,因此有时需要通过造口粪便转流来控制疾病进展和缓解症状。有研究对仅行粪便转流治疗重度结肠或肛周CD 的结果进行了评估,但其可靠性受限于患者数量较少,且未对肛管直肠狭窄的疗效进行单独评估。Yamamoto 等评价了31 例重度肛周CD 患者行粪便转流的结局,虽然81%的患者术后临床症状缓解,但仅有10%的患者恢复了肠道连续性,且71%的患者最终需要行直肠切除术[2]。另一项研究对174 例粪便转流的难治性肛周CD 患者进行回顾,74%的患者术后症状缓解,但仅有2.2%的患者恢复了肠道连续性,且疾病复发率为100%,41.3%的患者最终需要行直肠切除术[26]。一项系统综述纳入了556 例难治性肛周CD 患者,Meta 分析结果显示仅有63.8%的患者在造口转流后获得早期应答,虽然有34.5%的患者尝试行造口回纳,但仅有16.6%的患者成功恢复了肠道连续性,41.6%的患者最终需要行直肠切除术[27]。CD 患者发生造口相关并发症的风险也需要特别关注。在一项纳入266 名造口患者的研究中,造口并发症的发生率为36%,其中CD 患者的造口并发症发生率为46%[28]。造口位置如何选择目前尚无定论。一项来自德国的研究对746 名行手术治疗的CD 患者进行了分析,其中结肠造口因相关并发症需要再手术的比例显著高于回肠造口(31% vs 5%,P<0.05)[29]。造口粪便转流虽然可以缓解患者排便困难或梗阻症状,但可能会掩盖局部病情的进展,如狭窄加重或者局部癌变等。对怀疑有癌变的患者应尽快通过MRI 等影像学手段和麻醉下活检明确诊断,通过早期诊断和治疗来改善患者的预后[30]。综上所述,粪便转流更适合作为直肠切除和永久性造口前的过渡,让患者有一个充分认识和适应的过程,并为直肠切除术创造较为有利的条件。
3.7 直肠切除术
经以上措施治疗后狭窄未能缓解,甚至症状加重或存在癌变风险时,建议尽快行直肠切除术。尽管采取积极的治疗措施,约50%的CD 肛管直肠狭窄患者最终仍因病情进展需要行直肠切除加永久性结肠造口。相关手术方式包括全结肠直肠切除(total proctocolectomy,TPC)加回肠造口、直肠切除加结肠造口,或对少量合适的病例行直肠切除吻合术[31]。伴有广泛结肠炎的CD 肛管直肠狭窄患者,TPC 加回肠造口应考虑作为首选术式。手术切除主要靶器官可以迅速改善患者的整体健康状况。此外有研究表明TPC 术后复发风险更低,复发间隔时间延长,停用CD 相关药物的可能性也更大[32-33]。病变局限的难治性CD 肛管直肠狭窄患者应选择何种术式目前尚无定论。一项研究纳入了10 名因肛周CD 行直肠切除加结肠造口术的患者,术前这些患者近端结肠内镜下均无明显病变,但术后有9 名患者很快出现严重的近端结肠复发,有5 名患者最终需行TPC,因此作者认为应该对这类患者行TPC 加回肠造口[34]。而另一项研究纳入了63 名类似患者,尽管68.3%的患者术前已有结肠受累,直肠切除加结肠造口术后中位随访17.7 个月,仅有3 名患者最终因难治性结肠病变需追加全结肠切除术[35]。未来需要根据患者的复发风险制定个体化治疗方案,对结肠复发风险高的患者采用TPC 而非仅行直肠切除术,可以有效降低因疾病复发需要再手术的风险。
4 结语
CD 肛管直肠狭窄的治疗领域仍存在很多亟待解决的问题,如缺乏高等级的临床研究证据,也无关于最佳治疗方案的临床指南可供参考。术前全面的临床和影像学评估以明确狭窄性质、完善狭窄病灶的信息参数是制定治疗方案的先决条件。药物治疗可以缓解炎症性狭窄,但对纤维性狭窄作用甚微[36]。纤维性狭窄首先进行扩肛治疗,如果无效可尝试经肛或内镜下的狭窄切开(切除)术。造口转流可以暂时缓解患者的症状,但这些患者中的大多数最终需接受结直肠切除术。对于不能接受切除直肠的患者,保留括约肌的经肛Heineke-Mikulicz 狭窄成形术和直肠袖套推移术可作为直肠切除前的保守治疗措施。
