MAPKKK参与植物生长发育及逆境胁迫调控的研究进展
2023-12-25陈磊清陈丽妃
陈磊清,陈丽妃
(福建师范大学生命科学学院,福建 福州 350117)
促分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK或MPK)是一种广泛存在于真核生物中,在进化过程中高度保守的生物信号转导模块,对植物生长发育及抵抗逆境胁迫起着至关重要的作用。典型的MAPK级联信号通路由MAPK激酶(Mitogen-activated protein kinasekinasekinase,MAP3K或MAPKKK或MKKK)、MAPK激酶(Mitogen-activated protein kinasekinase,MAP2K或MAPKK或MKK)和MAPK组成,该信号传导途径可将植物感受到的环境信号放大并传递,从而激活下游的酶及转录因子,最终激活靶基因表达,对外界信号做出应答[1]。MAPKKK位于MAPK级联通路的上游,可磷酸化激活MAPKK T环Thr/Ser基序中的两个氨基酸,进一步磷酸化激活MAPK(图1)。MAPKKK基因家族成员通常数量庞大,且在植物的生长发育及适应逆境胁迫方面发挥极其重要的作用。尽管MAPK级联通路中部分MAPKKK成员的功能已被阐明,但大多数MAPKKK成员的功能仍然未知。MAPKKK在真核生物中具有普遍性和高度保守性,探索MAPKKK在植物调节生长发育以及响应外界生物或非生物胁迫信号的分子机制,发掘MAPKKK逆境胁迫调控应答功能基因并解析其分子调控通路,对提高作物抗逆性和培育具优良抗性的作物品种具有重要的理论指导意义。基于此,本文主要对MAPKKK参与调节植物生长发育及响应逆境胁迫的研究进展进行综述,期望为MAPKKK的分子机制研究提供参考。

图1 植物MAPKKK介导的MAPK级联途径作用模式图
1 植物MAPKKK的组成及分类
MAPKKK作用于MAPK级联通路的顶端,是一类苏氨酸 (nr)/丝氨酸 (ser)激酶,能通过磷酸化中游MAPKK活化环S/T-XXXXX-S/T基序中S/T残基来激活MAPKK,进而磷酸化激活下游MAPK。1993年Banno等[2]从烟草中分离出来的第一个编码MAP3K的基因NPK1,随后越来越多的MAPKKK基因在植物中被鉴定出来[3]。与中游MAPKK和下游MAPK相比,MAPKKK数量最为庞大,也表现出更明显的复杂性和序列多样性,拥有更为多样的初级结构和二级结构。根据催化结构域的氨基酸保守基因序列的不同,MAPKKK基因家族可细分为MEKK、Raf和ZIK这3个亚家族,MEKK和Raf是其中两个较大的亚组,ZIK亚家族成员最少[4],大多数植物都符合这一规律(表1)。MEKK亚族成员中YDA、ANP1、ANP2、和ANP3与细胞周期调控相关,Raf亚族成员中CTR1和EDR1与逆境胁迫相关。每类成员含有必需的蛋白激酶区域以及其他的功能特区,MEKK大多数具有保守的G(T/S)Px(W/Y/F)MAPEV结构域,Raf大多数具有保守的GTxx(W/Y)MAPE结构域,ZIK大多数具有保守的GTPEFMAPE(L/V)Y结构域[5]。值得注意的是,MEKK亚族的蛋白质结构保守性与ZIK亚族和Raf亚族相比相对较低,这也意味着MEKK亚族在植物生长发育及逆境响应的功能更为重要。

表1 26种植物的MAPKKK的分类
2 MAPKKK在植物生长发育中的调控应答
植物的生长发育受多种因素调控,是一个复杂且重要的生理过程。据大量文献报道,MAPK级联信号通路与植物生长周期的基本发育过程相关,几乎参与植物生长的整个过程,包括配子和胚胎发育、形成组织器官及形态建成等,而且在植物生长发育中细胞增殖和细胞分化两个重要的进程都起着关键的作用,是植物生长发育中不可或缺的信号传导和调控途径之一。MAPKKK作为MAPK级联通路中上游成员,在植物胚胎发育、气孔发育、根部发育、叶片和花结构发育等过程中都起着不可或缺的调节作用(表2)。
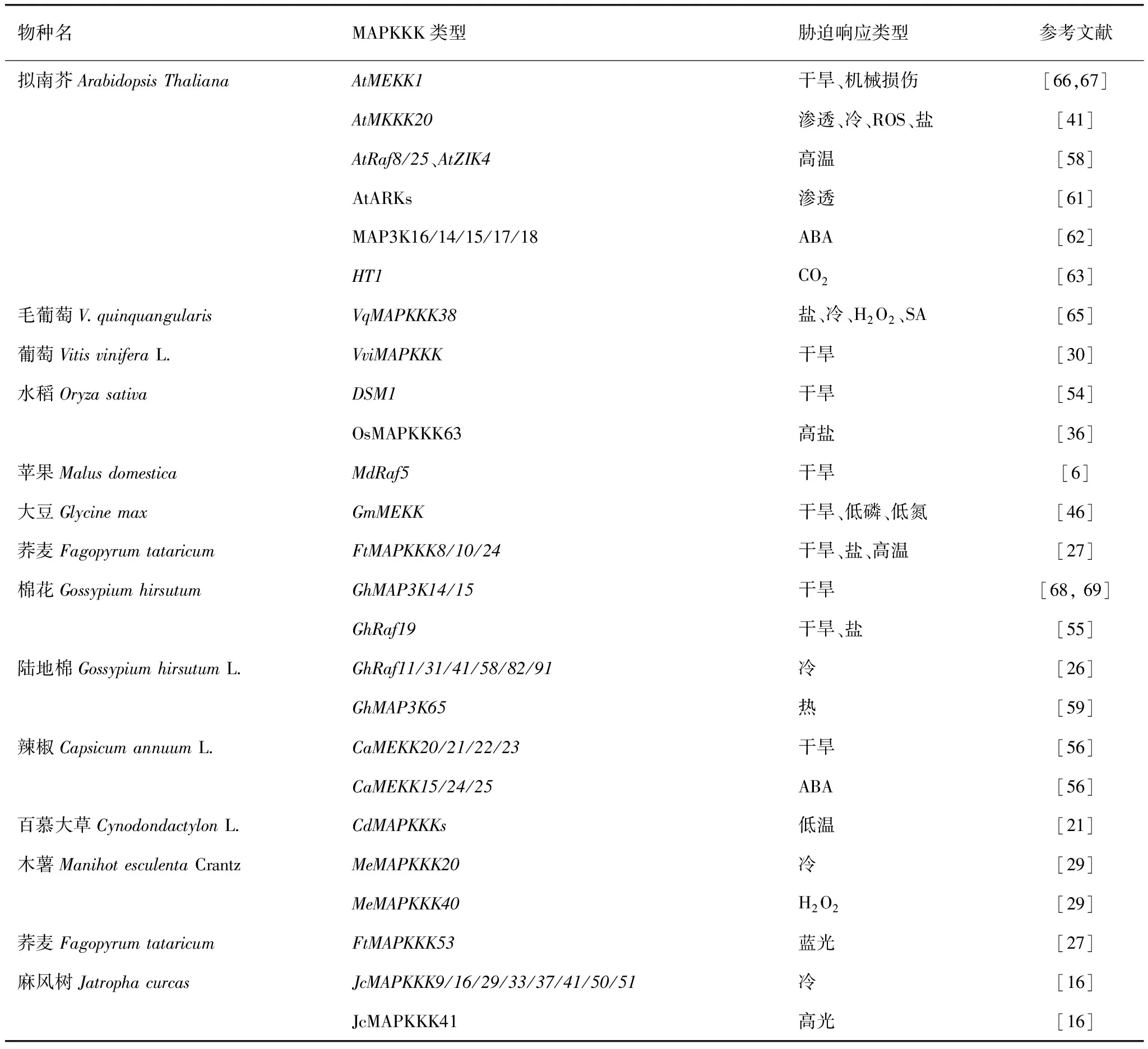
表2 MAPKKK在植物非生物胁迫中的调控应答
2.1 胚胎发育
MAPKKK参与调控植物胚胎发育在宏观方面表现在影响植物组织、器官和胚胎的发育,在微观方面可影响植物细胞分裂和分化。Chaiwongsar等[32]研究确定拟南芥MAP3Kε1和MAP3Kε2可在胚胎发育过程中表达,且MAPKKKε1或MAPKKKε2双突变组合导致胚胎致死性。Xu等[33]研究表明OsMKKK10通过OsMKKK10-OsMKK4-OsMAPK6级联通路正向调节水稻粒径和重量,OsMKKK10功能缺失会导致小而轻的籽粒、短穗和半矮秆植株,而构成活性OsMKKK10的过表达会导致大而重的籽粒、长穗和高的植株。Tian等[34]研究发现水稻MAPKKK10-MAPKK4-MAPK6-WRKY53级联通路在叶片角度和种子大小控制方面发挥作用。Liu等[35]研究指出水稻OsMKKK70介导的OsMKKK70-OsMKK4-OsMAPK6-OsWRKY53级联通路在控制粒形和叶角中共同发挥作用,过表达OsMKKK70导致植物产生更长的种子,且OsMKKK70、OsMKKK62和OsMKKK55在调节种子大小和叶角方面存在冗余功能。Na等[36]研究发现OsMAPKKK63过表达株系在水稻和拟南芥中均表现出胎生表型,表明OsMAPKKK63可能参与种子休眠控制。Liu等[37]发现水稻OsMAPKKK5的截短变体OstMAPKKK5通过影响细胞大小正向调控水稻株高和产量。Yin等[26]研究发现在陆地棉GhMEKK20和GhMEKK42主要在胚珠中表达,在其他测试组织中低表达,表明二者可能在胚珠特异性发育中发挥作用。
2.2 气孔发育
气孔作为植物表皮上的特化气孔,主要作用是调节植物与外界环境的气体交换和水分蒸发。已有的研究证实,拟南芥YODA (YDA或MAPKKK4)在气孔发育中的作用至关重要。Samakovli等[38]发现YODA与热休克蛋白HSP90相互作用,并通过调节下游MPK3/6激酶的磷酸化来调控气孔发育,且YODA和HSP90之间的串扰导致转录因子SPCH (SPEECHLESS)的不稳定和转录失活,从而影响气孔发育。Lee等[39]研究表明YDA-MKK4/5-MPK3/6级联通路通过作用于包含RLK ERECTA (ER)/ER-like 1 (ERL1)/ERL2和RLP Too Many mouth (TMM)的受体复合物下游来调控气孔发育。此外,Guo等[40]研究证明YDA可被定位于细胞皮层的蛋白磷酸酶BSL1激活,从而进一步提高MPK3/6活性,抑制气孔形成。
2.3 根部发育
根的作用主要体现在固定位置和为植株生长提供养分,MAPKKK参与调控植物根部发育在部分植物中得到证实。在拟南芥中,MAP3K20通过磷酸化下游MKK3激酶和MPK18激酶调节根微管功能,MAP3K20突变体也存在微管组织缺陷。值得注意的是,MAP3K20突变体在正常生长条件下与野生型植物相比发育无明显缺陷,而经二硝基苯胺除草剂(Oryzalin)处理后的MAP3K20突变体幼苗根明显短于野生型[41-42]。拟南芥AtMEKK1可通过参与谷氨酸信号通路调控根系发育,AtMEKK1突变体与野生型相比,植株整体矮化,根毛短,侧根少[43]。AtMAP3K4作为MAPK6的上游蛋白,在根的发育和有丝分裂过程中微管的调控中发挥重要作用,AtMAP3K4突变体中主根和侧根的细胞分裂紊乱,导致细胞质分裂终止[44]。拟南芥MAP3Kε1和MAP3Kε2在根中均有表达,且MAP3Kε1均匀地分布在所有类型的组织中,而MAP3Kε2的表达主要集中在根管组织区域[32]。麻风树JcMAPKKK64主要在根中表达,JcMAPKKK27在根中高表达,JcMAPKKK9/35/55/58/59在所有测试组织中都高表达,其中JcMAPKKK9在根中表现出更高的表达[16]。棉花GhMAP3K40在本氏烟草N.benthamiana中的过表达抑制了根的生长[45]。
2.4 叶片和花结构发育
已有的文献报道,MAPKKK在调控植物叶片和花结构发育发挥重要作用。麻风树JcMAPKKK51在叶片中高表达,JcMAPKKK56在叶片中特异性表达,JcMAPKKK59和JcMAPKKK65在叶片中具有更高的表达水平,表明其在叶片特异性发育中发挥作用[16]。GmMEKK在大豆叶片中的表达水平最高,其次是根、茎、花、荚,在种子中没有表达,这表明GmMEKK在大豆中可能具有重要的生物学功能[46]。水稻中一个新MAPKKK基因OsCSL1的破坏导致含有积累的淀粉颗粒的叶绿体和脱氯幼苗的严重破坏,且OsCSL1的突变可导致能量缺乏和水稻幼苗过早死亡,表明OsCSL1对水稻叶绿体的发育至关重要[47]。水稻OsMKKK10介导的OsMKKK10-OsMKK4-OsMPK6级联通路参与调控水稻花序结构发育[48]。拟南芥YODA-MKK4/5-MPK3/6级联通路在受体样蛋白激酶ERECTA的下游调节局部细胞的增殖,从而使花序结构发生改变[49]。龙葵MAPKKK基因ScFRK1参与调控胚囊和花粉发育,ScFRK1的下调严重影响胚囊和花粉的发育,并导致授粉后产生部分孤雌果实[50]。MAP3Kε1、MAP3Kε2和MAP3K20在拟南芥不同组织中均有表达,尤其是在花粉粒中[42,51]。MAPKKKε1或MAPKKKε2纯合子的植株没有明显的突变表型,而MAPKKKε1和MAPKKKε2双突变组合引起花粉致死,在MAP3Kε1/2背景中使用诱导的MAP3Kε1结构可挽救花粉活性,表明MAP3Kε1是拟南芥花粉发育过程中质膜正常功能所必需的[52]。值得注意的是,MAP3Kε1和MAP3Kε2在参与花粉粒落在柱头前的花粉萌发过程存在功能冗余,且MAP3Kε1/2与MOB1A/1B相互作用,可能通过茉莉酸 (JA)信号串扰影响拟南芥胼胝体积累,在限制花粉萌发中发挥重要作用[51]。
2.5 其他发育过程的调控
MAP3Ks除直接作用于生长发育外,还影响植物的昼夜节律和一些代谢过程,间接影响植物的生长发育[3]。如拟南芥AtZIK4蛋白WNK1 (At3g04910)被证实在体外磷酸化假定的昼夜节律时钟成分APRR3,并可能通过调节其生物活性参与调控昼夜节律[53]。过表达OsMKKK70水稻植株的粒径和叶角增大情况类似于增强的油菜素甾醇 (BR)信号突变体的表型,表明OsMKKK70可能在水稻BR信号传导调控中发挥积极作用[35]。水稻OstMAPKKK5的过表达可导致各种形式的内源性赤霉素(GA)含量增加,尤其是最常见的活性形式GA1、GA3、GA4,进而导致细胞增大,并最终导致株高和产量增长[37]。麻风树JcMAPKKK51和JcMAPKKK55与乙酰辅酶A羧化酶ACC1和ACC3相互作用,表明其可能在脂肪酸合成和延伸中发挥作用[16]。
3 MAPKKK在植物非生物胁迫中的调控应答
植物作为固着生物难免面临各种生物和非生物胁迫,并进化出大量复杂的信号转导机制,以调节其发育并增强其对这些胁迫的抵抗力。植物已经进化出各种环境反应机制,通过激活多种信号转导途径来适应环境压力,将自身损害降至最低。应激激活的分子通路包括多个相互连接的调节网络,如蛋白激酶信号级联通路,可有效地将输入信号转换为合适的输出。MAPK级联途径是植物响应生物及非生物胁迫最常见的信号通路之一,MAPKKK作为该信号通路的第一接收者和传递者,负责将信号放大后依次传递给MAPKK和MAPK,最终介导植物对外界信号的应答,在植物响应非生物胁迫中起着不可或缺的调节作用,包括干旱胁迫、盐胁迫、极端温度胁迫、渗透胁迫等。
3.1 干旱胁迫
植物对干旱胁迫的生理响应,是一个非常复杂而精妙的过程。干旱胁迫是限制全球植物生产力和分布的主要环境因素之一,研究证实MAPKKK参与植物对干旱胁迫的防御反应。Ning等[54]研究表明水稻Raf 亚家族的DSM1(DROUGHT-HYPERSENSITIVEMUTANT1)可通过清除活性氧(ROS)来调节水稻的耐旱性。Sun等[6]研究认为过表达苹果MAPKKK基因MdRaf5可导致叶片对干旱胁迫的敏感性降低,这与调控气孔关闭和蒸腾速率有关。Jia等[55]运用病毒诱导基因沉默 (VIGS)技术获得GhRaf19转基因棉花植株,发现其对干旱和盐胁迫的耐受性增强,表明棉花GhRaf19可负向调节干旱和盐胁迫。Lim等[56]认为辣椒MEKK基因可能参与干旱胁迫反应,研究发现在干旱胁迫下,除CaMEKK16和CaMEKK17外,辣椒CaMEKK基因表达量在处理2 h后显著增加,并且CaMEKK20/21/22/23基因在6 h后持续高表达。Wang等[30]研究表明葡萄MAPKKK基因家族成员积极响应干旱胁迫,葡萄VviMAPKKK基因在植株受到干旱胁迫时的表达水平几乎都呈显著增加的趋势,许多VviMAPKKK转录物增加了10倍以上,其中有4个转录物(VviMAPKKK22/23/51/54)的表达增加了20倍以上。Sha等[46]发现大豆根中属于MEKK1(STE11/BCK1)类MAPKKK基因的GmMEKK受干旱胁迫后上调表达。Ye等[29]研究发现木薯中MeMAPKKK16/18/19/20/23/30/40在干旱处理2~14 d的表达明显上调,表明它们可能在木薯响应干旱胁迫中起作用。
3.2 盐胁迫
盐胁迫是植物在高盐环境下面临的一种生理压力,可导致植物生长不良、凋零甚至死亡。研究发现,部分MAPKKK参与调控植物对盐胁迫的响应过程,Yang等[57]研究发现MAPKKK18在盐胁迫期间持续上调,这表明它在耐盐性中起着至关重要的作用。Kim等[41]研究表明拟南芥mkkk20突变体(SALK_124389)对高盐胁迫表现出显著的敏感性,进一步试验表明MKKK20通过调节MPK6活性来参与响应高盐胁迫[41]。Na等[36]揭示了水稻OsMAPKKK63具有体外激酶活性,并且它与水稻MAPKK中盐胁迫响应的中介OsMKK1和OsMKK6相互作用,提示OsMAPKKK63可能参与了高盐响应。Chen等[45]研究发现棉花GhMAP3K40正向调节耐盐性且可受盐胁迫诱导,高盐胁迫下过表达GhMAP3K40可提高植物发芽率。Jia等[55]研究表明棉花Raf19在盐胁迫下抑制ROS相关抗氧化基因的表达,负调控棉花耐盐性,导致ROS的积累。
3.3 极端温度胁迫
极端温度胁迫是限制植物生长发育的主要环境胁迫,主要包括高温胁迫和低温胁迫。随着地球气候环境的变化,高温已成为影响主要粮食作物生长发育的重要因素。拟南芥AtRaf8、AtRaf25和AtZIK4在高温胁迫下表达水平上调[58]。拟南芥YODA与HSP90相互作用并通过激活下游MKK4/5-MPK3/6级联通路来响应热胁迫[38]。棉花Raf亚族成员GhMAP3K65可受热胁迫诱导,沉默GhMAP3K65可提高棉花植株的耐热性,过表达GhMAP3K65使棉花对热应激的敏感性增强[59]。低温胁迫对植物的正常生长代谢产生不利影响,严重时可造成冻害现象。棉花MAP3K基因GhRaf19正向调控低温胁迫,过表达棉花GhRaf19可增加植株耐低温能力,而GhRaf19的沉默使棉花植株抗寒能力下降[55]。在陆地棉中,GhRaf31/58/82仅在12 h的冷胁迫下高表达,GhRaf41和GhRaf91在冷胁迫下的表达水平较低,GhRaf11的表达水平在冷胁迫下增加[26]。在低温胁迫下,百慕大草12个CdMAPKKKs和13个CdMAPKKKs分别显著上调和下调;其中有6个CdMAPKKKs至少在一个时间点受到低温胁迫的显著诱导[21]。在冷胁迫下,木薯MeMAPKKK20转录物在所有测试时间点都被显著诱导[29]。麻风树在冷胁迫处理12、24、48 h后,有8个JcMAPKKKs(JcMAPKKK9/16/29/33/37/41/50/51)的表达均显著上调,尤其是JcMAPKKK16和JcMAPKKK41在冷胁迫12 h后显著上调,这表明二者在麻风树低温反应中具有潜在的重要功能[16]。
3.4 渗透胁迫
环境干旱和高盐会造成渗透胁迫,抑制植物生长和产量。植物对渗透胁迫有多种信号通路,其中植物激素脱落酸(ABA)起着重要作用[60]。Lim等[56]研究发现辣椒经外源ABA处理后,CaMEKK15/24/25基因表现出不同程度的诱导,CaMEKK16/20/22基因表达量在处理6 h和12 h后均显著增加。Katsuta等[61]研究证明拟南芥ABA和MAPKKK家族B3支的非生物胁迫应答Raf-like激酶AtARKs在气孔关闭应对干旱的核心因子SnRK2介导的渗透胁迫应答中起着关键作用。Choi等[62]研究指出拟南芥MAP3K16和MAP3K14/15/17/18参与ABA反应,根据发育阶段发挥负或正作用,并且MAP3K16可能通过MKK3和ABR1(ABA REPRESSOR1)发挥作用。Kim等[41]发现拟南芥MKKK20在NaCl、H2O2和冷处理下调控MPK6的活性,结果表明MKKK20可能通过调控MPK6活性参与了对各种非生物胁迫,特别是渗透胁迫的响应。
3.5 其他胁迫
拟南芥Raf亚家族基因HT1(HIGHLEAFTEMPERATURE1)是CO2信号传导的关键调节因子,HT1正向调节CO2反应,并部分参与光诱导的气孔开放途径[63]。H2O2是一种重要的ROS,也是导致植物对病原体和非生物胁迫因子反应的级联反应中的关键信号分子[64]。在木薯中,MeMAPKKK40经H2O2处理后在所有时间点都表现出显著的下调[29]。荞麦15个MAPKKK基因在蓝光处理下表达上调,其中FtMAPKKK53基因的表达上调最明显[27]。毛葡萄幼叶暴露于外源或H2O2会增加VqMAPKKK38的表达,且VqMAPKKK38在毛葡萄叶片中的过表达可显著增强水杨酸(SA)诱导的二苯乙烯的积累,同时强烈诱导STS(stilbene synthases)和MYB14的表达[65]。棉花GhRaf19的表达可被H2O2诱导,过表达GhRaf19可激活ROS相关抗氧化基因或酶的表达来增强棉花对冷胁迫的抗性,而沉默GhRaf19使棉花植株抗寒能力下降,产生更大的ROS积累[55]。麻风树JcMAPKKK41与ABI2(ABA insensitive 2)结合,通过抑制ABA信号通路,在调控气孔关闭、高光胁迫、对葡萄糖的响应、种子萌发、抑制营养生长等方面发挥重要作用[16]。
4 MAPKKK在植物生物胁迫中的调控应答
4.1 细菌、真菌和病毒侵害
植物有一个复杂的免疫系统,也称为效应器,可以识别来自不同病原体的毒力蛋白,包括细菌、真菌、卵菌和病毒。MAPKKK作为MAPK级联通路中最大的家族,在植物对细菌、真菌和病毒侵害的响应过程中发挥重要作用。拟南芥Raf成员ILK5(INTEGRIN-LINKEDKINASE)突变体植株对丁香假单胞菌病原体感染表现出更高的易感性[70]。拟南芥MAPKKKδ-1(MKD1)是完全免疫抵御细菌和真菌感染所必需的,它参与了赤霉素的植物毒素应答和对紫丁香假单胞菌的抗性[71]。拟南芥MAPKKK5基因敲除突变体破坏了几丁质诱导的MAPK激活和对油菜链格孢(Alternariabrassicicola)的抗病能力[72]。水稻Raf亚家族基因OsEDR1通过物理相互作用抑制OsMPKK10.2的活性,从而使植株对稻黄单胞菌致病变种Xoc(Xanthomonasoryzaepv.oryzicola)的抗性减弱[73]。水稻Raf亚族成员OsILA1通过抑制OsMAPKK4-OsMAPK6级联通路,对白叶枯病(xanthomonasoryzaepv.oryzae)具有广谱抗性[74]。苹果MdMAPKKK1在调节对葡萄座腔菌(Botryosphaeriadothidea)的抗性中发挥正向调控作用,过表达MdMAPKKK1诱导病原体非依赖性细胞死亡,沉默MdMAPKKK1降低了苹果愈伤组织和果实对葡萄座腔菌的抗性[75]。PbrMAPKKK基因与梨抗黑斑病的生命过程呈正相关,VIGS表明PbrMAPKKK82基因增强了梨对黑斑病的抗性,qRT-PCR结果表明梨PbrMAPKKK12/13/53/60/65/82/83/96与黑斑病抗性相关,PbrMAPKKK3/9/11/34/80/81/99/100与黑斑病易感性相关[10]。番茄SlMAPKKKε是与植物免疫相关的细胞死亡信号网络的正调节因子,SlMAPKKKε的沉默降低了番茄对油菜黄单胞菌和丁香假单胞菌的抗性,导致疾病症状的出现和细菌生长的增强[76]。番茄SlM3Kα通过激活MAPK信号,导致与胞内受体抗病蛋白(Nucleotide-binding leucine-rich repeat Receptor,NLR)触发的免疫相关的程序性细胞死亡 (PCD),且SlM3Kα与SlMai1在本氏烟草叶片中的共表达增强了MAPK的磷酸化,加速了PCD的发生[77]。
MAPK级联通路是植物免疫信号网络中的重要节点,通过传输来自不同刺激的信号来调节下游防御反应,同时也受病原菌和植物因子的调控。Wan等[78]研究表明TaRaf46介导了条形柄锈菌小麦专化型Pst(Puccinastriiformisf.sp.tritici)中一种富含丝氨酸的效应因子Pst27791的毒力,在小麦重要病原菌Pst感染过程中发挥负调节植物免疫的作用。Zhai等[59]研究认为棉花GhMAP3K65可能通过SA、JA、ET (乙烯)和ROS信号通路响应病原菌侵染,沉默GhMAP3K65可增强棉花对青枯病(R.solanacearum)的抗性,过表达GhMAP3K65可增强植株对青枯病的敏感性。Murphy等[79]报道了与马铃薯MAP3K StVIK与RXLR效应子Pi17316互作,且StVIK作为一种易感性因子,可增强感染晚疫病菌(P.infestans)的定植。MAPKKKε与一种寄生菌RXLR-WY型效应子PexRD2相互作用,并干扰依赖于该激酶的植物免疫相关信号通路[80]。最近,REN等[81]发现马铃薯StMAP3Kβ2与StMAP3Kε共享相同的下游MEK2-SIPK/WIPK级联通路,且StMAP3Kβ2同源基因NbMAP3Kβ2的VIGS增强了马铃薯感染晚疫病菌的定植,并减轻了番茄抗性蛋白Cf4或黄枝孢无毒蛋白Avr4诱导的细胞死亡。除此之外,病原菌产生的MAPKKK也能诱导植物细胞死亡和ROS爆发。PbMAKKK7-PbMAKK3-PbMAK1/3级联通路中的PbMAPKKK7是甘蓝根肿菌(Plasmodiophorabrassicae)侵染植物的调控因子,可诱导ROS积累和细胞死亡,增强植物对烟草花叶病毒 (Tobacoomosaicvirus,TMV)和灰霉病(B.cinerea)的易感性[82-83]。至今,仍然有许多植物与病原菌相互作用的机制尚不清楚,需要投入更多的研究来探索MAPKKK在MAPK级联通路中如何调控植物侵染期间宿主细胞的死亡。
4.2 植食性昆虫侵害
根据已有的研究,MAPK级联通路中的部分MAPKKK成员参与了植物对植食性昆虫的防御反应。Guo等[84]研究证明桃蚜(Myzuspersicae)半胱氨酸蛋白酶组织蛋白酶B3(CathB3)的propeptide domain与烟草EDR1-like蛋白互作,进一步揭示了蚜虫唾液蛋白CathB3是通过稳定EDR1激活维管束中ROS通路,从而抑制蚜虫对植物韧皮部的摄食,表明EDR1-like在介导烟草对蚜虫的有效防御中发挥作用。Li等[85]研究揭示了一种新型的植物敏感因子Raf36在MKK2的上游起作用并直接靶向MKK2,负向调节拟南芥对寄生蜂的抗性。Guo等[86]研究揭示了MAP4K4-Raf-MAP2K1-ERK、MAP4K4-MAP3K7-MAP2K4-JNK和MAP4K4-MAP3K7-MAP2K6-p38的3个潜在激活途径,在克服苏云金芽孢杆菌(Bacillusthuringiensis,Bt)的毒性中起着关键作用,从而使十字花科蔬菜作物“超级害虫”小菜蛾(PlutellaxylostellaL.)对BtCry1Ac杀虫蛋白产生高抗性。Sözen等[87]研究表明拟南芥AtMAP3K14-MKK3-MPK1/2/7信号模块是植物基于JA激活从而抑制海灰翅蛾(Spodopteralittoralis)生长的一个缓慢过程,这一个新发现的MAPK级联通路对于保护植物不受植食性昆虫侵害具有重要作用。
5 结语
MAPKKK在调节植物生长发育及对环境的适应过程中起着重要作用,这在许多植物中得到证实。尽管植物中越来越多MAPK级联通路的作用机制被揭示,但MAPKKK在调控植物株高与产量、花粉发育、金属离子胁迫、光胁迫、病原菌侵染、植食性害虫侵害等方面的分子机制有待进一步阐明。利用基因编辑技术敲除或过表达作物中的关键MAPKKK来研究它们在植物生长发育与抗逆功能中的分子机制,运用酵母双杂交、融合蛋白沉降、免疫共沉淀等技术筛选验证MAPKKK互作蛋白并寻找MAPKKK上游的调控因子,鉴定MAPKKK介导的MAPK模块下游靶标将有助于更好地理解植物如何响应逆境胁迫,同时培养农艺性状更好和抗逆性更强的作物也是未来工作的重点。因此,仍需要对更多植物MAPKKK基因的功能进行分析,探究它们在调节植物生长发育和响应逆境胁迫信号的分子机制,进一步更新和完善MAPK级联通路的调控网络,从而优化植物育种策略来提高作物对逆境胁迫的适应能力,使病原体和宿主之间的协同进化向有利于植物的方向倾斜。
