池蝶蚌急性高温和菌刺激胁迫应答HSP70 B2-like的表达特征
2023-12-21陈凯欣邱齐骏
陈凯欣,赵 溪,邱齐骏,吴 娣,2,彭 扣,2
(1.南昌大学 生命科学学院,南昌 330031; 2.江西省水产动物资源与利用重点实验室,南昌 330031; 3.江西省抚州市农业科学研究所,抚州 344000)
池蝶蚌(Hyriopsisschlegelii)隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、蚌科(Unionidae)、帆蚌属(Hyriopsis),因其育珠性能佳、产珠品质优、环境适应能力强等特点,是我国一种重要的淡水育珠蚌。水温是影响贝类存活、生长发育、免疫功能和分布的主要环境因子之一,水温超过一定范围,机体会产生热应激反应,导致其生理功能减弱、免疫功能降低,甚至死亡[1]。温度胁迫是指生物对正常生存温度之外温度的反应,包括低温胁迫和高温胁迫[2-3]。就淡水育珠贝而言,20~35 ℃是其生活的适宜温度。高于35 ℃会造成热昏迷现象,影响珍珠的产量和质量,高于40 ℃会造成育珠贝死亡[4]。池蝶蚌作为重要的淡水育珠蚌之一,在育珠生产过程中,容易遭受病原微生物侵袭。近年来,病害影响给我国淡水育珠业造成了重大经济损失[5]。因此,提高淡水育珠蚌抗高温热害和免疫防御能力对其养殖的可持续发展具有重要意义。
热激蛋白(Heat shock protein,HSP)是生物体内与抗逆相关的一类十分重要的蛋白质,对机体免受应激因素损害和增强机体对胁迫环境的耐受性,维持细胞正常生理功能具有重要作用[6]。HSP70家族是HSP超家族的重要成员,分子质量为68~74 ku,是一类应激保护蛋白[6]。研究表明,HSP70家族成员在帮助机体应答高温、缺氧、重金属、病菌感染等环境胁迫方面起关键作用,具分子伴侣功能,能帮助蛋白进行重新正确折叠、装配和转运,清除错误折叠、受损或变性蛋白[6]。HSP70作为HSP超家族中最保守的蛋白,广泛存在于各种生物体内,已从植物、动物和微生物体内成功克隆出HSP70基因[6]。
在无脊椎软体动物中,已开展多种重要经济贝的HSP70序列测定及其表达研究,如长牡蛎(Crassostreagigas)[7]、美洲牡蛎(Crassostreavirginica)[8]、食用牡蛎(Ostreaedulis)[9]、紫贻贝(Mytilusgalloprovincialis)[10]、海湾扇贝(Argopectenirradians)[11]、文蛤(Meretrixmeretrix)[12]、合浦珠母贝(Pinctadamartensii)[13]、栉孔扇贝(Chlamysfarreri)[14]、缢蛏(Sinonovaculaconstricta)[15]、褶纹冠蚌(Cristariaplicata)[16]和三角帆蚌(Hyriopsiscumingii)[5]等,发现HSP70家族在贝类中参与各种环境胁迫应答,起重要保护作用。研究表明,缢蛏急性高温胁迫4 h时HSP70在肝胰腺和鳃中表达量开始显著升高[1]。皱纹盘鲍(Haliotisdiscushannai)受热刺激和鳗弧菌(Vibrioanguillarum)感染后肌肉和鳃组织中的HSP70的表达显著提高[17]。热休克和菌胁迫厚壳贻贝能显著增强HSP70基因在鳃和肝胰腺中的表达水平[18]。但未见急性胁迫下池蝶蚌HSP70家族成员表达特征分析的报道。嗜水气单胞菌是广泛分布于水体中兼性厌氧型的致病菌,淡水育珠蚌细菌性瘟病可能与之相关[19],本研究报道了池蝶蚌HSP70家族成员HSP70B2-like cDNA全长序列,并研究了池碟蚌HSP70B2-like在不同组织和急性高温及注射嗜水气单胞菌胁迫后相关组织中的转录表达特征,旨在为池蝶蚌抗逆生理研究提供资料,为其抗逆品种培育提供理论依据。
1 材料与方法
1.1 材料
池蝶蚌采自抚州市南城县洪门水库池蝶蚌良种养殖基地,为三龄健康蚌,经测量壳长为(120±4.5)mm、壳宽(69.21±1.6)mm、壳高(324±0.5)mm。池蝶蚌取回实验室置水族箱(800 mm×400 mm×400 mm)中暂养一周。水温控制在(25±1)℃,pH(7.5±0.1),连续充气,每2天换水1/3,并投喂适量小球藻。暂养结束后,随机选取3只蚌以Trizol法提取池蝶蚌的肝胰腺组织的总RNA用于RACE-PCR。组织表达检测随机选取3只室温(25 ℃)培育蚌提取闭壳肌、性腺、缩足肌、肝胰腺、鳃、斧足、肾、外套膜和血细胞等9个组织的总RNA用于qPCR。高温胁迫实验具体操作简述为从培养池中随机选取15只蚌,处理方法:15只蚌均预先常温(25 ℃)室内培养缸充气养殖一周,待其适应环境稳定后,随机选3只蚌设为对照组,另12只放置在37 ℃的鼓风培养箱中高温胁迫下培养,分别在培养6、12、24和48 h后各时间点随机选取3只快速提取鳃、肝胰腺、外套膜、肾、血细胞和闭壳肌组织总RNA,再反转录成cDNA。菌胁迫实验时,随机分5组,每组3只,给每只蚌闭壳肌注射50 μL嗜水气单胞菌(2.5×109细胞/mL,PBS重悬),各组胁迫时间依次为6、12、24和48 h,0 h的对照组则注射相同剂量的PBS,分别每3只蚌混合取鳃、肝胰腺、血细胞和闭壳肌等4个组织。按照此方法重复3次,非生物和生物胁迫两种不同刺激处理各组45只蚌,总需90只蚌。
1.2 方法
1.2.1 EST序列获得
根据本实验室池蝶蚌高通量转录组数据库筛选HSP70家族的同源基因序列,从筛查HSP70家族中众多成员的部分序列中,同源比对分析后,选定其中一条与GenBank已报道其他物种HSP70s同源性较高且其ORF序列相对较完整的HSP70B2-like的EST做进一步研究分析。
1.2.2 RNA提取和cDNA模板合成
材料中所述的池蝶蚌各组织解剖后置于预加液氮的研钵中研磨成粉末后,利用RNAiso Plus 试剂(Takara公司)提取组织总RNA,选用Clontech公司SMARTTM-RACE cDNA Amplification Kit试剂盒用于RACE cDNA合成。选用Takara公司反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)用于组织表达荧光定量PCR分析cDNA合成。
1.2.3 cDNA全长克隆和序列分析
根据转录组获得的池蝶蚌HSP70EST序列设计5′RACE和 3′RACE 特异性引物,使用SMARTTMRACE Amplification Kit 和Advantage 2 PCR Kit以RACE cDNA为模板分别进行5′和3′ RACE 扩增。将表1中的引物HSP70-5GSP1和通用引物UPM配对,进行5′端第一轮PCR扩增;以稀释20倍的第一轮PCR产物为模板,再用HSP70-5GSP2和NUP进行第二轮PCR扩增;进行3′端扩增,同上类似则是引物HSP70-3GSP1和HSP70-3GSP2分别同UPM和NUP进行配对。PCR 扩增产物经1.0%琼脂糖凝胶电泳检测,使用DNA胶回收试剂盒回收纯化目的片段,纯化产物连接pMD19-T 载体后转化到E.coliTop10感受态细胞,经菌落PCR鉴定的阳性克隆送生工生物工程(上海)股份有限公司测序。

表1 研究用到的引物
利用DNAMAN软件进行全长序列拼接。DNAStar软件找到开放阅读框,推导出其氨基酸序列,在NCBI上BLASTP进行序列同源性比对。用TMHMM软件跨膜区分析;使用SignalP 5.0 进行信号肽预测。使用DNAMAN 软件进行多序列比对。采用MEGA 6.0软件,基于邻位结合法(Neighbor-Joining,NJ)构建系统进化树,Bootstrap设置重复1 000次计算各分支置信度,使用RAxML和MrBayes对构建进化树进行相似度验证。
1.2.4 qRT-PCR分析
采用qRT-PCR检测池蝶蚌HSP70mRNA的组织表达及高温胁迫和注射嗜水气单胞菌后的表达特征。根据HSP70cDNA序列和池蝶蚌β-actin(EU047596),分别设计一对表达分析引物 (表1)。将材料中所述的用于qRT-PCR分析提取的相应各组织总RNA反转录成cDNA,根据TaKaRa的荧光定量试剂盒(嵌合检测法) 进行qRT-PCR检测。反应体系和程序参考SYBR®Premix Ex TaqTMⅡ说明书,采用20 μL反应体系,包括10 μL的2×SYBR Green Real-Time PCR Master Mix,1 μL模板,0.4 μL PCR Forward Primer(10 μmol/L),0.4 μL PCR Reverse Primer (10 μmol/L),0.4 μL ROX Reference DyeⅡ(50×),7.8 μL ddH2O,每个样品设置3个重复,以蒸馏水代替模板作为阴性对照。荧光定量PCR反应程序:95 ℃预变性60 s;95 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃再延伸10 min。应用 2-ΔΔCT法分析相对表达值。使用SPSS 17.0软件对结果进行显著性分析。
2 结果与分析
2.1 池蝶蚌HSP70 B2-like cDNA克隆与序列特征
池蝶蚌HSP70B2-like cDNA为2 209 bp,包括267 bp的5′UTR,25 bp的3′UTR和1 917 bp的ORF,该ORF编码638个氨基酸(图1)。预测蛋白分子质量为70.40 ku,等电点(pI)为5.70。池蝶蚌HSP70B2-like cDNA提交GenBank,登录号为OP429215。SignalP分析其不含信号肽,TMHMM预测其无跨膜区,该序列含有4个糖基化位点(N36,N362,N387,N489),具有HSP70家族保守的3个标签序列(I10DLGTTYS17,V198FDLGGGTFDVSIL211和V336VLVGGSTRIPKVQK350)以及1个ATP酶结构域(A132EAYLGKK139)、双向核定位序列(K248RKHKKDISKANRALRR264)、底物肽结合结构域(T383-E545)和C端结构域(R512-P615)(图1)。
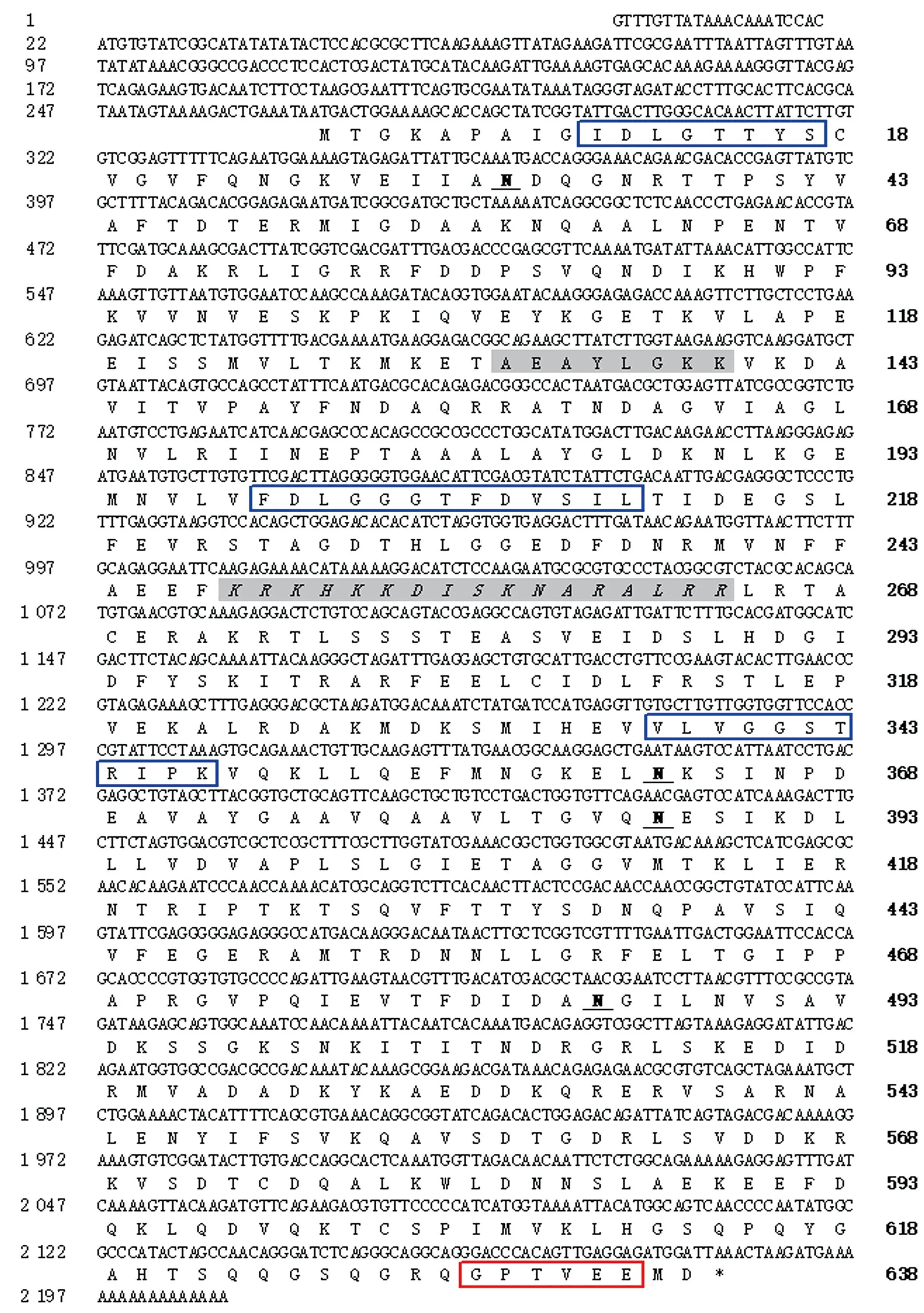
3个标签序列用蓝色方框标出,ATP酶结构域用阴影标示,双向核定位信号位点用阴影并字母斜体标示,糖基化位点字母加粗并下划线标示,C端保守区域用红色方框标出。
2.2 池蝶蚌HSP70 B2-like序列同源性与系统发育树
经BLASTP同源比对分析发现,池蝶蚌HSP70 B2-like与NCBI GenBank发布的其他物种的HSP70显示出较高的亲缘性,相似性最高的为褶纹冠蚌(C.plicata),达97.0%。应用DNAMAN软件进一步对不同物种HSP70序列多重比对,如图2所示,不同物种的HSP70在N端不是很保守,而C端的5~7个氨基酸保守性很强。HSP70家族所具有的标签序列、核定位序列、糖基化位点和特征性结构域在池蝶蚌HSP70 B2-like序列中均可找到,较为保守。

3个标签序列用蓝色方框标出,ATP酶结构域用加粗上划线标示,双向核定位信号位点用双箭头标示,糖基化位点用箭头标出,C端保守区域用红色方框标示。各物种的HSP70序列登录号:池蝶蚌(OP429215),褶纹冠蚌(ADM64336.1),三角帆蚌(AHN82525.1),长牡蛎 (XP_011435905.1),紫贻贝(CAH04106.1),斑马鱼 (NP_001093532.1),非洲爪蟾(NP_001121147.1),原鸡(NP_001006686.1),人(NP_005336.3),果蝇(NP_731651.1)。
通过MEGA 6.0软件邻接法构建池蝶蚌HSP70 B2-like系统发育树发现,池蝶蚌HSP70 B2-like与加州红鲍(Haliotisrufescens)、福寿螺(Pomaceacanaliculata)、美洲帘蛤(Mercenariamercenaria)、虾夷扇贝(Mizuhopectenyessoensis)、美洲牡蛎(C.virginica)、长牡蛎(C.gigas)等软体动物的HSP70家族中B2亚家族聚为同一分支簇(图3)。池蝶蚌首先与褶纹冠蚌(C.plicata)聚为一小分支,且和紫贻贝(M.galloprovincialis)的HSP70均落在B2亚家族分支簇。报道的三角帆蚌(H.cumingii)HSP70未落在软体动物分支簇上。果蝇(Drosophilamelanogaster)、美洲斑潜蝇(Liriomyzasativae)、烟草天蛾(Manducasexta)和埃及伊蚊(Aedesaegypti)等节肢动物的HSP70汇聚成另一分支簇。斑马鱼(Daniorerio)、非洲爪蟾(Xenopuslaevis)、原鸡(Gallusgallus)、小鼠(Musmusculus)、家犬(Canislupusfamiliaris)、马(Equuscaballus)和人(Homosapiens)等脊椎动物的HSP70则汇聚成另一不同分支簇。应用RAxML和MrBayes构建发育树均得到类似聚类结果。

各物种的HSP70序列登录:池蝶蚌(OP429215),褶纹冠蚌(ADM64336.1),三角帆蚌(AHN82525.1),福寿螺(XP_025099490.1),长牡蛎 (XP_011435905.1),美洲牡蛎(XP_022315428.1),虾夷扇贝(XP_021370483.1),美洲帘蛤(XP_045165411.1),紫贻贝(CAH04106.1),加州红鲍(XP_046367549.1),斑马鱼(NP_001093532.1),非洲爪蟾 (NP_001121147.1),原鸡(NP_001006686.1),小鼠(AAC84169.1),马(NP_001243852.1),家犬(BAB78505.1),人(NP_005336.3),烟草天蛾(AAO65964.1),埃及伊蚊(XP_021693655.1),美洲潜斑蝇(AAW32099.2),果蝇(NP_731651.1)。
2.3 池蝶蚌HSP70 B2-like组织表达
使用qRT-PCR分析池蝶蚌HSP70B2-like在不同组织中的特异性转录表达特征,结果如图4所示,室温(25 ℃)条件下HSP70B2-like mRNA在被检测的9种组织中均有表达,闭壳肌中的相对表达量最高,其次为性腺和缩足肌,而后是肝胰腺和鳃,而在血细胞、外套膜和肾中的表达量相对较低。
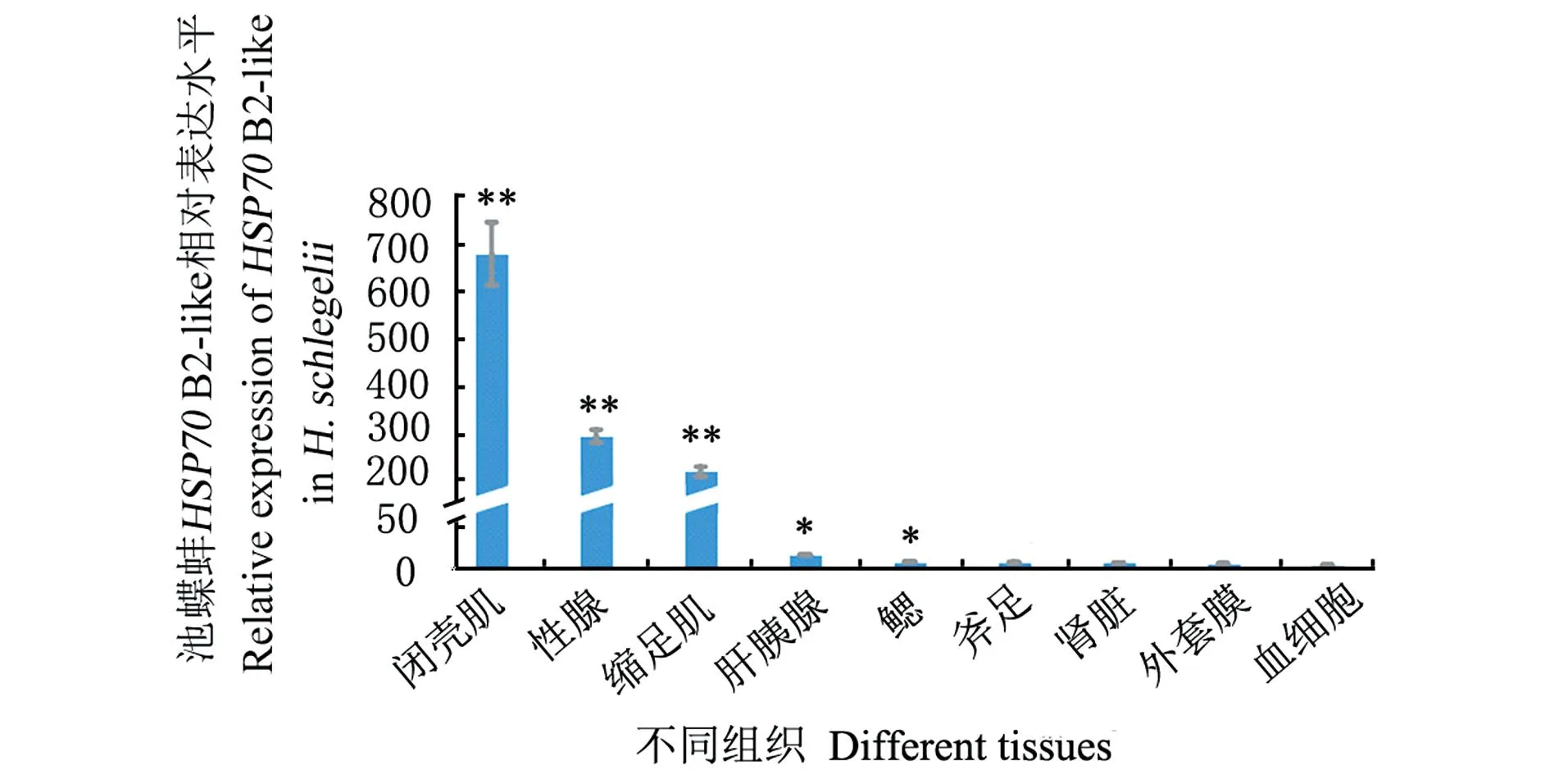
取平均值±标准误;* 为差异显著(P<0.05);** 为差异极显著(P<0.01)。
2.4 热刺激对池蝶蚌HSP70 B2-like组织表达影响
经高温(37 ℃)胁迫刺激处理,以室温(25 ℃)为对照(0 h),如图5所示,热刺激6 h,HSP70B2-like在闭壳肌、肝胰腺、肾和外套膜中的转录表达明显增强(P<0.01),在血细胞和鳃中的表达呈现短暂下调,但在12 h表现上调。热刺激48 h,HSP70B2-like在血细胞、外套膜和肾中的转录表达量明显增加,而在闭壳肌、鳃和肝胰腺中的表达量回落。
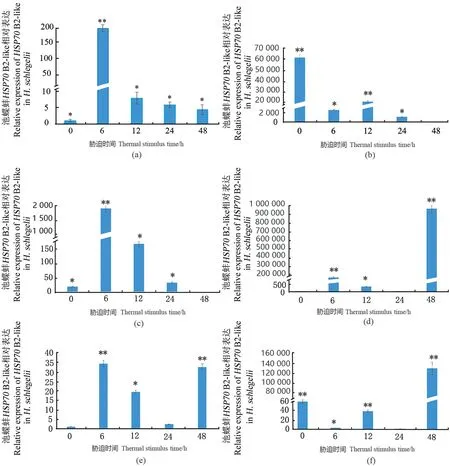
(a)闭壳肌;(b)鳃;(c)肝胰腺;(d)外套膜;(e)肾;(f)血细胞。取平均值±标准误;* 为差异显著(P<0.05);** 为差异极显著(P<0.01)。
2.5 菌感染后池蝶蚌HSP70 B2-like 组织表达变化
嗜水气单胞菌注射感染之后,6、12和24 h实验组的HSP70B2-like在肝胰腺[图6(b)]、血细胞[图6(c)]和闭壳肌[图6(d)]中的转录表达均表现显著上调,6 h实验组的HSP70B2-like在鳃[图6(a)]的表达呈显著下调,12 h呈现上调,24 h下调。48 h实验组的HSP70B2-like在鳃、肝胰腺血细胞和闭壳肌中的表达均表现回落(图6)。
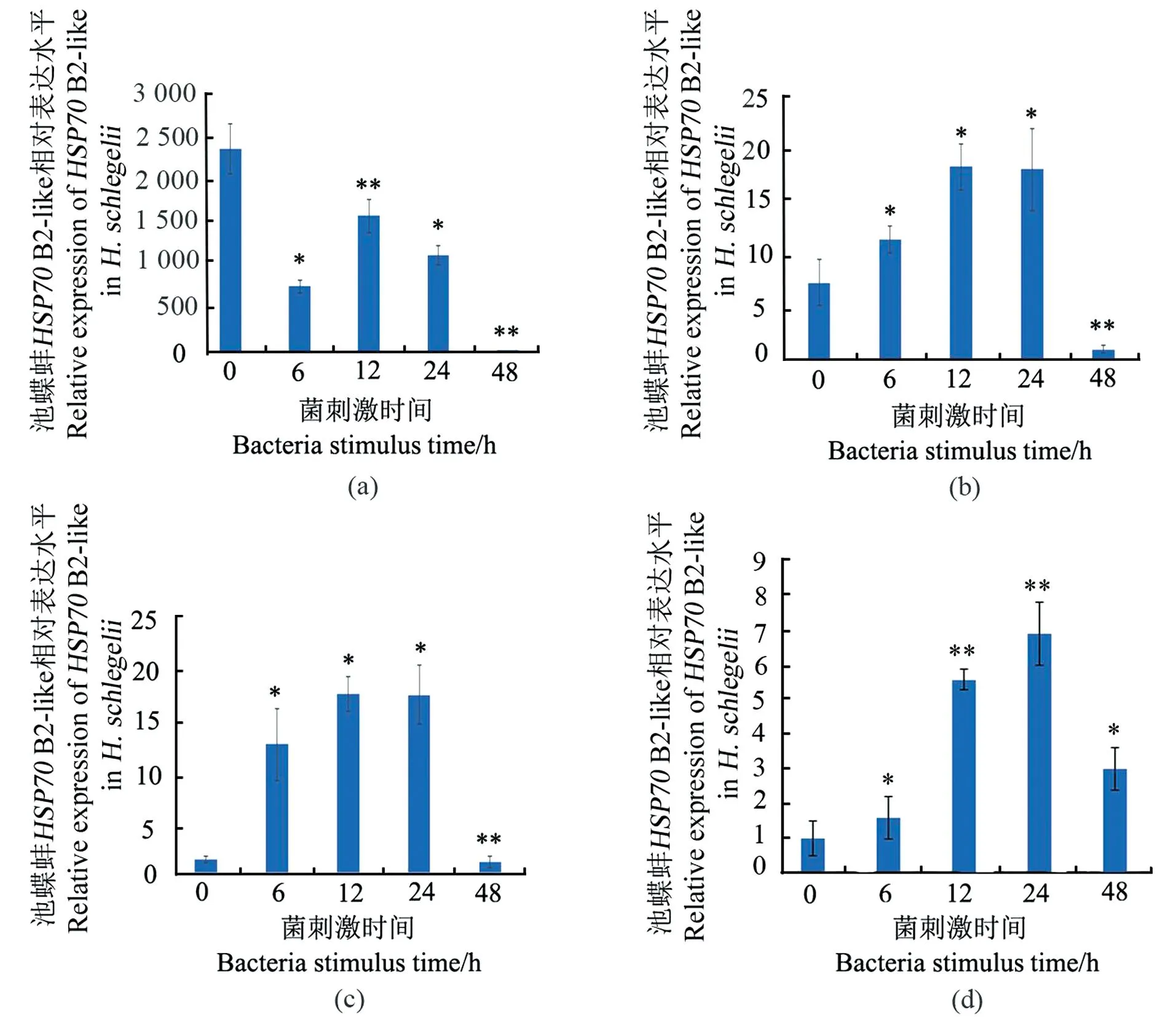
(a)鳃;(b)肝胰腺;(c)血细胞;(d)闭壳肌。取平均值±标准误;* 为差异显著(P<0.05);** 为差异极显著(P<0.01)。
3 讨论
HSP70是一种在代谢过程中促进细胞稳态的重要蛋白,具有分子伴侣、抗氧化、抗细胞凋亡、免疫调节等重要功能[6,20]。本研究从池蝶蚌中克隆获得序列具有其他物种HSP70家族典型特征序列,包括3个标签序列(IDLGTTYS、VFDLGGGTFDVSIL和VVLVGGSTRIPKVQK)、N端ATP酶结构域(A131EAYLGTT138)和双向核定位信号(K250KDPSESKRALRRL263)[7,20],与已报道的褶纹冠蚌HSP70氨基酸序列长度一致[16],但比三角帆蚌HSP70序列短[5]。BLASTP和多重序列比对显示,该序列与褶纹冠蚌HSP70同源性最高,在构建的分子系统发育树中,该序列首先与褶纹冠蚌HSP70紧密聚为一支,并与其他8种软体动物HSP70聚为一大簇,特别是和加州红鲍、福寿螺、美洲帘蛤、虾夷扇贝、美洲牡蛎和长牡蛎的HSP70 B2亚家族同落在一大分支上,而与三角帆蚌HSP70距离较远,推测克隆序列为池蝶蚌HSP70家族的成员,且属B2亚家族。虽然一些软体动物中只报道了一个HSP70[6,20],但真核生物HSP70家族存在多个成员[6,20]。Tavaria等[21]发现人HSP70家族至少存在11个成员。牡蛎中发现HSP70基因发生了明显扩张,数目高达88个[20,22]。栉孔扇贝基因组中鉴定了HSP70家族65个成员[23]。在物种分类学上,池蝶蚌与三角帆蚌同属不同种,相较于褶纹冠蚌与之亲缘关系更近[19],推测本研究选用的三角帆蚌HSP70可能属于HSP70家族中另一亚家族成员。
信号肽预测结果显示,池蝶蚌HSP70 B2-like的N端无信号肽跨膜结构域,TMHMM预测其无跨膜区,说明其不属于分泌性蛋白,亦非膜蛋白,可能为胞质蛋白。HSP70家族蛋白至少包括4类蛋白质,第一类是结构型HSP70蛋白,又称HSP70的同源蛋白(HSC70),热刺激后只有少量增加;第二类是诱导性HSP70蛋白,在正常细胞中也有少量表达,细胞发生应激后,表达迅速增加;第三类是GRP78(Bip),定位于细胞内质网;第四类是GRP75,位于线粒体[6]。软体动物胞质型的HSP70其C端通常具有细胞质特异性调控基序GP(T/K)(V/I)EE(V/M)D[20],而定位于内质网、细胞核和线粒体的HSP70其C端通常分别具有特异性的KDEL、NUCDISC和MITDISC基序[20]。对池蝶蚌HSP70 B2-like序列分析发现,其C端存在基序GPTVEEMD,说明池蝶蚌HSP70 B2-like在细胞质有分布,属胞质型HSP70。但池蝶蚌HSP70 B2-like也存在双向核定位信号序列,推测其除胞质发挥作用外,当受到热休克或细菌感染等胁迫后,胞质内的HSP70 B2-like可能还可以迁移到核内发挥功能保护作用。
尽管HSP70广泛存在于各类生物体内,但各物种的HSP70的表达具有组织特异性。三角帆蚌HSP70以肝胰腺中的表达最高,其次是性腺[5]。褶纹冠蚌HSP70在鳃中的表达较高,其次是肌肉[16]。香港牡蛎HSP70在肌肉中表达最高[24]。本研究发现池蝶蚌HSP70B2-like在不同组织中均有表达,以闭壳肌的表达量最高,其次是性腺,在血细胞、外套膜、肾、鳃、肝胰腺及斧足的表达量较低,表明其表达有组织特异性。
作为一种应激保护蛋白,HSP70帮助生物体迅速适应环境变化以抵御外界不良损害[1,5,20]。Nakano等[25]对潮间带杜父鱼研究表明,HSP70在体内贮存量与机体热耐受能力呈正相关。长牡蛎37 ℃预处理2 h,转置44 ℃致死温度下,生存期延长了2周,与鳃中大量积累的HSP70有关[26]。说明轻度或非致死热休克诱导HSP70基因表达上调有助于水生动物抵抗不良环境因子胁迫,进而产生非特异性的保护作用[27]。37 ℃刺激三角帆蚌,处理2 h鳃中的HSP70表达显著上调[5]。热休克和病原菌处理褶纹冠蚌,各组织中HSP70mRNA表达量有明显提高[11]。本研究采用急性高温(37 ℃)胁迫处理池蝶蚌后,检测发现各组织中的HSP70B2-like转录表达均有显著变化,其中,闭壳肌、肝胰腺、外套膜和肾在胁迫6 h其转录水平显著增强,随后逐渐下降,表现为明显的时间依赖性。这可能与HSP70在转录水平的反馈调节方式有关[6],在无胁迫条件下,细胞质中HSP70蛋白与热休克转录因子(HSF)结合为无活性复合物;热胁迫后,大量HSP70与变性蛋白结合,导致HSF从 HSP70-HSF复合物中释放,游离的HSF在蛋白激酶或其他丝氨酸/苏氨酸激酶的作用下磷酸化,形成活性三聚体并转入细胞核内与热休克元件(HSE)序列结合,并进一步被激酶磷酸化,然后启动HSP70的表达,导致机体中HSP70表达水平上升;当HSP70累积到一定程度时又与HSE结合,引起HSF与HSE分离,转录停止,从而实现反馈抑制HSP70的表达,HSP70表达水平逐渐下降至诱导前水平。在鳃和血细胞先降后升,推测可能是急性高温胁迫的初始阶段(0~6 h),通过关闭或降低鳃和血细胞HSP70B2-like参与的一些快速调节途径以应对环境的变化,但随后(12 h)启动了由HSP70B2-like参与的调节以应对应激导致的不良反应。另一种可能是池蝶蚌鳃和血细胞具有更高的热敏感度,其HSP70B2-like可能类似三角帆蚌在热胁迫2 h诱导了其显著增强表达,但胁迫时间过长到6 h可能出现负反馈调控抑制了其表达。外套膜、血细胞和肾组织中HSP70B-like基因在37 ℃胁迫后分别在6 h(或12 h)和48 h出现两次表达峰,这与其他组织不同。这可能是急性高温胁迫诱导HSP70 B2-like高表达后,可以修复热休克导致的部分受损蛋白,同时诱导产生的HSP70 B2-like还可以作为一种“危险信号”使机体提高抗氧化防御功能,刺激机体某些相关细胞因子活化正反馈诱导HSP70B2-like再次增强表达。
HSP70还是一个参与抵抗病原菌感染的免疫防御相关基因。病原菌侵染文蛤可显著增强其在肝胰腺和鳃中的表达[12]。近江牡蛎在感染溶藻弧菌后,外套膜、鳃、消化腺、心脏和血细胞等5种不同组织中HSP70mRNA均出现了显著性高表达[28]。本研究注射嗜水气单胞菌胁迫处理池蝶蚌,发现HSP70B2-like在池蝶蚌鳃、肝胰腺、血细胞和闭壳肌中的表达也均显著增加,但其表达变化有组织差异性,肝胰腺、血细胞和闭壳肌中HSP70B2-like mRNA表达量在6 h已被显著增强表达并持续至24 h,随后便逐渐下降。池蝶蚌鳃组织中HSP70B2-like mRNA表达则是先降后升再回落,表达量变化规律同其受到急性高温胁迫相似。表明池蝶蚌HSP70 B2-like不仅是热胁迫时大量表达的蛋白,也是生物胁迫如病原菌侵染时诱导表达的蛋白。这可能是当池蝶蚌被细菌感染后,其为消除病原菌,机体自身的免疫细胞会释放一些诸如活性氧分子、阳离子多肽、溶菌酶和细胞因子等分子,这些分子可诱导产生包括HSP70s在内的多种热休克蛋白。释放的活性氧分子在杀灭外来侵染的病原菌同时,也会对宿主自身正常细胞造成损伤,造成自身蛋白的变性,机体不同组织中的变性蛋白诱导差异水平的HSP70s产生,产生的HSP70s或者帮助变性蛋白复性,或者清除永久变性蛋白[28]。有研究表明,经急性高温诱导增加HSP70含量,增强了凡纳滨对虾对副溶血弧菌感染的抗性,并发现敲低HSP70表达的对虾在副溶血弧菌和白斑综合征病毒感染时死亡率升高[27],说明通过诱导水生动物产生内源 HSP70,能增强水生动物的抗逆/病性。这在水生动物抗逆和病害防控方面可能具有广泛的潜在应用价值[27-28]。然而,在生产实践中仍需谨慎进行,需进一步探究具体的操作方案[29]。正如厚壳贻贝在一定温度变化范围内可通过调节自身代谢水平应对温度升高带来的胁迫,但短时间内大幅升温显著影响厚壳贻贝的摄食、代谢和免疫反应[2]。
4 结论
研究克隆鉴定了一个池蝶蚌HSP70B2-like基因,并通过急性高温胁迫和病原菌刺激实验证明其是一个应激表达蛋白基因,且属胞质诱导型HSP70,参与了机体应对高温胁迫和抗病原菌入侵的应答过程,暗示其在机体的抗高温热害和免疫防御中发挥着重要作用。池蝶蚌HSP70B2-like基因的克隆为深入研究其介导的抗逆能力和免疫机理以及指导池蝶蚌抗逆育种和遗传改良打下基础。
